Method Article
Выделение почвенных микроорганизмов с помощью технологии iChip
В этой статье
Резюме
В методе iChip используется недорогое и простое устройство для изоляции in-situ , которое увеличивает скорость обнаружения новых микроорганизмов из почвы. Новые микроорганизмы могут быть использованы для дальнейших исследований, связанных с микробиомом почвы или открытием природных продуктов, а также для других применений.
Аннотация
В методе выделения iChip используется устройство для выделения in-situ , которое повышает пригодность к культивированию ранее некультивируемых микроорганизмов. Микроорганизмы являются важным источником новых химических веществ и потенциально биологически активных молекул. Однако только 1% микроорганизмов окружающей среды может быть культивирован с помощью обычных лабораторных методов. В условиях роста устойчивости к противомикробным препаратам поиск новых лекарств для борьбы с инфекциями и болезнями приобретает первостепенное значение, а важнейшим методом поиска новых молекул является открытие новых микроорганизмов. При инкубации колоний почвенных микроорганизмов в лунках 96-луночной пластины, закрытой полупроницаемой мембраной и инкубируемой поверх почвы, микробы находятся в контакте с водой и факторами роста из почвы, что позволяет изолировать новые микробы в лабораторных условиях. После периода одомашнивания в iChip микроорганизмы потенциально могут быть субкультивированы на обычных средах и использованы для дальнейшего изучения. Это устройство имеет важное значение для открытия биоактивных молекул и исследования почвенного микробиома и ранее использовалось в обоих приложениях.
Введение
Бактерии окружающей среды являются богатым источником натуральных продуктов (НЧ)1. Эти метаболиты не являются жизненно важными для выживания микроорганизмов, а вместо этого производятся для облегчения их колонизации, вытесняя другие микроорганизмы в окружающей ихсреде. Эволюция точно настроила химические структуры и активность НЧ, сделав их эффективными противомикробными агентами. Таким примером является даптомицин, антибиотик, одобренный FDA в 2003году. В последние годы резистентность микробов возросла по частоте и степени тяжести, и новые препараты, такие как даптомицин, выступают в качестве препаратов последней линии против инфекций, у которых развилась устойчивость к старым антибиотикам4. Разработка новых антибиотиков и других лекарств имеет важное значение для поддержания излечимости распространенных инфекций и болезней.
Несмотря на то, что НЧ часто являются хорошими лекарствами, фармацевтическая промышленность обратилась к синтетическим методам для разработки лекарств после золотого века антибиотиков в 1950-х и 1960-х годах. К 1970-м годам одни и те же микроорганизмы и антимикробные метаболиты продолжали повторно изолироваться, приэтом обнаруживалось все меньше и меньше новых кандидатов в лекарства. Почвенный микробиом содержит большое микробное разнообразие, но только небольшое количество микроорганизмов может быть выделено в обычных лабораторных условиях. Подавляющее большинство почвенных микроорганизмов микроорганизмов, обнаруженных с помощью геномики, не наблюдаются при культивировании традиционными методами культивирования, что приводит к тому, что проблема получила название «аномалия большого количества пластин»7. Эти некультивируемые микробы были названы микробной темной материей, поскольку известно, что они существуют, но не могут быть изучены in vitro до тех пор, пока их не удастся выделить в виде чистых культур. Эти некультивируемые микроорганизмы, вероятно, могут производить множество кандидатов в лекарства, что имеет большое значение в эпоху устойчивости микробов.
Метод iChip является одним из методов, который может быть использован для увеличения восстановления новых микроорганизмов из окружающей среды 8,9. Эта технология помогает моделировать естественную среду обитания бактерий во время инкубации, тем самым повышая способность культивировать микроорганизмы, которые в противном случае не смогли бы выжить в обычных лабораторных условиях. Модифицированные чипы iChips уже разработаны и используются для выделения микроорганизмов из различных источников, таких как почва, отложения, морская среда и кишечник животных 11,12,13,14,15,16. Возможно, наиболее впечатляющим случаем использования этой технологии стала компания NovoBiotic Pharmaceuticals, гдебыла обнаружена новая бактерия, Eleftheria terrae. Было обнаружено, что этот микроорганизм продуцирует теиксобактин, антибиотик нового класса, который подавляет несколько устойчивых видов бактерий, имеющих отношение к здоровью человека, без обнаруженного развития резистентности 5,18. Это было впечатляющее открытие, поскольку теиксобактин является первым новым классом антибиотиков, обнаруженным за последние десятилетия, и является признаком того, что этот метод является многообещающим путем для открытия новых лекарств и преодоления большой аномалии количества пластин. В настоящем документе представлен модифицированный чип iChip, основанный на предыдущей публикации Berdy et al., который был оптимизирован для простоты использования и предотвращения загрязнения9.
протокол
1. Подготовка среды и стерилизация
- Приготовьте и простерилизуйте сукцинатную среду с минимальным содержанием солей (СМС), которая состоит из 0,1 г картофельного крахмала, 1 г казаминокислот, 0,125 г казеинового расщепления и 15 г бактериологического или технического агара на 1 л воды.
- Стерилизуйте среду в автоклаве и 100 мл молекулярной воды в жидкостном цикле в течение 20 мин при температуре 121 °C.
ПРИМЕЧАНИЕ: Убедитесь, что все другие предметы, которые будут контактировать со смесью агар-клеток, приобретены стерильными, включая наконечники для пипеток и центрифужные пробирки, в противном случае они также будут автоклавированы.
2. Модифицированная конструкция iChip
- Удалите дно лунок в четырех 96-луночных пластинах с помощью 5-миллиметрового агарового пробивного инструмента.
- Разрежьте поликарбонатные мембраны 0,05 мкм на прямоугольники размером 7,6 см х 11 см, или равные размерам дна 96-луночной пластины.
- С помощью силиконового герметика приклейте поликарбонатные мембраны длиной 0,05 мкм к дну 96-луночных пластин, следя за тем, чтобы клей герметизировал лунки, но не полностью закрывал отверстия лунок. Дайте высохнуть не менее 24 часов или следуйте инструкциям на клее.
ПРИМЕЧАНИЕ: Герметик должен быть водонепроницаемым, нетоксичным и на 100% силиконовым. Большинство аквариумных герметиков будут работать хорошо.
3. Приготовление клеточных суспензий
- Промаркируйте четыре центрифужные пробирки по 15 мл A-D и четыре центрифуги по 50 мл E-H и добавьте в каждую по 4,5 мл стерильной воды.
- Отмерьте 1 г почвы в центрифужную пробирку объемом 50 мл, добавьте 10 мл стерильной воды и понаблюдайте в течение 10 минут.
- Дайте почве отстояться в течение 10 минут.
- Пипеткой внесите 0,5 мл надосадочной жидкости, содержащей клетки, из почвы в пробирку А и тщательно перемешайте.
- Добавьте 0,5 мл клеточной суспензии из пробирки А в пробирку Б и тщательно перемешайте. Перелейте 0,5 мл раствора В в пробирку С и тщательно перемешайте. Повторите то же самое для всех остальных пробирок центрифуги, завершив серию 10-кратных разведений по восьми пробиркам центрифуги.
- Удалите 0,5 мл из пробирки H, чтобы во всех пробирках был одинаковый объем.
ПРИМЕЧАНИЕ: Эти концентрации оптимизированы для местных почв. При первой попытке выполнить эту процедуру выполните более широкий диапазон разведений, чтобы найти подходящую концентрацию образца.
4. Модифицированная инокуляция iChip
- Полностью погрузите чипы iChips в 95% этанол не менее чем на 15 минут.
- Извлеките пластины из этанола и выложите их на стерильное бумажное полотенце. Дав этанолу испариться, включите УФ-стерилизатор в колпаке с ламинарным потоком на 15 минут для дальнейшей стерилизации.
- Пипетка 360 мкл стерильной среды SMS в первую колонку планшета для выполнения функций контрольных лунок.
- Добавьте 45 мл СМС, охлажденного до 50 °С, в клеточную суспензию в пробирке Е и тщательно перемешайте, чтобы соединить клеточную суспензию и агар.
- Пипеткой 360 мкл смеси агар-клеток из шага 4.4 во все остальные лунки 96-луночного планшета.
ПРИМЕЧАНИЕ: Рекомендуется использовать многоканальный пипетку, так как агар быстро затвердевает. Не рекомендуется повторно нагревать смесь агара и клеток после смешивания из-за риска гибели микроорганизмов. - После того, как среда будет закреплена, запечатайте верхнюю часть планшетов крышкой для планшетов PCR.
- Повторите шаги с 3.3 по 3.6 с пробирками F-H, чтобы заполнить в общей сложности четыре чипа iChip с десятикратной разницей в концентрациях.
ПРИМЕЧАНИЕ: При необходимости среду можно разогревать в микроволновой печи в течение 30 секунд с ослабленной крышкой или держать в водяной бане с температурой 60 °C между пластинами, чтобы гарантировать, что она останется расплавленной для каждой из них.
5. Инкубация
- Поместите пластины в коробку, содержащую примерно один дюйм почвы, используемой в шаге 3.2, мембраной вниз и установите крышку.
- Инкубируйте планшеты в закрытой емкости, в темном месте при температуре 25 °C.
ПРИМЕЧАНИЕ: Через неделю проверьте содержимое модифицированных чипов iChip, чтобы убедиться, что загрязнение не произошло во время настройки. О загрязнении свидетельствует разрастание одного или нескольких микроорганизмов во всех лунках планшета. - Через 6 недель осмотрите чипы iChips. Используйте планшеты, содержащие рост, менее чем в 25% лунок для изоляции колоний.
6. Изоляция колонии
- Промойте модифицированные чипы iChips 3 раза стерильной водой, чтобы удалить все частицы почвы.
- Протрите верхнюю и боковые стороны пластины 95% этанолом, избегая стороны с полупроницаемой мембраной.
- С помощью стерильного лезвия разрежьте крышку пластины вокруг одной лунки, содержащей колонию.
- С помощью стерильного инструмента для полос проткните колонию и нанесите полосу на SMS-агар пластинами размером 100 x 15 мм методом четырех квадрантов.
- Повторите то же самое для всех остальных колоний в iChips, которые выращивают по одной колонии на лунку.
ПРИМЕЧАНИЕ: Для крошечных колоний пластину можно поместить обратно в почву и инкубировать до тех пор, пока она не станет достаточно большой для субкультуры, при условии, что крышка пластины не была снята вокруг лунки. - Инкубируйте планшеты SMS при температуре 25 °C и следите за их ростом.
- Осмотрите колонии, чтобы убедиться, что культуры аксенических культур были изолированы.
7. Идентификация микроорганизмов
- Секвенирование геномов восстановленныхизолятов 20.
- Оцените геномы с помощью JSpeciesWS или другой платформы идентификации на основе генома, чтобы определить степень сходства каждого изолята с известными микроорганизмами в GenomesDB.
- Классифицируйте изоляты ниже принятых сообществом пороговых значений для идентификации видов как предположительно новые.
Результаты
Визуальный обзор протокола показан на рисунке 1. Успешный эксперимент с модифицированным чипом приводит к тому, что по крайней мере одна пластина содержит рост менее чем в 25% лунок, при этом в контрольных лунках роста не происходит. Такое количество лунок с ростом обычно обеспечивает выделение одиночных колоний в лунках. Кроме того, число колоний, или количество лунок, содержащих колонии, должно уменьшаться в десять раз с каждой последующей пластиной, приготовленной из серии разведений. Репрезентативные результаты представлены на рисунке 2. где планшеты 7 и 8 являются успешными iChips, поскольку они содержат рост менее чем в 25% лунок, и процент лунок, содержащих колонии, уменьшается с каждой пластиной, как показано в таблице 1. Если все планшеты в исследовании содержат более одной колонии в скважине или не содержат колоний в любой скважине, это является отрицательным результатом.
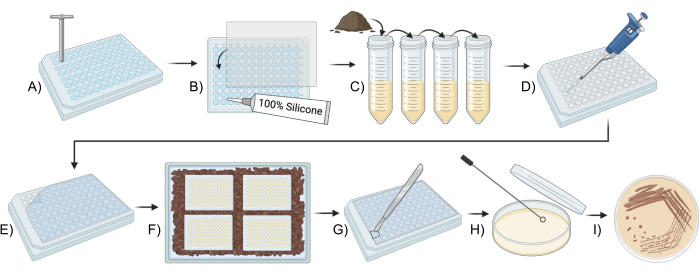
Рисунок 1: Схематический обзор использования модифицированного чипа iChip для культивирования почвенных микробов. (A,B) Конструкция планшета (шаг 2). (C) Приготовление инокулюма (Шаг 3). (D,E) Настройка iChip (шаг 4). (F) Инкубация чипа iChip (шаг 5). (Г-И) Перенос изолятов в обычные среды (Шаг 6). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
| Ичип | Концентрация почвы в агаровой суспензии | Колодцы с колониями | Колониеобразующие единицы |
| E | 5,0 x 10-6 г/мл | Все | Слишком много, чтобы сосчитать |
| F | 5,0 x 10-7 г/мл | Все | Слишком много, чтобы сосчитать |
| G | 5,0 x 10-8 г/мл | 22 | 22 |
| H | 5,0 x 10-9 г/мл | 6 | 6 |
Таблица 1: Репрезентативные данные успешного эксперимента с iChip, в котором количество лунок, содержащих колонии, уменьшается с каждым серийным разведением.
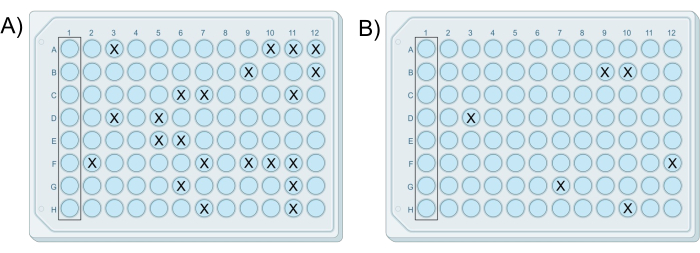
Рисунок 2: Примерные результаты двух успешных модифицированных чипов iChip. iChips были получены в том же эксперименте, в котором (А) пластина, приготовленная из клеточно-агаровой смеси G, содержит 22 колонии, и (В) пластина, приготовленная из клеточно-агаровой смеси H, содержит шесть колоний, что согласуется с 10-кратной разницей в разведении между смесями. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Колонии можно визуализировать невооруженным глазом или с помощью микроскопии, как показано на рисунке 3A-G. Колонии могут расти на поверхности агара, как видно на рисунке 3B, или встраиваться в агар, как колония на рисунке 3F. Могут быть случаи, когда в успешном модифицированном чипе iChip есть две колонии в одной и той же лунке, как показано на рисунке 3G. В некоторых случаях колонии находятся достаточно далеко друг от друга, чтобы их можно было проколоть иглой отдельно и субкультивировать; однако маловероятно, что микроорганизмы на рисунке 3G могут быть легко культивированы как аксенические микроорганизмы. Примеры колоний, перенесенных с iChip на обычные SMS-носители, показаны на рисунке 4.
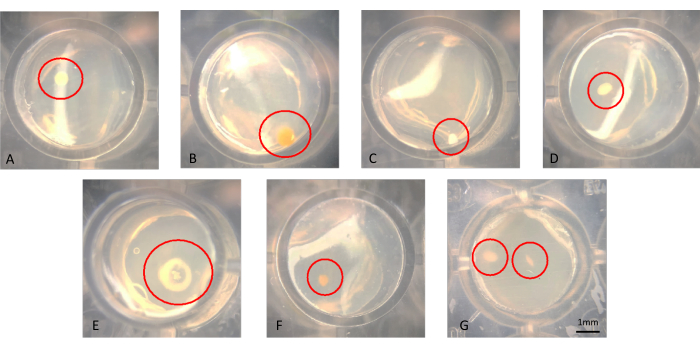
Рисунок 3: Репрезентативный микроскопический вид колоний, растущих в iChip после 6 недель инкубации. (A-F) Наблюдаются одиночные колонии, которые должны быть субкультивированы, а в (G) две колонии наблюдаются в непосредственной близости, которые трудно получить в качестве аксенических культур. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
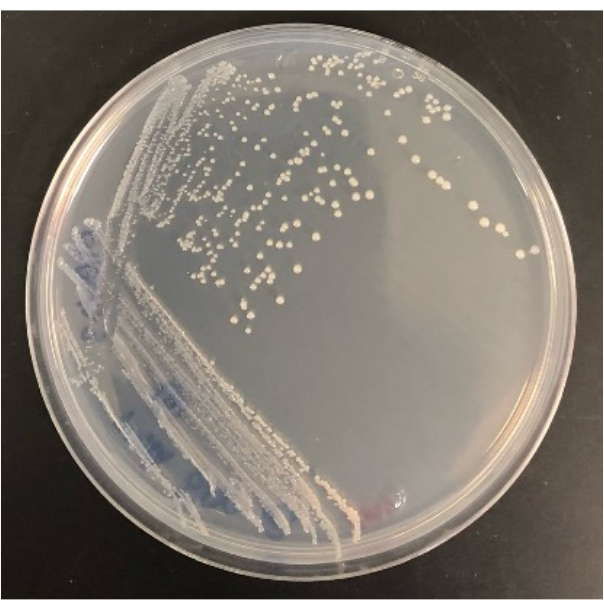
Рисунок 4: Репрезентативный результат работы бактерии, выделенной из модифицированного чипа iChip, которая когда-то росла на пластине с агаром SMS. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Возможность изолировать колонии из модифицированного чипа iChip на обычных агаровых пластинах также определяет успех эксперимента. Не все колонии, растущие в модифицированном iChip, переживут перенос на обычные планшеты. В iChip колонии подвергаются воздействию факторов роста и питательных веществ почвы, что повышает их пригодность к выращиванию. Для некоторых микроорганизмов периода одомашнивания недостаточно, чтобы сделать их пригодными для культивирования в обычных условиях. Скорость восстановления колоний из iChip в планшеты будет варьироваться от эксперимента к эксперименту, но некоторые из них должны расти в планшетах, так как этот метод также позволяет культивировать легко культивируемые микроорганизмы. Например, модифицированные чипы iChips на рисунке 2 содержали в общей сложности 28 колоний, а количество колоний, выросших на агаровых пластинах после субкультуры, составило 16, в то время как 12 не пережили перенос. Изоляты могут быть идентифицированы и использованы для дальнейшего изучения после культивирования на полноразмерных агаровых планшетах, как показано на рисунке 4.
Успешный эксперимент с модифицированным iChip должен привести к выделению микроорганизмов, которые отличаются от известных микроорганизмов на видовом уровне. Степень сходства каждого изолята с известными микроорганизмами определяется путем сравнения выделенной ДНК с геномами известных микроорганизмов. Показатели tetra Z ближайших родственных микроорганизмов к каждому изоляту описывают процент сходства. На рисунке 5 показано, что из двенадцати выделенных бактерий четыре были новыми видами или выше, две, вероятно, были новыми штаммами, а шесть были известными микроорганизмами. Восстановление нескольких новых видов или штаммов согласуется с ранее опубликованными экспериментами iChip, что указывает на то, что эта модифицированная конструкция iChip не препятствует увеличению восстановления новых видов11.
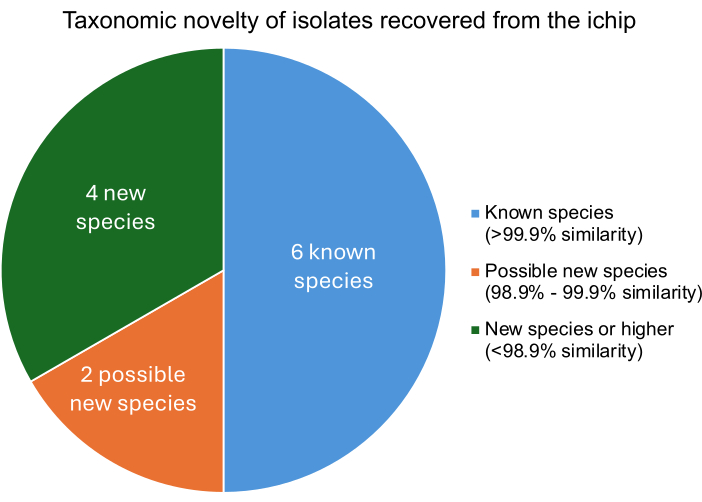
Рисунок 5: Уровень таксономической классификации изолятов, полученных в результате эксперимента с iChip. Процентное сходство определялось на основе баллов tetra Z, которые описывают сходство изолятов с известными бактериями, где сходство >99,9% указывает на совпадение видов, 98,9%-99,9% сходство указывает на возможный новый вид, а сходство <98,9% указывает на новый вид или выше. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Обсуждение
Многочисленные методы, такие как анализ генома и изучение бесшумных путей биосинтеза, способствовали открытию новых биологически активных химических веществ впоследние годы. Тем не менее, НЧ, обнаруженные с помощью таких методов, часто демонстрируют высокое структурное сходство с известными соединениями. Получение доступа к ранее не культивируемым микроорганизмам откроет доступ к большему химическому разнообразию и НУП с новыми способами действия, которые могут лучше помочь в борьбе с устойчивостью микробов. Было показано, что метод выделения iChip повышает культивируемость новых микроорганизмов, которые могут быть использованы для создания библиотек микроорганизмов для открытия новых НЧ.
Самая ранняя концептуализация iChip была опубликована в 2002 году, которая состояла из одиночных металлических колец, содержащих смесь агаровых клеток, запечатанных полупроницаемыми мембранами и инкубированных in situ23. Позже, в 2010 году, он был переработан для создания небольшого чипа с множеством лунок11, за которым последовала разработка недорогого iChip, созданного из обычных лабораторных материалов, во влиятельной публикации Nature Protocols в 2017году. В эту публикацию в протокол Nature было внесено несколько изменений для повышения его практичности и удобства использования. Протокол Nature включает в себя приклеивание полупроницаемой мембраны к обеим сторонам чипа по сравнению с этим методом, при котором используется покрытие из клейкой пластины с одной стороны. Проблемы могут возникнуть при использовании силиконового клея для крепления мембраны после загрузки iChip. Насколько нам известно, все нетоксичные силиконовые клеи выделяют уксусную кислоту по мере схватывания, что может повлиять нажизнеспособность клеток. Протокол, описанный в этом видео, также значительно сокращает объем обработки, необходимой после инокуляции, за счет использования крышки ПЦР-планшета для герметизации заполненной пластины, что еще больше обеспечивает стерильность и сокращает время настройки. Основываясь на идентификации нескольких новых изолятов в этом эксперименте, использование только одной полупроницаемой мембраны препятствует увеличению скорости открытия новых организмов, о котором сообщалось для iChips, сконструированных с двумя полупроницаемыми мембранами. Однако для количественной оценки воздействия потребуются дальнейшие эксперименты с большим размером выборки.
Еще одна модификация метода заключается в том, чтобы использовать только субкультуры из модифицированных чипов, которые содержат прирост менее чем в 25% лунок. Если колонии растут в большинстве лунок планшета, вероятно, есть несколько лунок, которые содержат несколько микроорганизмов, даже если их не так легко увидеть. В ходе разработки метода было установлено, что получить аксенические культуры при субкультурировании из скважин, содержащих более одной колонии, практически невозможно. Выделение неаксенических культур создает значительные проблемы с точки зрения анализа биологической активности и идентификации. Таким образом, для простоты рекомендуется выращивать только модифицированные чипы iChip с колониями, растущими в части лунок.
Наиболее существенной проблемой, которая может возникнуть при использовании методов iChip, является загрязнение колодцев или целых iChips другими микроорганизмами. На загрязнение указывают колонии, растущие в контрольных лунках, или один и тот же микроорганизм, растущий в нескольких лунках или на всей территории модифицированного iChip. Источником загрязнения может быть недостаточная стерилизация материалов во время установки или неправильная техника асептики. В таких случаях убедитесь, что все используемые материалы стерилизованы автоклавом или этанолом, как указано в методе, и убедитесь, что не происходит контакта между любыми нестерильными предметами и модифицированным чипом iChip, кроме смеси агар-клеток. Если на дне или в верхней части нескольких модифицированных лунок iChip наблюдается чрезмерный рост одного микроорганизма, это, скорее всего, является результатом неполного уплотнения между лунками и мембраной. В этом случае убедитесь, что используемый клей на 100% состоит из силикона, который не разлагается в этаноле, и убедитесь, что полупроницаемая мембрана и крышка ПЦР-пластины полностью герметизированы вокруг каждой скважины во время строительства.
Серии разрежений, используемые в настоящем протоколе, должны обеспечивать адекватное разбавление для большинства типов почв со сроком хранения менее одной недели, поскольку они включают в себя тысячекратный диапазон разбавлений. Тем не менее, могут быть значительные различия в количестве микроорганизмов между типами почв. Если контрольные лунки не содержат роста, но в каждой лунке всех четырех модифицированных чипов iChip растут несколько колоний, используемые концентрации клеток были недостаточно низкими. Серию разведения следует модифицировать для достижения более низких концентраций клеток в смесях клеточных сред, используемых для создания модифицированных чипов iChips. Аналогичным образом, если ни в одном из этих планшетов не наблюдается роста, концентрации, используемые в смесях клеток и сред, должны быть увеличены. В качестве альтернативы можно предположить, что температура используемой среды была слишком высокой для выживания микроорганизмов. В таком случае среде следует дать максимально остыть без затвердевания перед добавлением в разбавленную клеточную суспензию.
Эта технология является важным шагом вперед на пути к преодолению аномалии большого количества плит. Тем не менее, он по-прежнему ограничен непригодностью традиционных методов культивирования, о чем свидетельствует количество микроорганизмов, которые не выживают при переносе с модифицированного iChip на обычные агаровые пластины. В предыдущих публикациях сообщалось, что многократные раунды субкультуры и инкубации в iChips еще больше увеличивают культивируемость микроорганизмов. Увеличенное время одомашнивания и воздействие факторов роста почвы во время приема агара в iChip увеличивает вероятность того, что колония будет расти только на агаре. Тем не менее, не сообщалось, что этот подход дает более высокую вероятность появления новых микроорганизмов, чем при одной инкубации iChip 25,26.
Многие другие тактики изучаются и модифицируются для повышения культивируемости новых микроорганизмов. Например, было предложено сделать целое устройство iChip из полупроницаемого материала для облегчения совместного культивирования микроорганизмов в соседних скважинах27. Тем не менее, преимуществом конструкции, описанной в этой публикации, является ее низкая стоимость, при этом стоимость изготовления одной пластины составляет примерно 12 долларов США (4 доллара США за 96-луночный планшет, 8 долларов США за мембрану, 2 доллара США за покрытие ПЦР). Кроме того, его простая конструкция делает его несложным инструментом при использовании в соответствии с описанием и предоставляет множество возможностей для настройки. Несмотря на то, что в этом протоколе используется среда, селективная по отношению к бактериям, экспериментальная установка теоретически может быть настроена на нацеливание на желаемую микробную популяцию путем модификации используемой среды, например, использование среды, подавляющей бактерии, для нацеливания на грибы или агар с низким содержанием питательных веществ для спорулирующих микроорганизмов.
Раскрытие информации
Авторы заявили об отсутствии конфликта интересов.
Благодарности
Мы с благодарностью выражаем признательность за финансирование J-base (J-001757, J-001842), предоставленное через Министерство сельского хозяйства и агропродовольственной промышленности Канады, которое сделало этот проект возможным. Мы благодарим Бретта ван Хейнингена за съемку видеоконтента для этого протокола. Мы также хотели бы поблагодарить Рона Маттерса за сбор образцов почвы, использованных в экспериментах, описанных в этой публикации.
Материалы
| Name | Company | Catalog Number | Comments |
| 0.1-20 µL pipette tips | VWR | 76322-158 | Pack of 768 |
| 0.2 mL PCR tubes | ThermoFisher Scientific | AB0337 | Case of 1000 |
| 0.5-5 mL single channel pipette | VWR | CA11020-004 | |
| 1 L glass bottle | Millipore Sigma | CLS13951L | Must be autoclaveable. |
| 100 x 15 mm Petri plates | VWR | 25384-342 | Case of 500 |
| 100% Silicone sealant | Marineland | 31003 | |
| 1000 µL multichannel pipette tips | ThermoFisher Scientific | 9401113 | Case of 960 |
| 100-1000 µL pipette tips | VWR | 76322-164 | Pack of 768 |
| 100-1000 µL single channel pipette | VWR | 76169-240 | |
| 100-1200 µL multichannel pippette | ThermoFisher Scientific | 46300800 | Must have 360 µL volume capacity. |
| 1-10 µL single channel pipette | VWR | 76169-232 | |
| 1-5 mL pipette tips | VWR | CA11020-008 | Pack of 500 |
| 15 mL sterile centrifuge tubes | VWR | CA21008-918 | Case of 500 |
| 16s rRNA-F primer (AGAGTTTGATCCTGGCTCAG) – 10mM | Integrated DNA Technologies | 51-01-19-06 | 10 µg |
| 16s rRNA-R primer (ACGGCTACCTTGTTACGACTT) – 10mM | Integrated DNA Technologies | 51-01-19-07 | 10 µg |
| 4 mm cork borer | VWR | 470121-860 | |
| 50 mL sterile centrifuge tubes | VWR | CA21008-940 | Case of 500 |
| 95% ethanol | Thermo Fisher Scientific | A412-500 | 500 mL |
| 96-well plate | VWR | 10062-900 | Case of 100 |
| Autoclave | Cole-Parmer | UZ-01850-34 | 8 L, 115 VAC |
| Bacteriological agar | ThermoFisher Scientific | 443570010 | 1 kg |
| bin | Thomas Scientific | 1216H91 | 5 bins per pack |
| Casamino acids | ThermoFisher Scientific | 223120 | 500 g |
| Casein digest | ThermoFisher Scientific | 211610 | 500 g |
| Electrofluoresis grade agarose | Thermo Fisher Scientific | J66501.30 | 250 g |
| iBright FL1500 Imaging System | ThermoFisher Scientific | A44115 | |
| Laminar flow hood | CleanTech | 1000-6-A | |
| Minion Nanopore Sequencer | Oxford Nanopore Technologies | MinIon Mk1C | |
| NanoDrop One/One Microvolume UV-Vis Spectrophotometer | ThermoFisher Scientific | ND-ONE-W | |
| Nuclease Free Water | Thermo Fisher Scientific | AM9937 | 10 x 50 mL |
| Nucleobond HMW DNA kit | Takara | 740160.2 | |
| Paper towel | VWR | 89402-824 | |
| Phusion Green Hot Start II High-Fidelity PCR Master Mix | Thermo Fisher Scientific | F566L | 500 Reactions |
| Potato starch | ThermoFisher Scientific | 419690025 | 2.5 kg |
| QIAGEN CLC Genomics Workbench Software or similar | Qiagen | ||
| Rapid Barcoding 24 Kit | Oxford Nanopore Technologies | SQK-RBK114.24 | |
| SimpliAmp thermal cycler | Applied Biosystems | A24811 | |
| Sterile Inoculation loops with needle | VVWR | 76534-512 | Case of 1000 |
| Sterile surgical blade | VWR | 76457-444 | |
| SYBR Safe, or simmilar | ThermoFisher Scientific | S33101 | |
| UltraPure Agarose | ThermoFisher Scientific | 16500-500 | |
| Vortex | VWR | 76549-928 | Must accomadate 15 and 50 mL centrifuge tubes |
| VWR Stereo Zoom Trinocular Microscope | VWR | 89404-476 | |
| Whatman Nuclepore Track-Etched Membranes | Millipore Sigma | WHA113502 | L x W 8 in. x 10 in., pore size 0.03 μm |
Ссылки
- Newman, D. J., Cragg, G. M. Natural products as sources of new drugs over the nearly four decades from 01/1981 to 09/2019. J Nat Prod. 83 (3), 770-803 (2020).
- Fouillaud, M., Dufosse, L. Microbial secondary metabolism and biotechnology. Microorganisms. 10 (1), 123 (2022).
- Rizzetto, G., et al. Role of daptomycin in cutaneous wound healing: A narrative review. Antibiotics. 11 (7), 944 (2022).
- Miethke, M., et al. Towards the sustainable discovery and development of new antibiotics. Nat Rev Chem. 5 (10), 726-749 (2021).
- Gunjal, V., Thakare, R., Chopra, S., Reddy, D. S. Teixobactin: A paving stone toward a new class of antibiotics. J Med Chem. 63, 12171-12195 (2020).
- Atanasov, A. G., Zotchev, S. B., Dirsch, V. M., Supuran, C. T. Natural products in drug discovery: Advances and opportunities. Nat Rev Drug Discov. 20 (3), 200-216 (2021).
- Epstein, S. S. The phenomenon of microbial uncultivability. Curr Opin Microbiol. 16 (5), 636-642 (2013).
- Wright, G. An irresistible newcomer. Nature. 517, 422-444 (2015).
- Berdy, B., Spoering, A., Ling, L., Epstein, S. In situ cultivation of previously uncultivable microorganisms using the ichip. Nat Protoc. 12 (10), 2232-2242 (2017).
- Jung, D., et al. Triggering growth via growth initiation factors in nature: A putative mechanism for in situ cultivation of previously uncultivated microorganisms. Front Microbiol. 12, 537194 (2021).
- Nichols, D., et al. Use of ichip for high-throughput in situ cultivation of "uncultivable" microbial species. Appl Environ Microbiol. 76 (8), 2445-2450 (2010).
- Megaw, J., Kelly, S. A., Thompson, T. P., Skvortsov, T., Gilmore, B. F. Profiling the microbial community of a triassic halite deposit in Northern Ireland: An environment with significant potential for biodiscovery. FEMS Microbiol Lett. 366 (22), fnz242 (2019).
- Vitorino, I., et al. Novel and conventional isolation techniques to obtain planctomycetes from marine environments. Microorganisms. 9 (10), 2078 (2021).
- Moote, P., Polo, R. O., Uwiera, R. R. E., Inglis, G. D. Comparison of strategies for isolation anaerobic bacteria from the porcine intestine. Appl Environ Microbiol. 87 (9), e00088-e00121 (2021).
- Vitorino, I. R., et al. Rhodopirellula aestuarii sp. Nov., a novel member of the genus rhodopirellula isolated from brackish sediments collected in the tagus river estuary, Portugal. Syst Appl Microbiol. 45 (6), 126360 (2022).
- Ding, H., et al. Hanstruepera marina sp. Nov. and Hanstruepera flava sp. Nov., two novel species in the family flavobacteriaceae isolated by a modified in situ cultivation technique from marine sediment. Front Microbiol. 13, 957397 (2022).
- Ling, L. L., et al. A new antibiotic kills pathogens without detectable resistance. Nature. 517 (7535), 455-459 (2015).
- Qi, Y. K., et al. Discovery, synthesis, and optimization of teixobactin, a novel antibiotic without detectable bacterial resistance. J Pept Sci. 28 (11), e3428 (2022).
- Piddock, L. J. Teixobactin, the first of a new class of antibiotics discovered by ichip technology. J of Antimicrob Chemother. 70 (10), 2679-2680 (2015).
- Gong, L., Wong, C. H., Idol, J., Ngan, C. Y., Wei, C. L. Ultra-long read sequencing for whole genomic DNA analysis. J Vis Exp. (145), e58954 (2019).
- Covington, B. C., Xu, F., Seyedsayamdost, M. R. A natural product chemist's guide to unlocking silent biosynthetic gene clusters. Annu Rev Biochem. 90, 763-788 (2021).
- Lee, N., et al. Mini review: Genome mining approaches for the identification of secondary metabolite biosynthetic gene clusters in Streptomyces. Comput Mol Biol. 18, 1548-1556 (2020).
- Kaeverlein, T., Lewis, K., Epstein, S. S. Isolating "uncultivable" microorganisms in pure culture in a simulated natural environment. Science. 296 (5570), 1127-1129 (2002).
- Trcek, J., Mira, N. P., Jarboe, L. R. Adaptation and tolerance of bacteria against acetic acid. Appl Microbiol Biotechnol. 99 (15), 6215-6229 (2015).
- Kurm, V., Van Der Putten, W. H., Hol, W. H. G. Cultivation-success of rare soil bacteria is not influenced by incubation time and growth medium. PLOS One. 14 (1), e0210073 (2019).
- Buerger, S., et al. Microbial scout hypothesis and microbial discovery. Appl Environ Microbiol. 78 (9), 3229-3233 (2012).
- Lodhi, A. F., Zhang, Y., Adil, M., Deng, Y. Antibiotic discovery: Combining isolation chip (ichip) technology and co-culture technique. Appl Microbiol Biotechnol. 102 (17), 7333-7341 (2018).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены