Method Article
iChip Teknolojisi Kullanılarak Toprak Mikroorganizmalarının İzolasyonu
Bu Makalede
Özet
iChip tekniği, topraktan yeni mikroorganizma keşfi oranlarını artıran ucuz ve basit bir yerinde izolasyon cihazı kullanır. Yeni mikroorganizmalar, diğer uygulamaların yanı sıra toprak mikrobiyomu veya doğal ürün keşfi ile ilgili daha fazla çalışma için kullanılabilir.
Özet
iChip izolasyon tekniği, daha önce kültürlenemeyen mikroorganizmaların yetiştirilebilirliğini artıran yerinde bir izolasyon cihazı kullanır. Mikroorganizmalar, yeni kimyasalların ve potansiyel olarak biyoaktif moleküllerin önemli bir kaynağıdır. Bununla birlikte, çevresel mikroorganizmaların sadece% 1'i geleneksel laboratuvar yöntemleri kullanılarak kültürlenebilir. Antimikrobiyal direncin artmasıyla birlikte, enfeksiyonlar ve hastalıklarla mücadele etmek için yeni ilaçlar bulmak her şeyden önemlidir ve yeni molekülleri bulmak için kritik bir yöntem yeni mikroorganizmaların keşfidir. Yarı geçirgen bir zar ile kapatılmış ve toprağın üzerinde inkübe edilmiş 96 oyuklu bir plakanın kuyularında toprak mikroorganizma kolonilerini inkübe ederek, mikroplar topraktan su ve büyüme faktörleri ile temas halindedir ve yeni mikropların laboratuvar ortamında izole edilmesine olanak tanır. Bir iChip'te bir süre evcilleştirildikten sonra, mikroorganizmalar potansiyel olarak geleneksel ortama alt kültürlenebilir ve daha fazla çalışma için kullanılabilir. Bu cihaz, biyoaktif molekül keşfi ve toprak mikrobiyom araştırmaları için değerlidir ve daha önce her iki uygulamada da kullanılmıştır.
Giriş
Çevresel bakteriler zengin bir doğal ürün (NP) kaynağıdır1. Bu metabolitler, mikroorganizmaların hayatta kalması için hayati öneme sahip değildir, bunun yerine çevrelerindeki diğer mikroorganizmaları geride bırakarak kolonizasyonlarını kolaylaştırmak için üretilirler2. Evrim, NP'lerin kimyasal yapılarına ve aktivitelerine ince ayar yaparak onları etkili antimikrobiyal ajanlar haline getirdi. Böyle bir örnek, 2003 yılında FDA tarafından onaylanan bir antibiyotik olan daptomisin'dir3. Son yıllarda, mikrobiyal direncin oluşumu ve şiddeti artmıştır ve daptomisin gibi yeni ilaçlar, eski antibiyotiklere direnç geliştiren enfeksiyonlara karşı son basamak tedaviler olarak durmaktadır4. Yeni antibiyotiklerin ve diğer ilaçların geliştirilmesi, yaygın enfeksiyonları ve hastalıkları tedavi edilebilir kılmak için çok önemlidir.
NP'ler genellikle iyi ilaç öncüleri yapsa da, ilaç endüstrisi 1950'lerden 1960'lara kadar antibiyotiklerin altın çağından sonra ilaç keşfi için sentetik yöntemlere yöneldi5. 1970'lere gelindiğinde, aynı mikroorganizmalar ve antimikrobiyal metabolitler tekrar tekrar yeniden izole edilmeye devam ettive giderek daha az sayıda yeni ilaç adayı keşfedildi 1,6. Toprak mikrobiyomu büyük mikrobiyal çeşitlilik içerir, ancak geleneksel laboratuvar koşullarında yalnızca az sayıda mikroorganizma izole edilebilir. Genomik tarafından tespit edilen mikroorganizmaların toprak mikroorganizmalarının büyük çoğunluğu, geleneksel kültür yöntemleri kullanılarak kültürlendiğinde gözlenmez ve bu da sorunun "büyük plaka sayısı anomalisi" olarak adlandırılmasına yol açar7. Bu kültürlenemeyen mikroplar, var oldukları bilindiği için mikrobiyal karanlık madde olarak adlandırılmıştır, ancak saf kültürler olarak izole edilinceye kadar in vitro olarak incelenemezler. Bu kültürlenemeyen mikroorganizmalar, mikrobiyal direnç çağında büyük önem taşıyan çok sayıda ilaç adayı üretebilir.
iChip tekniği, yeni mikroorganizmaların çevreden geri kazanımını artırmak için kullanılabilecek bir yöntemdir 8,9. Bu teknoloji, inkübasyon sırasında bakterilerin doğal ortamını simüle etmeye yardımcı olur, böylece aksi takdirde geleneksel laboratuvar koşullarında hayatta kalamayan mikroorganizmaların yetiştirilebilirliğini arttırır10. Modifiye iChip'ler zaten geliştirilmiş ve mikroorganizmaları toprak, tortu, deniz ortamları ve hayvan bağırsakları gibi birçok farklı kaynaktan izole etmek için kullanılmıştır 11,12,13,14,15,16. Bu teknolojinin kullanımının belki de en etkili örneği, yeni bir bakteri olan Eleftheria terrae'nin keşfedildiği NovoBiotic Pharmaceuticals tarafından olmuştur17. Bu mikroorganizmanın, direnç gelişimi tespit edilmeden insan sağlığına uygun birkaç dirençli bakteri türünü inhibe eden yeni bir sınıfın antibiyotiği olan Teixobactin'i ürettiği bulundu 5,18. Bu etkili bir keşifti, çünkü Teixobactin on yıllardır keşfedilen ilk yeni antibiyotik sınıfıdır ve bu tekniğin yeni ilaç keşifleri ve büyük plaka sayısı anomalisi19'un üstesinden gelmek için umut verici bir yol olduğunun bir işaretidir. Burada, Berdy ve ark. kullanım kolaylığı ve kontaminasyon önleme için optimize edilmiş9.
Protokol
1. Ortam hazırlama ve sterilizasyon
- 1 L suda 0.1 g patates nişastası, 1 g kasamino asit, 0.125 g kazein sindirimi ve 15 g bakteriyolojik veya teknik agardan oluşan süksinat minimal tuz ortamını (SMS) hazırlayın ve sterilize edin.
- 20 dakika, 121 ° C'lik bir sıvı döngüsü kullanarak ortamı ve 100 mL moleküler dereceli suyu otoklavla sterilize edin.
NOT: Pipet uçları ve santrifüj tüpleri de dahil olmak üzere agar hücresi karışımıyla temas edecek diğer tüm öğelerin steril olarak satın alındığından emin olun, aksi takdirde bunları da otoklavlayın.
2. Modifiye iChip yapısı
- 5 mm'lik bir agar zımba aleti kullanarak dört adet 96 oyuklu plakadaki kuyuların tabanlarını çıkarın.
- 0,05 μm polikarbonat membranları 7,6 cm x 11 cm dikdörtgenler halinde veya 96 oyuklu plakanın tabanının boyutlarına eşit olarak kesin.
- Silikon bir dolgu macunu kullanarak, 96 oyuklu plakaların dibine 0,05 μm polikarbonat membranlar yapıştırın, yapıştırıcının kuyucukları sızdırmaz hale getirdiğinden, ancak kuyuların açıklıklarını tamamen kaplamadığından emin olun. En az 24 saat kurumaya bırakın veya yapıştırıcı üzerindeki talimatlara uyun.
NOT: Mastik su geçirmez, toksik olmayan ve %100 silikon olmalıdır. Çoğu akvaryum sızdırmazlık maddesi iyi çalışacaktır.
3. Hücre süspansiyonlarının hazırlanması
- Dört adet 15 mL santrifüj tüpü AD ve dört adet 50 mL santrifüj tüpü EH etiketleyin ve her birine 4,5 mL steril su ekleyin.
- 50 mL'lik bir santrifüj tüpüne 1 g toprak ölçün, 10 mL steril su ekleyin ve 10 dakika girdap yapın.
- Toprak süspansiyonunun 10 dakika oturmasına izin verin.
- Topraktan süpernatan içeren hücrelerin 0.5 mL'sini A tüpüne pipetleyin ve iyice karıştırın.
- Tüp A'daki hücre süspansiyonunun 0.5 mL'sini tüp B'ye ekleyin ve iyice karıştırın. 0.5 mL çözelti B'yi C tüpüne aktarın ve iyice karıştırın. Kalan tüm santrifüj tüpleri için bunu tekrarlayın ve sekiz santrifüj tüpü boyunca bir dizi 10 kat seyreltme işlemini tamamlayın.
- Tüm tüplerde eşit hacme sahip olmak için H tüpünden 0,5 mL çıkarın.
NOT: Bu konsantrasyonlar yerel topraklar için optimize edilmiştir. Bu prosedürü ilk kez denerken, uygun numune konsantrasyonunu bulmak için daha geniş bir seyreltme aralığı gerçekleştirin.
4. Modifiye iChip aşılaması
- İChips'i en az 15 dakika boyunca %95 etanole tamamen batırın.
- Plakaları etanolden çıkarın ve steril kağıt havlu üzerine yerleştirin. Etanolün buharlaşmasına izin verirken, daha fazla sterilize etmek için UV sterilizatörünü laminer akış başlığında 15 dakika boyunca açın.
- 360 μL steril SMS ortamını kontrol kuyusu görevi görmesi için plakanın ilk sütununa pipetleyin.
- 50 ° C'ye soğutulmuş 45 mL SMS'yi tüp E'deki hücre süspansiyonuna ekleyin ve hücre süspansiyonu ile agar'ı birleştirmek için iyice karıştırın.
- Adım 4.4'ten itibaren 360 μL'lik agar hücresi karışımını 96 oyuklu plakanın diğer tüm kuyucuklarına pipetleyin.
NOT: Agar hızlı bir şekilde katılaştığı için çok kanallı bir pipet önerilir. Mikroorganizmaları öldürme riski nedeniyle agar hücresi karışımının karıştırıldıktan sonra tekrar ısıtılması tavsiye edilmez. - Ortam ayarlandıktan sonra, plakaların üst kısmını bir PCR plaka kapağı ile kapatın.
- Toplam dört iChip'i konsantrasyonlarda on kat farkla doldurmak için 3.3 ila 3.6 arasındaki adımları FH tüpleriyle tekrarlayın.
NOT: Ortam, gerektiğinde gevşetilmiş bir kapakla 30 saniye boyunca mikrodalgada pişirilebilir veya her biri için erimiş kalmasını sağlamak için plakalar arasında 60 °C'lik bir sıcak su banyosunda tutulabilir.
5. Kuluçka
- Plakaları, membran tarafı aşağı bakacak şekilde, adım 3.2'de kullanılan toprağın yaklaşık bir inçini içeren bir kutuya yerleştirin ve kapağı yerleştirin.
- Plakaları kapalı kapta, 25 ° C'de karanlık bir yerde inkübe edin.
NOT: Bir hafta sonra, kurulum sırasında kontaminasyon oluşmadığından emin olmak için değiştirilmiş iChip'lerin içeriğini inceleyin. Kontaminasyon, bir plakanın tüm oyuklarında tek veya birkaç mikroorganizmanın aşırı büyümesi ile gösterilir. - 6 hafta sonra iChips'i inceleyin. Koloni izolasyonu için oyukların% 25'inden daha azında büyüme içeren plakaları kullanın.
6. Koloni izolasyonu
- Tüm kir parçacıklarını gidermek için modifiye edilmiş iChips 3x'i steril suyla durulayın.
- Plakanın üstünü ve yanlarını% 95 etanol ile silin, yarı geçirgen zarın bulunduğu taraftan kaçının.
- Steril bir bıçak kullanarak, bir koloni içeren bir kuyucuğun etrafındaki plaka kapağını kesin.
- Steril bir çizgi aleti kullanarak, koloniyi delin ve dört kadran yöntemini kullanarak 100 x 15 mm'lik plakalar halinde SMS agar üzerine çizin.
- Kuyucuk başına bir koloni yetiştiren iChips'teki diğer tüm koloniler için tekrarlayın.
NOT: Küçük koloniler için, plaka tekrar toprağa yerleştirilebilir ve plaka örtüsü kuyu etrafından çıkarılmadığı sürece alt kültür için yeterince büyük olana kadar inkübe edilebilir. - SMS plakalarını 25 °C'de inkübe edin ve büyümeyi izleyin.
- Aksenik kültürlerin izole edildiğinden emin olmak için kolonileri inceleyin.
7. Mikroorganizmaların tanımlanması
- Geri kazanılan izolatların genomlarını sıralayın20.
- Her bir izolatın GenomesDB'deki bilinen mikroorganizmalarla benzerlik derecesini belirlemek için JSpeciesWS veya başka bir genom tabanlı tanımlama platformu kullanarak genomları değerlendirin.
- Türlerin tanımlanması için topluluk tarafından kabul edilen eşiklerin altındaki izolatları, varsayılan olarak yeni olarak kategorize edin.
Sonuçlar
Protokolün görsel bir genel bakışı Şekil 1'de gösterilmiştir. Başarılı bir modifiye iChip deneyi, kontrol kuyularında herhangi bir büyüme meydana gelmeden, kuyuların %25'inden daha azında büyüme içeren en az bir plaka ile sonuçlanır. Büyüme gösteren bu kuyu sayısı genellikle tek kolonilerin kuyularda izole edilmesini sağlar. Ek olarak, kolonilerin sayısı veya koloni içeren kuyucukların sayısı, seyreltme serisinden hazırlanan sonraki her bir plaka ile on kat azalmalıdır. Temsili sonuçlar Şekil 2'de gösterilmiştir. burada plaka 7 ve 8, kuyuların %25'inden daha azında büyüme içerdiğinden ve Tablo 1'de gösterildiği gibi koloni içeren kuyuların yüzdesi her plakayla birlikte azaldığından başarılı iChip'lerdir. Bir denemedeki tüm plakalar kuyucuk başına birden fazla koloni içeriyorsa veya herhangi bir kuyucukta koloni yoksa, bu olumsuz bir sonuç oluşturur.
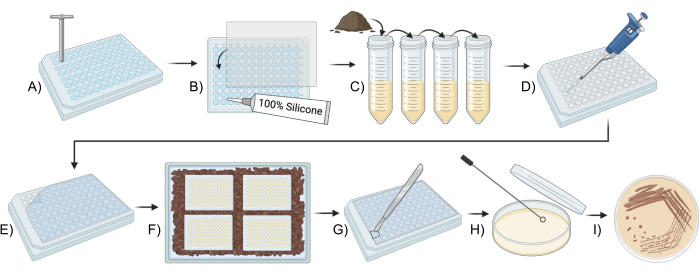
Şekil 1: Toprak mikroplarını kültürlemek için modifiye edilmiş bir iChip kullanmak için şematik genel bakış. (A,B) Plakanın yapısı (Adım 2). (C) Aşının hazırlanması (Adım 3). (D,E) iChip kurulumu (Adım 4). (F) iChip'in inkübasyonu (adım 5). (G-I) İzolatların konvansiyonel ortama aktarılması (Adım 6). Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
| Ichip Teknolojisi | Agar süspansiyonunda toprak konsantrasyonu | Kolonili kuyular | Koloni Oluşturan Birimler |
| E | 5.0 x 10-6 g/mL | Tüm | Sayılamayacak kadar çok |
| F | 5.0 x 10-7 g/mL | Tüm | Sayılamayacak kadar çok |
| G | 5.0 x 10-8 g/mL | 22 | 22 |
| H | 5.0 x 10-9 g/mL | 6 | 6 |
Tablo 1: Koloni içeren kuyucuk sayısının seri olarak her seyreltme ile azaldığı başarılı bir iChip deneyinden elde edilen temsili veriler.
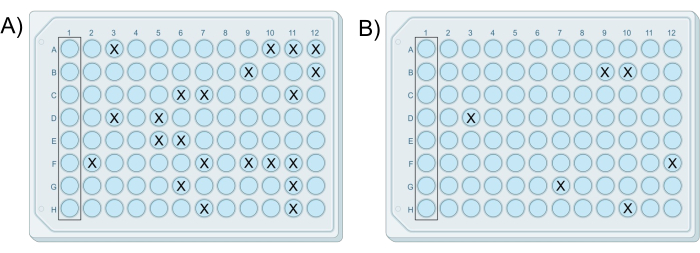
Şekil 2: İki başarılı modifiye iChip'in örnek sonuçları. iChips, (A) hücre-agar karışımı G'den hazırlanan plakanın 22 koloni içerdiği ve (B) hücre-agar karışımı H'den hazırlanan plakanın, karışımlar arasındaki 10 kat seyreltme farkıyla tutarlı olarak altı koloni içerdiği aynı deneyden alınmıştır. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Şekil 3A-G'de gösterildiği gibi koloniler çıplak gözle veya mikroskopi ile görselleştirilebilir. Koloniler, Şekil 3B'de görüldüğü gibi agarın yüzeyinde büyüyor olabilir veya Şekil 3F'deki koloni gibi agarın içine gömülü olabilir. Şekil 3G'deki gibi başarılı bir modifiye iChip'te aynı kuyuda iki koloninin bulunduğu durumlar olabilir. Bazı durumlarda, koloniler birbirinden ayrı ayrı bir iğne ile delinebilecek ve alt kültürlenebilecek kadar uzaktır; bununla birlikte, Şekil 3G'dekilerin aksenik mikroorganizmalar olarak kolayca kültürlenmesi olası değildir. İChip'ten geleneksel SMS ortamına aktarılan koloni örnekleri Şekil 4'te gösterilmektedir.
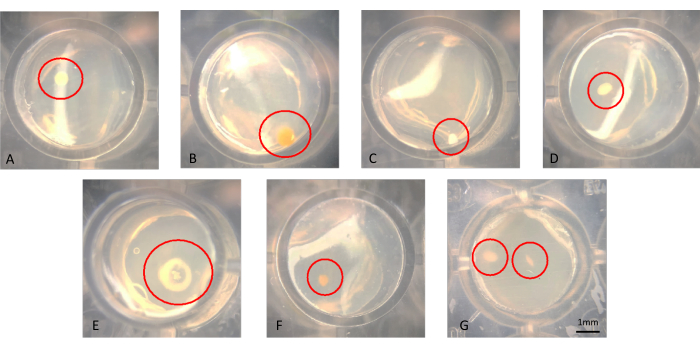
Şekil 3: 6 haftalık inkübasyondan sonra bir iChip'te büyüyen kolonilerin temsili mikroskobik görünümü. (AF) Alt kültüre alınması gereken tek koloniler gözlenir ve (G) içinde aksenik kültür olarak elde edilmesi zor olan yakın mesafede iki koloni gözlenir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
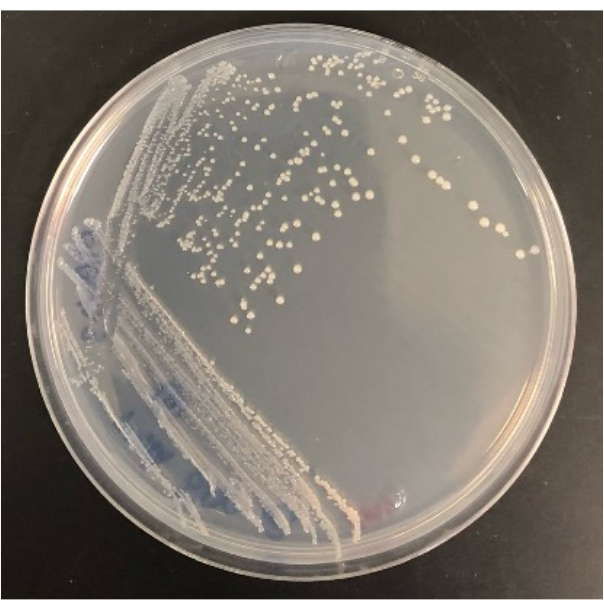
Şekil 4: Bir SMS agar plakası üzerinde büyüdüğünde modifiye edilmiş iChip'ten izole edilen bir bakterinin temsili sonucu. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Kolonileri modifiye edilmiş iChip'ten geleneksel agar plakalarına izole etme yeteneği de deneyin başarısını belirler. Modifiye edilmiş iChip'te büyüyen tüm koloniler, geleneksel plakalara transferden sağ çıkamayacaktır. Bir iChip'te koloniler büyüme faktörlerine ve toprak besinlerine maruz kalarak yetiştirilebilirliklerini artırır. Bazı mikroorganizmalar için, evcilleştirme süresi, onları geleneksel koşullarda kültürlenebilir hale getirmek için yeterli değildir. Bir iChip'ten plakalara kolonilerin geri kazanım oranı deneyden deneye değişecektir, ancak bu yöntem aynı zamanda kolayca kültürlenebilen mikroorganizmaları da kültürleyeceğinden bazıları plakalarda büyümelidir. Örneğin, Şekil 2'deki modifiye iChip'ler toplamda 28 koloni içeriyordu ve alt kültürden sonra agar plakalarında büyüyen koloni sayısı 16 iken, 12'si transferden sağ çıkamadı. İzolatlar, Şekil 4'te gösterildiği gibi, tam boyutlu agar plakaları üzerinde kültürlendikten sonra tanımlanabilir ve daha fazla çalışma için kullanılabilir.
Başarılı bir modifiye iChip deneyi, tür düzeyinde bilinen mikroorganizmalardan farklı mikroorganizmaların izolasyonu ile sonuçlanmalıdır. Her bir izolatın bilinen mikroorganizmalara benzerlik derecesi, izole edilen DNA'nın bilinen mikroorganizmaların genomları ile karşılaştırılmasıyla bulunur. Her bir izolata en yakın ilişkili mikroorganizmaların tetra Z skorları, yüzde benzerliği tanımlar. Şekil 5 , izole edilen on iki bakteriden dördünün yeni tür veya daha yüksek olduğunu, ikisinin muhtemelen yeni suşlar olduğunu ve altısının bilinen mikroorganizmalar olduğunu göstermektedir. Birkaç yeni türün veya suşun geri kazanılması, daha önce yayınlanmış iChip deneyleriyle tutarlıdır, bu da bu değiştirilmiş iChip yapısının yeni türlerin geri kazanımındaki artışı engellemediğini gösterir11.
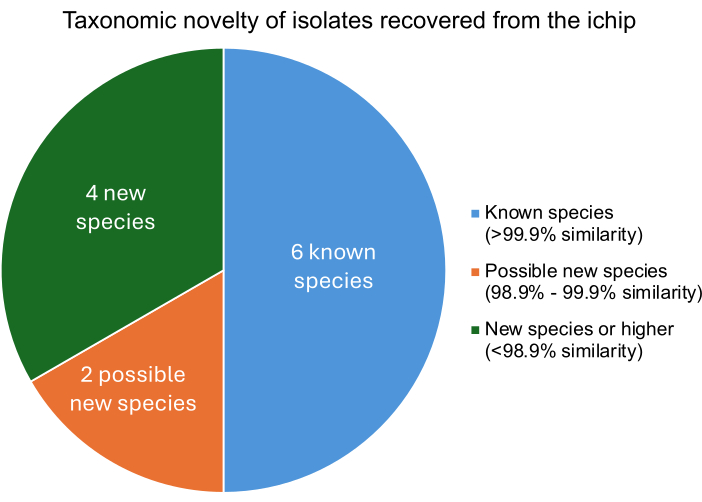
Şekil 5: Bir iChip deneyinden elde edilen izolatların taksonomik sınıflandırma seviyesi. Yüzde benzerlik, izolatların bilinen bakterilere benzerliğini tanımlayan tetra Z skorlarına göre belirlendi, burada %>99.9 benzerlik bir tür eşleşmesini, %98.9-%99.9 benzerlik olası yeni bir türü ve %<98.9 benzerlik yeni bir tür veya daha yüksek bir türü gösteriyor. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Tartışmalar
Genom madenciliği ve sessiz biyosentetik yolların incelenmesi gibi çok sayıda yöntem, son yıllarda yeni biyoaktif kimyasalların keşfini kolaylaştırmıştır21,22. Bununla birlikte, bu tür yöntemler kullanılarak keşfedilen NP'ler genellikle bilinen bileşiklere yüksek yapısal benzerlik gösterir. Daha önce kültürlenmemiş mikroorganizmalara erişim sağlamak, mikrobiyal dirençle mücadelede daha iyi yardımcı olabilecek yeni etki modlarına sahip daha fazla kimyasal çeşitliliğin ve NP'lerin kilidini açacaktır. İChip izolasyon tekniğinin, yeni NP'lerin keşfi için mikroorganizma kütüphaneleri oluşturmak için kullanılabilecek yeni mikroorganizmaların yetiştirilebilirliğini arttırdığı gösterilmiştir.
Bir iChip'in en eski kavramsallaştırması, yarı geçirgen zarlarla kapatılmış ve yerinde 23 inkübe edilmiş bir agar hücre karışımı içeren tek metal halkalardan oluşan2002 yılında yayınlandı. Daha sonra 2010 yılında birçok kuyu11 içeren küçük bir çip içerecek şekilde yinelendi, ardından 2017'de etkili bir Nature Protocols yayınında ortak laboratuvar malzemelerinden yapılmış ucuz bir iChip geliştirildi9. Pratikliğini ve kullanım kolaylığını artırmak için bu yayındaki Nature protokolünde çeşitli değişiklikler yapılmıştır. Nature protokolü, bir tarafında yapışkan bir plaka kapağı kullanan bu yönteme kıyasla bir çipin her iki tarafına yarı geçirgen bir zarın yapıştırılmasını içerir. İChip yüklendikten sonra zarı yapıştırmak için silikon yapıştırıcı kullanılırken sorunlar ortaya çıkabilir. Bildiğimiz kadarıyla, tüm toksik olmayan silikon yapıştırıcılar sertleştikçe asetik asit yayar ve bu da hücre canlılığını etkileyebilir24. Bu videoda özetlenen protokol, doldurulmuş plakayı kapatmak için PCR plaka kapağını kullanarak aşılamadan sonra gereken işlem miktarını da önemli ölçüde azaltır, steriliteyi daha da sağlar ve kurulum süresini azaltır. Bu deneyden elde edilen çok sayıda yeni izolatın tanımlanmasına dayanarak, yalnızca tek bir yarı geçirgen zarın kullanılması, iki yarı geçirgen zarla inşa edilen iChip'ler için bildirilen yeni organizma keşfi oranlarındaki artışı engellemektedir. Bununla birlikte, etkiyi ölçmek için daha büyük bir örneklem boyutuna sahip daha fazla deney gerekecektir.
Başka bir yöntem modifikasyonu, kuyuların %25'inden daha azında büyüme içeren modifiye edilmiş iChip'lerden yalnızca alt kültüre tabi tutulmasıdır. Bir plakanın oyuklarının çoğunda koloniler büyürse, kolayca görünmese bile birden fazla mikroorganizma içeren bazı kuyular olması muhtemeldir. Yöntem geliştirme sırasında, birden fazla koloni içeren kuyulardan alt kültür yapılırken aksenik kültürler elde etmenin büyük ölçüde imkansız olduğu bulunmuştur. Aksenik olmayan kültürlerin izolasyonu, biyoaktivite tahlilleri ve tanımlaması açısından aşağı yönde önemli sorunlar ortaya çıkarmaktadır. Bu nedenle, basitlik için, yalnızca kuyucukların bir kısmında büyüyen kolonilere sahip modifiye edilmiş iChips'lerin alt kültüre alınması önerilir.
iChip yöntemleri ile ortaya çıkabilecek en önemli sorun, kuyuların veya tüm iChip'lerin diğer mikroorganizmalarla kontaminasyonudur. Kontaminasyon, kontrol kuyularında büyüyen koloniler veya birkaç kuyucuk veya modifiye edilmiş iChip'in tüm alanı boyunca büyüyen aynı mikroorganizma ile gösterilir. Kontaminasyonun kaynağı, kurulum sırasında malzemelerin yetersiz sterilizasyonundan veya uygun olmayan aseptik teknikten kaynaklanıyor olabilir. Bu gibi durumlarda, kullanılan tüm malzemelerin yöntemde belirtildiği gibi otoklav veya etanol ile sterilize edildiğinden emin olun ve steril olmayan herhangi bir ürün ile agar hücresi karışımı dışında modifiye edilmiş iChip arasında hiçbir temas olmadığından emin olun. Birden fazla modifiye edilmiş iChip kuyusunun altında veya üstünde tek bir mikroorganizmanın aşırı büyümesi gözlenirse, bu büyük olasılıkla kuyucuklar ve zar arasındaki eksik bir sızdırmazlığın sonucudur. Bu durumda, kullanılan yapıştırıcının etanolde bozunmayan %100 silikon olduğundan emin olun ve inşaat sırasında yarı geçirgen membran ve PCR plaka kapağının her bir kuyucuğun etrafına tamamen kapatıldığından emin olun.
Mevcut protokolde kullanılan seyreltme serisi, bin kat seyreltme aralığı içerdiğinden, bir haftadan daha az bir depolama süresi ile çoğu toprak türü için yeterli seyreltme sağlamalıdır. Bununla birlikte, toprak türleri arasında mikroorganizma sayımlarında önemli farklılıklar olabilir. Kontrol kuyuları büyüme içermiyorsa, ancak dört modifiye iChip'in her birinde birden fazla koloni büyüyorsa, kullanılan hücre konsantrasyonları yeterince düşük değildi. Seyreltme serisi, modifiye edilmiş iChips'i kurmak için kullanılan hücre-ortam karışımlarında daha düşük hücre konsantrasyonlarına ulaşacak şekilde modifiye edilmelidir. Benzer şekilde, bu plakaların hiçbirinde büyüme gözlenmezse, hücre-ortam karışımlarında kullanılan konsantrasyonlar arttırılmalıdır. Alternatif olarak, kullanılan ortamın sıcaklığının mikroorganizmaların hayatta kalması için çok yüksek olması mümkündür. Böyle bir durumda, seyreltilmiş hücre süspansiyonuna eklenmeden önce ortamın katılaşmadan mümkün olduğunca soğumasına izin verilmelidir.
Teknoloji, büyük plaka sayısı anomalisinin üstesinden gelmeye yönelik önemli bir ilerlemedir. Bununla birlikte, modifiye edilmiş iChip'ten geleneksel agar plakalarına transferden sağ çıkamayan mikroorganizmaların sayısı ile gösterildiği gibi, geleneksel kültürleme tekniklerinin uygun olmaması ile hala sınırlıdır. Önceki yayınlar, iChips'te çoklu alt kültür ve inkübasyon turlarının mikroorganizmaların yetiştirilebilirliğini daha da artırdığını bildirmiştir. Uzun evcilleştirme süresi ve iChip'te agar üzerindeyken toprak büyüme faktörlerine maruz kalma, bir koloninin tek başına agar üzerinde büyüme şansını artırır. Bununla birlikte, bu yaklaşımın tek bir iChip inkübasyonundan daha yüksek bir yeni mikroorganizma olasılığı sağladığı bildirilmemiştir25,26.
Yeni mikroorganizmaların yetiştirilebilirliğini artırmak için başka birçok taktik araştırılmakta ve değiştirilmektedir. Örneğin, komşu kuyulardaki mikroorganizmaların ko-kültürünü kolaylaştırmak için yarı geçirgen bir malzemeden bütün bir iChip cihazının yapılması önerilmiştir27. Bununla birlikte, bu yayında özetlenen inşaatın bir avantajı, yaklaşık 12 $ 'a (96 oyuklu plaka başına 4 $, membran başına 8 $, PCR kapağı başına 2 $) eşit bir plaka inşa etme maliyeti ile düşük maliyetidir. Ayrıca, basit yapısı, açıklandığı gibi kullanıldığında onu karmaşık olmayan bir araç haline getirir ve özelleştirme için birçok olanak sağlar. Bu protokol bakteriler için bir ortam seçici kullansa da, deney düzeneği teorik olarak, mantarları hedeflemek için bakteri baskılayıcı ortam veya sporlanan mikroorganizmalar için düşük besinli agar kullanmak gibi, kullanılan ortamı değiştirerek istenen bir mikrobiyal popülasyonu hedeflemek için ayarlanabilir.
Açıklamalar
Yazarlar herhangi bir çıkar çatışması olmadığını beyan etmişlerdir.
Teşekkürler
Bu projeyi mümkün kılan Tarım ve Tarım-Gıda Kanada aracılığıyla sağlanan J-base finansmanını (J-001757, J-001842) minnetle kabul ediyoruz. Brett van Heyningen'e bu protokol için video içeriğini çektiği için teşekkür ederiz. Bu yayında açıklanan deneylerde kullanılan toprak örneklerini topladığı için Ron Matters'a da teşekkür ederiz.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 0.1-20 µL pipette tips | VWR | 76322-158 | Pack of 768 |
| 0.2 mL PCR tubes | ThermoFisher Scientific | AB0337 | Case of 1000 |
| 0.5-5 mL single channel pipette | VWR | CA11020-004 | |
| 1 L glass bottle | Millipore Sigma | CLS13951L | Must be autoclaveable. |
| 100 x 15 mm Petri plates | VWR | 25384-342 | Case of 500 |
| 100% Silicone sealant | Marineland | 31003 | |
| 1000 µL multichannel pipette tips | ThermoFisher Scientific | 9401113 | Case of 960 |
| 100-1000 µL pipette tips | VWR | 76322-164 | Pack of 768 |
| 100-1000 µL single channel pipette | VWR | 76169-240 | |
| 100-1200 µL multichannel pippette | ThermoFisher Scientific | 46300800 | Must have 360 µL volume capacity. |
| 1-10 µL single channel pipette | VWR | 76169-232 | |
| 1-5 mL pipette tips | VWR | CA11020-008 | Pack of 500 |
| 15 mL sterile centrifuge tubes | VWR | CA21008-918 | Case of 500 |
| 16s rRNA-F primer (AGAGTTTGATCCTGGCTCAG) – 10mM | Integrated DNA Technologies | 51-01-19-06 | 10 µg |
| 16s rRNA-R primer (ACGGCTACCTTGTTACGACTT) – 10mM | Integrated DNA Technologies | 51-01-19-07 | 10 µg |
| 4 mm cork borer | VWR | 470121-860 | |
| 50 mL sterile centrifuge tubes | VWR | CA21008-940 | Case of 500 |
| 95% ethanol | Thermo Fisher Scientific | A412-500 | 500 mL |
| 96-well plate | VWR | 10062-900 | Case of 100 |
| Autoclave | Cole-Parmer | UZ-01850-34 | 8 L, 115 VAC |
| Bacteriological agar | ThermoFisher Scientific | 443570010 | 1 kg |
| bin | Thomas Scientific | 1216H91 | 5 bins per pack |
| Casamino acids | ThermoFisher Scientific | 223120 | 500 g |
| Casein digest | ThermoFisher Scientific | 211610 | 500 g |
| Electrofluoresis grade agarose | Thermo Fisher Scientific | J66501.30 | 250 g |
| iBright FL1500 Imaging System | ThermoFisher Scientific | A44115 | |
| Laminar flow hood | CleanTech | 1000-6-A | |
| Minion Nanopore Sequencer | Oxford Nanopore Technologies | MinIon Mk1C | |
| NanoDrop One/One Microvolume UV-Vis Spectrophotometer | ThermoFisher Scientific | ND-ONE-W | |
| Nuclease Free Water | Thermo Fisher Scientific | AM9937 | 10 x 50 mL |
| Nucleobond HMW DNA kit | Takara | 740160.2 | |
| Paper towel | VWR | 89402-824 | |
| Phusion Green Hot Start II High-Fidelity PCR Master Mix | Thermo Fisher Scientific | F566L | 500 Reactions |
| Potato starch | ThermoFisher Scientific | 419690025 | 2.5 kg |
| QIAGEN CLC Genomics Workbench Software or similar | Qiagen | ||
| Rapid Barcoding 24 Kit | Oxford Nanopore Technologies | SQK-RBK114.24 | |
| SimpliAmp thermal cycler | Applied Biosystems | A24811 | |
| Sterile Inoculation loops with needle | VVWR | 76534-512 | Case of 1000 |
| Sterile surgical blade | VWR | 76457-444 | |
| SYBR Safe, or simmilar | ThermoFisher Scientific | S33101 | |
| UltraPure Agarose | ThermoFisher Scientific | 16500-500 | |
| Vortex | VWR | 76549-928 | Must accomadate 15 and 50 mL centrifuge tubes |
| VWR Stereo Zoom Trinocular Microscope | VWR | 89404-476 | |
| Whatman Nuclepore Track-Etched Membranes | Millipore Sigma | WHA113502 | L x W 8 in. x 10 in., pore size 0.03 μm |
Referanslar
- Newman, D. J., Cragg, G. M. Natural products as sources of new drugs over the nearly four decades from 01/1981 to 09/2019. J Nat Prod. 83 (3), 770-803 (2020).
- Fouillaud, M., Dufosse, L. Microbial secondary metabolism and biotechnology. Microorganisms. 10 (1), 123 (2022).
- Rizzetto, G., et al. Role of daptomycin in cutaneous wound healing: A narrative review. Antibiotics. 11 (7), 944 (2022).
- Miethke, M., et al. Towards the sustainable discovery and development of new antibiotics. Nat Rev Chem. 5 (10), 726-749 (2021).
- Gunjal, V., Thakare, R., Chopra, S., Reddy, D. S. Teixobactin: A paving stone toward a new class of antibiotics. J Med Chem. 63, 12171-12195 (2020).
- Atanasov, A. G., Zotchev, S. B., Dirsch, V. M., Supuran, C. T. Natural products in drug discovery: Advances and opportunities. Nat Rev Drug Discov. 20 (3), 200-216 (2021).
- Epstein, S. S. The phenomenon of microbial uncultivability. Curr Opin Microbiol. 16 (5), 636-642 (2013).
- Wright, G. An irresistible newcomer. Nature. 517, 422-444 (2015).
- Berdy, B., Spoering, A., Ling, L., Epstein, S. In situ cultivation of previously uncultivable microorganisms using the ichip. Nat Protoc. 12 (10), 2232-2242 (2017).
- Jung, D., et al. Triggering growth via growth initiation factors in nature: A putative mechanism for in situ cultivation of previously uncultivated microorganisms. Front Microbiol. 12, 537194 (2021).
- Nichols, D., et al. Use of ichip for high-throughput in situ cultivation of "uncultivable" microbial species. Appl Environ Microbiol. 76 (8), 2445-2450 (2010).
- Megaw, J., Kelly, S. A., Thompson, T. P., Skvortsov, T., Gilmore, B. F. Profiling the microbial community of a triassic halite deposit in Northern Ireland: An environment with significant potential for biodiscovery. FEMS Microbiol Lett. 366 (22), fnz242 (2019).
- Vitorino, I., et al. Novel and conventional isolation techniques to obtain planctomycetes from marine environments. Microorganisms. 9 (10), 2078 (2021).
- Moote, P., Polo, R. O., Uwiera, R. R. E., Inglis, G. D. Comparison of strategies for isolation anaerobic bacteria from the porcine intestine. Appl Environ Microbiol. 87 (9), e00088-e00121 (2021).
- Vitorino, I. R., et al. Rhodopirellula aestuarii sp. Nov., a novel member of the genus rhodopirellula isolated from brackish sediments collected in the tagus river estuary, Portugal. Syst Appl Microbiol. 45 (6), 126360 (2022).
- Ding, H., et al. Hanstruepera marina sp. Nov. and Hanstruepera flava sp. Nov., two novel species in the family flavobacteriaceae isolated by a modified in situ cultivation technique from marine sediment. Front Microbiol. 13, 957397 (2022).
- Ling, L. L., et al. A new antibiotic kills pathogens without detectable resistance. Nature. 517 (7535), 455-459 (2015).
- Qi, Y. K., et al. Discovery, synthesis, and optimization of teixobactin, a novel antibiotic without detectable bacterial resistance. J Pept Sci. 28 (11), e3428 (2022).
- Piddock, L. J. Teixobactin, the first of a new class of antibiotics discovered by ichip technology. J of Antimicrob Chemother. 70 (10), 2679-2680 (2015).
- Gong, L., Wong, C. H., Idol, J., Ngan, C. Y., Wei, C. L. Ultra-long read sequencing for whole genomic DNA analysis. J Vis Exp. (145), e58954 (2019).
- Covington, B. C., Xu, F., Seyedsayamdost, M. R. A natural product chemist's guide to unlocking silent biosynthetic gene clusters. Annu Rev Biochem. 90, 763-788 (2021).
- Lee, N., et al. Mini review: Genome mining approaches for the identification of secondary metabolite biosynthetic gene clusters in Streptomyces. Comput Mol Biol. 18, 1548-1556 (2020).
- Kaeverlein, T., Lewis, K., Epstein, S. S. Isolating "uncultivable" microorganisms in pure culture in a simulated natural environment. Science. 296 (5570), 1127-1129 (2002).
- Trcek, J., Mira, N. P., Jarboe, L. R. Adaptation and tolerance of bacteria against acetic acid. Appl Microbiol Biotechnol. 99 (15), 6215-6229 (2015).
- Kurm, V., Van Der Putten, W. H., Hol, W. H. G. Cultivation-success of rare soil bacteria is not influenced by incubation time and growth medium. PLOS One. 14 (1), e0210073 (2019).
- Buerger, S., et al. Microbial scout hypothesis and microbial discovery. Appl Environ Microbiol. 78 (9), 3229-3233 (2012).
- Lodhi, A. F., Zhang, Y., Adil, M., Deng, Y. Antibiotic discovery: Combining isolation chip (ichip) technology and co-culture technique. Appl Microbiol Biotechnol. 102 (17), 7333-7341 (2018).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır