Method Article
تصوير حي طويل الأمد لتطور الساق ذبابة الفاكهة بعد إزالة الحفرة
In This Article
Summary
هنا ، يتم تقديم بروتوكول للتصوير الحي طويل الأمد لساق ذبابة الفاكهة أثناء مرحلة العذراء ، بما في ذلك الإزالة الكاملة للشادرة. يمكن أيضا تطبيق هذا البروتوكول على الأنسجة الأخرى.
Abstract
على مدى العقود الماضية ، تم إحراز تقدم كبير في فهم آليات تحديد مصير الخلية. ومع ذلك ، فإن العملية التي تشكل بها الخلايا التي يحددها المصير أشكالا كائينة ثلاثية الأبعاد لا تزال غير واضحة. سهلت التطورات الحديثة في الفحص المجهري متحد البؤر الجهود المبذولة لمراقبة ديناميكيات الخلية أثناء التطور من خلال التصوير الحي. ذبابة الفاكهة خادرة سوداء البطن مثالية للتصوير الحي نظرا لثباتها وبشرة العذراء الشفافة وتوافر خطوط مراسل الفلورسنت. التحدي الأساسي للتصوير هو الشرانق ، البشرة المحيطة بالخادرة ، والتي تعيق التصوير البصري. في حين أن الطرق السابقة تضمنت إما إزالة جزئية أو كاملة للعذراء ، إلا أن الحفاظ على صلاحية العذراء لفترات طويلة بعد هذا الإجراء ظل يمثل تحديا. هنا ، يتم تقديم طريقة بسيطة للتصوير الحي ليوم من ذبابة الفاكهة أثناء مرحلة العذراء ، بما في ذلك إزالة الشرانق بالكامل. تتضمن الطريقة إزالة المعدرة من خادرة ملتصقة بشريط على الوجهين ، متبوعا بتجميع غرفة صغيرة على طبق زجاجي القاع لإحاطة الخادرة وقطرة ماء. هذا الإعداد مباشر وموثوق ويدعم بقاء العذراء الممتد عن طريق منع الجفاف. ساهم التصوير الحي طويل المدى لذبابة الفاكهة الخادرة بشكل كبير في التقاط كيفية خضوع الساق البالغة لتغيرات هيكلية ثلاثية الأبعاد دراماتيكية على مدار 2-3 أيام. تشمل هذه التغييرات التكوين العابر لبنية مثيرة للاهتمام (الهيكل الشبيه بالبارثينون) بواسطة الخلايا الظهارية ، وتضيق الأنسجة السريع ، وتكوين المفاصل ، واستطالة الشعر الخشن. هذه الطريقة قابلة للتطبيق على مراقبة الأنسجة المختلفة ويمكن دمجها مع تقنيات أخرى ، مثل الحث الجيني البصري ، لتعزيز فهم ديناميكيات الخلية أثناء تكوين الشكل النهائي للأنسجة في مرحلة العذراء.
Introduction
على الرغم من التقدم الكبير الذي تم إحرازه على مدى العقود العديدة الماضية في توضيح آلية تحديد مصير الخلية ، إلا أن كيفية بناء الخلايا التي يحددها القدر لأشكال كائن حي ثلاثي الأبعاد لا يزال بعيد المنال. بفضل التحسينات التكنولوجية في الفحص المجهري متحد البؤر ، تتزايد محاولات الكشف عن ديناميكيات الخلية أثناء التطوير عن طريق التصوير الحي في السنوات الأخيرة1،2. ذبابة الفاكهة خادرة ميلانوجستر تم تفضيلها للتصوير الحي بسبب ميزاتها المناسبة: عدم الحركة ، وشفافية بشرة العذراء ، وتوافر خطوط مراسل الفلورسنت3،4،5. أكبر عقبة أمام إجراء التصوير الحي لذبابة الفاكهة خادرة هي الشرانق (حالة العذراء) ، بشرة يرقات الطور النهائي المشوهة والمدبوغة المحيطة بالخادرة. لتجنب الانسداد البصري ، تمت إزالة الشرانق جزئيا أو كليا بالطرق المبلغ عنهاسابقا 1،2،3،4،5،6،7،8،9،10. تؤدي الإزالة الكاملة للpuparium إلى زيادة مساحة المراقبة وقابليتها للتطبيق على الأنسجة المختلفة. ومع ذلك ، فإن الخادرة التي لا تحتوي على الشرانقية تموت عادة في غضون نصف يوم تقريبا ، ويفترض أن يكون ذلك بسبب الجفاف. لذلك ، يعد الحفاظ على رطوبة العذراء أمرا بالغ الأهمية للتصوير الحي الممتد. في حين أن المدة الدقيقة لبقاء العذراء بعد إزالة العذراء بالكامل في الطرق السابقة غير واضحة ، إلا أن الأمثلة المبلغ عنها استمرت عادة لمدة تصل إلى حوالي 20 ساعة. نظرا لأن مرحلة العذراء تستمر حوالي أربعة أيام ، فمن المتوقع أن تساهم طريقة التصوير الحي لفترة أطول في التقاط العملية الكاملة لتكوين شكل الأنسجة.
ذبابة الفاكهة الساق البالغة هي نموذج ممتاز لدراسة عملية تكوين شكل الأنسجة ثلاثية الأبعاد. وهو مشتق من البدائية على شكل قرص (قرص الساق) التي تشكلت خلال مراحل اليرقات. يتم تحديد المناطق المقابلة لكل جزء في الساق البالغة من خلال مرحلة ما قبل العذراء11. بعد ذلك ، يبرز قرص الساق من الجزء المركزي لتكوين بنية أنبوبية منتفخة بعد حوالي 11 ساعة من تكوين الشرانق (APF). كيف يحقق هذا النسيج ، بشكله البسيط ، شكله النهائي للساق البالغة في المراحل اللاحقة ظلت غير واضحة لفترة طويلة. تم نشر العديد من الدراسات التي تقترب من هذا العدد12،13،14. نظرا لأنهم لاحظوا الأنسجة الثابتة أو المستنبتة ، لا يمكن تتبع التغييرات المستمرة في الخلايا الفردية ، وكانت المعلومات التي تم الحصول عليها مجزأة إلى حد ما. لفهم عملية التشكيل بشكل كامل ، من الضروري مراقبة التغييرات في الخلايا الفردية بشكل مستمر من خلال التصوير الحي طويل الأمد.
كشفت دراسة حديثة النقاب عن التشوه الديناميكي للهياكل ثلاثية الأبعاد في الأنسجة والمستويات الخلوية عن طريق التصوير الحي طويل المدى (الشكل 1). النتيجة الأكثر إثارة للاهتمام في هذه الدراسة هي التكوين العابر لبنية معقدة بشكل غير متوقع بواسطة الخلايا الظهارية. يتميز هذا الهيكل ، المسمى "الهيكل الشبيه بالبارثينون" ، بإسقاطات قشرية ووصلات تشبه الشبكة القاعدية للخلايا الظهارية. الأهم من ذلك ، أن تكوين هذا الهيكل واختفائه يتزامن مع تضييق الأنسجة السريع15. استمر تكوين الشكل اللاحق ، بما في ذلك تكوين المفصل واستطالة الشعر الخشن ، لمدة 2-3 أيام. التقط التصوير الحي طويل المدى بشكل فعال القصة الكاملة لهذه الأحداث المتسلسلة التي استمرت أياما.
توفر هذه المقالة طريقة خطوة بخطوة لإجراء تصوير مباشر لمدة أيام لساق ذبابة الفاكهة أثناء مرحلة العذراء مع الإزالة الكاملة للشرانقية. الطريقة سهلة المتابعة ويمكن تطبيقها على العديد من الأنسجة الأخرى.
Protocol
يستخدم هذا البروتوكول ذبابة الفاكهة سلالات ميلانوجستر التي تعبر عن مراسلي الفلورسنت15. يتم سرد تفاصيل الكواشف والمعدات المستخدمة في الدراسة في جدول المواد.
1. تحضير الخادرة
- باستخدام فرشاة الرسم ، اجمع الشرانق البيضاء من السلالة المرغوبة ذبابة الفاكهة السوداء من القوارير وضعها في أطباق أو قوارير فارغة (الشكل 2 أ).
ملاحظة: في هذه الدراسة ، تشير "الشرانق البيضاء" إلى المرحلة بين عندما تصبح اليرقة غير متحركة تماما وقبل أن تصبح الشرانق بنية اللون. تستمر هذه المرحلة حوالي 30 دقيقة عند 25 درجة مئوية. - احتضان الشرانق البيضاء لمدة 14 ساعة على الأقل عند 25 درجة مئوية حتى تتطور إلى المرحلة المراد ملاحظتها (الشكل 2 ب).
ملاحظة: لا يمكن إزالة الشرانق إلا بعد تكوين بشرة العذراء بالكامل عند 12-13.5 ساعة APF وإزالتها بسهولة فقط بعد 14 ساعة APF. - امسح الغراء وطار الطعام بعيدا عن الشرانق بفرشاة رسم مبللة بالماء المقطر.
ملاحظة: يجب أن يكون الجانب البطني من الشرانق نظيفا بشكل خاص لتحقيق التصاق كاف بالشريط على الوجهين في الخطوات اللاحقة. - ضع الشرانق على مناديل التنظيف لعدة دقائق حتى تجف.
ملاحظة: الرطوبة المتبقية على الشرانق ستمنع الالتصاق الجيد بشريط على الوجهين. - ثبت قطعة من الشريط على الوجهين على شريحة زجاجية.
- ضع الشرانق المجففة على شريط على الوجهين مع الجانب البطني لأسفل (الشكل 2 ج).
- ادفع الجانب الظهري من الشرانق برفق باستخدام فرشاة رسم مجففة لتحقيق التصاق أفضل بالشريط على الوجهين.
- تحت مجهر استريو ، افتح الأوبيركولوم بعناية باستخدام زوج من الملقط (الشكل 2 D ، E).
ملاحظة: الذراع هو المنطقة الأمامية للضواعية في الشرانق حيث تخرج الذبابة البالغة ، وبالتالي تفتح بسهولة. - من حافة الفتحة المفتوحة ، أدخل أحد أطراف الملقط في الفراغ بين الخادرة والشرانق (الشكل 2F).
ملاحظة: احرص على عدم إتلاف بشرة العذراء بطرف الملقط. - أمسك الpuparium بالملقط واسحبه للخارج حتى ينفتح.
- ارفع الأجزاء الممزقة من الشرانق بالملقط وألصقها بشريط على الوجهين (الشكل 2G).
- كرر الخطوات 1.10-1.11 حتى تصل فتحة الشرانق إلى النهاية الخلفية ، تاركة جزءا صغيرا من الشرانق (الشكل 2 ح ، أنا).
ملاحظة: إذا خرج السائل من خادرة ، لكان قد تضرر (الشكل 2 ك). لمراقبة التطور الطبيعي ، تجنب تصوير الشرانق التالفة.
2. إعداد التصوير
- ضع 1 ميكرولتر من الماء المقطر أو زيت السيليكون (عند استخدام عدسة غمر السيليكون) في قاع طبق ذو قاع زجاجي.
- انقع فرشاة الرسم في الماء المقطر واغرف الخادرة برفق (الشكل 2J).
- ضع الخادرة مع الجانب البطني لأسفل على الماء المقطر أو زيت السيليكون (الشكل 2 لتر).
- باستخدام ماصة دقيقة ، ضع 10 ميكرولتر من الماء المقطر بالقرب من حافة الجزء الزجاجي من الطبق ذو القاع الزجاجي (الشكل 2L).
- ضع دائرة من شحم السيليكون مع حقنة حول حافة الجزء الزجاجي من الطبق ذو القاع الزجاجي (الشكل 2 م).
- ضع غطاء على شحم السيليكون لإغلاقه (الشكل 2 م). التجميع موضح في الشكل 2N.
ملاحظة: تأكد من عدم وجود فجوات بين الغطاء وشحم السيليكون.
3. التصوير متحد البؤر
- قم بتشغيل مجهر ليزر متحد البؤر المقلوب وبرنامج التصوير.
- ضع الطبق على متقبل المسرح بمجهر متحد البؤر المقلوب.
- ابحث عن الشرانق ذات العدسة الموضوعية ذات التكبير المنخفض في مراقبة المجال الساطع. تأكد من أن الشرانق لا تظهر أي تسرب لسوائل الجسم.
- قم بتوسيط المنطقة المطلوبة من الخادرة المراد ملاحظتها في منطقة الاهتمام (ROI).
ملاحظة: الجوانب الأمامية الجانبية للرسغ في الساقين الأولى والثانية ، والجانب البطني من الرصغ في الساق الثالثة ، موجهة نحو الجانب البطني من الخادرة. لذلك ، يمكن ملاحظة القسم الطولي من الرصغ على طول المحور الظهري البطني في الساقين الأولى والثانية ، بينما يمكن ملاحظة تلك الموجودة على طول المحور الأمامي الخلفي في الساق الثالثة. - قم بتغيير العدسة الموضوعية إلى عدسة التصوير المباشر.
ملاحظة: إذا تم استخدام عدسة غمر في الماء، فسوف يجف الماء الموجود بين العدسة والطبق ذو القاع الزجاجي أثناء المراقبة طويلة المدى. يوصى باستخدام عدسة غمر بزيت السيليكون. - اضبط شروط الملاحظة المطلوبة وابدأ الحصول على البيانات.
ملاحظة: لمنع أي ضرر للخادرة ، يجب أن تكون قوى الليزر ضئيلة بقدر ما يمكن الحصول على صور واضحة. يعد تقليل عائد الاستثمار وزيادة حجم الخطوة مفيدا في توفير الوقت للحصول على مكدس Z. يجب مراعاة التحول المستقبلي للأنسجة عند تحديد عمق مكدس Z. في حالة مراقبة الساق عند 15-25 ساعة APF ، نظرا لأن الساق تضيق كثيرا ، فإن أقرب جزء إلى الغطاء (الظهارة الجانبية) يتحرك بسرعة أعمق. بالنظر إلى هذه الحركة ، يجب تعيين مداخن Z العميقة جدا من الأول. يتم توفير مثال على إعداد المجهر متحد البؤر للتصوير الحي لمنطقة رسغ الساق من 15-30 ساعة APF في الملف التكميلي 1. لا مفر من تلاشي التألق أثناء التصوير الحي على المدى الطويل. للتخفيف من هذه المشكلة ، ينصح باستخدام الحد الأدنى من طاقة الليزر. يوصى باستخدام المكون الإضافي ImageJ "AutoEnhance"16 لمعالجة بيانات التصوير المباشر للتعويض عن تأثيرات التلاشي.
النتائج
هنا ، يتم وصف مثال على التصوير الحي لمدة 44 ساعة لذبابة الفاكهة النامية الساق البالغة في مرحلة العذراء. تم جمع الذباب الذي يعبر عن His2Av-mRFP17 (نوى وضع العلامات) و sGMCA18 (بروتين الأكتين المرتبط بعلامة GFP Moesin ، أكتين الملصق) في مرحلة العذراء البيضاء واحتضانها لمدة 15 ساعة عند 25 درجة مئوية. تمت إزالة الشرانق وتركيبه وفقا للبروتوكول (الشكل 2). تم الحصول على صور مكدس Z للرسغ والرسغ ، بالقرب من طرف الساق ، بنجاح كل 15 دقيقة من 16 ساعة إلى 60 ساعة APF في درجة حرارة الغرفة (ليست صارمة ، ولكن بالقرب من 25 درجة مئوية). يظهر النصف الأول من سلسلة الصور في الشكل 3 ، والنصف الأخير في الشكل 4 ، والفيلم بأكمله في الفيلم 1. مع تضييق أنسجة الساق بسرعة ، شكلت الخلايا الظهارية بشكل عابر بنية مثيرة للاهتمام ، هيكل يشبه البارثينون ، يتميز بإسقاطات الظلية والوصلات القاعدية (الشكل 3). لوحظ انخفاض السماكة الظهارية حتى بعد اكتمال المخطط التفصيلي تقريبا (الشكل 4). يتم استعراض العملية برمتها في الشكل 1.
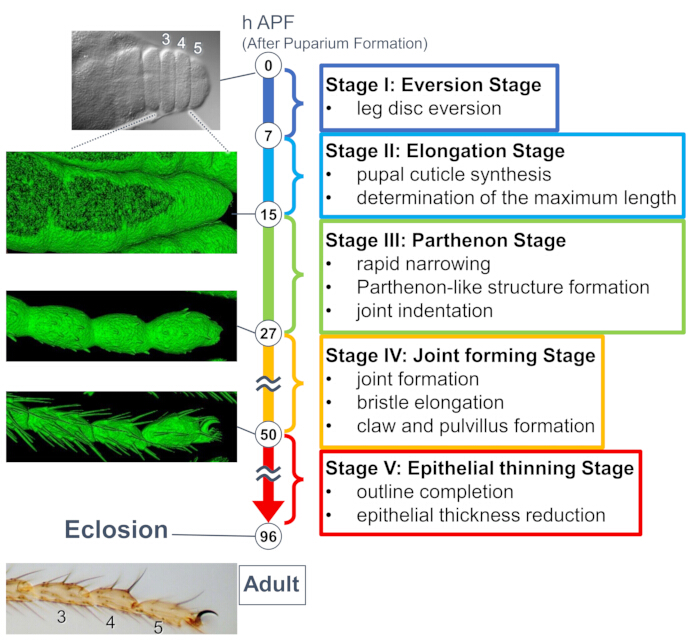
الشكل 1: نظرة عامة على الشكل النهائي لذبابة الفاكهة الكرسغ البالغ خلال مرحلة العذراء. تم تقسيم العملية برمتها إلى خمس مراحل بناء على التغيرات المورفولوجية على كل من مستويات الأنسجة والخلايا التي لوحظت في تجارب التصوير الحي طويلة المدى. يتم عرض الصور التمثيلية أو الصور المعروضة على السطح (إشارة sGMCA) المقابلة لعدة نقاط زمنية على الجانب الأيسر. يتم كتابة وصف موجز للأحداث في كل مرحلة على الجانب الأيمن. تم تعديل هذا الرقم من Hiraiwa et al.15. انظر أيضا الفيلم 1. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
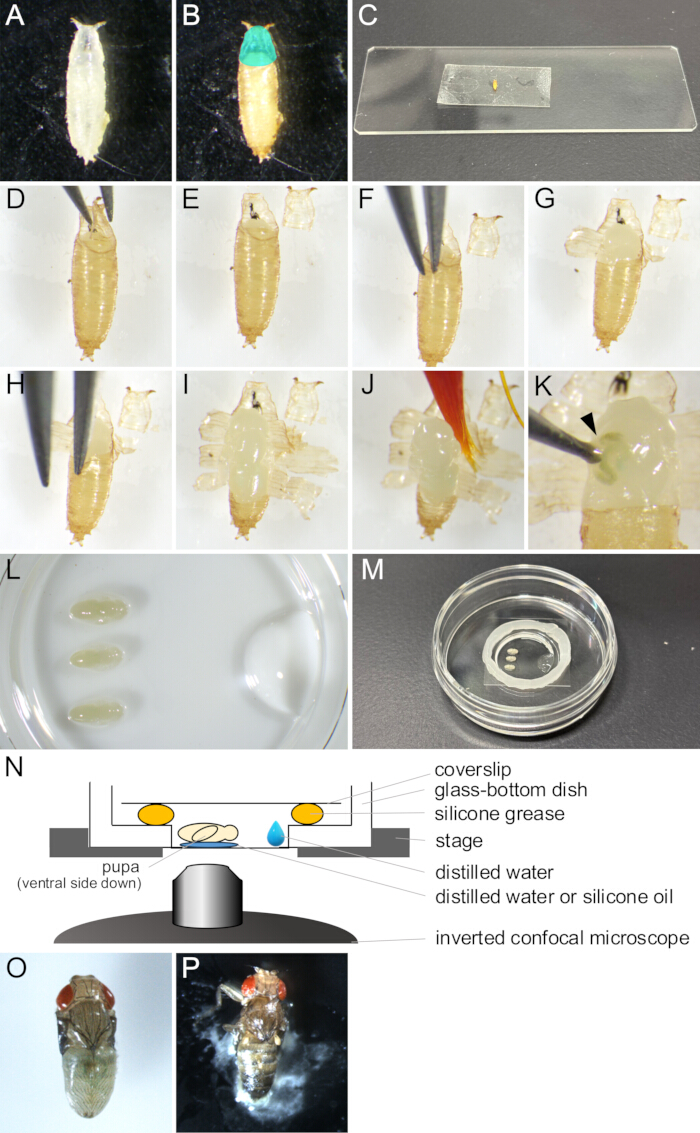
الشكل 2: إزالة Puparium وتجميع التركيب للتصوير الحي. (أ) خادرة بيضاء مجمعة في طبق. (ب) ظهرت الخادرة في (أ) بعد الحضانة لمدة 15 ساعة عند 25 درجة مئوية. تشير المنطقة السماوية الملونة إلى الطبقة العظمية. (ج) صورة فوتوغرافية تظهر خادرة ملتصقة بقطعة من الشريط اللاصق على الوجهين. (D-J) سلسلة من الصور توضح إجراء إزالة الشرانق. (د) يتم رفع الطبقة بالملقط. (ه) تتم إزالة الصوت. (و) يتم إدخال طرف ملقط بين بشرة العذراء والشرانقية. (ز) يتم فتح المعرنرة جزئيا. (ح) يتم إدخال طرف ملقط مرة أخرى. (ط) تم فتح المعرنقة ، ولم يتبق سوى جزء صغير من الطرف الخلفي. (ي) الخادرة التي يتم رفعها بواسطة فرشاة الرسم. (ك) مثال على تسرب سوائل الجسم للخادرة. يشار إلى السائل الخارج من الجرح الذي يتم دسه طرف الملقط برأس سهم. (L-N) صور ورسوم توضيحية توضح تجميع الجبل. (L) عرض صورة من الجانب العلوي تظهر الشرانق الموضوعة والماء المقطر في قاع طبق زجاجي القاع. (م) الطبق بعد الانتهاء من تجميع التركيب. تم وضع شحم السيليكون على طول الحافة حول الجزء الزجاجي ، وتم وضع غطاء على الشحوم لإغلاقه. (ن) رسم تخطيطي لمجموعة تركيب ذبابة الفاكهة خادرة للتصوير الحي على المدى الطويل. (س) تطورت خادرة مثبتة تقريبا بالاغة. (ع) خادرة مثبتة على الإغلاق. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
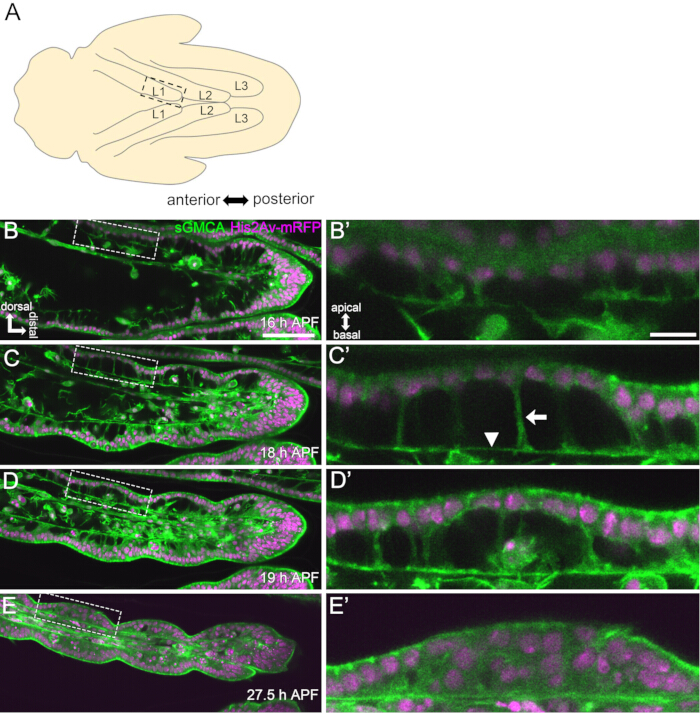
الشكل 3: تغيرات الشكل الديناميكي في الخلايا الظهارية الرصغية في 16-27.5 ساعة APF. (أ) رسم توضيحي للخادرة يرى من الجانب البطني. يتوافق المستطيل المتقطع مع المنطقة التي لوحظت في (B-E). L1: الساق الأولى ، L2: الساق الثانية ، L3: الساق الثالثة. (B ، C ، D ، E) صور ثابتة من التصوير المباشر للجزء البعيد من الرص الرغي في sGMCA (أخضر) و His2Av-mRFP (أرجواني) تعبر عن الذبابة. تضيق الأنسجة بسرعة ، وتتقدم المسافة البادئة لمناطق المفاصل. (ب '، ج' ، د '، ه') تكبير المناطق المحاطة بالخطوط المتقطعة في (B,C,D,E) على التوالي. يظهر السهم ورأس السهم في (C') مثالا على الإسقاطات القبلية وموضع الوصلات القاعدية ، على التوالي. يبدأ الهيكل الشبيه بالبارثينون في التكون في (B') ، ويتشكل بالكامل في (C') ، ويبدأ في الاختفاء في (D') ، ويصبح من الصعب رؤيته في (E'). البعيد إلى اليمين والظهري إلى الأعلى في جميع الأشكال. تظهر المراحل في الزوايا اليمنى السفلية في (B ، C ، D ، E). قضبان المقياس: B ، C ، D ، E: 50 ميكرومتر ؛ B',C',D',E': 10 ميكرومتر. تم تعديل هذا الرقم من Hiraiwa et al.15. انظر أيضا الفيلم 1. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
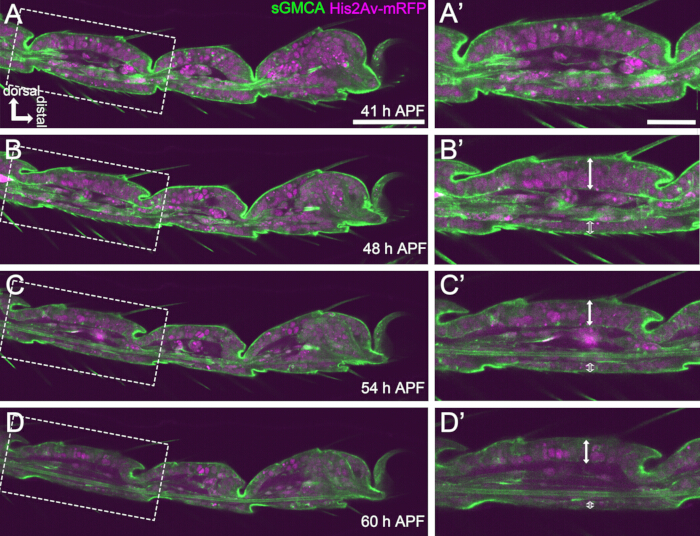
الشكل 4: تغيرات الشكل في طبقة الخلية الظهارية الرصغية في 41-60 ساعة APF. (أ ، ب ، ج ، د) صور ثابتة من نفس مجموعة البيانات المتسلسلة للتصوير الحي مثل الشكل 3. يتم تكبير المستطيلات المتقطعة في (A ، B ، C ، D) في (A '، B' ، C' ، D ') ، على التوالي. بحلول حوالي 48 ساعة APF (A-B') ، يكون تكوين الشكل الخارجي ، مثل استطالة الشعيرات والمخالب والبولفيلي ، قد اكتمل تقريبا. تحرك الجزء السفلي من المفصل الذي تم غزوه بشكل قريب ، وبعد ذلك ، تقدم تكوين هيكل الكرة والمقبس بعد حوالي 54 ساعة APF. أصبح الاختلاف المورفولوجي بين الظهارة الظهرية والبطنية واضحا (أسهم مزدوجة وأسهم مزدوجة مفتوحة في B '، C '، D'). بعد 54 ساعة APF (C-D') ، انخفضت الطبقة الظهارية سمكها دون تغيير الخطوط العريضة للشرائح. الظهرية إلى الأعلى وبعيدة إلى اليمين في جميع الأشكال. أشرطة المقياس: A ، B ، C ، D: 50 ميكرومتر ؛ أ '، ب '، ج '، د': 20 ميكرومتر ، وقد تم الاستشهاد بهذا الرقم من Hiraiwa et al.15. انظر أيضا الفيلم 1. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
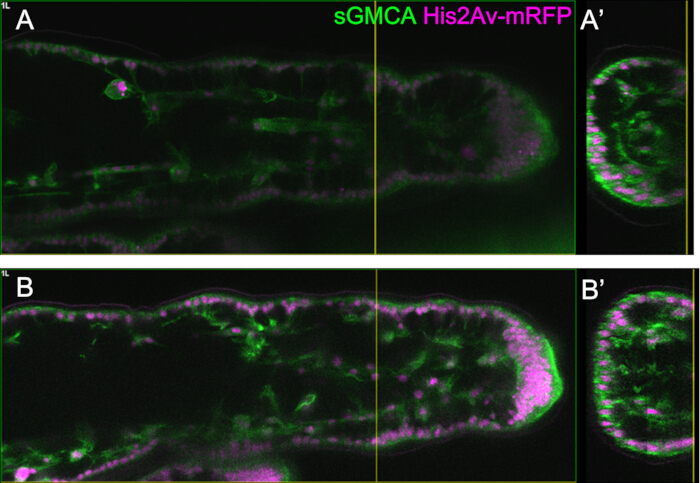
الشكل 5: مثال على مراقبة الساق باستخدام وظيفة Bright Z. (أ ، ب) صور للمنطقة المقابلة والعمق والمرحلة من المحطة الثالثة من sGMCA (أخضر) و His2Av-mRFP (أرجواني) تعبر عن الذبابة ، مع (B) أو بدون (A) باستخدام وظيفة Bright Z. (أ) مستخرج مستوى XY بعمق 59.1 ميكرومتر من مراقبة المنطقة الرصغية في الساق الثالثة عند 16 ساعة APF تم الحصول عليها دون استخدام وظيفة Bright Z. (أ) يتوافق عرض المقطع العرضي مع الخط الرأسي الأصفر في (A). يشير الخط العمودي في (A') إلى المستوى البؤري ل (A). (ب) مستوى XY بعمق 61.6 ميكرومتر مستخرج من مراقبة المنطقة الرصغية في الساق الثالثة عند 16 ساعة APF تم الحصول عليها باستخدام وظيفة Bright Z. تم ضبط كل من جهد PMT وطاقة الليزر. تم تحسين رؤية الصورة مقارنة ب (A). (ب') يتوافق العرض المقطعي مع الخط الرأسي الأصفر في (B). يشير الخط العمودي الأصفر في (B') إلى المستوى البؤري ل (B). الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
الملف التكميلي 1: مثال على إعداد المجهر متحد البؤر للتصوير الحي لمنطقة الساق من 15-30 ساعة APF. الرجاء النقر هنا لتنزيل هذا الملف.
فيلم 1: تصوير حي طويل الأمد للجزء البعيد من الرصغ لمدة 44 ساعة. تم استخدام ذبابة sGMCA (أخضر) و His2Av-mRFP (أرجواني). تم استخراج مستوى XY الأكثر تمثيلا من نفس مجموعة البيانات مثل الشكل 3 والشكل 4. تشير رؤوس الأسهم إلى أمثلة على المناطق المشتركة المستقبلية. الخلايا سريعة الحركة في الأنسجة هي خلايا شبيهة بالبلاعم. الإشارة الشبيهة بالسلسلة الممتدة على طول الأجزاء الرصغية هي جزء من الحاجز. يظهر الطابع الزمني hh: mm. البعيد إلى اليمين ، والظهري إلى الأعلى. تم اقتباس هذا الفيلم من Hiraiwa et al.15الرجاء النقر هنا لتنزيل هذا الملف.
Discussion
في هذه المقالة ، يتم توفير بروتوكول مفصل للتصوير الحي طويل الأمد لساق ذبابة الفاكهة في مرحلة العذراء. يبرز القرص التخيلي للساق من الجزء المركزي لتشكيل بنية أنبوبية ، ثم يحدث تكوين الشكل النهائي للساق البالغة في مرحلة العذراء بطريقة كانت بعيدة المنال. كانت المحاولات السابقة لمراقبة هذه العملية بشكل أساسي عن طريق التلوين الثابت ، وزراعة الأنسجة ، والمجهر الإلكترونيالماسح 12،13،14. لم تتمكن هذه الطرق من تتبع التغييرات المستمرة في الخلايا الفردية ، وتم الحصول على معلومات مجزأة فقط. باستخدام الطريقة الموضحة في هذه الدراسة ، يمكن ملاحظة عملية تكوين الشكل النهائي للمنطقة الرصغية بنجاح كتصوير حي متسلسل لمدة أيام بواسطة مجهر متحد البؤر ، ويمكن تتبع التغييرات في الخلايا الفردية باستمرار. تم وصف ديناميكيات الخلايا المثيرة للاهتمام التي كشفت عنها هذا التصوير الحي بالتفصيل في التقرير الأخير15.
من أجل التصوير الحي الناجح على المدى الطويل ، من الأهمية بمكان الحفاظ على صلاحية الخادرة والتأكد من أن نموها لا يتأثر. في الطريقة الموضحة هنا ، تطورت الخادرة التي تمت إزالتها من الشرانق إلى البالغين الفاطميين والبالغين في كثير من الحالات (الشكل 2O ، P). كانت توقيتات التغيرات المورفولوجية للرسغ النامي التي لوحظت بهذه الطريقة متوافقة مع التقارير السابقة12،13،14. علاوة على ذلك ، أظهرت الخلايا الظهارية تغييرات مثل تقليل السماكة حتى في 48-60 ساعة APF (32-44 ساعة بعد التركيب) (الشكل 4 ب '-د'). تشير هذه الحقائق إلى أن الخادرة لا تزال سليمة ولا تشهد أي انقطاع أو تأخير تقريبا في تطورها الطبيعي أثناء التصوير الحي طويل المدى باستخدام الطريقة الموضحة هنا. يرجى ملاحظة أن صلاحية الخادرة التي تمت إزالتها من الشرانق وتخضع للتصوير الحي يمكن أن تختلف اعتمادا على توقيت إزالة الشرانق ، والتعامل في الإجراء ، ومدى السمية الضوئية في التصوير ، وسلالات الذباب المستخدمة.
تتمثل إحدى الخطوات الحاسمة لضمان سلامة الخادرة وتطورها في إزالة المعدرة دون الإضرار بالخادرة. يعد الالتصاق المستقر للخادرة بالشريط على الوجهين والتعامل الدقيق مع الملقط مفاتيح النجاح. منع جفاف الخادرة أمر بالغ الأهمية أيضا. في هذا الصدد ، يعد تجنب أي فجوات بين الغطاء وشحم السيليكون أمرا بالغ الأهمية.
لتجنب جفاف الخادرة ، تضمنت العديد من الطرق السابقة الإزالة الجزئية للخادرة1،2،3،4،5،6،7. ومع ذلك ، لمراقبة الخادرة بأكملها ، يفضل الإزالة الكاملة للخادرة. على الرغم من أن الحد الأقصى لوقت بقاء الخادرة غير معروف ، فقد تم الإبلاغ عن العديد من الطرق التي تتم بها إزالة الشرانق بالكامل8،9،10. الطريقة الأكثر شيوعا لتوفير الرطوبة للخادرة في هذه الطرق هي استخدام ورق الترشيح المبلل. بالمقارنة مع الطرق السابقة ، فإن الطريقة الموضحة هنا توفر الرطوبة عن طريق وضع قطرة ماء بطريقة أبسط وأسهل. بالإضافة إلى ذلك ، تتضمن العديد من الطرق السابقة تركيب الخادرة على شريحة زجاجية. عند تركيب الخادرة التي تمت إزالتها من الشرانق على شريحة زجاجية ، يمكن أن تكون هناك مشكلة حيث يؤدي الضغط على الغطاء على الخادرة إلى إجهاد الخادرة ، أو يؤدي الغطاء المائل إلى حدوث ضوضاء وتشوهات وعدم وضوح في الصور. تستخدم الطريقة الموضحة هنا طبقا ذو قاع زجاجي ، مما يلغي الحاجة إلى الضغط على الغطاء على الخادرة ، مما يسمح بمراقبة الأنسجة بالقرب من حالتها الطبيعية قدر الإمكان. نظرا لعدم وجود حاجة لضبط زاوية زجاج الغطاء ، فإن الإعداد مستقر وسهل التعامل معه وأكثر موثوقية. لذلك ، لا تتطلب هذه الطريقة أي مهارات متخصصة تقريبا ، مما يسمح حتى للمبتدئين بإجراء التصوير المباشر بنجاح.
القيود الرئيسية لهذه الطريقة هي عمق الملاحظات ودقة الوقت. في ظل ظروف مراقبة الرسغ ، لا يمكن الحصول على صور واضحة إلا بعمق حوالي 40 ميكرومتر. يساعد استخدام وظيفة Bright Z في معالجة هذه المشكلة. على سبيل المثال ، كما هو موضح في الشكل 5 ، أدت زيادة طاقة الليزر وجهد PMT مع زيادة العمق من خلال استخدام وظيفة Bright Z إلى تحسين جودة الصور في المواضع الأعمق. ومع ذلك ، فإن زيادة طاقة الليزر تأتي مع مقايضة تنطوي على السمية الضوئية وتلاشي الإشارة. لذلك ، من الضروري إيجاد الظروف المثلى التي تتوافق مع الغرض من المراقبة. دقة الوقت مهمة أيضا عند مراقبة الخلايا والأنسجة سريعة الحركة. يعد تقليل الشرائح وتضييق عائد الاستثمار من الحلول الرئيسية لهذه المشكلة. قد يؤدي استخدام معدات حديثة ذات حساسية محسنة للكاشف أو مجهر متحد البؤر للقرص الدوار إلى تحسين دقة الوقت. قيد آخر يتعلق بمرحلة الخادرة. لا يمكن إزالة الشرانق إلا بعد تشكيل بشرة العذراء بالكامل في 12-13.5 ساعة APF19ولا يمكن إزالتها بسهولة إلا بعد 14 ساعة APF. يمكن ملاحظة المراحل المبكرة من 12 ساعة APF جزئيا عن طريق تركيب الخادرة دون إزالة الشرانق15 ، على الرغم من صعوبة الحصول على صور واضحة بسبب حركات الأنسجة السريعة والعوائق البصرية بواسطة الشرانق في هذه الحالة.
استكشاف الاخطاء
صعوبة في إزالة المعدرة
أثناء إزالة الشرانق ، من المهم التصاق الجانب البطني من الشرانق بالشريط على الوجهين. يجب إزالة الغراء والطعام من سطح الشرانق ، والتجفيف اللاحق مهم لأن الأسطح الرطبة تمنع الالتصاق الجيد. والجدير بالذكر أن الشريط على الوجهين في جدول المواد له التصاق أقوى على الجانب الداخلي. يجب استخدام الجانب الداخلي (الأقوى) للالتصاق بالخادرة. يعد قطع العذررة بمقص التشريح بدلا من تمزيقها بالملقط مفيدا عندما تكون إزالة الشرانق صعبة.
تسرب السوائل من الخادرة
من الأهمية بمكان إزالة الشرانق دون الإضرار بالخادرة. يشير تسرب سائل جسم العذراء إلى تلف الخادرة (الشكل 2 ك). يجب تجنب هذه الخادرة من التصوير الحي. لمنع تلف العذراء أثناء إزالة الشرانق ، بالإضافة إلى التعامل الدقيق ، يوصى باستخدام ملقط بأطراف عريضة نسبيا.
جودة صورة رديئة
عندما تكون إشارة الفلورسنت ضعيفة جدا ، هناك العديد من الطرق لضبط السطوع ، مثل زيادة جهد PMT ، وفتح الثقب (CA) ، وإبطاء سرعة المسح ، وزيادة قوة الليزر. يرجى التذكير بأن كل طريقة لها آثار جانبية: قد تؤدي زيادة جهد PMT إلى زيادة الضوضاء ، وفتح الثقب يقلل من دقة المحور Z ، وإبطاء سرعة المسح يطيل وقت المسح ، وزيادة قوة الليزر تزيد من خطر السمية الضوئية والتبييض. يجب العثور على الإعدادات المناسبة اعتمادا على منطقة الاهتمام وأنواع ومستويات التعبير الخاصة بمراسلي الفلورسنت والطول المطلوب للتصوير المباشر. بشكل عام ، يوصى بتقليل طاقة الليزر للتصوير الحي على المدى الطويل.
تلاشي التألق
يتلاشى التألق أمر لا مفر منه في التصوير الحي على المدى الطويل. ينصح بالحد الأدنى من استخدام طاقة الليزر لتجنب هذه المشكلة. للتعويض عن التلاشي ، يوصى باستخدام المكون الإضافي ImageJ "AutoEnhance"16 عند معالجة بيانات التصوير المباشر المكتسبة.
بفضل الإزالة الكاملة للخادرة ، فإن هذه الطريقة قابلة للتطبيق بشكل كبير على الأنسجة الأخرى فقط عن طريق تعديل عائد الاستثمار واتجاه الخادرة. في الواقع ، على الرغم من أن هذه ليست تصويرا حيا ، فقد لوحظ الجزء القريب من الساق ، والخرطوم ، وظهارة الرأس بالقرب من الهوائي ، وظهارة الصدر الظهري بهذه الطريقة في Hiraiwa et al.15. قد يسهل هذا التطبيق على مجموعة واسعة من الأنسجة مزيدا من التكامل مع التقنيات الأخرى ، مثل الحث البصري للجينات. قد تكون هذه الطريقة قابلة للتطبيق أيضا على أنواع cyclorrhaphan (المكونة للشهيرة) بخلاف ذبابة الفاكهة. علاوة على ذلك ، يمكن استخدامه لأنواع الحشرات الأخرى إذا كان لديهم بشرة عذراء شفافة. تقدم هذه المقالة إرشادات مفصلة لباحثي ذبابة الفاكهة لإجراء تصوير حي للخادرة لالتقاط ديناميكيات الخلايا في الأنسجة الحية.
Disclosures
ويعلن أصحاب البلاغ عدم وجود مصالح متضاربة.
Acknowledgements
نحن ممتنون للدكتور ماسايوكي ميورا (جامعة طوكيو) والدكتور يويا فوجيساوا (جامعة طوكيو) على المشورة الفنية ، ونشكر مركز بلومنجتون للمخزون على موارد الذبابة.
Materials
| Name | Company | Catalog Number | Comments |
| 35 mm/glass base dish | IWAKI | 3911-035 | |
| Cleaning wipes | NIPPON PAPER CRECIA | S-200 | |
| Dumont #3c Forceps | Fine Science Tools | 11231-20 | |
| Dumont #5SF | Fine Science Tools | 11252-00 | |
| Eppendorf Research plus 2-20 µL | Eppendorf | 3123000098 | |
| Fly strain: His2Av-mRFP, sGMCA | Bloomington Drosophila Stock Center | 59023 | |
| FV3000 | EVIDENT | inverted confocal microscope | |
| FV31S-SW | EVIDENT | software for FV3000 | |
| G40L | Shin-Etsu Silicone | silicone grease | |
| Micro Cover Glass 18 x 18 mm 0.13-0.17 mm | MATSUNAMI | C018181 | |
| Micro Slide Glass 76 x 26 mm 0.9-1.2 mm | MATSUNAMI | S7213 | |
| NEO-SABLE Size 0 round, fine | Pentel | XZBNR-0 | paintbrush |
| SIL300CS-30CC | EVIDENT | silicone oil | |
| Stereomicroscope System SZX7 | EVIDENT | ||
| Terumo syringe 50 mL | Terumo | SS-50ESZ | |
| Transparent double sided tape | Scotch | 665-1-12 | Since the inner layer has stronger adhesion than the outer layer, the inner layer should be used to fix pupae. |
| UPLSAPO10x | EVIDENT | ||
| UPLSAPO40XS | EVIDENT | silicone immersion lens | |
| Vannas Spring Scissors - 2.5mm Cutting Edge | Fine Science Tools | 15000-08 | optional |
References
- Koto, A., Kuranaga, E., Miura, M. Temporal regulation of Drosophila IAP1 determines caspase functions in sensory organ development. J Cell Biol. 187 (2), 219-231 (2009).
- Ninov, N., Martín-Blanco, E. Live imaging of epidermal morphogenesis during the development of the adult abdominal epidermis of Drosophila. Nat Protoc. 2 (12), 3074-3080 (2007).
- Chiba, M., et al. Activatable photosensitizer for targeted ablation of lacZ-positive cells with single-cell resolution. ACS Cent Sci. 5 (11), 1676-1681 (2019).
- Umetsu, D., et al. Local increases in mechanical tension shape compartment boundaries by biasing cell intercalations. Curr Biol. 24 (16), 1798-1805 (2014).
- Tran, N. V., et al. Programmed disassembly of a microtubule-based membrane protrusion network coordinates 3D epithelial morphogenesis in Drosophila. EMBO J. 43 (6), 568-594 (2024).
- Hellerman, M. B., Choe, R. H., Johnson, R. I. Live-imaging of the Drosophila pupal eye. J Vis Exp. (95), e52120 (2015).
- O'Connor, J. T., Shannon, E. K., Hutson, M. S., Page-McCaw, A. Mounting Drosophila pupae for laser ablation and live imaging of the dorsal thorax. STAR Protoc. 3 (2), 101396 (2022).
- Ziserman, D., Roegiers, F. Live-cell imaging of sensory organ precursor cells in intact Drosophila pupae. J Vis Exp. (51), e2706 (2011).
- Tögel, M., Pass, G., Paululat, A. In vivo imaging of Drosophila wing heart development during pupal stages. Int J Dev Biol. 57 (1-2), 13-24 (2013).
- Weavers, H., Franz, A., Wood, W., Martin, P. Long-term in vivo tracking of inflammatory cell dynamics within Drosophila pupae. J Vis Exp. (136), e57871 (2018).
- Kojima, T. Developmental mechanism of the tarsus in insect legs. Curr Opin Insect Sci. 19, 36-42 (2017).
- Mirth, C., Akam, M. Joint development in the Drosophila leg: Cell movements and cell populations. Dev Biol. 246 (2), 391-406 (2002).
- Mirth, C. Ecdysteroid control of metamorphosis in the differentiating adult leg structures of Drosophila melanogaster. Dev Biol. 278 (1), 163-174 (2005).
- Tajiri, R., Misaki, K., Yonemura, S., Hayashi, S. Dynamic shape changes of ECM-producing cells drive morphogenesis of ball-and-socket joints in the fly leg. Development. 137 (12), 2055-2063 (2010).
- Hiraiwa, S., et al. Unveiling the cell dynamics during the final shape formation of the tarsus in Drosophila adult leg by live imaging. Dev Genes Evol. , (2024).
- . ImageJ plugin page Available from: https://signaling.riken.jp/en/en-tools/imagej/629/ (2024)
- Pandey, R., Heidmann, S., Lehner, C. F. Epithelial re-organization and dynamics of progression through mitosis in Drosophila separase complex mutants. J Cell Sci. 118 (4), 733-742 (2005).
- Kiehart, D. P., Galbraith, C. G., Edwards, K. A., Rickoll, W. L., Montague, R. A. Multiple forces contribute to cell sheet morphogenesis for dorsal closure in Drosophila. J Cell Biol. 149 (2), 471-490 (2000).
- Ashburner, M. . Drosophila: A Laboratory Handbook. , (1989).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved