Method Article
Imagem ao vivo de longo prazo do desenvolvimento da perna de pupa de Drosophila após a remoção do pupário
Neste Artigo
Resumo
Aqui, um protocolo é apresentado para imagens ao vivo de longo prazo da perna de Drosophila durante o estágio de pupa, envolvendo a remoção completa do pupário. Este protocolo também pode ser aplicado a outros tecidos.
Resumo
Nas últimas décadas, um progresso significativo foi feito na compreensão dos mecanismos de determinação do destino celular. No entanto, o processo pelo qual as células determinadas pelo destino formam formas organísmicas tridimensionais permanece obscuro. Avanços recentes na microscopia confocal facilitaram os esforços para observar a dinâmica celular durante o desenvolvimento por meio de imagens ao vivo. A pupa de Drosophila melanogaster é ideal para imagens ao vivo devido à sua imobilidade, cutícula pupal transparente e disponibilidade de linhas repórter fluorescentes. Um dos principais desafios para a imagem é o pupário, a cutícula que envolve a pupa, que obstrui a imagem óptica. Embora os métodos anteriores envolvessem a remoção parcial ou completa do pupário, manter a viabilidade da pupa por longos períodos após esse procedimento permaneceu um desafio. Aqui, um método simples é apresentado para imagens ao vivo de dias da perna de Drosophila durante o estágio de pupa, envolvendo a remoção completa do pupário. O método inclui a remoção do pupário de uma pupa aderida a fita dupla-face, seguida pela montagem de uma pequena câmara em um prato com fundo de vidro para envolver a pupa e uma gota de água. Essa configuração é direta, confiável e suporta a sobrevivência prolongada da pupa, evitando a dessecação. Imagens ao vivo de longo prazo da pupa de Drosophila contribuíram significativamente para capturar como a perna adulta sofre mudanças estruturais tridimensionais dramáticas ao longo de 2-3 dias. Essas mudanças incluem a formação transitória de uma estrutura intrigante (a estrutura semelhante ao Partenon) por células epiteliais, rápido estreitamento do tecido, formação de articulações e alongamento das cerdas. Este método é aplicável à observação de vários tecidos e pode potencialmente ser combinado com outras técnicas, como a indução óptica de genes, para avançar na compreensão da dinâmica celular durante a formação da forma final dos tecidos no estágio de pupa.
Introdução
Apesar do progresso considerável nas últimas décadas na elucidação do mecanismo de determinação do destino celular, como as células determinadas pelo destino constroem formas tridimensionais do organismo ainda é indescritível. Graças aos avanços tecnológicos na microscopia confocal, as tentativas de desvendar a dinâmica celular durante o desenvolvimento por imagens ao vivo têm aumentado nos últimos anos 1,2. A pupa de Drosophila melanogaster tem sido favorecida para imagens ao vivo devido às suas características adequadas: imobilidade, transparência da cutícula da pupa e disponibilidade de linhas repórteres fluorescentes 3,4,5. O maior obstáculo para a realização de imagens ao vivo da pupa de Drosophila é o pupário (caso de pupa), a cutícula larval de ínstar final deformada e bronzeada ao redor da pupa. Para evitar obstrução óptica, o pupário foi parcial ou completamente removido em métodos relatados anteriormente 1,2,3,4,5,6,7,8,9,10. A remoção completa do pupário maximiza a área de observação e a aplicabilidade a vários tecidos. No entanto, a pupa sem seu pupário normalmente morre em cerca de meio dia, presumivelmente devido à dessecação. Portanto, manter a umidade da pupa é crucial para imagens ao vivo estendidas. Embora a duração exata da sobrevivência da pupa após a remoção completa do pupário em métodos anteriores não seja clara, os exemplos relatados geralmente duravam até cerca de 20 horas. Como o estágio de pupa dura cerca de quatro dias, esperava-se que um método para imagens ao vivo ainda mais longas contribuísse para capturar todo o processo de formação da forma do tecido.
A perna adulta de Drosophila é um excelente modelo para estudar o processo de formação da forma do tecido tridimensional. Deriva dos primórdios em forma de disco (disco da perna) formados durante os estágios larvais. As regiões correspondentes a cada segmento na perna adulta são determinadas pelo estágio pré-pupal11. Em seguida, o disco da perna se projeta da parte central para formar uma estrutura tubular inchada cerca de 11 h após a formação do pupário (APF). Como esse tecido, com sua forma simples, atinge sua forma final da perna adulta nos estágios subsequentes permaneceu obscuro por muito tempo. Vários estudos abordando essa questão foram publicados 12,13,14. Como observaram tecidos fixos ou cultivados, mudanças contínuas em células individuais não puderam ser rastreadas e as informações obtidas foram um tanto fragmentadas. Para entender completamente o processo de modelagem, é essencial observar as mudanças nas células individuais continuamente por meio de imagens ao vivo de longo prazo.
Um estudo recente revelou a deformação dinâmica de estruturas tridimensionais nos níveis tecidual e celular por imagens ao vivo de longo prazo (Figura 1). A descoberta mais intrigante neste estudo é a formação transitória de uma estrutura inesperadamente complexa pelas células epiteliais. Essa estrutura, chamada de "estrutura semelhante ao Partenon", apresenta projeções apicobasais e conexões basais semelhantes a telas de células epiteliais. É importante ressaltar que a formação e o desaparecimento dessa estrutura coincidem com o rápido estreitamento do tecido15. A formação da forma subsequente, incluindo a formação da articulação e o alongamento das cerdas, prosseguiu por 2-3 dias. Imagens ao vivo de longo prazo capturaram efetivamente toda a história desses eventos sequenciais de dias.
Este artigo fornece um método passo a passo para realizar imagens ao vivo de dias da perna de Drosophila durante o estágio de pupa com remoção completa do pupário. O método é fácil de seguir e pode ser aplicado a vários outros tecidos.
Protocolo
Este protocolo usa cepas de Drosophila melanogaster que expressam repórteres fluorescentes15. Os detalhes dos reagentes e equipamentos usados no estudo estão listados na Tabela de Materiais.
1. Preparação da pupa
- Com um pincel, colete pupas brancas da cepa desejada de Drosophila melanogaster dos frascos e coloque-as em pratos ou frascos vazios ( Figura 2A ).
NOTA: Neste estudo, "pupas brancas" refere-se ao estágio entre o momento em que a larva fica completamente imóvel e antes que o pupário fique marrom. Esta fase dura cerca de 30 minutos a 25 °C. - Incubar as pupas brancas durante, pelo menos, 14 h a 25 °C até que se desenvolvam na fase a observar (figura 2B).
NOTA: O pupário pode ser removido somente após a cutícula pupal ter sido totalmente formada em 12-13,5 h APF e facilmente removido somente após 14 h APF. - Limpe a cola e voe a comida para longe do pupário com um pincel embebido em água destilada.
NOTA: O lado ventral do pupário deve estar especialmente limpo para obter adesão suficiente à fita dupla-face em etapas posteriores. - Coloque as pupas em lenços umedecidos por alguns minutos para secar.
NOTA: A umidade restante no pupário impediria uma boa adesão a uma fita dupla-face. - Fixe um pedaço de fita dupla-face em uma lâmina de vidro.
- Coloque as pupas secas em uma fita dupla-face com o lado ventral voltado para baixo (Figura 2C).
- Empurre suavemente o lado dorsal das pupas com um pincel seco para obter uma melhor adesão à fita dupla-face.
- Sob um microscópio estéreo, abra cuidadosamente o opérculo com um par de pinças (Figura 2 D, E).
NOTA: O opérculo é a região anterodorsal do pupário de onde sai a mosca adulta, abrindo-se facilmente. - A partir da borda do opérculo aberto, insira uma das pontas da pinça no espaço entre a pupa e o pupário (Figura 2F).
NOTA: Tenha cuidado para não danificar a cutícula pupal com a ponta da pinça. - Segure o pupário com uma pinça e puxe-o para fora até que se abra.
- Levante os fragmentos rasgados do pupário com uma pinça e cole-os com fita dupla-face (Figura 2G).
- Repita as etapas 1.10-1.11 até que a abertura do pupário atinja a extremidade posterior, deixando uma pequena porção do pupário (Figura 2 H,I).
NOTA: Se o fluido saísse de uma pupa, ela teria sido danificada (Figura 2K). Para observar o desenvolvimento normal, evite obter imagens de pupas danificadas.
2. Configuração de imagem
- Coloque 1 μL de água destilada ou óleo de silicone (ao usar uma lente de imersão de silicone) no fundo de um prato com fundo de vidro.
- Mergulhe um pincel na água destilada e retire suavemente a pupa (Figura 2J).
- Coloque a pupa com o lado ventral voltado para baixo sobre a água destilada ou óleo de silicone (Figura 2L).
- Com uma micropipeta, coloque 10 μL da água destilada perto da borda da parte de vidro do prato com fundo de vidro (Figura 2L).
- Coloque um círculo de graxa de silicone com uma seringa ao redor da borda da parte de vidro do prato com fundo de vidro (Figura 2M).
- Coloque uma lamínula na graxa de silicone para selá-la (Figura 2M). O conjunto é ilustrado na Figura 2N.
NOTA: Certifique-se de que não haja espaços entre a lamínula e a graxa de silicone.
3. Imagem confocal
- Ligue um microscópio a laser confocal invertido e um software de imagem.
- Coloque o prato no stage aceitador de um microscópio confocal invertido.
- Encontre as pupas com uma lente objetiva de baixa ampliação na observação de campo claro. Certifique-se de que as pupas não apresentem nenhum vazamento do fluido corporal.
- Centralize a área desejada da pupa para observar na região de interesse (ROI).
NOTA: Os lados anterolaterais do tarso na primeira e segunda pernas, e o lado ventral do tarso na terceira perna, são orientados para o lado ventral da pupa. Portanto, a seção longitudinal do tarso ao longo do eixo dorsoventral pode ser observada na primeira e segunda pernas, enquanto aquelas ao longo do eixo ântero-posterior podem ser observadas na terceira perna. - Troque a lente objetiva para a de imagens ao vivo.
NOTA: Se uma lente de imersão em água for usada, a água entre a lente e o prato com fundo de vidro secará durante a observação de longo prazo. Recomenda-se uma lente sem imersão ou imersão em óleo de silicone. - Ajuste as condições para a observação desejada e inicie a aquisição de dados.
NOTA: Para evitar qualquer dano à pupa, as potências do laser devem ser mínimas, desde que imagens nítidas possam ser obtidas. Minimizar o ROI e aumentar o tamanho da etapa é útil para economizar tempo para a aquisição da pilha Z. A transformação futura do tecido deve ser considerada ao decidir a profundidade da pilha Z. No caso de observação da perna em 15-25 h APF, uma vez que a perna se estreita muito, a parte mais próxima da lamínula (epitélio lateral) se move rapidamente mais fundo. Considerando esse movimento, pilhas Z extra profundas devem ser definidas desde o início. Um exemplo da configuração do microscópio confocal para imagens ao vivo da região do tarso da perna de 15 a 30 h APF é fornecido no Arquivo Suplementar 1. O desbotamento da fluorescência é inevitável durante imagens ao vivo de longo prazo. Para mitigar esse problema, é aconselhável usar o mínimo de potência do laser. O plug-in ImageJ "AutoEnhance"16 é recomendado para processar dados de imagens ao vivo para compensar os efeitos de desbotamento.
Resultados
Aqui, é descrito um exemplo de imagem ao vivo de 44 horas da perna adulta de Drosophila em desenvolvimento no estágio de pupa. Moscas expressando His2Av-mRFP17 (núcleos de marcação) e sGMCA18 (proteína de ligação à actina marcada com GFP Moesin, marcando actina) foram coletadas no estágio de pupa branca e incubadas por 15 h a 25 ° C. O pupário foi removido e montado de acordo com o protocolo (Figura 2). Imagens da pilha Z do tarso e do pré-tarso, perto da ponta da perna, foram obtidas com sucesso a cada 15 minutos de 16 h a 60 h APF à temperatura ambiente (não estrito, mas próximo a 25 ° C). A primeira metade da série de imagens é mostrada na Figura 3, a segunda metade na Figura 4 e o filme do todo no Filme 1. À medida que o tecido da perna se estreitava rapidamente, as células epiteliais formavam transitoriamente uma estrutura intrigante, a estrutura semelhante ao Partenon, caracterizada por suas projeções apicobasais e conexões basais (Figura 3). A redução da espessura epitelial foi observada mesmo após o contorno estar quase concluído (Figura 4). Todo o processo é visto na Figura 1.
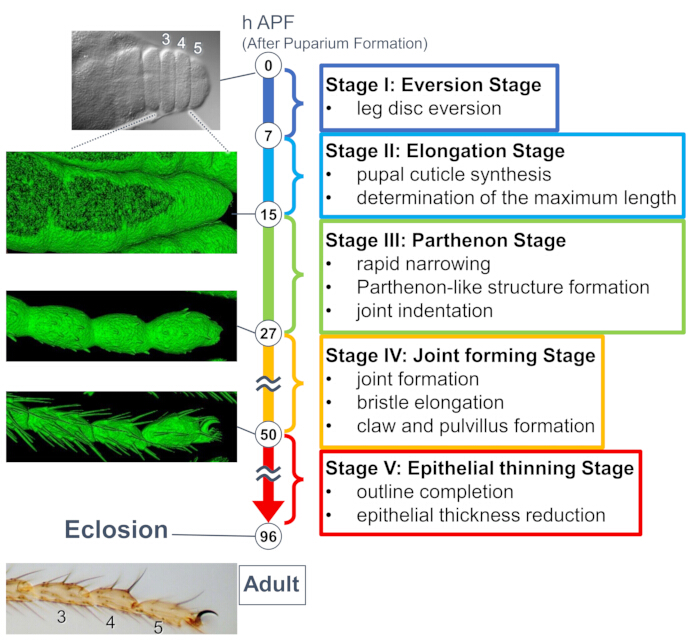
Figura 1: A visão geral da formação da forma final do tarso adulto de Drosophila durante o estágio de pupa. Todo o processo foi dividido em cinco estágios com base nas mudanças morfológicas nos níveis tecidual e celular observadas em experimentos de imagem ao vivo de longo prazo. Fotos representativas ou imagens renderizadas na superfície (sinal sGMCA) correspondentes a vários pontos de tempo são mostradas no lado esquerdo. Breves descrições dos eventos em cada estágio estão escritas no lado direito. Essa figura foi modificada de Hiraiwa et al.15. Veja também o filme 1. Clique aqui para ver uma versão maior desta figura.
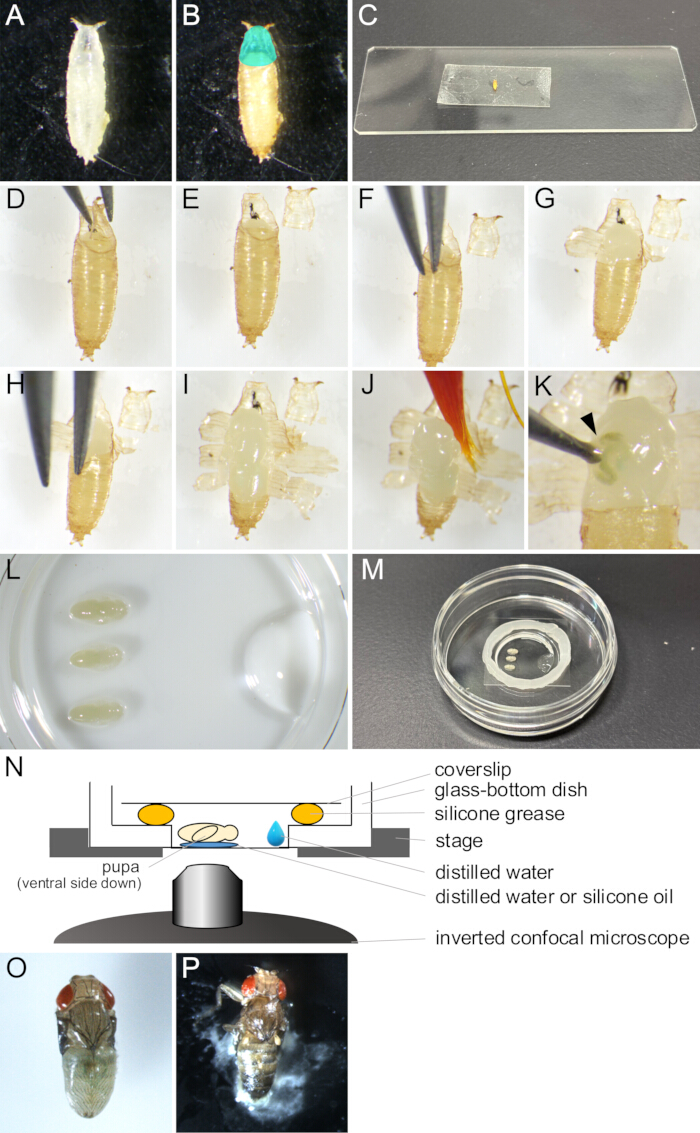
Figura 2: Remoção de pupário e montagem para imagens ao vivo. (A) Uma pupa branca coletada em um prato. (B) A pupa apareceu em (A) após incubação por 15 h a 25 ° C. A região ciano colorido indica o opérculo. (C) Uma fotografia mostrando uma pupa aderida a um pedaço de fita dupla-face. (D-J) Série de imagens mostrando o procedimento de remoção do pupário. (D) O opérculo é levantado com uma pinça. (E) O opérculo é removido. (F) Uma ponta de fórceps é inserida entre a cutícula pupal e o pupário. (G) O pupário está parcialmente aberto. (H) Uma ponta de fórceps é inserida novamente. (I) O pupário se abriu, deixando apenas uma pequena porção da extremidade posterior. (J) A pupa sendo levantada por um pincel. (K) Um exemplo de vazamento de fluido corporal da pupa. O fluido que sai da ferida cutucada pela ponta de uma pinça é indicado por uma ponta de flecha. (L-N) Imagens e ilustrações mostrando a montagem da montagem. (L) Uma imagem visualizada de cima mostrando pupas colocadas e água destilada no fundo de um prato com fundo de vidro. (M) O prato após a conclusão da montagem da montagem. Graxa de silicone foi colocada ao longo da borda ao redor da parte do vidro e uma lamínula foi colocada na graxa para selá-la. (N) Desenho esquemático do conjunto de montagem da pupa de Drosophila para imagens ao vivo de longo prazo. (O) Uma pupa montada se desenvolveu quase adulta. (P) Uma pupa montada fechando. Clique aqui para ver uma versão maior desta figura.
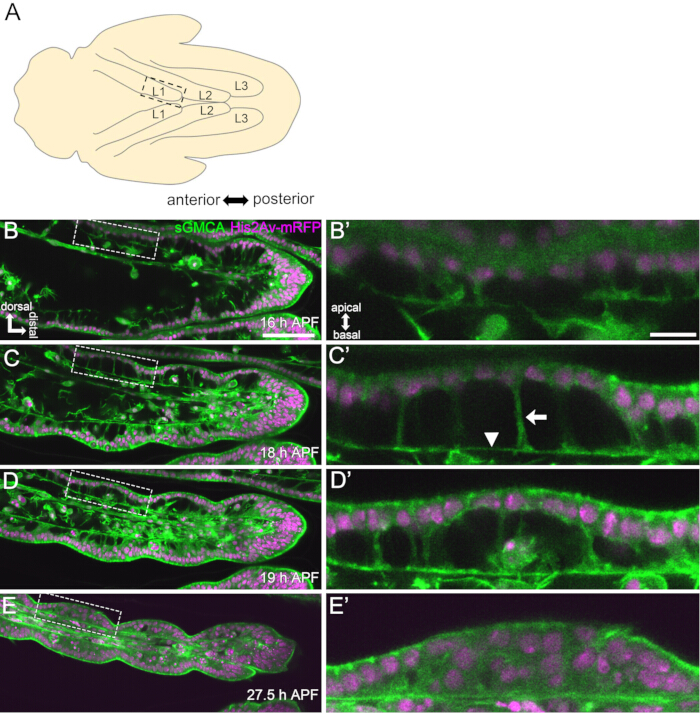
Figura 3: Mudanças dinâmicas de forma nas células epiteliais do tarso em 16-27,5 h APF. (A) Uma ilustração da pupa vista do lado ventral. O retângulo tracejado corresponde à região observada em (B-E). L1: primeira perna, L2: segunda perna, L3: terceira perna. (B,C,D,E) Fotos da imagem ao vivo da parte distal do tarso na mosca que expressa sGMCA (verde) e His2Av-mRFP (magenta). O tecido se estreita rapidamente e o recuo das regiões articulares progride. (B',C',D',E') Ampliação das regiões cercadas pelas linhas tracejadas em (B,C,D,E), respectivamente. A seta e a ponta da seta em (C') mostram um exemplo de projeções apicobasais e a posição das conexões basais, respectivamente. A estrutura semelhante ao Partenon começa a se formar em (B'), é totalmente formada em (C'), começa a desaparecer em (D') e se torna difícil de ver em (E'). Distal é à direita e dorsal ao topo em todas as figuras. Os estágios são mostrados nos cantos inferiores direitos em (B,C,D,E). Barras de escala: B,C,D,E: 50 μm; B',C',D',E': 10 μm. Essa figura foi modificada de Hiraiwa et al.15. Veja também o filme 1. Clique aqui para ver uma versão maior desta figura.
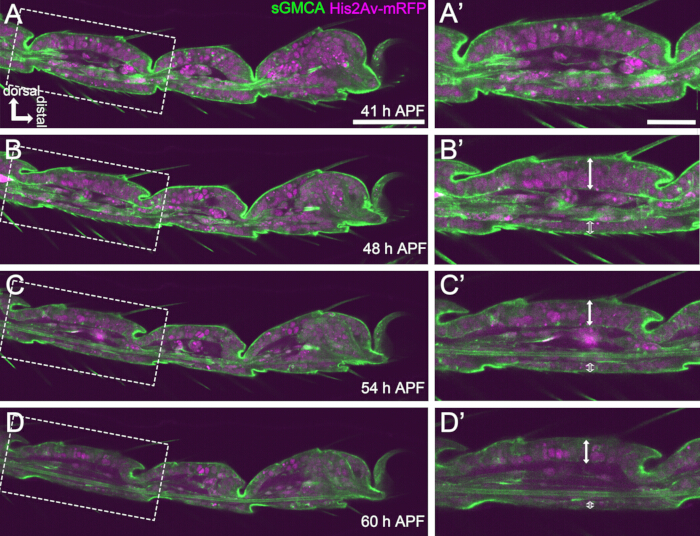
Figura 4: Mudanças de forma na camada de células epiteliais do tarso em 41-60 h APF. (A, B, C, D) Imagens estáticas do mesmo conjunto de dados sequencial de imagens ao vivo da Figura 3. Retângulos tracejados em (A,B,C,D) são ampliados em (A',B',C',D'), respectivamente. Por volta de 48 h APF (AB '), a formação da forma externa, como alongamento de cerdas, garras e pulvilões, está quase completa. A parte inferior da articulação invaginada moveu-se proximalmente e, em seguida, a formação da estrutura esférica progrediu após cerca de 54 h APF. A diferença morfológica entre o epitélio dorsal e ventral tornou-se aparente (setas duplas e setas duplas abertas em B',C',D'). Após 54 h APF (C-D'), a camada epitelial diminuiu sua espessura sem quase alterar o contorno dos segmentos. Dorsal é para o topo e distal para a direita em todas as figuras. Barras de escala: A, B, C, D: 50 μm; A',B',C',D': 20 μm.Este valor foi citado de Hiraiwa et al.15. Veja também o filme 1. Clique aqui para ver uma versão maior desta figura.
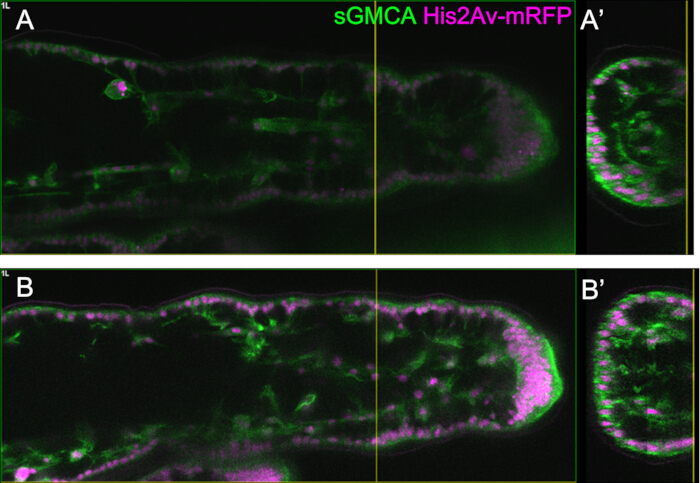
Figura 5: Um exemplo da observação da perna usando a função Bright Z. (A, B) Imagens da região, profundidade e estágio correspondentes da terceira perna da mosca que expressa sGMCA (verde) e His2Av-mRFP (magenta), com (B) ou sem (A) usando a função Bright Z. (A) Um plano XY a 59,1 μm de profundidade extraído da observação da região do tarso na terceira perna em 16 h APF adquirido sem o uso da função Bright Z. (A') A vista transversal corresponde à linha vertical amarela em (A). A linha vertical em (A') indica o plano focal de (A). (B) Um plano XY a 61,6 μm de profundidade extraído da observação da região do tarso na terceira perna a 16 h APF adquirido usando a função Bright Z. Tanto a tensão PMT quanto a potência do laser foram ajustadas. A visibilidade da imagem é melhorada em comparação com (A). (B') A vista seccional corresponde à linha vertical amarela em (B). A linha vertical amarela em (B') indica o plano focal de (B). Clique aqui para ver uma versão maior desta figura.
Arquivo Suplementar 1: Um exemplo da configuração do microscópio confocal para imagens ao vivo da região do tarso da perna de 15 a 30 h APF. Clique aqui para baixar este arquivo.
Filme 1: Imagem ao vivo de longo prazo da parte distal do tarso por 44 h. Foram utilizados os sGMCA (verde) e His2Av-mRFP (magenta) expressando mosca. O plano XY mais representativo foi extraído do mesmo conjunto de dados da Figura 3 e da Figura 4. As pontas das setas indicam exemplos de futuras regiões conjuntas. As células que se movem rapidamente no tecido são células semelhantes a macrófagos. O sinal em forma de corda que se estende ao longo dos segmentos do tarso faz parte do septo. O carimbo de data/hora mostra hh: mm. Distal é à direita e dorsal ao topo. Este filme foi adaptado de Hiraiwa et al.15Clique aqui para baixar este arquivo.
Discussão
Neste artigo, é fornecido um protocolo detalhado para imagens ao vivo de longo prazo da perna de Drosophila no estágio de pupa. O disco imaginário da perna se projeta da parte central para formar uma estrutura tubular e, em seguida, a formação da forma final da perna adulta ocorre no estágio de pupa de uma maneira que era indescritível. Tentativas anteriores de observar esse processo foram principalmente por coloração fixa, cultura de tecidos e microscópio eletrônico de varredura 12,13,14. Esses métodos não puderam rastrear mudanças contínuas em células individuais e apenas informações fragmentárias foram obtidas. Com o método descrito neste estudo, o processo de formação da forma final da região do tarso pode ser observado com sucesso como a imagem sequencial ao vivo de dias por um microscópio confocal, e as alterações nas células individuais podem ser rastreadas continuamente. A intrigante dinâmica celular revelada por esta imagem ao vivo foi descrita em detalhes no relatório recente15.
Para imagens vivas bem-sucedidas a longo prazo, é crucial manter a viabilidade da pupa e garantir que seu desenvolvimento permaneça inalterado. No método descrito aqui, a pupa removida do pupário desenvolveu-se no adulto do farato e no adulto em muitos casos (Figura 2O, P). Os tempos das mudanças morfológicas do tarso em desenvolvimento observados por este método foram consistentes com relatos anteriores 12,13,14. Além disso, as células epiteliais apresentaram alterações como a redução da espessura mesmo em 48-60 h APF (32-44 h após a montagem) ( Figura 4B '-D '). Esses fatos sugerem que a pupa permanece intacta e quase não sofre interrupção ou atraso em seu desenvolvimento normal durante imagens vivas de longo prazo usando o método descrito aqui. Observe que a viabilidade da pupa removida do pupário submetida a imagens ao vivo pode variar dependendo do momento da remoção do pupário, do manuseio no procedimento, da extensão da fototoxicidade na imagem e das cepas de moscas usadas.
Uma das etapas críticas para garantir a integridade da pupa e seu desenvolvimento é remover o pupário sem prejudicar a pupa. A adesão estável da pupa à fita dupla-face e o manuseio cuidadoso da pinça são as chaves para o sucesso. Prevenir a desidratação da pupa também é crucial. Nesse sentido, é fundamental evitar espaços entre a lamínula e a graxa de silicone.
Para evitar a dessecação da pupa, muitos métodos anteriores envolviam a remoção parcial do pupário 1,2,3,4,5,6,7. Para observar toda a pupa, no entanto, a remoção completa do pupário é favorecida. Embora o tempo máximo de sobrevivência da pupa não seja conhecido, vários métodos nos quais o pupário é totalmente removido foram relatados 8,9,10. A abordagem mais comum para fornecer umidade para a pupa nesses métodos é o uso de papel de filtro umedecido. Em comparação com os métodos anteriores, o descrito aqui fornece umidade colocando uma gota d'água de maneira mais simples e fácil. Além disso, muitos métodos anteriores envolvem a montagem da pupa em uma lâmina de vidro. Ao montar a pupa removida do pupário em uma lâmina de vidro, pode haver um problema em que pressionar a lamínula contra a pupa causa estresse à pupa ou uma lamínula inclinada introduz ruído, distorções e falta de clareza nas imagens. O método aqui descrito emprega um prato com fundo de vidro, que elimina a necessidade de pressionar a lamínula contra a pupa, permitindo a observação dos tecidos o mais próximo possível de seu estado natural. Como não há necessidade de ajustar o ângulo da lamínula, a configuração é estável, fácil de manusear e mais confiável. Portanto, esse método quase não requer habilidades especializadas, permitindo que até mesmo iniciantes realizem imagens ao vivo com sucesso.
As principais limitações deste método são a profundidade das observações e as resoluções de tempo. Sob as condições de observação do tarso, imagens nítidas só podem ser obtidas até cerca de 40 μm de profundidade. O uso da função Bright Z ajuda a resolver esse problema. Por exemplo, como mostrado na Figura 5, aumentar a potência do laser e a tensão PMT à medida que a profundidade aumenta, empregando a função Bright Z, melhorou a qualidade das imagens em posições mais profundas. No entanto, aumentar a potência do laser vem com uma compensação envolvendo fototoxicidade e desvanecimento do sinal. Portanto, é necessário encontrar as condições ideais que se alinhem com o objetivo da observação. A resolução do tempo também é importante ao observar células e tecidos em movimento rápido. A redução de fatias e a redução do ROI são as principais soluções para esse problema. O uso de equipamentos atualizados com sensibilidade aprimorada do detector ou um microscópio confocal de disco giratório pode melhorar a resolução do tempo. Outra limitação está relacionada ao estágio da pupa. O pupário pode ser removido somente após a cutícula pupal ter sido totalmente formada em 12-13,5 h APF19e pode ser facilmente removido somente após 14 h APF. Os estágios anteriores a 12 h APF podem ser parcialmente observados montando a pupa sem remover o pupário15, embora a obtenção de imagens nítidas seja difícil devido aos movimentos rápidos do tecido e obstáculos ópticos do pupário nessa condição.
Solucionando problemas
Dificuldade na remoção do pupário
Ao remover o pupário, a adesão do lado ventral do pupário à fita dupla-face é importante. A cola e os alimentos devem ser removidos da superfície do pupário, e a secagem subsequente é importante, pois as superfícies molhadas impedem uma boa adesão. Notavelmente, a fita dupla face na mesa de materiais tem uma adesão mais forte no lado interno. O lado interno (mais forte) deve ser usado para aderir a pupa. Cortar o pupário com uma tesoura de dissecação em vez de rasgá-lo com uma pinça é útil quando a remoção do pupário é difícil.
Vazamento de fluido da pupa
É fundamental remover o pupário sem prejudicar a pupa. O vazamento do fluido corporal da pupa indica danos à pupa (Figura 2K). Essa pupa deve ser evitada de imagens ao vivo. Para evitar danos à pupa enquanto o pupário é removido, além do manuseio cuidadoso, recomenda-se o uso de pinças com pontas relativamente largas.
Má qualidade de imagem
Quando o sinal fluorescente é muito fraco, há muitas maneiras de ajustar o brilho, como aumentar a tensão PMT, abrir o orifício (CA), diminuir a velocidade de varredura e aumentar a potência do laser. Lembre-se de que todos os métodos têm efeitos colaterais: aumentar a tensão PMT pode aumentar o ruído, abrir o orifício reduz a resolução do eixo Z, diminuir a velocidade de varredura prolonga o tempo de varredura e aumentar a potência do laser aumenta o risco de fototoxicidade e branqueamento. As configurações apropriadas devem ser encontradas dependendo da região de interesse, dos tipos e níveis de expressão dos repórteres fluorescentes e da duração desejada da imagem ao vivo. No geral, recomenda-se que a potência do laser seja minimizada para imagens ao vivo de longo prazo.
Desvanecimento da fluorescência
O desvanecimento da fluorescência é inevitável em imagens ao vivo de longo prazo. Recomenda-se o uso mínimo da potência do laser para evitar esse problema. Para compensar o desbotamento, o plug-in ImageJ "AutoEnhance"16 é recomendado ao processar os dados de imagem ao vivo adquiridos.
Graças à remoção completa do pupário, este método é altamente aplicável a outros tecidos apenas modificando o ROI e a orientação da pupa. De fato, embora não sejam imagens ao vivo, a parte proximal da perna, a tromba, o epitélio da cabeça próximo à antena e o epitélio do tórax dorsal foram observados por esse método em Hiraiwa et al.15. Essa aplicabilidade a uma ampla gama de tecidos pode facilitar uma maior integração com outras técnicas, como a indução óptica de genes. Este método também pode ser aplicável a espécies de ciclorrafano (formadoras de pupário) que não sejam Drosophila. Além disso, poderia ser usado para outras espécies de insetos se eles tiverem uma cutícula de pupa transparente. Este artigo fornece instruções detalhadas para os pesquisadores de Drosophila realizarem imagens ao vivo da pupa para capturar a dinâmica celular em tecidos vivos.
Divulgações
Os autores declaram não haver interesses conflitantes.
Agradecimentos
Somos gratos ao Dr. Masayuki Miura (Universidade de Tóquio) e ao Dr. Yuya Fujisawa (Universidade de Tóquio) pelo aconselhamento técnico, e agradecemos ao Bloomington Stock Center pelos recursos para moscas.
Materiais
| Name | Company | Catalog Number | Comments |
| 35 mm/glass base dish | IWAKI | 3911-035 | |
| Cleaning wipes | NIPPON PAPER CRECIA | S-200 | |
| Dumont #3c Forceps | Fine Science Tools | 11231-20 | |
| Dumont #5SF | Fine Science Tools | 11252-00 | |
| Eppendorf Research plus 2-20 µL | Eppendorf | 3123000098 | |
| Fly strain: His2Av-mRFP, sGMCA | Bloomington Drosophila Stock Center | 59023 | |
| FV3000 | EVIDENT | inverted confocal microscope | |
| FV31S-SW | EVIDENT | software for FV3000 | |
| G40L | Shin-Etsu Silicone | silicone grease | |
| Micro Cover Glass 18 x 18 mm 0.13-0.17 mm | MATSUNAMI | C018181 | |
| Micro Slide Glass 76 x 26 mm 0.9-1.2 mm | MATSUNAMI | S7213 | |
| NEO-SABLE Size 0 round, fine | Pentel | XZBNR-0 | paintbrush |
| SIL300CS-30CC | EVIDENT | silicone oil | |
| Stereomicroscope System SZX7 | EVIDENT | ||
| Terumo syringe 50 mL | Terumo | SS-50ESZ | |
| Transparent double sided tape | Scotch | 665-1-12 | Since the inner layer has stronger adhesion than the outer layer, the inner layer should be used to fix pupae. |
| UPLSAPO10x | EVIDENT | ||
| UPLSAPO40XS | EVIDENT | silicone immersion lens | |
| Vannas Spring Scissors - 2.5mm Cutting Edge | Fine Science Tools | 15000-08 | optional |
Referências
- Koto, A., Kuranaga, E., Miura, M. Temporal regulation of Drosophila IAP1 determines caspase functions in sensory organ development. J Cell Biol. 187 (2), 219-231 (2009).
- Ninov, N., Martín-Blanco, E. Live imaging of epidermal morphogenesis during the development of the adult abdominal epidermis of Drosophila. Nat Protoc. 2 (12), 3074-3080 (2007).
- Chiba, M., et al. Activatable photosensitizer for targeted ablation of lacZ-positive cells with single-cell resolution. ACS Cent Sci. 5 (11), 1676-1681 (2019).
- Umetsu, D., et al. Local increases in mechanical tension shape compartment boundaries by biasing cell intercalations. Curr Biol. 24 (16), 1798-1805 (2014).
- Tran, N. V., et al. Programmed disassembly of a microtubule-based membrane protrusion network coordinates 3D epithelial morphogenesis in Drosophila. EMBO J. 43 (6), 568-594 (2024).
- Hellerman, M. B., Choe, R. H., Johnson, R. I. Live-imaging of the Drosophila pupal eye. J Vis Exp. (95), e52120 (2015).
- O'Connor, J. T., Shannon, E. K., Hutson, M. S., Page-McCaw, A. Mounting Drosophila pupae for laser ablation and live imaging of the dorsal thorax. STAR Protoc. 3 (2), 101396 (2022).
- Ziserman, D., Roegiers, F. Live-cell imaging of sensory organ precursor cells in intact Drosophila pupae. J Vis Exp. (51), e2706 (2011).
- Tögel, M., Pass, G., Paululat, A. In vivo imaging of Drosophila wing heart development during pupal stages. Int J Dev Biol. 57 (1-2), 13-24 (2013).
- Weavers, H., Franz, A., Wood, W., Martin, P. Long-term in vivo tracking of inflammatory cell dynamics within Drosophila pupae. J Vis Exp. (136), e57871 (2018).
- Kojima, T. Developmental mechanism of the tarsus in insect legs. Curr Opin Insect Sci. 19, 36-42 (2017).
- Mirth, C., Akam, M. Joint development in the Drosophila leg: Cell movements and cell populations. Dev Biol. 246 (2), 391-406 (2002).
- Mirth, C. Ecdysteroid control of metamorphosis in the differentiating adult leg structures of Drosophila melanogaster. Dev Biol. 278 (1), 163-174 (2005).
- Tajiri, R., Misaki, K., Yonemura, S., Hayashi, S. Dynamic shape changes of ECM-producing cells drive morphogenesis of ball-and-socket joints in the fly leg. Development. 137 (12), 2055-2063 (2010).
- Hiraiwa, S., et al. Unveiling the cell dynamics during the final shape formation of the tarsus in Drosophila adult leg by live imaging. Dev Genes Evol. , (2024).
- . ImageJ plugin page Available from: https://signaling.riken.jp/en/en-tools/imagej/629/ (2024)
- Pandey, R., Heidmann, S., Lehner, C. F. Epithelial re-organization and dynamics of progression through mitosis in Drosophila separase complex mutants. J Cell Sci. 118 (4), 733-742 (2005).
- Kiehart, D. P., Galbraith, C. G., Edwards, K. A., Rickoll, W. L., Montague, R. A. Multiple forces contribute to cell sheet morphogenesis for dorsal closure in Drosophila. J Cell Biol. 149 (2), 471-490 (2000).
- Ashburner, M. . Drosophila: A Laboratory Handbook. , (1989).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados