Method Article
Puparium çıkarıldıktan sonra Drosophila pupa bacak gelişiminin uzun süreli canlı görüntülenmesi
Bu Makalede
Özet
Burada, pupa evresinde Drosophila bacağının uzun süreli canlı görüntülenmesi için pupariumun tamamen çıkarılmasını içeren bir protokol sunulmaktadır. Bu protokol diğer dokulara da uygulanabilir.
Özet
Son on yıllarda, hücre kaderi belirleme mekanizmalarının anlaşılmasında önemli ilerlemeler kaydedilmiştir. Bununla birlikte, kader tarafından belirlenen hücrelerin üç boyutlu organizma şekilleri oluşturma süreci belirsizliğini korumaktadır. Konfokal mikroskopideki son gelişmeler, canlı görüntüleme yoluyla gelişim sırasında hücre dinamiklerini gözlemleme çabalarını kolaylaştırmıştır. Drosophila melanogaster pupa, hareketsizliği, şeffaf pupa kütikülü ve floresan raportör hatlarının mevcudiyeti nedeniyle canlı görüntüleme için idealdir. Görüntüleme için birincil zorluk, optik görüntülemeyi engelleyen pupayı çevreleyen kütikül olan puparium'dur. Önceki yöntemler pupariumun kısmen veya tamamen çıkarılmasını içerirken, bu prosedürden sonra uzun süreler boyunca pupa canlılığını korumak zor olmaya devam etmiştir. Burada, pupa aşamasında Drosophila bacağının günlerce canlı görüntülenmesi için tam puparium çıkarılmasını içeren basit bir yöntem sunulmaktadır. Yöntem, pupariumun çift taraflı bantla yapıştırılmış bir pupadan çıkarılmasını ve ardından pupayı ve bir damla suyu çevrelemek için cam tabanlı bir tabak üzerine küçük bir haznenin monte edilmesini içerir. Bu kurulum basit, güvenilirdir ve kurumayı önleyerek uzun süreli pupa sağkalımını destekler. Drosophila pupa'nın uzun süreli canlı görüntülemesi, yetişkin bacağının 2-3 gün içinde nasıl dramatik üç boyutlu yapısal değişikliklere uğradığını yakalamaya önemli ölçüde katkıda bulunmuştur. Bu değişiklikler, epitel hücreleri tarafından ilgi çekici bir yapının (Parthenon benzeri yapı) geçici oluşumunu, hızlı doku daralmasını, eklem oluşumunu ve kıl uzamasını içerir. Bu yöntem, çeşitli dokuların gözlemlenmesi için geçerlidir ve potansiyel olarak, pupa evresindeki dokuların son şekil oluşumu sırasında hücre dinamiklerinin anlaşılmasını ilerletmek için optik gen indüksiyonu gibi diğer tekniklerle birleştirilebilir.
Giriş
Son birkaç on yılda, hücre kaderini belirleme mekanizmasının aydınlatılmasında kayda değer ilerlemeye rağmen, kader tarafından belirlenen hücrelerin üç boyutlu organizma şekillerini nasıl oluşturdukları hala belirsizdir. Konfokal mikroskopideki teknolojik gelişmeler sayesinde, canlı görüntüleme ile gelişim sırasında hücre dinamiklerini ortaya çıkarma girişimleri son yıllarda artmaktadır 1,2. Drosophila melanogaster pupa, uygun özellikleri nedeniyle canlı görüntüleme için tercih edilmiştir: hareketsizlik, pupa kütikülünün şeffaflığı ve floresan raportör hatlarınınmevcudiyeti 3,4,5. Drosophila pupa'nın canlı görüntülemesinin yapılmasının önündeki en büyük engel, pupayı çevreleyen deforme olmuş ve tabaklanmış son instar larva kütikülü olan puparium (pupa vakası). Optik tıkanıklığı önlemek için, daha önce bildirilen yöntemlerdepuparium kısmen veya tamamen çıkarıldı 1,2,3,4,5,6,7,8,9,10. Pupariumun tamamen çıkarılması, gözlem alanını ve çeşitli dokulara uygulanabilirliği en üst düzeye çıkarır. Bununla birlikte, puparyumu olmayan pupa, muhtemelen kurumaya bağlı olarak tipik olarak yaklaşık yarım gün içinde ölür. Bu nedenle, pupa neminin korunması, uzun süreli canlı görüntüleme için çok önemlidir. Önceki yöntemlerde tam puparium çıkarıldıktan sonra pupa sağkalımının kesin süresi belirsiz olsa da, bildirilen örnekler tipik olarak yaklaşık 20 saate kadar sürmüştür. Pupa evresi yaklaşık dört gün sürdüğü için, daha uzun canlı görüntüleme yönteminin tüm doku şekli oluşum sürecini yakalamaya katkıda bulunması bekleniyordu.
Drosophila yetişkin bacağı, üç boyutlu doku şekli oluşturma sürecini incelemek için mükemmel bir modeldir. Larva dönemlerinde oluşan disk şeklindeki primordia'dan (bacak diski) türemiştir. Erişkin bacağındaki her bir segmente karşılık gelen bölgeler, hazırlık aşaması11 tarafından belirlenir. Daha sonra, bacak diski, puparium oluşumundan (APF) yaklaşık 11 saat sonra şişkin bir boru şeklinde yapı oluşturmak için merkezi kısımdan çıkıntı yapar. Bu dokunun basit şekli ile sonraki aşamalarda erişkin bacağının son şeklini nasıl elde ettiği uzun süre belirsizliğini korumuştur. Bu konuyu ele alan çeşitli çalışmalar yayınlanmıştır 12,13,14. Sabit veya kültürlenmiş dokuları gözlemledikleri için, tek tek hücrelerdeki sürekli değişiklikler izlenemedi ve elde edilen bilgiler bir şekilde parçalandı. Şekillendirme sürecini tam olarak anlamak için, uzun süreli canlı görüntüleme yoluyla tek tek hücrelerdeki değişiklikleri sürekli olarak gözlemlemek önemlidir.
Yakın zamanda yapılan bir çalışma, uzun süreli canlı görüntüleme ile doku ve hücresel düzeylerdeki üç boyutlu yapıların dinamik deformasyonunu ortaya koymuştur (Şekil 1). Bu çalışmadaki en ilgi çekici bulgu, epitel hücreleri tarafından beklenmedik şekilde karmaşık bir yapının geçici olarak oluşmasıdır. "Parthenon benzeri yapı" olarak adlandırılan bu yapı, apikobazal çıkıntılara ve epitel hücrelerinin bazal ağ benzeri bağlantılarına sahiptir. Daha da önemlisi, bu yapının oluşumu ve kaybolması hızlı doku daralması ile aynı zamana denk gelir15. Eklem oluşumu ve kıl uzaması dahil olmak üzere sonraki şekil oluşumu 2-3 gün boyunca devam etti. Uzun süreli canlı görüntüleme, günlerce süren bu ardışık olayların tüm hikayesini etkili bir şekilde yakaladı.
Bu makale, pupariumun tamamen çıkarılmasıyla pupa aşamasında Drosophila bacağının günlerce canlı görüntülemesini gerçekleştirmek için adım adım bir yöntem sunmaktadır. Yöntemin takip edilmesi kolaydır ve diğer çeşitli dokulara uygulanabilir.
Protokol
Bu protokol, floresan muhabirleri15 eksprese eden Drosophila melanogaster suşlarını kullanır. Çalışmada kullanılan reaktiflerin ve ekipmanların detayları Malzeme Tablosunda listelenmiştir.
1. Pupa'nın hazırlanması
- Bir boya fırçası ile, istenen Drosophila melanogaster suşunun beyaz pupalarını şişelerden toplayın ve bunları tabaklara veya boş şişelere koyun (Şekil 2A).
NOT: Bu çalışmada "beyaz pupa", larvaların tamamen hareketsiz hale gelmesi ile puparium kahverengileşmeden önceki aşamayı ifade eder. Bu aşama 25 °C'de yaklaşık 30 dakika sürer. - Beyaz pupaları, gözlemlenecek aşamaya gelene kadar 25 ° C'de en az 14 saat kuluçkaya yatırın (Şekil 2B).
NOT: Puparium ancak pupa kütikülü 12-13.5 saat APF'de tamamen oluşturulduktan sonra çıkarılabilir ve ancak 14 saat APF'den sonra kolayca çıkarılabilir. - Yapıştırıcıyı silin ve damıtılmış suya batırılmış bir boya fırçası ile yiyecekleri pupariumdan uzaklaştırın.
NOT: Pupariumun ventral tarafı, sonraki adımlarda çift taraflı banda yeterli yapışma sağlamak için özellikle temiz olmalıdır. - Pupaları kuruması için birkaç dakika temizleme mendillerinin üzerine koyun.
NOT: Puparium üzerinde kalan nem, çift taraflı bir banda iyi bir yapışmayı önleyecektir. - Bir cam slayt üzerine bir parça çift taraflı bant sabitleyin.
- Kurutulmuş pupaları ventral tarafı aşağı bakacak şekilde çift taraflı bir bant üzerine yerleştirin (Şekil 2C).
- Çift taraflı banda daha iyi yapışma sağlamak için pupaların sırt tarafını kurumuş bir boya fırçası ile hafifçe itin.
- Stereo mikroskop altında, operkulumu bir çift forseps ile dikkatlice açın (Şekil 2 D,E).
NOT: Operkulum, yetişkin sineğin çıktığı puparyumun anterodorsal bölgesidir, bu nedenle kolayca açılır. - Açılan operkulumun kenarından, forsepslerin uçlarından birini pupa ve puparium arasındaki boşluğa yerleştirin (Şekil 2F).
NOT: Forsepsin ucuyla pupa kütikülüne zarar vermemeye dikkat edin. - Puparium'u forseps ile kavrayın ve kırılana kadar dışarı doğru çekin.
- Puparyumun yırtık parçalarını forseps ile kaldırın ve çift taraflı banda yapıştırın (Şekil 2G).
- Puparium'un açıklığı arka uca ulaşana kadar 1.10-1.11 adımlarını tekrarlayın ve puparyumun küçük bir kısmını bırakın (Şekil 2 H,I).
NOT: Bir pupadan sıvı çıksaydı, hasar görmüş olurdu (Şekil 2K). Normal gelişimi gözlemlemek için, hasarlı pupaları görüntülemekten kaçının.
2. Görüntüleme kurulumu
- Cam tabanlı bir tabağın dibine 1 μL damıtılmış su veya silikon yağı (silikon daldırma lensi kullanırken) koyun.
- Damıtılmış suya bir boya fırçası batırın ve pupayı nazikçe alın (Şekil 2J).
- Pupayı ventral tarafı aşağı bakacak şekilde damıtılmış su veya silikon yağı üzerine yerleştirin (Şekil 2L).
- Bir mikropipet ile, 10 μL damıtılmış suyu cam tabanlı tabağın cam kısmının kenarına yakın bir yere koyun (Şekil 2L).
- Cam tabanlı çanağın cam kısmının kenarına bir şırınga ile bir silikon yağ çemberi yerleştirin (Şekil 2M).
- Kapatmak için silikon gresin üzerine bir lamel koyun (Şekil 2M). Montaj Şekil 2N'de gösterilmiştir.
NOT: Lamel ile silikon gres arasında boşluk olmadığından emin olun.
3. Konfokal görüntüleme
- Ters çevrilmiş bir konfokal lazer mikroskobu ve görüntüleme yazılımını açın.
- Çanağı ters çevrilmiş bir konfokal mikroskobun sahne alıcısı üzerine yerleştirin.
- Parlak alan gözleminde düşük büyütmeli objektif merceğe sahip pupaları bulun. Pupaların vücut sıvısında herhangi bir sızıntı göstermediğinden emin olun.
- İlgilenilen bölgede gözlemlemek için pupa'nın istenen alanını ortalayın (ROI).
NOT: Birinci ve ikinci bacaklarda tarsusun anterolateral tarafları, üçüncü bacakta ise tarsusun ventral tarafı, pupanın ventral tarafına doğru yönlendirilmiştir. Bu nedenle, tarsusun dorsoventral eksen boyunca uzanan uzunlamasına bölümü birinci ve ikinci bacaklarda gözlenebilirken, ön-arka eksen boyunca olanlar üçüncü bacakta gözlenebilir. - Objektif lensi canlı görüntüleme için olanla değiştirin.
NOT: Suya daldırmalı bir lens kullanılıyorsa, lens ile cam tabanlı çanak arasındaki su uzun süreli gözlem sırasında kuruyacaktır. Daldırmasız veya silikon yağına daldırılmış bir lens önerilir. - İstenen gözlem için koşulları ayarlayın ve veri toplamaya başlayın.
NOT: Pupaya herhangi bir zarar gelmesini önlemek için, net görüntüler elde edilebildiği sürece lazer güçleri minimum düzeyde olmalıdır. Yatırım getirisini en aza indirmek ve adım boyutunu artırmak, Z yığını alımı için zamandan tasarruf etmeye yardımcı olur. Z yığınının derinliğine karar verirken dokunun gelecekteki dönüşümü dikkate alınmalıdır. 15-25 saat APF'de bacak gözlemi durumunda, bacak çok daraldığı için lamele en yakın kısım (lateral epitel) hızla derine doğru hareket eder. Bu hareket göz önüne alındığında, ekstra derin Z yığınları ilkinden itibaren ayarlanmalıdır. Bacak tarsal bölgesinin 15-30 saat APF'den canlı görüntülenmesi için konfokal mikroskop ayarının bir örneği Ek Dosya 1'de verilmiştir. Uzun süreli canlı görüntüleme sırasında floresan solması kaçınılmazdır. Bu sorunu azaltmak için minimum lazer gücü kullanılması tavsiye edilir. Solma efektlerini telafi etmek için canlı görüntüleme verilerinin işlenmesi için ImageJ eklentisi "AutoEnhance"16 önerilir.
Sonuçlar
Burada, pupa evresinde gelişmekte olan Drosophila yetişkin bacağının 44 saatlik canlı görüntülemesinin bir örneği anlatılmaktadır. His2Av-mRFP17 (etiketleme çekirdekleri) ve sGMCA18 (GFP etiketli aktin bağlayıcı protein Moesin, aktin etiketleme) eksprese eden sinekler beyaz pupa aşamasında toplandı ve 25 ° C'de 15 saat inkübe edildi. Puparium protokole göre çıkarıldı ve monte edildi (Şekil 2). Bacağın ucuna yakın tarsus ve pretarsus'un Z yığını görüntüleri, oda sıcaklığında (katı değil, ancak 25 ° C'ye yakın) 16 saat ila 60 saat APF arasında her 15 dakikada bir başarıyla elde edildi. Görüntü serisinin ilk yarısı Şekil 3'te, ikinci yarısı Şekil 4'te ve tamamının filmi Film 1'de gösterilmiştir. Bacak dokusu hızla daraldıkça, epitel hücreleri geçici olarak ilgi çekici bir yapı oluşturdu, apikobazal çıkıntıları ve bazal bağlantıları ile karakterize edilen Parthenon benzeri yapı (Şekil 3). Epitel kalınlığındaki azalma, taslak neredeyse tamamlandıktan sonra bile gözlenmiştir (Şekil 4). Tüm süreç Şekil 1'de gözden geçirilmiştir.
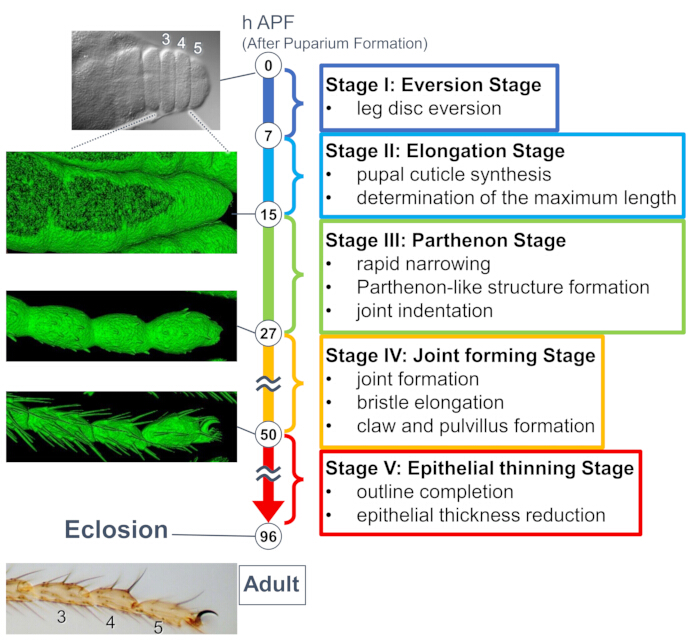
Şekil 1: Pupa evresindeki Drosophila ergin tarsusunun son şekil oluşumuna genel bakış. Tüm süreç, uzun süreli canlı görüntüleme deneylerinde gözlemlenen hem doku hem de hücresel düzeylerdeki morfolojik değişikliklere dayalı olarak beş aşamaya ayrıldı. Birkaç zaman noktasına karşılık gelen temsili fotoğraflar veya yüzey oluşturulmuş görüntüler (sGMCA sinyali) sol tarafta gösterilir. Her aşamadaki olayların kısa açıklamaları sağ tarafa yazılmıştır. Bu rakam Hiraiwa ve ark.15'ten değiştirilmiştir. Ayrıca bakınız Film 1. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
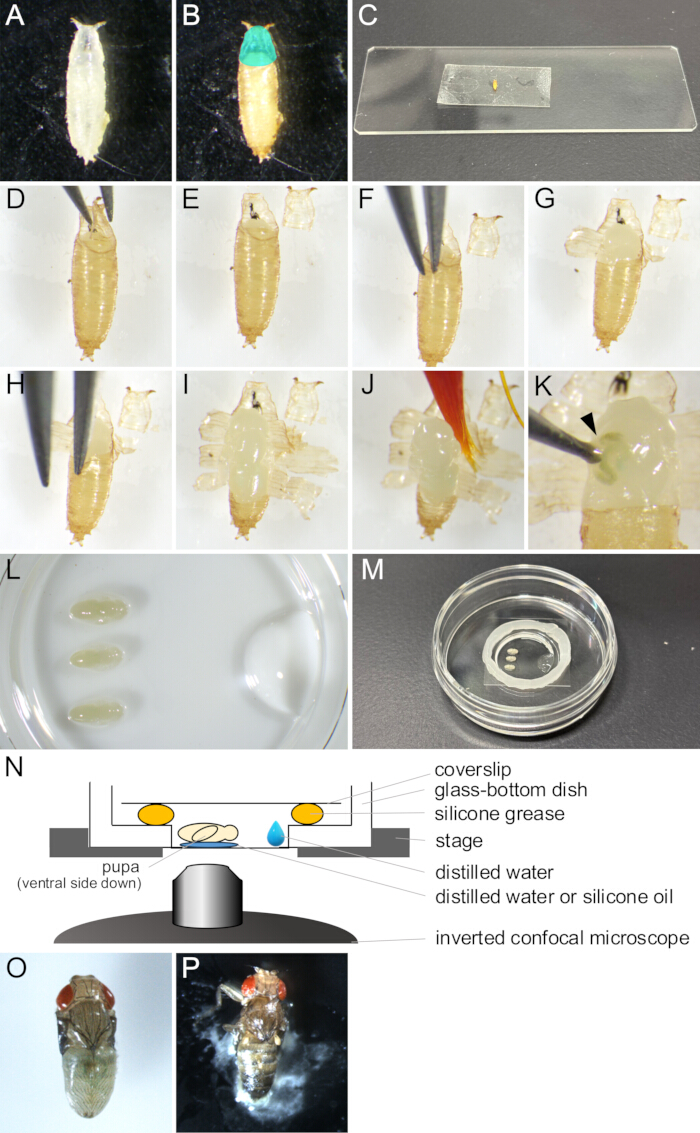
Şekil 2: Canlı görüntüleme için puparium çıkarma ve montaj montajı. (A) Bir tabakta toplanmış beyaz bir pupa. (B) Pupa, 25 ° C'de 15 saat inkübe edildikten sonra (A)'da ortaya çıktı. Bölge renkli camgöbeği operkulumu gösterir. (C) Çift taraflı bir bant parçasına yapıştırılmış bir pupayı gösteren bir fotoğraf. (D-J) Puparium çıkarma prosedürünü gösteren bir dizi görüntü. (D) Operkulum forseps ile kaldırılır. (E) Operkulum çıkarılır. (F) Pupa kütikül ile puparium arasına bir forseps ucu yerleştirilir. (G) Puparium kısmen açılmıştır. (H) Bir forseps ucu tekrar yerleştirilir. (I) Puparium açıldı ve arka ucun sadece küçük bir kısmını bıraktı. (J) Pupa bir boya fırçası ile kaldırılıyor. (K) Pupa'nın vücut sıvısı sızıntısına bir örnek. Forseps ucu ile açılan yaradan çıkan sıvı bir ok ucu ile gösterilir. (L-N) Montaj montajını gösteren resimler ve çizimler. (L) Cam tabanlı bir tabağın dibine yerleştirilmiş pupa ve damıtılmış suyu gösteren yukarıdan bakıldığında görüntülenen bir görüntü. (M) Montaj montajının tamamlanmasından sonraki çanak. Cam kısmın etrafındaki kenar boyunca silikon gres sürüldü ve gresin sızdırmaz hale getirilmesi için üzerine bir lamel yerleştirildi. (N) Uzun süreli canlı görüntüleme için Drosophila pupa'nın montaj düzeneğinin şematik çizimi. (O) Atlı bir pupa neredeyse yetişkin olarak gelişti. (P) Monte edilmiş bir pupa kapanıyor. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
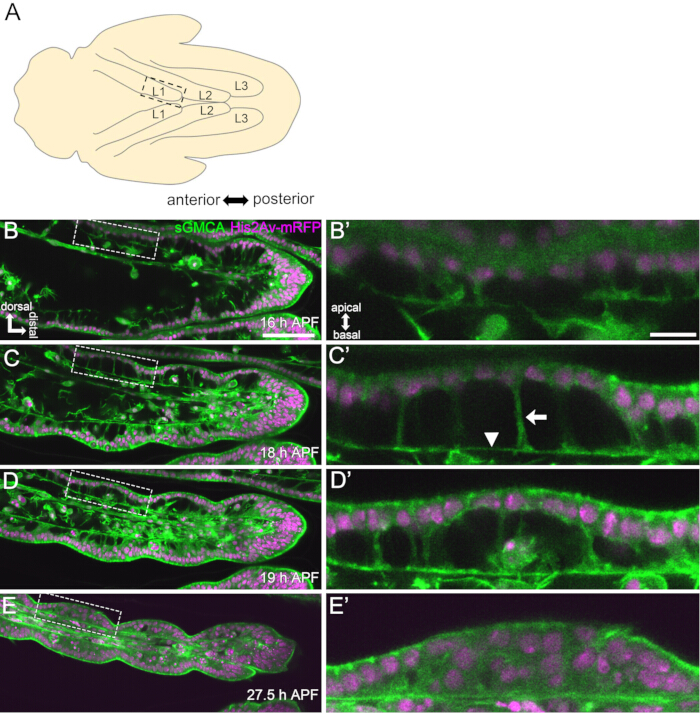
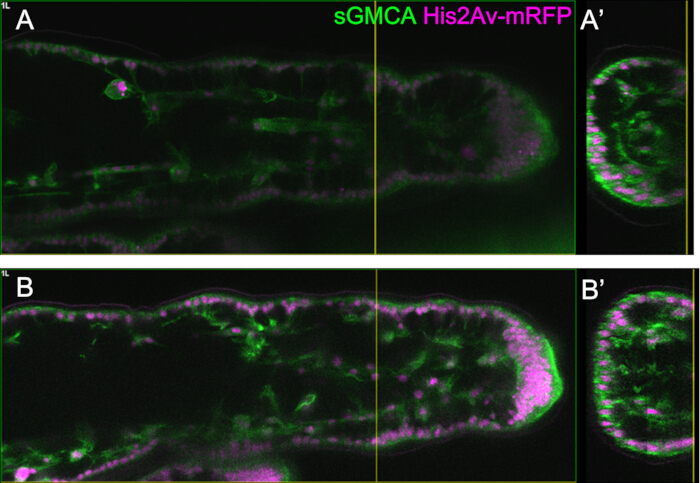
Şekil 3: 16-27.5 h APF'de tarsal epitel hücrelerinde dinamik şekil değişiklikleri. (A) Ventral taraftan görülen pupa'nın bir örneği. Kesikli dikdörtgen, (BE) içinde gözlemlenen bölgeye karşılık gelir. L1: birinci bacak, L2: ikinci bacak, L3: üçüncü bacak. (B,C,D,E) sGMCA (yeşil) ve His2Av-mRFP'de (macenta) sineği ifade eden tarsusun distal kısmının canlı görüntülemesinden kareler. Doku hızla daralır ve eklem bölgelerinin girintisi ilerler. (B',C',D',E') Sırasıyla (B,C,D,E) içindeki kesikli çizgilerle çevrili bölgelerin büyütülmesi. (C') içindeki ok ve ok ucu, sırasıyla apikobazal çıkıntıların bir örneğini ve bazal bağlantıların konumunu gösterir. Partenon benzeri yapı (B')'de oluşmaya başlar, (C')'de tamamen oluşur, (D')'de kaybolmaya başlar ve (E')'de görülmesi zorlaşır. Distal tüm şekillerde sağda ve dorsal tepeye doğrudur. Aşamalar sağ alt köşelerde (B,C,D,E) şeklinde gösterilir. Ölçek çubukları: B,C,D,E: 50 μm; B',C',D',E': 10 μm. Bu rakam Hiraiwa ve ark.15'ten değiştirilmiştir. Ayrıca bakınız Film 1. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
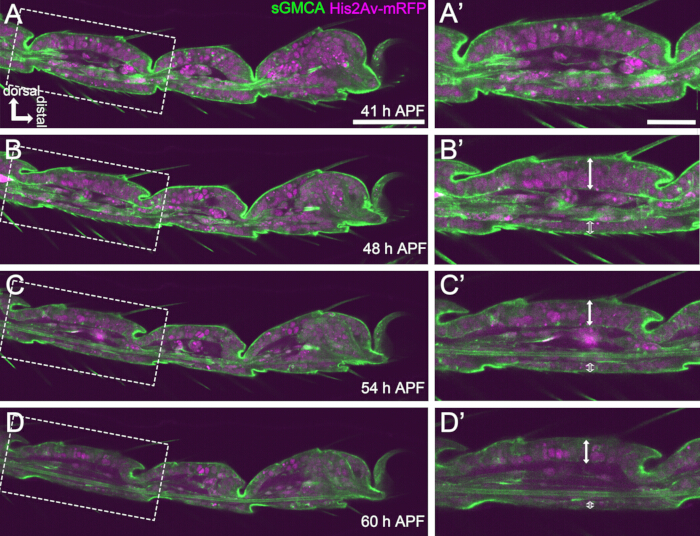
Şekil 4: 41-60 saat APF'de tarsal epitel hücre tabakasındaki şekil değişiklikleri. (A,B,C,D) Şekil 3 ile aynı sıralı canlı görüntüleme veri setinden hareketsiz görüntüler. (A,B,C,D) içindeki kesikli dikdörtgenler sırasıyla (A',B',C',D') içinde büyütülür. Yaklaşık 48 saat APF (AB') ile, kılların, pençelerin ve pulvillusların uzaması gibi dış şekil oluşumu neredeyse tamamlanır. İnvaze eklemin alt kısmı proksimal olarak hareket etti ve daha sonra, top ve soket yapı oluşumu yaklaşık 54 saat APF'den sonra ilerledi. Dorsal ve ventral epitel arasındaki morfolojik fark belirginleşti (B',C',D'de çift oklar ve açık çift oklar). 54 saat APF'den (C-D') sonra, epitel tabakası, segmentlerin ana hatlarını neredeyse hiç değiştirmeden kalınlığını azalttı. Tüm şekillerde sırt üstte ve sağda distaldir. Ölçek çubukları: A,B,C,D: 50 μm; A',B',C',D': 20 μm.Bu rakam Hiraiwa ve ark.15'ten alınmıştır. Ayrıca bakınız Film 1. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Şekil 5: Bright Z fonksiyonu kullanılarak yapılan bacak gözlemine bir örnek.(A,B) Parlak Z işlevi kullanılarak (B) ile veya (A) olmadan sineği ifade eden sGMCA (yeşil) ve His2Av-mRFP'nin (macenta) üçüncü bacağının ilgili bölgesinin, derinliğinin ve aşamasının görüntüleri. (A) Bright Z fonksiyonu kullanılmadan elde edilen 16 h APF'de üçüncü bacaktaki tarsal bölgenin gözleminden çıkarılan 59.1 μm derinlikte bir XY düzlemi. (Bir') Kesit görünümü, (A)'daki sarı dikey çizgiye karşılık gelir. (A') içindeki dikey çizgi, (A)'nın odak düzlemini gösterir. (B) Bright Z fonksiyonu kullanılarak elde edilen 16 saatlik APF'de üçüncü bacaktaki tarsal bölgenin gözleminden çıkarılan 61.6 μm derinliğinde bir XY düzlemi. Hem PMT voltajı hem de lazer gücü ayarlandı. Görüntünün görünürlüğü (A) ile karşılaştırıldığında iyileştirilmiştir. (B') Kesit görünümü, (B) içindeki sarı dikey çizgiye karşılık gelir. (B') içindeki sarı dikey çizgi, (B)'nin odak düzlemini gösterir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Ek Dosya 1: 15-30 saat APF'den bacak tarsal bölgesinin canlı görüntülenmesi için konfokal mikroskop ayarına bir örnek. Bu dosyayı indirmek için lütfen buraya tıklayın.
Film 1: Tarsusun distal kısmının 44 saat boyunca uzun süreli canlı görüntülenmesi. sGMCA (yeşil) ve His2Av-mRFP (macenta) ifade eden sinek kullanıldı. En temsili XY düzlemi, Şekil 3 ve Şekil 4 ile aynı veri kümesinden çıkarıldı. Ok uçları gelecekteki ortak bölgelerin örneklerini gösterir. Dokuda hızlı hareket eden hücreler makrofaj benzeri hücrelerdir. Tarsal segmentler boyunca uzanan sicim benzeri sinyal, septumun bir parçasıdır. Zaman damgası ss: mm'yi gösterir. Distal sağda ve dorsal tepede. Bu film Hiraiwa ve ark.15'ten uyarlanmıştır Bu dosyayı indirmek için lütfen buraya tıklayın.
Tartışmalar
Bu makalede, pupa evresindeki Drosophila bacağının uzun süreli canlı görüntülenmesi için ayrıntılı bir protokol verilmiştir. Bacak hayali diski, boru şeklinde bir yapı oluşturmak için merkezi kısımdan çıkıntı yapar ve daha sonra yetişkin bacağının son şekil oluşumu, pupa aşamasında, anlaşılması zor bir şekilde gerçekleşir. Bu süreci gözlemlemek için önceki girişimler esas olarak sabit boyama, doku kültürü ve taramalı elektron mikroskobu 12,13,14 ile yapıldı. Bu yöntemler, tek tek hücrelerdeki sürekli değişiklikleri izleyemedi ve sadece parçalı bilgiler elde edildi. Bu çalışmada anlatılan yöntemle, tarsal bölgenin son şekil oluşum süreci, konfokal mikroskop ile günlerce süren ardışık canlı görüntüleme olarak başarılı bir şekilde gözlemlenebilir ve tek tek hücrelerdeki değişiklikler sürekli olarak izlenebilir. Bu canlı görüntüleme ile ortaya çıkan ilgi çekici hücre dinamikleri, son raporda ayrıntılı olarak açıklanmıştır15.
Başarılı uzun süreli canlı görüntüleme için, pupa'nın canlılığını korumak ve gelişiminin etkilenmeden kalmasını sağlamak çok önemlidir. Burada tarif edilen yöntemde, puparium ile çıkarılan pupa, birçok durumda pharate yetişkinine ve yetişkine dönüşmüştür (Şekil 2O,P). Bu yöntemle gözlenen gelişmekte olan tarsusun morfolojik değişikliklerinin zamanlamaları önceki raporlarla tutarlıydı 12,13,14. Ayrıca, epitel hücreleri 48-60 saat APF'de bile (montajdan 32-44 saat sonra) kalınlık azalması gibi değişiklikler gösterdi (Şekil 4B'-D'). Bu gerçekler, pupa'nın bozulmadan kaldığını ve burada açıklanan yöntemi kullanarak uzun süreli canlı görüntüleme sırasında normal gelişiminde neredeyse hiç bozulma veya gecikme yaşamadığını göstermektedir. Canlı görüntülemeye tabi tutulan pupariumla çıkarılan pupanın canlılığının, puparium çıkarmanın zamanlamasına, prosedürdeki kullanıma, görüntülemedeki fototoksisite derecesine ve kullanılan sinek suşlarına bağlı olarak değişebileceğini lütfen unutmayın.
Pupa'nın sağlamlığını ve gelişimini garanti altına almak için kritik adımlardan biri, pupaya zarar vermeden puparium'u çıkarmaktır. Pupa'nın çift taraflı banda stabil bir şekilde yapışması ve forsepslerin dikkatli bir şekilde kullanılması başarının anahtarıdır. Pupa'nın dehidrasyonunu önlemek de çok önemlidir. Bu bağlamda, lamel ile silikon gresi arasında herhangi bir boşluktan kaçınmak çok önemlidir.
Pupanın kurumasını önlemek için, önceki birçok yöntem puparium 1,2,3,4,5,6,7'nin kısmen uzaklaştırılmasını içeriyordu. Bununla birlikte, tüm pupayı gözlemlemek için, puparyumun tamamen çıkarılması tercih edilir. Pupa'nın maksimum sağkalım süresi bilinmemekle birlikte, pupariumun tamamen çıkarıldığı çeşitli yöntemler bildirilmiştir 8,9,10. Bu yöntemlerde pupa için nem sağlamak için en yaygın yaklaşım nemli filtre kağıdı kullanılmasıdır. Önceki yöntemlerle karşılaştırıldığında, burada anlatılan yöntem bir damla suyu daha basit ve kolay bir şekilde koyarak nem sağlar. Ek olarak, önceki birçok yöntem, pupa'nın bir cam slayt üzerine monte edilmesini içerir. Puparyum ile çıkarılan pupayı bir cam kaydırak üzerine monte ederken, lamel pupaya bastırmanın pupaya baskı yapması veya eğik bir lamel görüntülerde gürültü, bozulma ve netlik eksikliğine neden olduğu bir sorun olabilir. Burada tarif edilen yöntem, lameli pupaya bastırma ihtiyacını ortadan kaldıran ve dokuların doğal durumlarına mümkün olduğunca yakın gözlemlenmesine olanak tanıyan cam tabanlı bir tabak kullanır. Kapak camının açısını ayarlamaya gerek olmadığından, kurulum sabit, kullanımı kolay ve daha güvenilirdir. Bu nedenle, bu yöntem neredeyse hiç özel beceri gerektirmez ve yeni başlayanların bile canlı görüntülemeyi başarılı bir şekilde gerçekleştirmesine olanak tanır.
Bu yöntemin en büyük sınırlamaları, gözlemlerin derinliği ve zaman çözünürlükleridir. Tarsus'u gözlemleme koşulları altında, sadece yaklaşık 40 μm derinliğe kadar net görüntüler elde edilebilir. Bright Z işlevinin kullanılması bu sorunun çözülmesine yardımcı olur. Örneğin, Şekil 5'te gösterildiği gibi, Bright Z işlevini kullanarak derinlik arttıkça lazer gücünü ve PMT voltajını artırmak, daha derin konumlarda görüntülerin kalitesini iyileştirdi. Bununla birlikte, lazer gücünün arttırılması, fototoksisite ve sinyal solmasını içeren bir değiş tokuşla birlikte gelir. Bu nedenle, gözlemin amacına uygun en uygun koşulları bulmak gerekir. Zaman çözünürlüğü, hızla hareket eden hücreleri ve dokuları gözlemlerken de önemlidir. Dilimlerin azaltılması ve yatırım getirisinin daraltılması bu sorun için önde gelen çözümlerdir. Gelişmiş dedektör hassasiyetine sahip güncel ekipman veya dönen disk konfokal mikroskop kullanmak zaman çözünürlüğünü iyileştirebilir. Diğer bir sınırlama pupa aşaması ile ilgilidir. Puparium ancak pupa kütikülü 12-13.5 saat APF19'datamamen oluştuktan sonra çıkarılabilir ve ancak 14 saat APF'den sonra kolayca çıkarılabilir. 12 saatlik APF'den daha erken aşamalar, puparium15'i çıkarmadan pupa'nın monte edilmesiyle kısmen gözlemlenebilir, ancak bu durumda puparium tarafından hızlı doku hareketleri ve optik engeller nedeniyle net görüntüler elde etmek zordur.
Sorun giderme
Puparium çıkarmada zorluk
Puparium çıkarılırken, puparium ventral tarafının çift taraflı banda yapışması önemlidir. Tutkal ve yiyecekler puparium yüzeyinden uzaklaştırılmalıdır ve ıslak yüzeyler iyi yapışmayı önlediği için daha sonra kurutma önemlidir. Özellikle, malzeme tablasındaki çift taraflı bant, iç tarafta daha güçlü bir yapışma özelliğine sahiptir. Pupayı yapıştırmak için iç (daha güçlü) taraf kullanılmalıdır. Puparyumun çıkarılmasının zor olduğu durumlarda pupariumun forseps ile yırtmak yerine diseksiyon makası ile kesilmesi yardımcı olur.
Pupadan sıvı sızıntısı
Pupaya zarar vermeden puparyumun çıkarılması çok önemlidir. Pupa vücut sıvısının sızması, pupanın hasar gördüğünü gösterir (Şekil 2K). Bu tür pupalardan canlı görüntülemeden kaçınılmalıdır. Puparium çıkarılırken pupa hasarını önlemek için, dikkatli kullanıma ek olarak, nispeten geniş uçlu forseps kullanılması önerilir.
Düşük görüntü kalitesi
Floresan sinyali çok zayıf olduğunda, PMT voltajını artırmak, iğne deliğini (CA) açmak, tarama hızını yavaşlatmak ve lazer gücünü artırmak gibi parlaklığı ayarlamanın birçok yolu vardır. Lütfen her yöntemin yan etkileri olduğunu unutmayın: PMT voltajının arttırılması gürültüyü artırabilir, iğne deliğinin açılması Z ekseni çözünürlüğünü azaltabilir, tarama hızını yavaşlatmak tarama süresini uzatır ve lazer gücünün arttırılması fototoksisite ve ağartma riskini artırır. İlgilenilen bölgeye, floresan raportörlerin türlerine ve ifade düzeylerine ve canlı görüntülemenin istenen uzunluğuna bağlı olarak uygun ayarlar bulunmalıdır. Genel olarak, uzun süreli canlı görüntüleme için lazer gücünün en aza indirilmesi önerilir.
Floresansın solması
Uzun süreli canlı görüntülemede floresansın solması kaçınılmazdır. Bu sorunu önlemek için minimum lazer gücü kullanılması tavsiye edilir. Solmayı telafi etmek için, elde edilen canlı görüntüleme verileri işlenirken ImageJ eklentisi "AutoEnhance"16 önerilir.
Pupariumun tamamen çıkarılması sayesinde, bu yöntem sadece pupanın yatırım getirisini ve yönünü değiştirerek diğer dokulara oldukça uygulanabilir. Nitekim bunlar canlı görüntüleme olmasalar da Hiraiwa ve ark.15 çalışmasında bacağın proksimal kısmı, hortum, antene yakın baş epiteli ve dorsal toraks epiteli bu yöntemle gözlenmiştir15. Geniş bir doku yelpazesine bu tür bir uygulanabilirlik, genlerin optik indüksiyonu gibi diğer tekniklerle daha fazla entegrasyonu kolaylaştırabilir. Bu yöntem, Drosophila dışındaki cyclorrhaphan (puparium oluşturan) türlere de uygulanabilir. Ayrıca, şeffaf bir pupa kütikülüne sahip olmaları durumunda diğer böcek türleri için potansiyel olarak kullanılabilir. Bu makale, Drosophila araştırmacılarının canlı dokulardaki hücre dinamiklerini yakalamak için pupa'nın canlı görüntülemesini gerçekleştirmeleri için ayrıntılı talimatlar sağlar.
Açıklamalar
Yazarlar hiçbir rekabet çıkarı beyan etmezler.
Teşekkürler
Teknik tavsiyeleri için Dr. Masayuki Miura'ya (Tokyo Üniversitesi) ve Dr. Yuya Fujisawa'ya (Tokyo Üniversitesi) minnettarız ve sinek kaynakları için Bloomington Stok Merkezi'ne teşekkür ediyoruz.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 35 mm/glass base dish | IWAKI | 3911-035 | |
| Cleaning wipes | NIPPON PAPER CRECIA | S-200 | |
| Dumont #3c Forceps | Fine Science Tools | 11231-20 | |
| Dumont #5SF | Fine Science Tools | 11252-00 | |
| Eppendorf Research plus 2-20 µL | Eppendorf | 3123000098 | |
| Fly strain: His2Av-mRFP, sGMCA | Bloomington Drosophila Stock Center | 59023 | |
| FV3000 | EVIDENT | inverted confocal microscope | |
| FV31S-SW | EVIDENT | software for FV3000 | |
| G40L | Shin-Etsu Silicone | silicone grease | |
| Micro Cover Glass 18 x 18 mm 0.13-0.17 mm | MATSUNAMI | C018181 | |
| Micro Slide Glass 76 x 26 mm 0.9-1.2 mm | MATSUNAMI | S7213 | |
| NEO-SABLE Size 0 round, fine | Pentel | XZBNR-0 | paintbrush |
| SIL300CS-30CC | EVIDENT | silicone oil | |
| Stereomicroscope System SZX7 | EVIDENT | ||
| Terumo syringe 50 mL | Terumo | SS-50ESZ | |
| Transparent double sided tape | Scotch | 665-1-12 | Since the inner layer has stronger adhesion than the outer layer, the inner layer should be used to fix pupae. |
| UPLSAPO10x | EVIDENT | ||
| UPLSAPO40XS | EVIDENT | silicone immersion lens | |
| Vannas Spring Scissors - 2.5mm Cutting Edge | Fine Science Tools | 15000-08 | optional |
Referanslar
- Koto, A., Kuranaga, E., Miura, M. Temporal regulation of Drosophila IAP1 determines caspase functions in sensory organ development. J Cell Biol. 187 (2), 219-231 (2009).
- Ninov, N., Martín-Blanco, E. Live imaging of epidermal morphogenesis during the development of the adult abdominal epidermis of Drosophila. Nat Protoc. 2 (12), 3074-3080 (2007).
- Chiba, M., et al. Activatable photosensitizer for targeted ablation of lacZ-positive cells with single-cell resolution. ACS Cent Sci. 5 (11), 1676-1681 (2019).
- Umetsu, D., et al. Local increases in mechanical tension shape compartment boundaries by biasing cell intercalations. Curr Biol. 24 (16), 1798-1805 (2014).
- Tran, N. V., et al. Programmed disassembly of a microtubule-based membrane protrusion network coordinates 3D epithelial morphogenesis in Drosophila. EMBO J. 43 (6), 568-594 (2024).
- Hellerman, M. B., Choe, R. H., Johnson, R. I. Live-imaging of the Drosophila pupal eye. J Vis Exp. (95), e52120 (2015).
- O'Connor, J. T., Shannon, E. K., Hutson, M. S., Page-McCaw, A. Mounting Drosophila pupae for laser ablation and live imaging of the dorsal thorax. STAR Protoc. 3 (2), 101396 (2022).
- Ziserman, D., Roegiers, F. Live-cell imaging of sensory organ precursor cells in intact Drosophila pupae. J Vis Exp. (51), e2706 (2011).
- Tögel, M., Pass, G., Paululat, A. In vivo imaging of Drosophila wing heart development during pupal stages. Int J Dev Biol. 57 (1-2), 13-24 (2013).
- Weavers, H., Franz, A., Wood, W., Martin, P. Long-term in vivo tracking of inflammatory cell dynamics within Drosophila pupae. J Vis Exp. (136), e57871 (2018).
- Kojima, T. Developmental mechanism of the tarsus in insect legs. Curr Opin Insect Sci. 19, 36-42 (2017).
- Mirth, C., Akam, M. Joint development in the Drosophila leg: Cell movements and cell populations. Dev Biol. 246 (2), 391-406 (2002).
- Mirth, C. Ecdysteroid control of metamorphosis in the differentiating adult leg structures of Drosophila melanogaster. Dev Biol. 278 (1), 163-174 (2005).
- Tajiri, R., Misaki, K., Yonemura, S., Hayashi, S. Dynamic shape changes of ECM-producing cells drive morphogenesis of ball-and-socket joints in the fly leg. Development. 137 (12), 2055-2063 (2010).
- Hiraiwa, S., et al. Unveiling the cell dynamics during the final shape formation of the tarsus in Drosophila adult leg by live imaging. Dev Genes Evol. , (2024).
- . ImageJ plugin page Available from: https://signaling.riken.jp/en/en-tools/imagej/629/ (2024)
- Pandey, R., Heidmann, S., Lehner, C. F. Epithelial re-organization and dynamics of progression through mitosis in Drosophila separase complex mutants. J Cell Sci. 118 (4), 733-742 (2005).
- Kiehart, D. P., Galbraith, C. G., Edwards, K. A., Rickoll, W. L., Montague, R. A. Multiple forces contribute to cell sheet morphogenesis for dorsal closure in Drosophila. J Cell Biol. 149 (2), 471-490 (2000).
- Ashburner, M. . Drosophila: A Laboratory Handbook. , (1989).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır