Method Article
Долгосрочная визуализация развития ноги куколки дрозофилы после удаления пупария в реальном времени
В этой статье
Резюме
Здесь представлен протокол для долгосрочной визуализации ноги дрозофилы в реальном времени на стадии куколки, включая полное удаление пупария. Этот протокол также может быть применен к другим тканям.
Аннотация
За последние десятилетия был достигнут значительный прогресс в понимании механизмов определения судьбы клеток. Тем не менее, процесс, с помощью которого определенные судьбой клетки формируют трехмерные формы организма, остается неясным. Последние достижения в области конфокальной микроскопии облегчили усилия по наблюдению за динамикой клеток во время развития с помощью визуализации в реальном времени. Куколка Drosophila melanogaster идеально подходит для визуализации в реальном времени благодаря своей неподвижности, прозрачной кутикуле куколки и наличию флуоресцентных репортерных линий. Основной проблемой для визуализации является пупарий, кутикула, окружающая куколку, которая препятствует оптическому изображению. В то время как предыдущие методы включали частичное или полное удаление куколки, поддержание жизнеспособности куколки в течение длительных периодов времени после этой процедуры оставалось сложной задачей. Здесь представлен простой метод визуализации ноги дрозофилы в течение нескольких дней на стадии куколки, включающий полное удаление пупария. Метод включает в себя извлечение пупария из куколки, приклеенной двусторонним скотчем, с последующей сборкой небольшой камеры на стеклянной посуде для помещения куколки и капли воды. Эта установка проста, надежна и способствует увеличению выживаемости куколки за счет предотвращения высыхания. Долгосрочная визуализация куколки дрозофилы в реальном времени внесла значительный вклад в то, чтобы понять, как нога взрослой особи претерпевает драматические трехмерные структурные изменения в течение 2-3 дней. Эти изменения включают в себя временное образование эпителиальными клетками интригующей структуры (парфеноподобной структуры), быстрое сужение тканей, образование суставов и удлинение щетины. Этот метод применим для наблюдения за различными тканями и потенциально может быть объединен с другими методами, такими как оптическая индукция генов, для улучшения понимания клеточной динамики во время формирования окончательной формы тканей на стадии куколки.
Введение
Несмотря на значительный прогресс, достигнутый за последние несколько десятилетий в выяснении механизма определения судьбы клеток, то, как клетки, определяемые судьбой, формируют трехмерные формы организма, до сих пор остается неясным. Благодаря технологическим усовершенствованиям в конфокальной микроскопии, в последние годы участились попытки раскрыть динамику клеток во время развития с помощью визуализации в реальном времени. Куколка Drosophila melanogaster была предпочтительна для визуализации в реальном времени из-за ее подходящих особенностей: неподвижности, прозрачности кутикулы куколки и наличия флуоресцентных репортерных линий 3,4,5. Самым большим препятствием для выполнения визуализации куколки дрозофилы в реальном времени является пупарий (куколка), деформированная и загорелая кутикула последнего возраста личинки, окружающая куколку. Чтобы избежать оптической обструкции, пупарий частично или полностью удаляли ранее описанными методами 1,2,3,4,5,6,7,8,9,10. Полное удаление пупария максимально увеличивает площадь обзора и применимость к различным тканям. Тем не менее, куколка без пупария обычно умирает в течение примерно половины дня, предположительно из-за высыхания. Таким образом, поддержание влажности куколки имеет решающее значение для расширенной визуализации в реальном времени. В то время как точная продолжительность выживания куколки после полного удаления пупария в предыдущих методах неясна, зарегистрированные примеры обычно длились примерно до 20 часов. Поскольку стадия куколки длится около четырех дней, ожидалось, что метод еще более длительной визуализации в реальном времени будет способствовать захвату всего процесса формирования формы ткани.
Нога взрослой особи дрозофилы является отличной моделью для изучения процесса формирования трехмерной формы ткани. Он происходит от дискообразных зачатков (ножных дисков), образующихся на личиночных стадиях. Области, соответствующие каждому сегменту в ноге взрослого человека, определяются постадии 11 предкуколки. Затем диск ноги выступает из центральной части, образуя раздутую трубчатую структуру примерно через 11 часов после образования пупария (APF). Каким образом эта ткань при своей простой форме достигает своей окончательной формы взрослой ноги на последующих стадиях, долгое время оставалось неясным. Опубликовано несколько исследований, посвященных этому вопросу: 12,13,14. Поскольку они наблюдали за неподвижными или культивируемыми тканями, непрерывные изменения в отдельных клетках не могли быть прослежены, а полученная информация была несколько фрагментирована. Чтобы полностью понять процесс формирования, важно постоянно наблюдать за изменениями в отдельных клетках с помощью долгосрочной визуализации в реальном времени.
Недавнее исследование показало динамическую деформацию трехмерных структур на тканевом и клеточном уровнях с помощью долгосрочной визуализации в реальном времени (рис. 1). Самым интригующим открытием в этом исследовании является временное образование эпителиальными клетками неожиданно сложной структуры. Эта структура, получившая название «парфеноподобная структура», характеризуется апикобазальными выступами и базальными сетчатыми соединениями эпителиальных клеток. Важно отметить, что образование и исчезновение этой структуры совпадает с быстрым сужениемтканей15. Последующее формирование формы, включая формирование суставов и удлинение щетины, продолжалось в течение 2-3 дней. Долгосрочная визуализация в реальном времени эффективно зафиксировала всю историю этих последовательных событий, длившихся несколько дней.
В данной статье представлен пошаговый метод выполнения многодневной визуализации ноги дрозофилы в течение суток на стадии куколки с полным удалением пупария. Метод прост в использовании и может быть применен к различным другим тканям.
протокол
В этом протоколе используются штаммы Drosophila melanogaster, экспрессирующие флуоресцентные репортеры15. Подробная информация о реактивах и оборудовании, использованных в исследовании, приведена в Таблице материалов.
1. Подготовка куколки
- С помощью кисти соберите из флаконов белые куколки нужного штамма Drosophila melanogaster и положите их в посуду или пустые флаконы (рисунок 2А).
ПРИМЕЧАНИЕ: В данном исследовании термин «белые куколки» относится к стадии между моментом, когда личинка становится полностью неподвижной, и до того, как пупарий становится коричневым. Этот этап длится около 30 минут при температуре 25 °C. - Инкубируйте белых куколок в течение не менее 14 ч при 25 °C до тех пор, пока они не перейдут в стадию, подлежащую наблюдению (рис. 2B).
ПРИМЕЧАНИЕ: Куколка может быть удалена только после того, как кукуколка полностью сформирована через 12-13,5 ч APF и легко удаляется только через 14 ч APF. - Сотрите клей и летящую пищу с пупария кистью, смоченной в дистиллированной воде.
ПРИМЕЧАНИЕ: Брюшная сторона пупария должна быть особенно чистой, чтобы обеспечить достаточную адгезию к двусторонней ленте на последующих этапах. - Поместите куколок на чистящие салфетки на несколько минут, чтобы они высохли.
ПРИМЕЧАНИЕ: Оставшаяся влага на пупарии помешает хорошему сцеплению с двусторонней лентой. - Закрепите кусок двустороннего скотча на предметном стекле.
- Поместите высушенные куколки на двусторонний скотч брюшной стороной вниз (рисунок 2В).
- Аккуратно надавите на тыльную сторону куколок сухой кистью, чтобы добиться лучшего сцепления с двусторонним скотчом.
- Под стереомикроскопом осторожно вскройте оперкулум с помощью щипцов (рисунок 2 D,E).
ПРИМЕЧАНИЕ: Оперкулум - это переднеродсальная область пупария, из которой взрослая муха выходит, таким образом, легко открываясь. - С края вскрытого оперкулума введите один из кончиков щипцов в пространство между куколкой и пупарием (рисунок 2F).
ПРИМЕЧАНИЕ: Будьте осторожны, чтобы не повредить кутикулу куколки кончиком щипцов. - Обхватите пупарий щипцами и потяните его наружу до тех пор, пока он не раскроется.
- Приподнимите оторванные отломки пупария с помощью щипцов и приклейте их к двустороннему скотчу (рисунок 2G).
- Повторяйте шаги 1.10-1.11 до тех пор, пока отверстие пупария не достигнет заднего конца, оставляя небольшую часть пупария (рисунок 2 H,I).
ПРИМЕЧАНИЕ: Если бы жидкость вышла из куколки, она была бы повреждена (Рисунок 2K). Чтобы наблюдать за нормальным развитием, избегайте визуализации поврежденных куколок.
2. Настройка образа
- Налейте 1 мкл дистиллированной воды или силиконового масла (при использовании силиконовой иммерсионной линзы) на дно посуды со стеклянным дном.
- Смочите кисть в дистиллированной воде и аккуратно зачерпните куколку (Рисунок 2J).
- Поместите куколку брюшной стороной вниз на дистиллированную воду или силиконовое масло (рис. 2L).
- С помощью микропипетки налейте 10 μL дистиллированной воды на край стеклянной части чашки со стеклянным дном (рис. 2L).
- Поместите круг силиконовой смазки с помощью шприца по краю стеклянной части тарелки со стеклянным дном (рисунок 2M).
- Наденьте защитный колпачок на силиконовую смазку, чтобы запечатать ее (Рисунок 2M). Сборка проиллюстрирована на рисунке 2N.
ПРИМЕЧАНИЕ: Убедитесь, что между покровным стеклом и силиконовой смазкой нет зазоров.
3. Конфокальная визуализация
- Включите инвертированный конфокальный лазерный микроскоп и программное обеспечение для визуализации.
- Поставьте чашку на сценический приемщик инвертированного конфокального микроскопа.
- Найдите куколок с объективом малого увеличения в светлом поле наблюдения. Следите за тем, чтобы у куколок не было подтекания жидкости из организма.
- Центрируйте желаемую область куколки для наблюдения в области интереса (ROI).
ПРИМЕЧАНИЕ: Переднебоковые стороны лапки на первой и второй ногах, а также вентральная сторона лапки на третьей ноге ориентированы на вентральную сторону куколки. Таким образом, продольный разрез предплюсны вдоль дорсовентральной оси можно наблюдать на первой и второй ногах, тогда как вдоль переднезадней оси можно наблюдать на третьей ноге. - Замените линзу объектива на линзу для съемки в реальном времени.
ПРИМЕЧАНИЕ: Если используется погружная линза, вода между линзой и чашкой со стеклянным дном высохнет во время длительного наблюдения. Рекомендуется использовать иммерсионную линзу без погружения или иммерсионную линзу на силиконовом масле. - Настройте условия для желаемого наблюдения и начните сбор данных.
ПРИМЕЧАНИЕ: Чтобы предотвратить причинение вреда куколке, мощность лазера должна быть минимальной, насколько можно получить четкое изображение. Минимизация окупаемости инвестиций и увеличение размера шага помогают сэкономить время на получение Z-стека. Будущая трансформация ткани должна учитываться при принятии решения о глубине Z-стека. В случае наблюдения за ногой в 15-25 ч APF, так как ножка сильно сужается, ближайшая к покровному листу часть (латеральный эпителий) быстро перемещается вглубь. Учитывая это движение, сверхглубокие стеки Z должны быть установлены с самого начала. Пример настройки конфокального микроскопа для визуализации области предплюсны ноги в реальном времени в период от 15 до 30 ч APF приведен в дополнительном файле 1. Затухание флуоресценции неизбежно при длительной визуализации в реальном времени. Чтобы смягчить эту проблему, рекомендуется использовать минимальную мощность лазера. Плагин ImageJ "AutoEnhance"16 рекомендуется для обработки данных изображения в реальном времени с целью компенсации эффектов выцветания.
Результаты
Здесь описан пример 44-часовой визуализации в реальном времени развивающейся ноги взрослой особи дрозофилы в стадии куколки. Мух, экспрессирующих His2Av-mRFP17 (мечение ядер) и sGMCA18 (меченый GFP актин-связывающий белок Moesin, мечение актина) собирали на стадии белой куколки и инкубировали в течение 15 ч при 25 °С. Пупарий был снят и смонтирован в соответствии с протоколом (рис. 2). Изображения предплюсны и предплюсны, расположенных вблизи кончика ноги, были успешно получены каждые 15 мин от 16 ч до 60 ч APF при комнатной температуре (не строгой, но около 25 °C). Первая половина серии изображений показана на рисунке 3, вторая половина — на рисунке 4, а весь фильм — на рисунке 1. По мере того, как ткань ног быстро сужалась, эпителиальные клетки временно образовывали интригующую структуру, парфеноподобную структуру, характеризующуюся своими апикобазальными выступами и базальными связями (рис. 3). Уменьшение толщины эпителия наблюдалось даже после того, как контур был практически завершен (рис. 4). Весь процесс показан на рисунке 1.
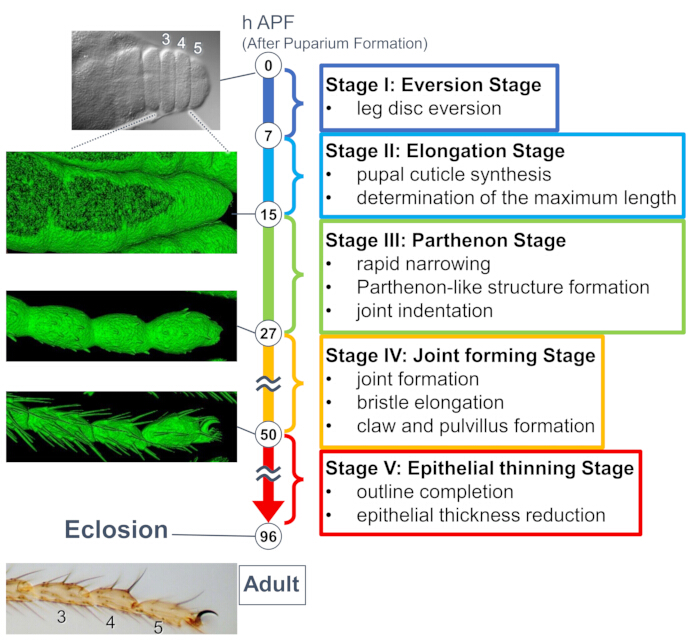
Рисунок 1: Обзор формирования окончательной формы взрослой лапки дрозофилы на стадии куколки. Весь процесс был разделен на пять этапов на основе морфологических изменений как на тканевом, так и на клеточном уровнях, наблюдаемых в долгосрочных экспериментах по визуализации в реальном времени. С левой стороны отображаются репрезентативные фотографии или изображения, отрисованные на поверхности (сигнал sGMCA), соответствующие нескольким временным точкам. Краткие описания событий на каждом этапе написаны с правой стороны. Эта цифра была изменена по сравнению с Hiraiwa et al.15. Смотрите также Фильм 1. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
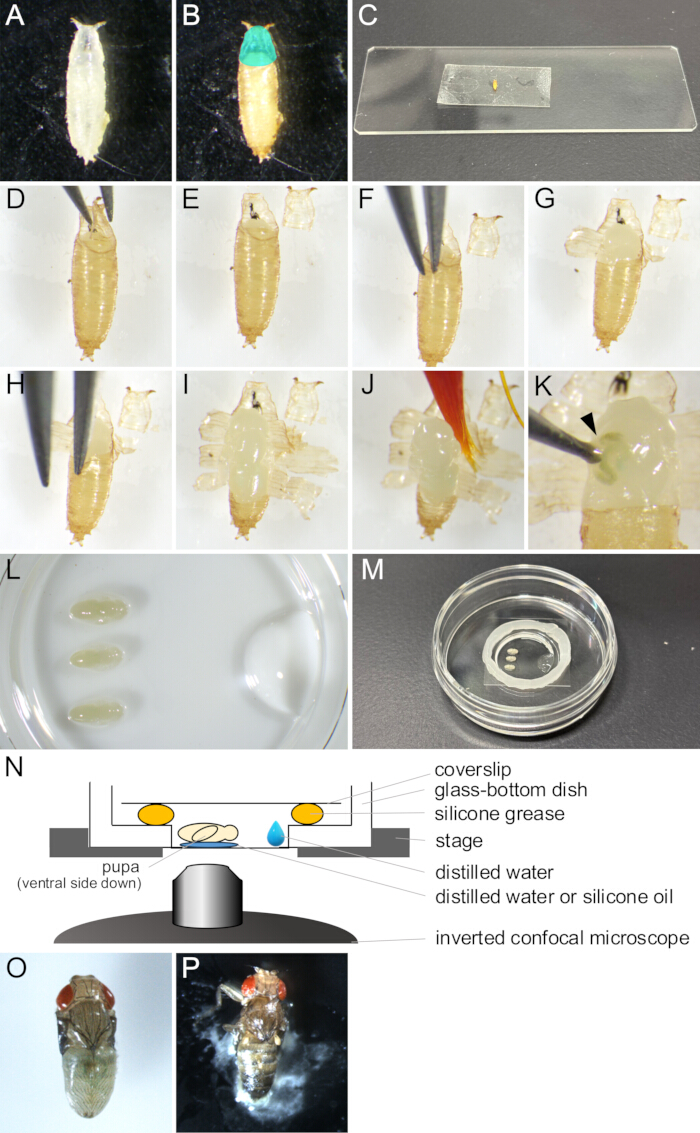
Рисунок 2: Удаление пупария и монтаж для визуализации в реальном времени. (A) Белая куколка, собранная в чашке. (В) Куколка показала себя в (А) после инкубации в течение 15 ч при 25°С. Область, окрашенная голубым цветом, указывает на оперкулум. (C) Фотография с изображением куколки, приклеенная к куску двустороннего скотча. (Д-Дж) Серия изображений, показывающих процедуру удаления пупария. (D) Оперкулум приподнимается с помощью щипцов. (E) Оперкулум удаляется. (F) Кончик щипца вводится между кутикулой куколки и пупарием. (G) Пупарий частично открыт. (H) Снова вставляется наконечник щипца. (I) Пупарий открылся, оставив лишь небольшую часть заднего конца. (J) Куколка поднимается кистью. (K) Пример утечки жидкости из организма из куколки. Жидкость, выходящая из раны, проколотой наконечником щипца, обозначается наконечником стрелки. (Л-Н) Изображения и иллюстрации, показывающие сборку крепления. (L) Изображение с обратной стороны, показывающее помещенных куколок и дистиллированную воду на дно чашки со стеклянным дном. (M) Тарелка после завершения монтажной сборки. Силиконовая смазка была нанесена по краю вокруг стеклянной части, а на смазку был наложен покровный стекло для ее герметизации. (N) Схематический чертеж монтажного узла куколки дрозофилы для долгосрочной визуализации в реальном времени. (O) Оседлая куколка развилась почти во взрослой особи. (P) Остекление куколки. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
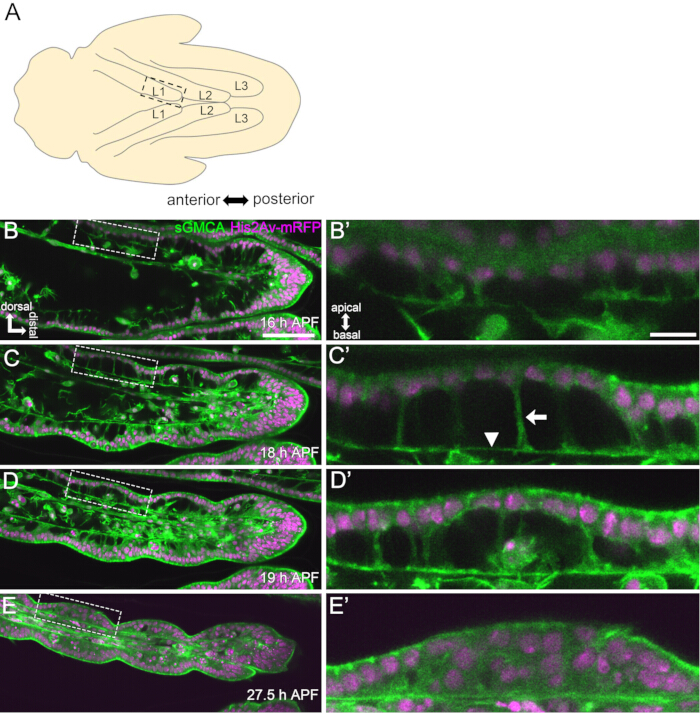
Рисунок 3: Динамические изменения формы эпителиальных клеток предплюсны за 16-27,5 ч APF. (A) Иллюстрация куколки, видимая с вентральной стороны. Пунктирный прямоугольник соответствует области, наблюдаемой в (B-E). L1: первая нога, L2: вторая нога, L3: третья нога. (B,C,D,E) Кадры из визуализации дистального отдела предплюсны в реальном времени в sGMCA (зеленый) и His2Av-mRFP (пурпурный) экспрессирующей мухе. Ткань быстро сужается, и углубление суставных областей прогрессирует. (B',C',D',E') Увеличение областей, окруженных пунктирными линиями в (B,C,D,E) соответственно. Стрелка и наконечник стрелки в (C') показывают пример апикобазальных проекций и положение базальных соединений соответственно. Парфеноновская структура начинает формироваться в (B'), полностью формируется в (C'), начинает исчезать в (D') и становится трудно различимой в (E'). Дистальный находится вправо и дорсальный к верху у всех фигур. Этапы показаны в нижних правых углах в (B,C,D,E). Масштабные линейки: B,C,D,E: 50 мкм; B',C',D',E': 10 мкм. Эта цифра была изменена по сравнению с Hiraiwa et al.15. Смотрите также Фильм 1. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
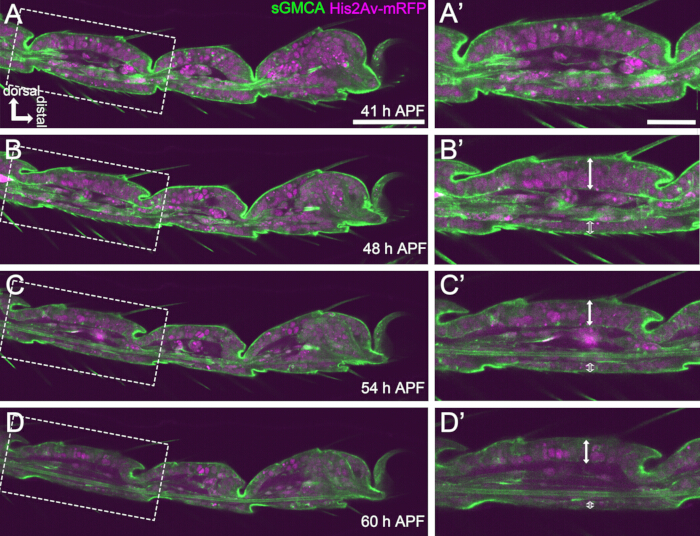
Рисунок 4: Изменения формы эпителиального слоя клеток предплюсны за 41-60 ч APF. (A,B,C,D) Неподвижные изображения из того же последовательного набора данных визуализации в реальном времени, что и на рисунке 3. Пунктирные прямоугольники в (A,B,C,D) увеличиваются в (A',B',C',D') соответственно. Примерно к 48 ч APF (A-B') формирование внешней формы, такое как удлинение щетины, когтей и пульвиллев, почти завершено. Дно инвагинированного сустава перемещалось проксимально, а затем формирование шаровой структуры прогрессировало примерно через 54 ч APF. Стало очевидным морфологическое различие между дорсальным и вентральным эпителием (двойные стрелки и открытые двойные стрелки у B',C',D'). Через 54 ч APF (C-D') эпителиальный слой уменьшил свою толщину без почти полного изменения контура сегментов. Дорсальный находится вверху и дистальнее вправо у всех фигур. Масштабные линейки: A,B,C,D: 50 мкм; A',B',C',D': 20 мкм. Эта цифра была приведена из Hiraiwa et al.15. Смотрите также Фильм 1. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
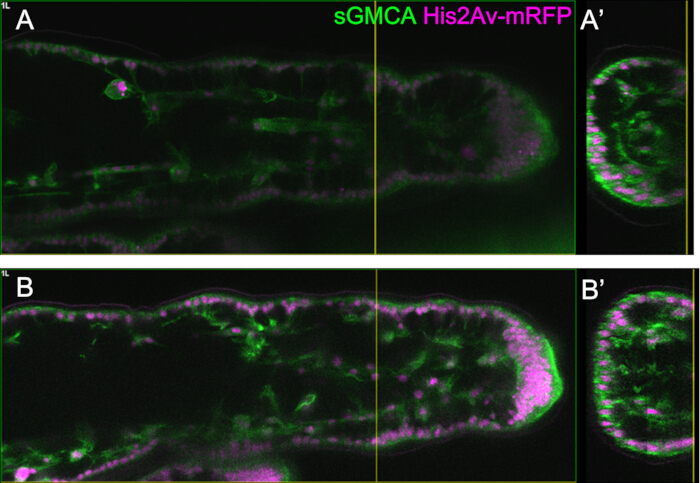
Рисунок 5: Пример наблюдения за ногами с помощью функции Bright Z. (А,Б) Изображения соответствующей области, глубины и стадии третьей ноги sGMCA (зеленый) и His2Av-mRFP (пурпурный) с выражением (B) или без (A) с использованием функции Bright Z. (A) Плоскость XY на глубине 59,1 мкм, полученная при наблюдении предплюсневой области в третьем участке при 16 ч APF, полученная без использования функции Bright Z. (А') Вид поперечного сечения соответствует желтой вертикальной линии на рисунке (A). Вертикальная линия в точке (A') указывает на фокальную плоскость точки (A). (B) Плоскость XY на глубине 61,6 мкм, полученная при наблюдении предплюсневой области в третьем участке при 16 ч APF, полученная с использованием функции Bright Z. Регулировалось как напряжение ФЭУ, так и мощность лазера. Видимость изображения улучшена по сравнению с (A). (В') Вид в разрезе соответствует желтой вертикальной линии на рисунке (B). Желтая вертикальная линия в точке (B') указывает на фокальную плоскость точки (B). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Дополнительный файл 1: Пример настройки конфокального микроскопа для визуализации области предплюсны ноги в реальном времени от 15 до 30 часов APF. Пожалуйста, нажмите здесь, чтобы скачать этот файл.
Фильм 1: Долгосрочная визуализация дистального отдела плюсны в течение 44 ч в реальном времени. Использовались экспрессирующие мухи sGMCA (зеленого цвета) и His2Av-mRFP (пурпурный). Наиболее репрезентативная плоскость XY была извлечена из того же набора данных, что и на рисунках 3 и 4. Стрелками обозначены примеры будущих совместных регионов. Быстро движущиеся клетки в ткани являются макрофагоподобными клетками. Струнообразный сигнал, проходящий вдоль сегментов предплюсны, является частью перегородки. Временная метка показывает hh: mm. Дистальный – справа, а спинной – к верху. Этот фильм был адаптирован из Hiraiwa et al.15Пожалуйста, нажмите здесь, чтобы скачать этот файл.
Обсуждение
В данной статье представлен подробный протокол для долгосрочной визуализации ноги дрозофилы в стадии куколки в режиме реального времени. Имагинальный диск ноги выступает из центральной части, образуя трубчатую структуру, а затем окончательное формирование формы взрослой ноги происходит на стадии куколки таким образом, который ранее был неуловимым. Предыдущие попытки наблюдать этот процесс были в основном с помощью фиксированного окрашивания, культуры тканей и сканирующего электронного микроскопа 12,13,14. Эти методы не могли отследить непрерывные изменения в отдельных клетках, и была получена лишь фрагментарная информация. С помощью метода, описанного в этом исследовании, процесс формирования окончательной формы области предплюсны можно успешно наблюдать в виде последовательной визуализации в реальном времени в течение нескольких дней с помощью конфокального микроскопа, а изменения в отдельных клетках можно отслеживать непрерывно. Интригующая динамика клеток, выявленная с помощью этой визуализации в реальном времени, была подробно описана в недавнем отчете15.
Для успешной долгосрочной визуализации в реальном времени крайне важно поддерживать жизнеспособность куколки и следить за тем, чтобы ее развитие не пострадало. В описанном здесь методе куколка, удаленная из пупария, во многих случаях развивалась во взрослую особь фарата и взрослую особь (рис. 2O,P). Сроки морфологических изменений развивающейся лапки, наблюдаемых с помощью этого метода, согласуются с предыдущими отчетами 12,13,14. Кроме того, эпителиальные клетки показали изменения, такие как уменьшение толщины, даже через 48-60 ч APF (32-44 ч после установки) (рис. 4B'-D'). Эти факты свидетельствуют о том, что куколка остается неповрежденной и практически не испытывает нарушений или задержек в своем нормальном развитии во время длительной визуализации в реальном времени с использованием описанного здесь метода. Обратите внимание, что жизнеспособность куколки, удаленной из пупария, подвергнутой визуализации в реальном времени, может варьироваться в зависимости от времени удаления пупария, обработки во время процедуры, степени фототоксичности при визуализации и используемых штаммов мух.
Одним из важнейших шагов для обеспечения целостности куколки и ее развития является удаление пупария без причинения вреда куколке. Стабильное сцепление куколки с двусторонним скотом и бережное обращение с щипцами – залог успеха. Предотвращение обезвоживания куколки также имеет решающее значение. В связи с этим крайне важно избегать любых зазоров между покровным стеклом и силиконовой смазкой.
Чтобы избежать высыхания куколки, многие предыдущие методы включали частичное удаление куколки 1,2,3,4,5,6,7. Однако для наблюдения за всей куколкой предпочтение отдается полному удалению пупария. Хотя максимальное время выживания куколки неизвестно, сообщалось о нескольких методах, при которых пустарий полностью удаляется. Наиболее распространенным подходом к обеспечению куколки влагой в этих методах является использование увлажненной фильтровальной бумаги. По сравнению с предыдущими методами, описанный здесь обеспечивает увлажнение путем добавления капли воды более простым и легким способом. Кроме того, многие предыдущие методы предполагают установку куколки на предметное стекло. При установке куколки, снятой из пупария, на предметное стекло может возникнуть проблема, когда прижатие покровного стекла к куколке вызывает стресс у куколки, или наклоненное покровное стекло приводит к шуму, искажениям и отсутствию четкости изображений. В описанном здесь методе используется чашка со стеклянным дном, которая устраняет необходимость прижимать покровное стекло к куколке, что позволяет наблюдать за тканями как можно ближе к их естественному состоянию. Поскольку нет необходимости регулировать угол наклона защитного стекла, настройка стабильна, проста в обращении и надежна. Поэтому этот метод практически не требует специализированных навыков, позволяя даже новичкам успешно выполнять живую визуализацию.
Основными ограничениями этого метода являются глубина наблюдений и временное разрешение. В условиях наблюдения за лапками четкие изображения могут быть получены только на глубине примерно до 40 мкм. Использование функции Bright Z помогает решить эту проблему. Например, как показано на рисунке 5, увеличение мощности лазера и напряжения ФЭУ по мере увеличения глубины за счет использования функции Bright Z улучшило качество изображений на более глубоких позициях. Однако увеличение мощности лазера сопряжено с компромиссом, связанным с фототоксичностью и затуханием сигнала. Поэтому необходимо найти оптимальные условия, которые соответствуют цели наблюдения. Временное разрешение также имеет значение при наблюдении за быстро движущимися клетками и тканями. Уменьшение количества срезов и сужение ROI являются ведущими решениями этой проблемы. Использование современного оборудования с повышенной чувствительностью детектора или конфокального микроскопа с вращающимся диском может повысить временное разрешение. Еще одно ограничение касается стадии куколки. Пупарий может быть удален только после того, как кутикула куколки полностью сформирована в 12-13,5 ч APF19и может быть легко удален только через 14 ч APF. Более ранние стадии, чем 12-часовой APF, можно частично наблюдать при установке куколки без удаления пупария15, даже несмотря на то, что получение четких изображений затруднено из-за быстрых движений тканей и оптических препятствий со стороны пупария в этом состоянии.
Устранение неполадок
Сложность в удалении пупария
При удалении пупария важна адгезия вентральной стороны пупария к двусторонней ленте. Клей и продукты питания должны быть удалены с поверхности пупария, а последующая сушка важна, так как влажные поверхности препятствуют хорошей адгезии. Примечательно, что двусторонняя лента в столе материалов имеет более прочную адгезию с внутренней стороны. Для приклеивания куколки следует использовать внутреннюю (более прочную) сторону. Разрезание пупария ножницами для рассечения вместо того, чтобы рвать его щипцами, полезно, когда удаление пупария затруднено.
Утечка жидкости из куколки
Очень важно удалить пупарий, не навредив куколке. Подтекание жидкости из тела куколки свидетельствует о повреждении куколки (рисунок 2К). Таких куколок следует избегать при съемке в режиме реального времени. Чтобы предотвратить повреждение куколки во время удаления куколки, в дополнение к осторожному обращению, рекомендуется использовать щипцы с относительно широкими наконечниками.
Низкое качество изображения
Когда флуоресцентный сигнал слишком слабый, существует множество способов регулировки яркости, таких как увеличение напряжения ФЭУ, открытие точечного отверстия (C.A.), замедление скорости сканирования и увеличение мощности лазера. Напоминаем, что каждый метод имеет побочные эффекты: увеличение напряжения ФЭУ может увеличить шум, открытие отверстия снижает разрешение по оси Z, замедление скорости сканирования удлиняет время сканирования, а увеличение мощности лазера увеличивает риск фототоксичности и обесцвечивания. Соответствующие настройки должны быть найдены в зависимости от области интереса, видов и уровней экспрессии флуоресцентных репортеров, а также желаемой продолжительности изображения в реальном времени. В целом, мощность лазера рекомендуется свести к минимуму для долгосрочной визуализации в реальном времени.
Затухание флуоресценции
Затухание флуоресценции неизбежно при долговременной визуализации в реальном времени. Чтобы избежать этой проблемы, рекомендуется минимальное использование мощности лазера. Для компенсации выцветания рекомендуется использовать плагин ImageJ "AutoEnhance"16 при обработке полученных данных изображения в реальном времени.
Благодаря полному удалению пупария, этот метод очень применим для других тканей просто за счет изменения ROI и ориентации куколки. Действительно, несмотря на то, что это не живая визуализация, проксимальная часть ноги, хоботок, эпителий головы возле антенны и эпителий тыльной части грудной клетки были исследованы с помощью этого метода в Hiraiwa et al.15. Такая применимость к широкому спектру тканей может способствовать дальнейшей интеграции с другими методами, такими как оптическая индукция генов. Этот метод может быть также применим к видам cyclorrhaphan (puparium-образующим), отличным от дрозофилы. Кроме того, он потенциально может быть использован для других видов насекомых, если у них есть прозрачная кукуколка куколки. В этой статье представлены подробные инструкции для исследователей дрозофил по выполнению визуализации куколки в реальном времени, чтобы зафиксировать динамику клеток в живых тканях.
Раскрытие информации
Авторы заявляют об отсутствии конкурирующих интересов.
Благодарности
Мы благодарны доктору Масаюки Миура (Токийский университет) и доктору Юя Фудзисаве (Токийский университет) за технические советы, а также благодарим Bloomington Stock Center за ресурсы для полетов.
Материалы
| Name | Company | Catalog Number | Comments |
| 35 mm/glass base dish | IWAKI | 3911-035 | |
| Cleaning wipes | NIPPON PAPER CRECIA | S-200 | |
| Dumont #3c Forceps | Fine Science Tools | 11231-20 | |
| Dumont #5SF | Fine Science Tools | 11252-00 | |
| Eppendorf Research plus 2-20 µL | Eppendorf | 3123000098 | |
| Fly strain: His2Av-mRFP, sGMCA | Bloomington Drosophila Stock Center | 59023 | |
| FV3000 | EVIDENT | inverted confocal microscope | |
| FV31S-SW | EVIDENT | software for FV3000 | |
| G40L | Shin-Etsu Silicone | silicone grease | |
| Micro Cover Glass 18 x 18 mm 0.13-0.17 mm | MATSUNAMI | C018181 | |
| Micro Slide Glass 76 x 26 mm 0.9-1.2 mm | MATSUNAMI | S7213 | |
| NEO-SABLE Size 0 round, fine | Pentel | XZBNR-0 | paintbrush |
| SIL300CS-30CC | EVIDENT | silicone oil | |
| Stereomicroscope System SZX7 | EVIDENT | ||
| Terumo syringe 50 mL | Terumo | SS-50ESZ | |
| Transparent double sided tape | Scotch | 665-1-12 | Since the inner layer has stronger adhesion than the outer layer, the inner layer should be used to fix pupae. |
| UPLSAPO10x | EVIDENT | ||
| UPLSAPO40XS | EVIDENT | silicone immersion lens | |
| Vannas Spring Scissors - 2.5mm Cutting Edge | Fine Science Tools | 15000-08 | optional |
Ссылки
- Koto, A., Kuranaga, E., Miura, M. Temporal regulation of Drosophila IAP1 determines caspase functions in sensory organ development. J Cell Biol. 187 (2), 219-231 (2009).
- Ninov, N., Martín-Blanco, E. Live imaging of epidermal morphogenesis during the development of the adult abdominal epidermis of Drosophila. Nat Protoc. 2 (12), 3074-3080 (2007).
- Chiba, M., et al. Activatable photosensitizer for targeted ablation of lacZ-positive cells with single-cell resolution. ACS Cent Sci. 5 (11), 1676-1681 (2019).
- Umetsu, D., et al. Local increases in mechanical tension shape compartment boundaries by biasing cell intercalations. Curr Biol. 24 (16), 1798-1805 (2014).
- Tran, N. V., et al. Programmed disassembly of a microtubule-based membrane protrusion network coordinates 3D epithelial morphogenesis in Drosophila. EMBO J. 43 (6), 568-594 (2024).
- Hellerman, M. B., Choe, R. H., Johnson, R. I. Live-imaging of the Drosophila pupal eye. J Vis Exp. (95), e52120 (2015).
- O'Connor, J. T., Shannon, E. K., Hutson, M. S., Page-McCaw, A. Mounting Drosophila pupae for laser ablation and live imaging of the dorsal thorax. STAR Protoc. 3 (2), 101396 (2022).
- Ziserman, D., Roegiers, F. Live-cell imaging of sensory organ precursor cells in intact Drosophila pupae. J Vis Exp. (51), e2706 (2011).
- Tögel, M., Pass, G., Paululat, A. In vivo imaging of Drosophila wing heart development during pupal stages. Int J Dev Biol. 57 (1-2), 13-24 (2013).
- Weavers, H., Franz, A., Wood, W., Martin, P. Long-term in vivo tracking of inflammatory cell dynamics within Drosophila pupae. J Vis Exp. (136), e57871 (2018).
- Kojima, T. Developmental mechanism of the tarsus in insect legs. Curr Opin Insect Sci. 19, 36-42 (2017).
- Mirth, C., Akam, M. Joint development in the Drosophila leg: Cell movements and cell populations. Dev Biol. 246 (2), 391-406 (2002).
- Mirth, C. Ecdysteroid control of metamorphosis in the differentiating adult leg structures of Drosophila melanogaster. Dev Biol. 278 (1), 163-174 (2005).
- Tajiri, R., Misaki, K., Yonemura, S., Hayashi, S. Dynamic shape changes of ECM-producing cells drive morphogenesis of ball-and-socket joints in the fly leg. Development. 137 (12), 2055-2063 (2010).
- Hiraiwa, S., et al. Unveiling the cell dynamics during the final shape formation of the tarsus in Drosophila adult leg by live imaging. Dev Genes Evol. , (2024).
- . ImageJ plugin page Available from: https://signaling.riken.jp/en/en-tools/imagej/629/ (2024)
- Pandey, R., Heidmann, S., Lehner, C. F. Epithelial re-organization and dynamics of progression through mitosis in Drosophila separase complex mutants. J Cell Sci. 118 (4), 733-742 (2005).
- Kiehart, D. P., Galbraith, C. G., Edwards, K. A., Rickoll, W. L., Montague, R. A. Multiple forces contribute to cell sheet morphogenesis for dorsal closure in Drosophila. J Cell Biol. 149 (2), 471-490 (2000).
- Ashburner, M. . Drosophila: A Laboratory Handbook. , (1989).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены