Method Article
Imágenes en vivo a largo plazo del desarrollo de la pata de la pupa de Drosophila después de la extracción del pupario
En este artículo
Resumen
Aquí, se presenta un protocolo para la obtención de imágenes en vivo a largo plazo de la pata de Drosophila durante la etapa de pupa, que implica la eliminación completa del pupario. Este protocolo también se puede aplicar a otros tejidos.
Resumen
En las últimas décadas, se han logrado avances significativos en la comprensión de los mecanismos de determinación del destino celular. Sin embargo, el proceso por el cual las células determinadas por el destino forman formas tridimensionales de organismos sigue sin estar claro. Los avances recientes en microscopía confocal han facilitado los esfuerzos para observar la dinámica celular durante el desarrollo a través de imágenes en vivo. La pupa de Drosophila melanogaster es ideal para imágenes en vivo debido a su inmovilidad, cutícula de pupa transparente y la disponibilidad de líneas reporteras fluorescentes. Un desafío principal para la obtención de imágenes es el pupario, la cutícula que rodea a la pupa, que obstruye la obtención de imágenes ópticas. Si bien los métodos anteriores implicaban la extirpación parcial o completa del pupario, mantener la viabilidad de la pupa durante períodos prolongados después de este procedimiento ha seguido siendo un desafío. Aquí, se presenta un método simple para obtener imágenes en vivo de la pata de Drosophila durante días durante la etapa de pupa, que implica la eliminación completa del pupario. El método consiste en retirar el pupario de una pupa adherida a cinta adhesiva de doble cara, seguido de montar una pequeña cámara en un plato con fondo de cristal para encerrar la pupa y una gota de agua. Esta configuración es sencilla, fiable y favorece la supervivencia prolongada de las pupas al evitar la desecación. Las imágenes en vivo a largo plazo de la pupa de Drosophila han contribuido significativamente a capturar cómo la pata adulta experimenta cambios estructurales tridimensionales dramáticos durante 2-3 días. Estos cambios incluyen la formación transitoria de una estructura intrigante (la estructura similar al Partenón) por parte de las células epiteliales, el rápido estrechamiento del tejido, la formación de articulaciones y el alargamiento de las cerdas. Este método es aplicable a la observación de varios tejidos y potencialmente puede combinarse con otras técnicas, como la inducción óptica de genes, para avanzar en la comprensión de la dinámica celular durante la formación de la forma final de los tejidos en la etapa de pupa.
Introducción
A pesar de los considerables avances logrados en las últimas décadas en la elucidación del mecanismo de determinación del destino celular, la forma en que las células determinadas por el destino construyen formas tridimensionales de organismos sigue siendo difícil de alcanzar. Gracias a las mejoras tecnológicas en microscopía confocal, los intentos de desvelar la dinámica celular durante el desarrollo por imagen en vivo han aumentado en los últimos años 1,2. La pupa de Drosophila melanogaster ha sido favorecida para la obtención de imágenes en vivo debido a sus características adecuadas: inmovilidad, transparencia de la cutícula de la pupa y disponibilidad de líneas reporteras fluorescentes 3,4,5. El mayor obstáculo para la realización de imágenes en vivo de la pupa de Drosophila es el pupario (caso de pupa), la cutícula larvaria deformada y bronceada del estadio final que rodea a la pupa. Para evitar la obstrucción óptica, el pupario se retiró parcial o completamente en los métodos previamente reportados 1,2,3,4,5,6,7,8,9,10. La extirpación completa del pupario maximiza el área de observación y la aplicabilidad a varios tejidos. Sin embargo, la pupa sin su pupario generalmente muere dentro de aproximadamente medio día, presumiblemente debido a la desecación. Por lo tanto, mantener la humedad de la pupa es crucial para la obtención de imágenes en vivo prolongadas. Si bien no está clara la duración exacta de la supervivencia de la pupa después de la eliminación completa del pupario en los métodos anteriores, los ejemplos reportados generalmente duraron hasta aproximadamente 20 h. Dado que la etapa de pupa dura alrededor de cuatro días, se esperaba que un método para obtener imágenes en vivo aún más largas contribuyera a capturar todo el proceso de formación de la forma del tejido.
La pata adulta de Drosophila es un excelente modelo para estudiar el proceso de formación de la forma tridimensional del tejido. Deriva de los primordios en forma de disco (disco de la pata) que se forman durante las etapas larvarias. Las regiones correspondientes a cada segmento en la pata adulta están determinadas por la etapa prepupal11. Luego, el disco de la pierna sobresale de la parte central para formar una estructura tubular hinchada alrededor de 11 h después de la formación del pupario (APF). La forma en que este tejido, con su forma simple, alcanza su forma final de la pierna adulta en etapas posteriores ha permanecido incierta durante mucho tiempo. Se han publicado varios estudios que abordan esta cuestión 12,13,14. Dado que observaron tejidos fijos o cultivados, no se pudieron rastrear los cambios continuos en las células individuales y la información obtenida estaba algo fragmentada. Para comprender completamente el proceso de conformación, es esencial observar los cambios en las células individuales de forma continua a través de imágenes en vivo a largo plazo.
Un estudio reciente reveló la deformación dinámica de las estructuras tridimensionales en los tejidos y los niveles celulares mediante imágenes en vivo a largo plazo (Figura 1). El hallazgo más intrigante de este estudio es la formación transitoria de una estructura inesperadamente compleja por parte de las células epiteliales. Esta estructura, denominada "estructura similar al Partenón", presenta proyecciones apicobasales y conexiones de células epiteliales en forma de malla basal. Es importante destacar que la formación y desaparición de esta estructura coincide con el rápido estrechamiento del tejido15. La formación posterior de la forma, incluida la formación de juntas y el alargamiento de las cerdas, procedió durante 2-3 días. Las imágenes en vivo a largo plazo capturaron de manera efectiva toda la historia de estos eventos secuenciales de varios días de duración.
Este artículo proporciona un método paso a paso para realizar imágenes en vivo de días de duración de la pata de Drosophila durante la etapa de pupa con extirpación completa del pupáro. El método es fácil de seguir y se puede aplicar a varios otros tejidos.
Protocolo
Este protocolo utiliza cepas de Drosophila melanogaster que expresan reporteros fluorescentes15. Los detalles de los reactivos y equipos utilizados en el estudio se enumeran en la Tabla de Materiales.
1. Preparación de la pupa
- Con un pincel, recoja las pupas blancas de la cepa deseada de Drosophila melanogaster de los viales y colóquelas en platos o viales vacíos (Figura 2A).
NOTA: En este estudio, las "pupas blancas" se refieren a la etapa entre el momento en que la larva se vuelve completamente inmóvil y antes de que el pupario se vuelva marrón. Esta etapa dura unos 30 min a 25 °C. - Incubar las pupas blancas durante al menos 14 h a 25 °C hasta que se desarrollen en la etapa que se va a observar (Figura 2B).
NOTA: El pupario se puede eliminar solo después de que la cutícula de la pupa se haya formado completamente a 12-13.5 h APF y se puede quitar fácilmente solo después de 14 h APF. - Limpia el pegamento y aleja la comida del pubario con un pincel empapado en agua destilada.
NOTA: El lado ventral del pupario debe estar especialmente limpio para lograr una adhesión suficiente a la cinta adhesiva de doble cara en pasos posteriores. - Coloque las pupas en toallitas limpiadoras durante varios minutos para que se sequen.
NOTA: La humedad restante en el pupario impediría una buena adherencia a una cinta adhesiva de doble cara. - Fije un trozo de cinta adhesiva de doble cara en un portaobjetos de vidrio.
- Coloque las pupas secas en una cinta adhesiva de doble cara con el lado ventral hacia abajo (Figura 2C).
- Empuje suavemente el lado dorsal de las pupas con un pincel seco para lograr una mejor adherencia a la cinta adhesiva de doble cara.
- Bajo un microscopio estereoscópico, abra cuidadosamente el opérculo con un par de pinzas (Figura 2 D,E).
NOTA: El opérculo es la región anterodorsal del pupario por donde sale la mosca adulta, abriéndose con facilidad. - Desde el borde del opérculo abierto, inserte una de las puntas de las pinzas en el espacio entre la pupa y el pupario (Figura 2F).
NOTA: Tenga cuidado de no dañar la cutícula de la pupa con la punta de las pinzas. - Agarre el pupario con pinzas y tire de él hacia afuera hasta que se abra.
- Levante los fragmentos desgarrados del pupario con pinzas y adhiéralos a la cinta adhesiva de doble cara (Figura 2G).
- Repita los pasos 1.10-1.11 hasta que la abertura del pupario llegue al extremo posterior, dejando una pequeña porción del pupario (Figura 2 H,I).
NOTA: Si el líquido saliera de una pupa, se habría dañado (Figura 2K). Para observar el desarrollo normal, evite obtener imágenes de las pupas dañadas.
2. Configuración de imágenes
- Coloque 1 μL de agua destilada o aceite de silicona (cuando use una lente de inmersión de silicona) en el fondo de un plato con fondo de vidrio.
- Remoja un pincel en el agua destilada y recoge suavemente la pupa (Figura 2J).
- Coloque la pupa con el lado ventral hacia abajo sobre el agua destilada o el aceite de silicona (Figura 2L).
- Con una micropipeta, coloque 10 μL de agua destilada cerca del borde de la porción de vidrio del plato con fondo de vidrio (Figura 2L).
- Coloque un círculo de grasa de silicona con una jeringa alrededor del borde de la porción de vidrio del plato con fondo de vidrio (Figura 2M).
- Coloque un cubreobjetos sobre la grasa de silicona para sellarla (Figura 2M). El ensamblaje se ilustra en la Figura 2N.
NOTA: Asegúrese de que no haya espacios entre el cubreobjetos y la grasa de silicona.
3. Imagen confocal
- Encienda un microscopio láser confocal invertido y un software de imágenes.
- Coloque la antena en el aceptador de platina de un microscopio confocal invertido.
- Encuentre las pupas con una lente de objetivo de bajo aumento en la observación de campo claro. Asegúrate de que las pupas no muestren ninguna fuga del líquido corporal.
- Centrar el área deseada de la pupa para observar en la región de interés (ROI).
NOTA: Los lados anterolaterales del tarso en la primera y segunda pata, y el lado ventral del tarso en la tercera pata, están orientados hacia el lado ventral de la pupa. Por lo tanto, la sección longitudinal del tarso a lo largo del eje dorsoventral se puede observar en la primera y segunda pata, mientras que las que se encuentran a lo largo del eje anteroposterior se pueden observar en la tercera pata. - Cambie la lente del objetivo por la de imágenes en vivo.
NOTA: Si se utiliza una lente de inmersión en agua, el agua entre la lente y el plato con fondo de vidrio se secará durante la observación a largo plazo. Se recomienda una lente sin inmersión o con aceite de silicona. - Ajuste las condiciones para la observación deseada e inicie la adquisición de datos.
NOTA: Para evitar cualquier daño a la pupa, la potencia del láser debe ser mínima en la medida en que se puedan obtener imágenes claras. Minimizar el retorno de la inversión y aumentar el tamaño de los pasos es útil para ahorrar tiempo en la adquisición de la pila Z. La transformación futura del tejido debe tenerse en cuenta a la hora de decidir la profundidad de la pila Z. En el caso de la observación de la pierna a las 15-25 h APF, dado que la pierna se estrecha mucho, la parte más cercana al cubreobjetos (epitelio lateral) se profundiza rápidamente. Teniendo en cuenta este movimiento, las pilas Z extra profundas deben establecerse desde el principio. En el Archivo Suplementario 1 se proporciona un ejemplo de la configuración del microscopio confocal para obtener imágenes en vivo de la región tarsiana de la pierna de 15 a 30 h APF. El desvanecimiento de la fluorescencia es inevitable durante las imágenes en vivo a largo plazo. Para mitigar este problema, es aconsejable utilizar una potencia láser mínima. El complemento de ImageJ "AutoEnhance"16 se recomienda para procesar datos de imágenes en vivo para compensar los efectos de desvanecimiento.
Resultados
Aquí, se describe un ejemplo de imágenes en vivo de 44 horas de la pata adulta de Drosophila en desarrollo en la etapa de pupa. Las moscas que expresan His2Av-mRFP17 (núcleos de marcado) y sGMCA18 (proteína de unión a actina marcada con GFP Moesin, actina de marcado) se recolectaron en la etapa de pupa blanca y se incubaron durante 15 h a 25 °C. El pupario se retiró y se montó de acuerdo con el protocolo (Figura 2). Se obtuvieron con éxito imágenes de pila Z del tarso y el pretarso, cerca de la punta de la pata, cada 15 min de 16 h a 60 h de APF a temperatura ambiente (no estricta, pero cercana a 25 °C). La primera mitad de la serie de imágenes se muestra en la Figura 3, la segunda mitad en la Figura 4 y la película de todo en la Película 1. A medida que el tejido de la pierna se estrechaba rápidamente, las células epiteliales formaron transitoriamente una estructura intrigante, la estructura similar al Partenón, caracterizada por sus proyecciones apicobasales y conexiones basales (Figura 3). La reducción del grosor epitelial se observó incluso después de que el contorno estaba casi terminado (Figura 4). Todo el proceso se describe en la Figura 1.
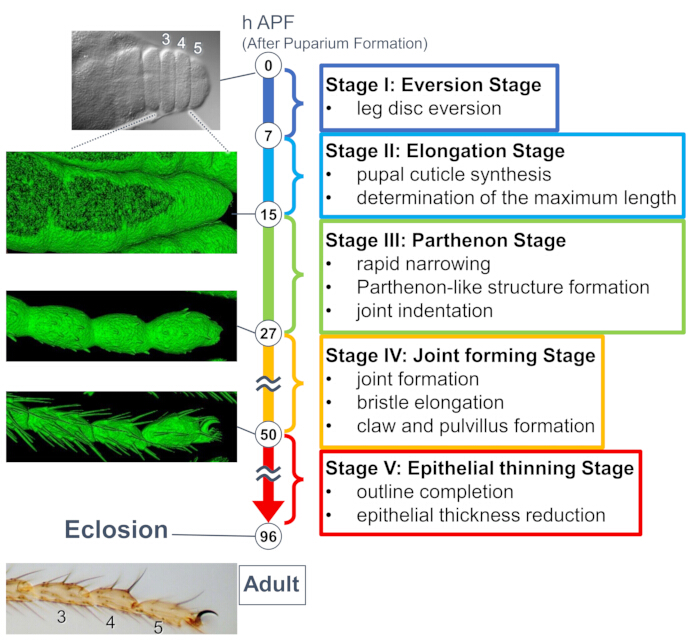
Figura 1: Resumen de la formación de la forma final del tarso adulto de Drosophila durante la etapa de pupa. Todo el proceso se dividió en cinco etapas basadas en los cambios morfológicos tanto a nivel tisular como celular observados en experimentos de imágenes en vivo a largo plazo. En el lado izquierdo se muestran fotos representativas o imágenes renderizadas en superficie (señal sGMCA) correspondientes a varios puntos de tiempo. En el lado derecho se escriben breves descripciones de los eventos en cada etapa. Esta figura ha sido modificada a partir de Hiraiwa et al.15. Véase también Película 1. Haga clic aquí para ver una versión más grande de esta figura.
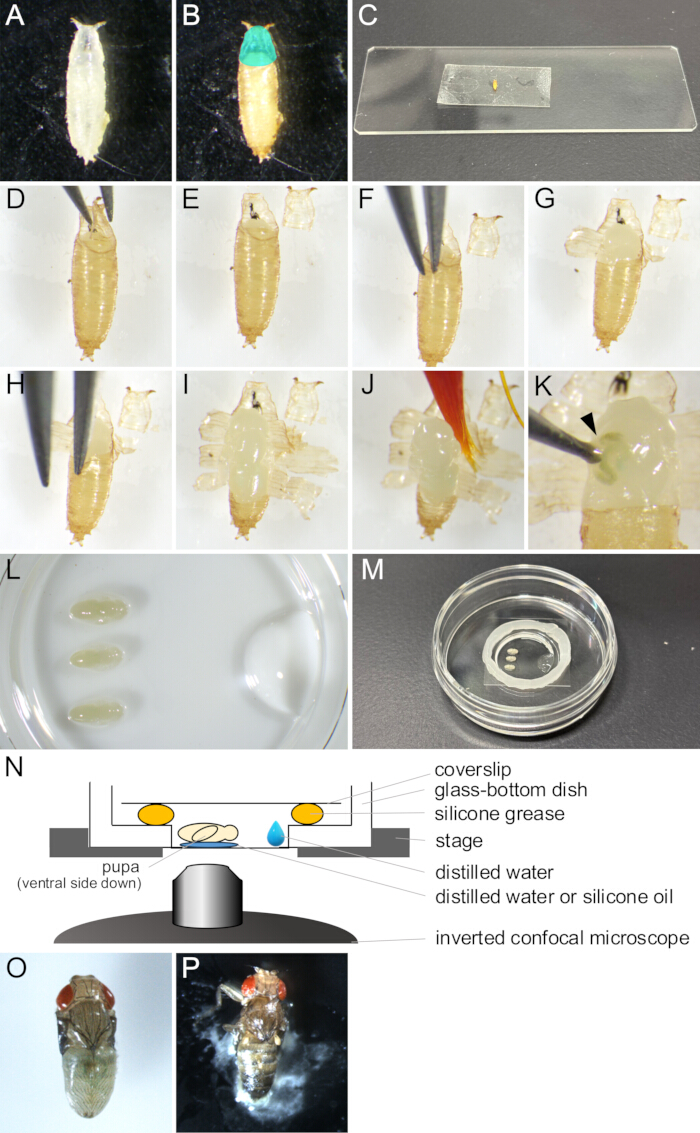
Figura 2: Extracción del pupario y montaje del montaje para la obtención de imágenes en vivo. (A) Una pupa blanca recogida en un plato. (B) La pupa apareció en (A) después de incubar durante 15 h a 25 °C. La región coloreada cian indica el opérculo. (C) Una fotografía que muestra una pupa adherida a un trozo de cinta adhesiva de doble cara. (D-J) Serie de imágenes que muestran el procedimiento de extracción del pupario. (D) El opérculo se levanta con fórceps. (E) Se extirpa el opérculo. (F) Se inserta una punta de pinza entre la cutícula de la pupa y el pupario. (G) El pupario está parcialmente abierto. (H) Se vuelve a insertar la punta de un fórceps. (I) El pupario se abrió, dejando solo una pequeña porción del extremo posterior. (J) La pupa siendo levantada por un pincel. (K) Un ejemplo de fuga de líquido corporal de la pupa. El líquido que sale de la herida pinchado por la punta de un fórceps se indica con una punta de flecha. (De izquierda a derecha) Imágenes e ilustraciones que muestran el montaje de la montura. (L) Una imagen vista desde el lado superior que muestra pupas colocadas y agua destilada en el fondo de un plato con fondo de vidrio. (M) El plato después de la finalización del ensamblaje del montaje. Se colocó grasa de silicona a lo largo del borde alrededor de la parte de vidrio y se colocó un cubreobjetos sobre la grasa para sellarla. (N) Dibujo esquemático del conjunto de montaje de la pupa de Drosophila para la obtención de imágenes en vivo a largo plazo. (O) Una pupa montada se desarrolló casi adulta. (P) Una pupa montada que se cierra. Haga clic aquí para ver una versión más grande de esta figura.
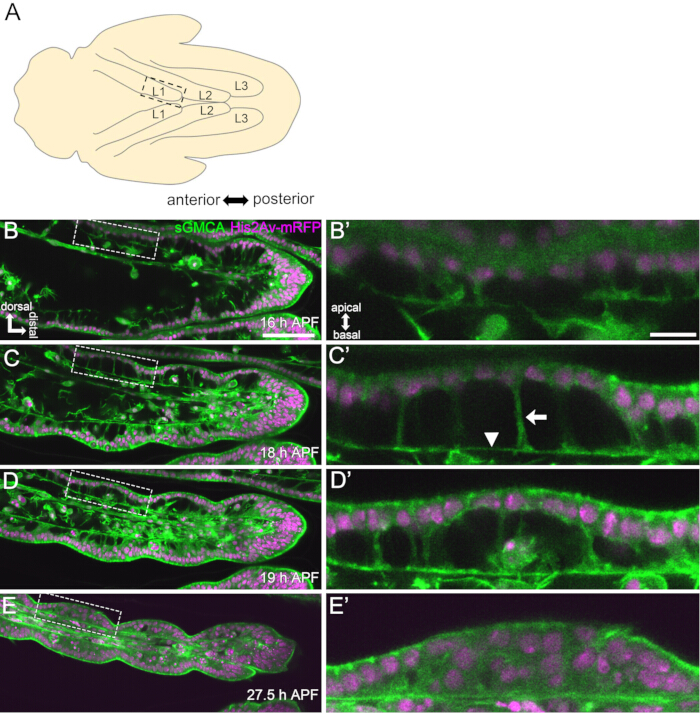
Figura 3: Cambios dinámicos de forma en las células epiteliales del tarso en 16-27,5 h de APF. (A) Una ilustración de la pupa vista desde el lado ventral. El rectángulo discontinuo corresponde a la región observada en (B-E). L1: primera pata, L2: segunda pata, L3: tercera pata. (B,C,D,E) Fotogramas de las imágenes en vivo de la parte distal del tarso en la mosca expresiva sGMCA (verde) e His2Av-mRFP (magenta). El tejido se estrecha rápidamente y la hendidura de las regiones articulares progresa. (B',C',D',E') Ampliación de las regiones rodeadas por las líneas discontinuas en (B,C,D,E), respectivamente. La flecha y la punta de flecha en (C') muestran un ejemplo de proyecciones apicobasales y la posición de las conexiones basales, respectivamente. La estructura similar al Partenón comienza a formarse en (B'), está completamente formada en (C'), comienza a desaparecer en (D') y se vuelve difícil de ver en (E'). La distal está a la derecha y la dorsal a la parte superior en todas las figuras. Las etapas se muestran en las esquinas inferiores derechas en (B,C,D,E). Barras de escala: B, C, D, E: 50 μm; B',C',D',E': 10 μm. Esta figura ha sido modificada a partir de Hiraiwa et al.15. Véase también Película 1. Haga clic aquí para ver una versión más grande de esta figura.
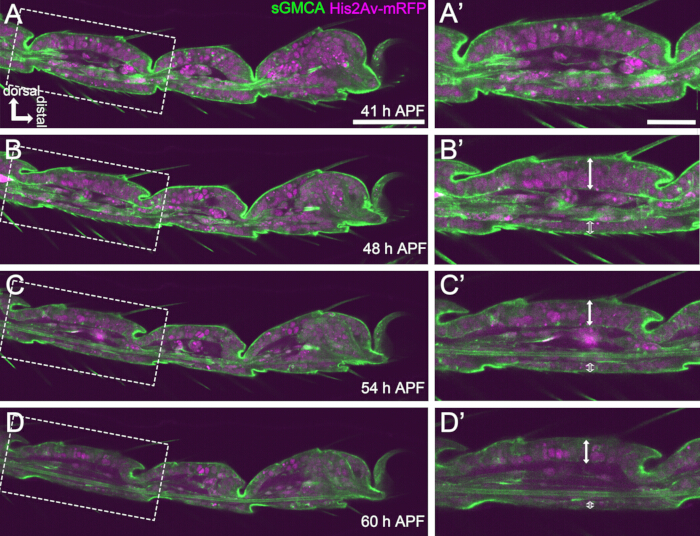
Figura 4: Cambios de forma en la capa de células epiteliales tarsales en 41-60 h APF. (A,B,C,D) Imágenes fijas del mismo conjunto de datos secuenciales de imágenes en vivo que la Figura 3. Los rectángulos discontinuos en (A,B,C,D) se amplían en (A',B',C',D'), respectivamente. Alrededor de las 48 h APF (A-B'), la formación de formas externas, como el alargamiento de cerdas, garras y pulvillos, está casi completa. La parte inferior de la articulación invaginada se movió proximalmente y, a continuación, la formación de la estructura esférica progresó después de unas 54 h de APF. La diferencia morfológica entre el epitelio dorsal y ventral se hizo evidente (flechas dobles y flechas dobles abiertas en B',C',D'). Después de 54 h APF (C-D'), la capa epitelial disminuyó su espesor sin apenas cambiar el contorno de los segmentos. La dorsal está hacia arriba y la distal hacia la derecha en todas las figuras. Barras de escala: A, B, C, D: 50 μm; A',B',C',D': 20 μm.Esta cifra ha sido citada de Hiraiwa et al.15. Véase también Película 1. Haga clic aquí para ver una versión más grande de esta figura.
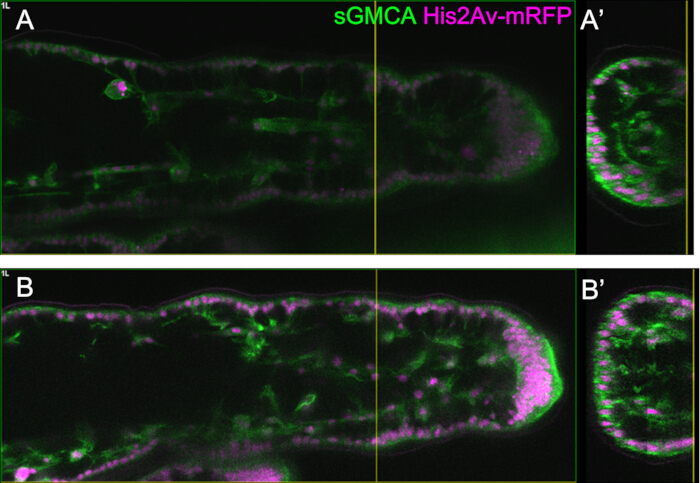
Figura 5: Un ejemplo de la observación de la pierna utilizando la función Bright Z. (A,B) Imágenes de la región, profundidad y etapa correspondientes de la tercera pata de la mosca que expresa sGMCA (verde) e His2Av-mRFP (magenta), con (B) o sin (A) usando la función Bright Z. (A) Un plano XY a 59,1 μm de profundidad extraído de la observación de la región tarsiana en la tercera pata a 16 h APF adquirida sin utilizar la función Bright Z. (A') La vista transversal corresponde a la línea vertical amarilla de (A). La línea vertical en (A') indica el plano focal de (A). (B) Un plano XY a 61,6 μm de profundidad extraído de la observación de la región tarsiana en la tercera pata a 16 h APF adquirida utilizando la función Bright Z. Se ajustaron tanto el voltaje PMT como la potencia del láser. La visibilidad de la imagen mejora en comparación con (A). (B') La vista en sección corresponde a la línea vertical amarilla de (B). La línea vertical amarilla en (B') indica el plano focal de (B). Haga clic aquí para ver una versión más grande de esta figura.
Archivo complementario 1: Un ejemplo de la configuración del microscopio confocal para obtener imágenes en vivo de la región tarsiana de la pierna de 15 a 30 h APF. Haga clic aquí para descargar este archivo.
Película 1: Imagen en vivo a largo plazo de la parte distal del tarso durante 44 h. Se utilizaron las moscas expresivas sGMCA (verde) e His2Av-mRFP (magenta). El plano XY más representativo se extrajo del mismo conjunto de datos que la Figura 3 y la Figura 4. Las puntas de flecha indican ejemplos de futuras regiones conjuntas. Las células que se mueven rápidamente en el tejido son células similares a los macrófagos. La señal en forma de cuerda que se extiende a lo largo de los segmentos del tarso es parte del tabique. La marca de tiempo muestra hh: mm. La distal está a la derecha y la dorsal hacia arriba. Esta película ha sido adaptada de Hiraiwa et al.15Por favor, haga clic aquí para descargar este archivo.
Discusión
En este artículo, se proporciona un protocolo detallado para la obtención de imágenes en vivo a largo plazo de la pata de Drosophila en la etapa de pupa. El disco imaginal de la pata sobresale de la parte central para formar una estructura tubular, y luego la formación de la forma final de la pata adulta ocurre en la etapa de pupa de una manera que había sido difícil de alcanzar. Los intentos previos de observar este proceso fueron principalmente mediante tinción fija, cultivo de tejidos y microscopio electrónico de barrido 12,13,14. Estos métodos no podían rastrear cambios continuos en células individuales, y solo se obtenía información fragmentaria. Con el método descrito en este estudio, el proceso final de formación de la forma de la región tarsiana se puede observar con éxito como imágenes secuenciales en vivo de días de duración mediante un microscopio confocal, y los cambios en las células individuales se pueden rastrear continuamente. La intrigante dinámica celular revelada por estas imágenes en vivo se ha descrito en detalle en el reciente informe15.
Para obtener imágenes en vivo a largo plazo con éxito, es crucial mantener la viabilidad de la pupa y garantizar que su desarrollo no se vea afectado. En el método descrito aquí, la pupa extraída del pupario se convirtió en el adulto de farate y en el adulto en muchos casos (Figura 2O,P). Los tiempos de los cambios morfológicos del tarso en desarrollo observados por este método fueron consistentes con reportes previos 12,13,14. Además, las células epiteliales mostraron cambios como la reducción del grosor incluso en 48-60 h APF (32-44 h después del montaje) (Figura 4B'-D'). Estos hechos sugieren que la pupa permanece intacta y casi no experimenta interrupciones o retrasos en su desarrollo normal durante las imágenes en vivo a largo plazo utilizando el método descrito aquí. Tenga en cuenta que la viabilidad de la pupa extraída del pupario sometida a imágenes en vivo puede variar según el momento de la extracción del pupario, la manipulación en el procedimiento, el grado de fototoxicidad en las imágenes y las cepas de moscas utilizadas.
Uno de los pasos críticos para garantizar la integridad de la pupa y su desarrollo es eliminar el pupario sin dañarlo. La adherencia estable de la pupa a la cinta adhesiva de doble cara y el manejo cuidadoso de las pinzas son las claves del éxito. Prevenir la deshidratación de la pupa también es crucial. En este sentido, es fundamental evitar cualquier espacio entre el cubreobjetos y la grasa de silicona.
Para evitar la desecación de la pupa, muchos métodos anteriores implicaban la eliminación parcial del pupario 1,2,3,4,5,6,7. Sin embargo, para observar toda la pupa se favorece la extirpación completa del pupario. A pesar de que no se conoce el tiempo máximo de supervivencia de la pupa, se han descrito varios métodos en los que se elimina completamente el pupario 8,9,10. El enfoque más común para proporcionar humedad a la pupa en estos métodos es el uso de papel de filtro humedecido. En comparación con los métodos anteriores, el descrito aquí proporciona humedad poniendo una gota de agua de una manera más sencilla y fácil. Además, muchos métodos anteriores implican montar la pupa en un portaobjetos de vidrio. Al montar la pupa eliminada del pupario en un portaobjetos de vidrio, puede haber un problema en el que presionar el cubreobjetos contra la pupa cause estrés a la pupa, o un cubreobjetos inclinado introduzca ruido, distorsiones y falta de claridad en las imágenes. El método descrito aquí emplea un plato con fondo de vidrio, lo que elimina la necesidad de presionar el cubreobjetos contra la pupa, lo que permite observar los tejidos lo más cerca posible de su estado natural. Dado que no es necesario ajustar el ángulo del cubreobjetos, la configuración es estable, fácil de manejar y más confiable. Por lo tanto, este método casi no requiere habilidades especializadas, lo que permite que incluso los principiantes realicen con éxito imágenes en vivo.
Las principales limitaciones de este método son la profundidad de las observaciones y las resoluciones temporales. En las condiciones de observación del tarso, solo se pueden obtener imágenes claras hasta unos 40 μm de profundidad. El uso de la función Bright Z ayuda a solucionar este problema. Por ejemplo, como se muestra en la Figura 5, el aumento de la potencia del láser y el voltaje PMT a medida que aumenta la profundidad mediante el empleo de la función Bright Z mejoró la calidad de las imágenes en posiciones más profundas. Sin embargo, el aumento de la potencia del láser conlleva una compensación que implica fototoxicidad y desvanecimiento de la señal. Por lo tanto, es necesario encontrar las condiciones óptimas que se alineen con el propósito de la observación. La resolución del tiempo también es importante cuando se observan células y tejidos que se mueven rápidamente. La reducción de los segmentos y la reducción del retorno de la inversión son las principales soluciones para este problema. El uso de equipos actualizados con sensibilidad de detector mejorada o un microscopio confocal de disco giratorio puede mejorar la resolución del tiempo. Otra limitación se relaciona con la etapa de la pupa. El pupario se puede eliminar solo después de que la cutícula de la pupa se haya formado completamente a las 12-13,5 h APF19y se puede eliminar fácilmente solo después de 14 h APF. Las etapas más tempranas de 12 h APF se pueden observar parcialmente montando la pupa sin extraer el pupario15, aunque la obtención de imágenes claras es difícil debido a los rápidos movimientos de los tejidos y a los obstáculos ópticos del pupario en esta condición.
Solución de problemas
Dificultad en la extirpación del pupario
Al retirar el pupario, es importante la adhesión del lado ventral del pupario a la cinta de doble cara. El pegamento y la comida deben eliminarse de la superficie del pupario, y el secado posterior es importante ya que las superficies húmedas impiden una buena adherencia. En particular, la cinta de doble cara en la mesa de material tiene una adhesión más fuerte en el lado interior. El lado interno (más fuerte) debe usarse para adherir la pupa. Cortar el pupario con tijeras de disección en lugar de rasgarlo con pinzas es útil cuando la extracción del pupario es difícil.
Fuga de líquido de la pupa
Es fundamental eliminar el pupario sin dañarlo. La fuga de líquido corporal de la pupa indica daño a la pupa (Figura 2K). Dicha pupa debe evitarse en las imágenes en vivo. Para evitar el daño de la pupa mientras se extrae el pupario, además de un manejo cuidadoso, se recomienda usar pinzas con puntas relativamente anchas.
Mala calidad de imagen
Cuando la señal fluorescente es demasiado débil, hay muchas formas de ajustar el brillo, como aumentar el voltaje PMT, abrir el orificio (CA), ralentizar la velocidad de escaneo y aumentar la potencia del láser. Tenga en cuenta que todos los métodos tienen efectos secundarios: aumentar el voltaje PMT puede aumentar el ruido, abrir el orificio reduce la resolución del eje Z, ralentizar la velocidad de escaneo alarga el tiempo de escaneo y aumentar la potencia del láser aumenta el riesgo de fototoxicidad y blanqueo. Se deben encontrar los ajustes apropiados en función de la región de interés, los tipos y niveles de expresión de los reporteros fluorescentes y la duración deseada de las imágenes en vivo. En general, se recomienda minimizar la potencia del láser para obtener imágenes en vivo a largo plazo.
Desvanecimiento de la fluorescencia
El desvanecimiento de la fluorescencia es inevitable en las imágenes en vivo a largo plazo. Se recomienda un uso mínimo de la potencia del láser para evitar este problema. Para compensar el desvanecimiento, se recomienda el complemento de ImageJ "AutoEnhance"16 cuando se procesan los datos de imagen en vivo adquiridos.
Gracias a la eliminación completa del pupario, este método es altamente aplicable a otros tejidos simplemente modificando el ROI y la orientación de la pupa. De hecho, a pesar de que no se trata de imágenes en vivo, la parte proximal de la pierna, la probóscide, el epitelio de la cabeza cerca de la antena y el epitelio del tórax dorsal fueron observados por este método en Hiraiwa et al.15. Esta aplicabilidad a una amplia gama de tejidos puede facilitar una mayor integración con otras técnicas, como la inducción óptica de genes. Este método también puede ser aplicable a especies de ciclorrrafano (formadoras de pupario) distintas de Drosophila. Además, podría usarse para otras especies de insectos si tienen una cutícula de pupa transparente. Este artículo proporciona instrucciones detalladas para que los investigadores de Drosophila realicen imágenes en vivo de la pupa para capturar la dinámica celular en tejidos vivos.
Divulgaciones
Los autores declaran no tener intereses contrapuestos.
Agradecimientos
Agradecemos al Dr. Masayuki Miura (Universidad de Tokio) y al Dr. Yuya Fujisawa (Universidad de Tokio) por su asesoramiento técnico, y agradecemos al Bloomington Stock Center por los recursos para moscas.
Materiales
| Name | Company | Catalog Number | Comments |
| 35 mm/glass base dish | IWAKI | 3911-035 | |
| Cleaning wipes | NIPPON PAPER CRECIA | S-200 | |
| Dumont #3c Forceps | Fine Science Tools | 11231-20 | |
| Dumont #5SF | Fine Science Tools | 11252-00 | |
| Eppendorf Research plus 2-20 µL | Eppendorf | 3123000098 | |
| Fly strain: His2Av-mRFP, sGMCA | Bloomington Drosophila Stock Center | 59023 | |
| FV3000 | EVIDENT | inverted confocal microscope | |
| FV31S-SW | EVIDENT | software for FV3000 | |
| G40L | Shin-Etsu Silicone | silicone grease | |
| Micro Cover Glass 18 x 18 mm 0.13-0.17 mm | MATSUNAMI | C018181 | |
| Micro Slide Glass 76 x 26 mm 0.9-1.2 mm | MATSUNAMI | S7213 | |
| NEO-SABLE Size 0 round, fine | Pentel | XZBNR-0 | paintbrush |
| SIL300CS-30CC | EVIDENT | silicone oil | |
| Stereomicroscope System SZX7 | EVIDENT | ||
| Terumo syringe 50 mL | Terumo | SS-50ESZ | |
| Transparent double sided tape | Scotch | 665-1-12 | Since the inner layer has stronger adhesion than the outer layer, the inner layer should be used to fix pupae. |
| UPLSAPO10x | EVIDENT | ||
| UPLSAPO40XS | EVIDENT | silicone immersion lens | |
| Vannas Spring Scissors - 2.5mm Cutting Edge | Fine Science Tools | 15000-08 | optional |
Referencias
- Koto, A., Kuranaga, E., Miura, M. Temporal regulation of Drosophila IAP1 determines caspase functions in sensory organ development. J Cell Biol. 187 (2), 219-231 (2009).
- Ninov, N., Martín-Blanco, E. Live imaging of epidermal morphogenesis during the development of the adult abdominal epidermis of Drosophila. Nat Protoc. 2 (12), 3074-3080 (2007).
- Chiba, M., et al. Activatable photosensitizer for targeted ablation of lacZ-positive cells with single-cell resolution. ACS Cent Sci. 5 (11), 1676-1681 (2019).
- Umetsu, D., et al. Local increases in mechanical tension shape compartment boundaries by biasing cell intercalations. Curr Biol. 24 (16), 1798-1805 (2014).
- Tran, N. V., et al. Programmed disassembly of a microtubule-based membrane protrusion network coordinates 3D epithelial morphogenesis in Drosophila. EMBO J. 43 (6), 568-594 (2024).
- Hellerman, M. B., Choe, R. H., Johnson, R. I. Live-imaging of the Drosophila pupal eye. J Vis Exp. (95), e52120 (2015).
- O'Connor, J. T., Shannon, E. K., Hutson, M. S., Page-McCaw, A. Mounting Drosophila pupae for laser ablation and live imaging of the dorsal thorax. STAR Protoc. 3 (2), 101396 (2022).
- Ziserman, D., Roegiers, F. Live-cell imaging of sensory organ precursor cells in intact Drosophila pupae. J Vis Exp. (51), e2706 (2011).
- Tögel, M., Pass, G., Paululat, A. In vivo imaging of Drosophila wing heart development during pupal stages. Int J Dev Biol. 57 (1-2), 13-24 (2013).
- Weavers, H., Franz, A., Wood, W., Martin, P. Long-term in vivo tracking of inflammatory cell dynamics within Drosophila pupae. J Vis Exp. (136), e57871 (2018).
- Kojima, T. Developmental mechanism of the tarsus in insect legs. Curr Opin Insect Sci. 19, 36-42 (2017).
- Mirth, C., Akam, M. Joint development in the Drosophila leg: Cell movements and cell populations. Dev Biol. 246 (2), 391-406 (2002).
- Mirth, C. Ecdysteroid control of metamorphosis in the differentiating adult leg structures of Drosophila melanogaster. Dev Biol. 278 (1), 163-174 (2005).
- Tajiri, R., Misaki, K., Yonemura, S., Hayashi, S. Dynamic shape changes of ECM-producing cells drive morphogenesis of ball-and-socket joints in the fly leg. Development. 137 (12), 2055-2063 (2010).
- Hiraiwa, S., et al. Unveiling the cell dynamics during the final shape formation of the tarsus in Drosophila adult leg by live imaging. Dev Genes Evol. , (2024).
- . ImageJ plugin page Available from: https://signaling.riken.jp/en/en-tools/imagej/629/ (2024)
- Pandey, R., Heidmann, S., Lehner, C. F. Epithelial re-organization and dynamics of progression through mitosis in Drosophila separase complex mutants. J Cell Sci. 118 (4), 733-742 (2005).
- Kiehart, D. P., Galbraith, C. G., Edwards, K. A., Rickoll, W. L., Montague, R. A. Multiple forces contribute to cell sheet morphogenesis for dorsal closure in Drosophila. J Cell Biol. 149 (2), 471-490 (2000).
- Ashburner, M. . Drosophila: A Laboratory Handbook. , (1989).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados