Method Article
Langzeit-Live-Bildgebung der Entwicklung der Puppenbein von Drosophila nach Entfernung der Puppen
In diesem Artikel
Zusammenfassung
In dieser Arbeit wird ein Protokoll für die Langzeit-Live-Bildgebung des Drosophila-Beins während des Puppenstadiums vorgestellt, bei dem das Puparium vollständig entfernt wird. Dieses Protokoll kann auch auf andere Gewebe angewendet werden.
Zusammenfassung
In den letzten Jahrzehnten wurden erhebliche Fortschritte beim Verständnis der Mechanismen der Bestimmung des Zellschicksals erzielt. Der Prozess, durch den schicksalsbestimmte Zellen dreidimensionale Organismenformen bilden, bleibt jedoch unklar. Jüngste Fortschritte in der konfokalen Mikroskopie haben es ermöglicht, die Zelldynamik während der Entwicklung durch Live-Bildgebung zu beobachten. Die Puppe Drosophila melanogaster eignet sich aufgrund ihrer Unbeweglichkeit, der transparenten Puppenkutikula und der Verfügbarkeit fluoreszierender Reporterlinien ideal für die Live-Bildgebung. Eine größte Herausforderung für die Bildgebung ist das Puparium, die Kutikula um die Puppe, die die optische Bildgebung behindert. Während bei früheren Methoden das Puparium entweder teilweise oder vollständig entfernt wurde, blieb die Aufrechterhaltung der Puppenlebensfähigkeit über längere Zeiträume nach diesem Verfahren eine Herausforderung. Hier wird eine einfache Methode zur tagelangen Live-Bildgebung des Drosophila-Beins während des Puppenstadiums vorgestellt, bei der die Puppen vollständig entfernt werden. Die Methode beinhaltet das Entfernen der Puppe von einer Puppe, die auf doppelseitigem Klebeband befestigt ist, gefolgt von dem Zusammenbau einer kleinen Kammer auf einer Glasbodenschale, um die Puppe und einen Tropfen Wasser einzuschließen. Dieser Aufbau ist unkompliziert, zuverlässig und unterstützt ein längeres Überleben der Puppen, indem er Austrocknung verhindert. Die Langzeit-Live-Bildgebung der Drosophila-Puppe hat wesentlich dazu beigetragen, zu erfassen, wie das erwachsene Bein über 2-3 Tage dramatische dreidimensionale strukturelle Veränderungen erfährt. Zu diesen Veränderungen gehören die vorübergehende Bildung einer faszinierenden Struktur (der Parthenon-ähnlichen Struktur) durch Epithelzellen, eine schnelle Gewebeverengung, Gelenkbildung und Borstendehnung. Diese Methode ist auf die Beobachtung verschiedener Gewebe anwendbar und kann möglicherweise mit anderen Techniken, wie z.B. der optischen Geninduktion, kombiniert werden, um das Verständnis der Zelldynamik während der endgültigen Formbildung von Geweben im Puppenstadium zu verbessern.
Einleitung
Trotz der beträchtlichen Fortschritte der letzten Jahrzehnte bei der Aufklärung des Mechanismus der Bestimmung des Zellschicksals ist es immer noch unklar, wie schicksalsbestimmte Zellen dreidimensionale Organismenformen aufbauen. Dank der technologischen Verbesserungen in der konfokalen Mikroskopie haben die Versuche, die Zelldynamik während der Entwicklung durch Live-Bildgebung aufzudecken, in den letzten Jahren zugenommen 1,2. Die Puppe Drosophila melanogaster wurde für die Live-Bildgebung bevorzugt, da sie folgende Eigenschaften aufweist: Immobilität, Transparenz der Puppenkutikula und Verfügbarkeit von fluoreszierenden Reporterlinien 3,4,5. Das größte Hindernis für die Live-Bildgebung der Drosophila-Puppe ist das Puparium (Puppengehäuse), die deformierte und gebräunte letzte Kutikula der Larve, die die Puppe umgibt. Um eine optische Obstruktion zu vermeiden, wurde das Puparium bei den zuvor berichteten Methoden 1,2,3,4,5,6,7,8,9,10 teilweise oder vollständig entfernt. Die vollständige Entfernung des Pupariums maximiert den Beobachtungsbereich und die Anwendbarkeit auf verschiedene Gewebe. Die Puppe ohne ihr Puppe stirbt jedoch in der Regel innerhalb von etwa einem halben Tag ab, vermutlich aufgrund von Austrocknung. Daher ist die Aufrechterhaltung der Puppenfeuchtigkeit für eine erweiterte Lebendbildgebung von entscheidender Bedeutung. Während die genaue Dauer des Überlebens der Puppen nach vollständiger Entfernung der Puppen bei früheren Methoden unklar ist, dauerten die berichteten Beispiele typischerweise bis zu etwa 20 Stunden. Da das Puppenstadium etwa vier Tage dauert, sollte eine Methode zur noch längeren Live-Bildgebung dazu beitragen, den gesamten Prozess der Gewebeformbildung zu erfassen.
Das adulte Bein von Drosophila ist ein hervorragendes Modell für die Untersuchung des Prozesses der dreidimensionalen Gewebeformbildung. Sie leitet sich von den scheibenförmigen Primordien (Beinscheibe) ab, die sich im Larvenstadium bilden. Die Regionen, die den einzelnen Segmenten im adulten Bein entsprechen, werden durch das Präpuppenstadiumbestimmt 11. Dann ragt die Beinscheibe aus dem zentralen Teil heraus und bildet etwa 11 h nach der Pupariumbildung (APF) eine aufgeblähte röhrenförmige Struktur. Wie dieses Gewebe mit seiner einfachen Form in den folgenden Stadien seine endgültige Form des Erwachsenenbeins erreicht, blieb lange Zeit unklar. Mehrere Studien, die sich diesem Thema nähern, wurden veröffentlicht 12,13,14. Da sie fixiertes oder kultiviertes Gewebe beobachteten, konnten kontinuierliche Veränderungen in einzelnen Zellen nicht nachvollzogen werden, und die gewonnenen Informationen waren etwas fragmentiert. Um den Formungsprozess vollständig zu verstehen, ist es unerlässlich, die Veränderungen in einzelnen Zellen kontinuierlich durch Langzeit-Live-Bildgebung zu beobachten.
Eine aktuelle Studie enthüllte die dynamische Verformung dreidimensionaler Strukturen auf Gewebe- und zellulärer Ebene durch Langzeit-Live-Bildgebung (Abbildung 1). Das faszinierendste Ergebnis dieser Studie ist die vorübergehende Bildung einer unerwartet komplexen Struktur durch Epithelzellen. Diese Struktur, die als "Parthenon-ähnliche Struktur" bezeichnet wird, weist apikobasale Vorsprünge und basale netzartige Verbindungen von Epithelzellen auf. Wichtig ist, dass die Bildung und das Verschwinden dieser Struktur mit einer raschen Gewebeverengung zusammenfällt15. Die anschließende Formbildung, einschließlich der Fugenbildung und der Borstendehnung, dauerte 2-3 Tage. Die Langzeit-Live-Bildgebung erfasste effektiv die gesamte Geschichte dieser tagelangen aufeinanderfolgenden Ereignisse.
Dieser Artikel bietet eine Schritt-für-Schritt-Methode zur Durchführung einer tagelangen Live-Bildgebung des Drosophila-Beins während des Puppenstadiums mit vollständiger Entfernung des Pupariums. Die Methode ist einfach zu befolgen und kann auf verschiedene andere Gewebe angewendet werden.
Protokoll
Dieses Protokoll verwendet Drosophila melanogaster-Stämme , die fluoreszierende Reporterexprimieren 15. Die Einzelheiten zu den in der Studie verwendeten Reagenzien und Geräten sind in der Materialtabelle aufgeführt.
1. Zubereitung der Puppe
- Sammeln Sie mit einem Pinsel weiße Puppen des gewünschten Stammes von Drosophila melanogaster aus Fläschchen und geben Sie sie in Schalen oder leere Fläschchen (Abbildung 2A).
HINWEIS: In dieser Studie bezieht sich "weiße Puppen" auf das Stadium zwischen dem Zeitpunkt, an dem die Larve völlig unbeweglich wird, und dem Zeitpunkt, an dem die Puppe braun wird. Diese Phase dauert ca. 30 min bei 25 °C. - Inkubieren Sie weiße Puppen mindestens 14 Stunden lang bei 25 °C, bis sie sich zu dem zu beobachtenden Stadium entwickeln (Abbildung 2B).
HINWEIS: Die Puppe kann erst entfernt werden, nachdem die Puppenkutikula bei 12-13,5 h APF vollständig ausgebildet ist und erst nach 14 h APF leicht entfernt werden kann. - Wischen Sie den Kleber und das Fliegenfutter mit einem in destilliertem Wasser getränkten Pinsel von den Puppen ab.
HINWEIS: Die ventrale Seite des Pupariums sollte besonders sauber sein, um in späteren Schritten eine ausreichende Haftung auf dem doppelseitigen Klebeband zu erreichen. - Legen Sie die Puppen zum Trocknen einige Minuten lang auf Reinigungstücher.
HINWEIS: Verbleibende Feuchtigkeit auf dem Puparium würde eine gute Haftung auf einem doppelseitigen Klebeband verhindern. - Befestige ein Stück doppelseitiges Klebeband auf einem Objektträger.
- Legen Sie die getrockneten Puppen mit der Bauchseite nach unten auf ein doppelseitiges Klebeband (Abbildung 2C).
- Schieben Sie die Rückenseite der Puppen vorsichtig mit einem getrockneten Pinsel an, um eine bessere Haftung auf dem doppelseitigen Klebeband zu erreichen.
- Öffnen Sie unter einem Stereomikroskop vorsichtig das Operculum mit einer Pinzette (Abbildung 2 D,E).
HINWEIS: Das Operculum ist die anterodorsale Region des Puppens, aus der die adulte Fliege herauskommt und sich leicht öffnet. - Führen Sie vom Rand des geöffneten Operculums aus eine der Spitzen der Pinzette in den Raum zwischen der Puppe und dem Puppen ein (Abbildung 2F).
HINWEIS: Achten Sie darauf, die Puppenhaut nicht mit der Spitze der Pinzette zu beschädigen. - Fassen Sie das Puppe mit einer Pinzette und ziehen Sie es nach außen, bis es aufbricht.
- Heben Sie die abgerissenen Fragmente des Pupariums mit einer Pinzette an und kleben Sie sie auf doppelseitiges Klebeband (Abbildung 2G).
- Die Schritte 1.10-1.11 wiederholen, bis die Öffnung des Pupariums das hintere Ende erreicht, wobei ein kleiner Teil des Pupariums übrig bleibt (Abbildung 2 H,I).
HINWEIS: Wenn Flüssigkeit aus einer Puppe austrat, wäre sie beschädigt worden (Abbildung 2K). Um eine normale Entwicklung zu beobachten, vermeiden Sie es, geschädigte Puppen abzubilden.
2. Einrichtung der Bildgebung
- Geben Sie 1 μl destilliertes Wasser oder Silikonöl (bei Verwendung einer Silikon-Tauchlinse) auf den Boden einer Glasbodenschale.
- Tränken Sie einen Pinsel in dem destillierten Wasser und schöpfen Sie die Puppe vorsichtig auf (Abbildung 2J).
- Legen Sie die Puppe mit der Bauchseite nach unten auf das destillierte Wasser oder Silikonöl (Abbildung 2L).
- Geben Sie mit einer Mikropipette 10 μl des destillierten Wassers in die Nähe des Randes des Glasteils der Glasbodenschale (Abbildung 2L).
- Legen Sie mit einer Spritze einen Kreis aus Silikonfett um den Rand des Glasteils der Glasbodenschale (Abbildung 2M).
- Legen Sie ein Deckglas auf das Silikonfett, um es abzudichten (Abbildung 2M). Die Montage ist in Abbildung 2N dargestellt.
HINWEIS: Stellen Sie sicher, dass zwischen dem Deckglas und dem Silikonfett keine Lücken vorhanden sind.
3. Konfokale Bildgebung
- Schalten Sie ein inverses konfokales Lasermikroskop und eine Bildgebungssoftware ein.
- Stellen Sie die Schüssel auf den Tischakzeptor eines inversen Konfokalmikroskops.
- Finden Sie die Puppen mit einer Objektivlinse mit geringer Vergrößerung in der Hellfeldbeobachtung. Stellen Sie sicher, dass die Puppen kein Austreten der Körperflüssigkeit aufweisen.
- Zentrieren Sie den gewünschten Bereich der Puppe, um ihn in der Region of Interest (ROI) zu beobachten.
HINWEIS: Die anterolateralen Seiten der Fußwurzel im ersten und zweiten Bein und die ventrale Seite der Fußwurzel im dritten Bein sind zur ventralen Seite der Puppe ausgerichtet. So ist im ersten und zweiten Bein der Längsschnitt der Fußwurzel entlang der dorsoventralen Achse zu beobachten, während im dritten Bein der Längsschnitt entlang der anteroposterioren Achse zu beobachten ist. - Tauschen Sie das Objektiv gegen ein Objektiv für Live-Bilder aus.
HINWEIS: Wenn eine Wasserimmersionslinse verwendet wird, trocknet das Wasser zwischen der Linse und der Glasbodenschale während der Langzeitbeobachtung aus. Es wird eine Tauchlinse ohne Eintauchen oder Silikonöl empfohlen. - Passen Sie die Bedingungen für die gewünschte Beobachtung an und starten Sie die Datenerfassung.
HINWEIS: Um Schäden an der Puppe zu vermeiden, sollte die Laserleistung so gering sein, dass klare Bilder erhalten werden können. Die Minimierung des ROI und die Erhöhung der Schrittgröße sind hilfreich, um Zeit für die Z-Stack-Akquisition zu sparen. Die zukünftige Transformation des Gewebes sollte bei der Entscheidung über die Tiefe des Z-Stapels berücksichtigt werden. Bei der Beinbeobachtung bei 15-25 h APF wandert der dem Deckglas am nächsten gelegene Teil (laterales Epithel) schnell tiefer, da sich das Bein sehr stark verengt. In Anbetracht dieser Bewegung sollten extra tiefe Z-Stacks von Anfang an gesetzt werden. Ein Beispiel für die Einstellung des konfokalen Mikroskops für die Live-Bildgebung der Fußwurzelregion von 15-30 h APF ist in der Zusatzdatei 1 enthalten. Ein Fluoreszenzverblassen ist bei der Langzeit-Live-Bildgebung unvermeidlich. Um dieses Problem zu entschärfen, ist es ratsam, nur minimale Laserleistung zu verwenden. Für die Verarbeitung von Live-Bilddaten zur Kompensation von Fading-Effekten empfiehlt sich das ImageJ-Plugin "AutoEnhance"16 .
Ergebnisse
Hier wird ein Beispiel für eine 44-Stunden-Live-Bildgebung des sich entwickelnden adulten Drosophila-Beins im Puppenstadium beschrieben. Fliegen, die His2Av-mRFP17 (markierende Zellkerne) und sGMCA18 (GFP-markiertes Aktin-bindendes Protein Moesin, markierendes Aktin) exprimieren, wurden im weißen Puppenstadium gesammelt und für 15 Stunden bei 25 °C inkubiert. Das Puparium wurde entfernt und gemäß dem Protokoll montiert (Abbildung 2). Z-Stapel-Bilder des Tarsus und des Pretarsus in der Nähe der Beinspitze wurden erfolgreich alle 15 Minuten von 16 h bis 60 h APF bei Raumtemperatur (nicht streng, aber nahe 25 °C) aufgenommen. Die erste Hälfte der Bildserie ist in Abbildung 3 dargestellt, die zweite Hälfte in Abbildung 4 und der Film des Ganzen in Film 1. Als sich das Beingewebe schnell verengte, bildeten die Epithelzellen vorübergehend eine faszinierende Struktur, die Parthenon-ähnliche Struktur, die durch ihre apikobasalen Vorsprünge und basalen Verbindungen gekennzeichnet ist (Abbildung 3). Die Verringerung der Epitheldicke wurde auch nach fast vollständiger Fertigstellung der Kontur beobachtet (Abbildung 4). Der gesamte Prozess ist in Abbildung 1 dargestellt.
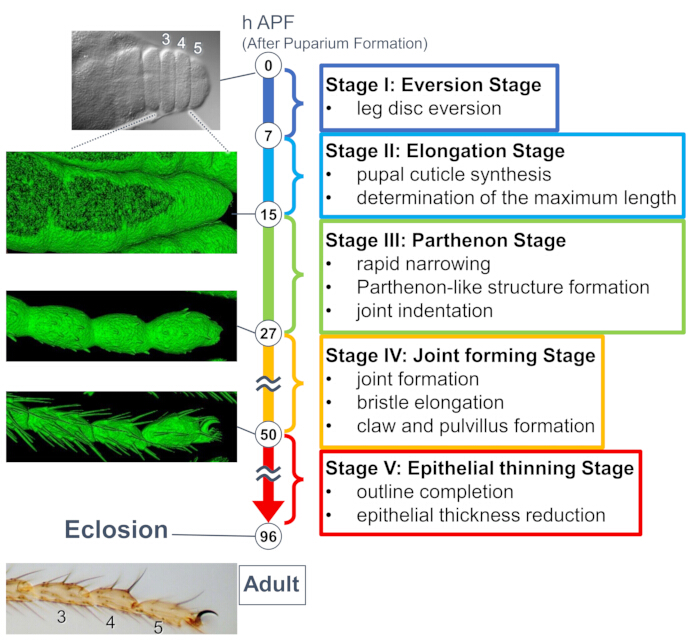
Abbildung 1: Die Übersicht über die endgültige Formbildung des adulten Tarsus der Drosophila während des Puppenstadiums. Der gesamte Prozess wurde in fünf Stufen unterteilt, basierend auf den morphologischen Veränderungen sowohl auf Gewebe- als auch auf zellulärer Ebene, die in Langzeit-Live-Imaging-Experimenten beobachtet wurden. Auf der linken Seite sind repräsentative Fotos oder oberflächengerenderte Bilder (sGMCA-Signal) dargestellt, die mehreren Zeitpunkten entsprechen. Kurze Beschreibungen der Ereignisse in jeder Phase finden Sie auf der rechten Seite. Diese Abbildung wurde von Hiraiwa et al.15 modifiziert. Siehe auch Film 1. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
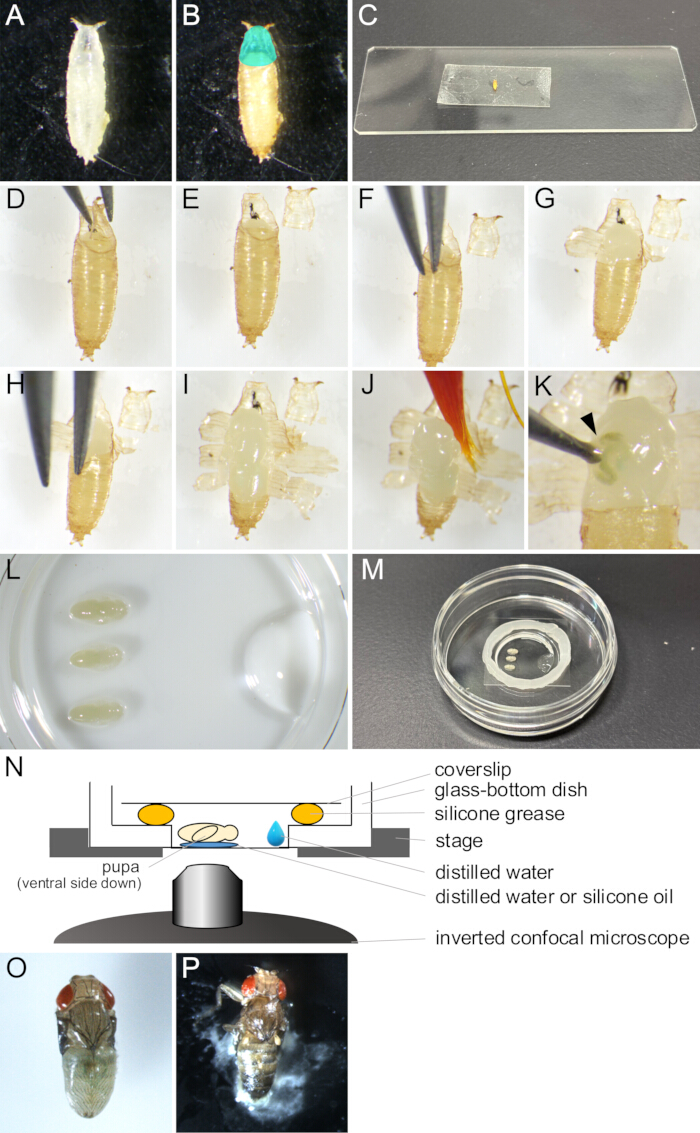
Abbildung 2: Puppenentfernung und Montage für die Live-Bildgebung. (A) Eine weiße Puppe, die in einer Schale gesammelt wurde. (B) Die Puppe wurde in (A) nach einer 15-stündigen Inkubation bei 25 °C gezeigt. Die cyanfarbene Region zeigt das Operculum an. (C) Ein Foto, das eine Puppe zeigt, die an einem Stück doppelseitigem Klebeband klebt. (D-J) Eine Reihe von Bildern, die das Verfahren zur Entfernung von Puppen zeigen. (D) Das Operculum wird mit einer Pinzette angehoben. (E) Das Operculum wird entfernt. (F) Eine Pinzettenspitze wird zwischen der Puppenkutikula und dem Puparium eingeführt. (G) Das Puparium ist teilweise geöffnet. (H) Eine Pinzettenspitze wird wieder eingeführt. (I) Das Puparium öffnete sich, so dass nur ein kleiner Teil des hinteren Endes übrig blieb. (J) Die Puppe wird mit einem Pinsel angehoben. (K) Ein Beispiel für das Austreten von Körperflüssigkeit aus der Puppe. Die Flüssigkeit, die aus der Wunde austritt und von einer Pinzettenspitze gestochen wird, wird durch eine Pfeilspitze angezeigt. (L-N) Bilder und Illustrationen, die die Montage der Halterung zeigen. (L) Ein Bild von oben, das Puppen und destilliertes Wasser auf dem Boden einer Glasbodenschale zeigt. (M) Die Schale nach Abschluss der Montage der Halterung. Silikonfett wurde entlang der Kante um den Glasteil aufgetragen und ein Deckglas auf das Fett gelegt, um es abzudichten. (N) Schematische Zeichnung der Montageanordnung der Drosophila-Puppe für die Langzeit-Live-Bildgebung. (O) Eine berittene Puppe entwickelte sich fast erwachsen. (P) Eine berittene Puppe, die sich löst. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
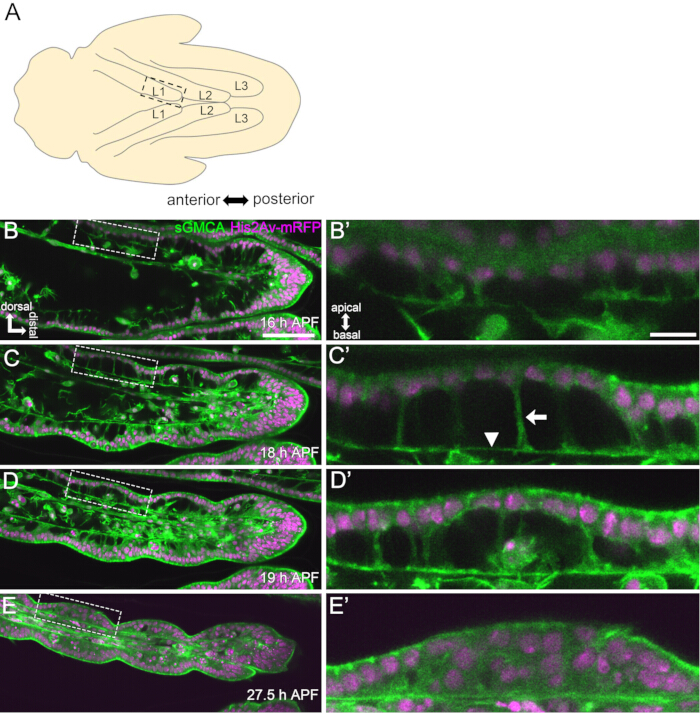
Abbildung 3: Dynamische Formänderungen in den Tarsalepithelzellen in 16-27,5 h APF. (A) Eine Illustration der Puppe von der ventralen Seite gesehen. Das gestrichelte Rechteck entspricht dem in (B-E) beobachteten Bereich. L1: erstes Bein, L2: zweites Bein, L3: drittes Bein. (B,C,D,E) Standbilder aus der Live-Bildgebung des distalen Teils der Fußwurzel in der sGMCA (grün) und His2Av-mRFP (magenta), die die Fliege exprimiert. Das Gewebe verengt sich rapide und die Einkerbung der Gelenkregionen schreitet voran. (B',C',D',E') Vergrößerung von Bereichen, die von den gestrichelten Linien in (B,C,D,E) umgeben sind. Der Pfeil und die Pfeilspitze in (C') zeigen ein Beispiel für apikobasale Projektionen bzw. die Position der basalen Verbindungen. Die Parthenon-ähnliche Struktur beginnt sich in (B') zu bilden, ist in (C') vollständig ausgebildet, beginnt in (D') zu verschwinden und wird in (E') schwer zu erkennen. Distal ist in allen Figuren rechts und dorsal nach oben. Die Stufen werden in den unteren rechten Ecken in (B,C,D,E) angezeigt. Maßstabsleisten: B,C,D,E: 50 μm; B',C',D',E': 10 μm. Diese Abbildung wurde von Hiraiwa et al.15 modifiziert. Siehe auch Film 1. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
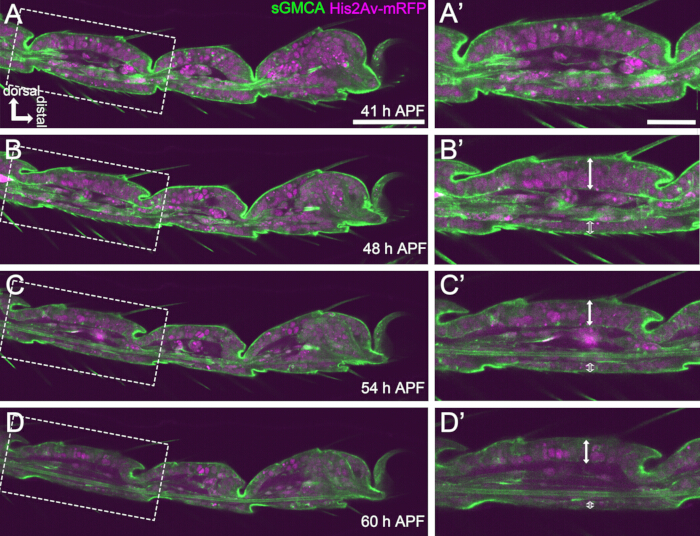
Abbildung 4: Formänderungen in der Epithelzellschicht des Tarsus in 41-60 h APF. (A,B,C,D) Standbilder aus demselben sequentiellen Datensatz der Live-Bildgebung wie in Abbildung 3. Gestrichelte Rechtecke in (A,B,C,D) werden in (A',B',C',D') vergrößert. Nach etwa 48 h APF (A-B') ist die äußere Formbildung, wie z. B. die Verlängerung von Borsten, Krallen und Pulvilli, fast abgeschlossen. Die Unterseite des invaginierten Gelenks bewegte sich proximal, und dann schritt die Bildung der Kugelgelenkstruktur nach etwa 54 h APF voran. Dabei wurde der morphologische Unterschied zwischen dem dorsalen und dem ventralen Epithel deutlich (Doppelpfeile und offene Doppelpfeile bei B',C',D'). Nach 54 h APF (C-D') nahm die Epithelschicht ihre Dicke ab, ohne den Umriss der Segmente kaum zu verändern. Dorsal ist bei allen Figuren nach oben und distal nach rechts. Maßstabsleisten: A,B,C,D: 50 μm; A',B',C',D': 20 μm.Diese Zahl wurde von Hiraiwa et al.15 zitiert. Siehe auch Film 1. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
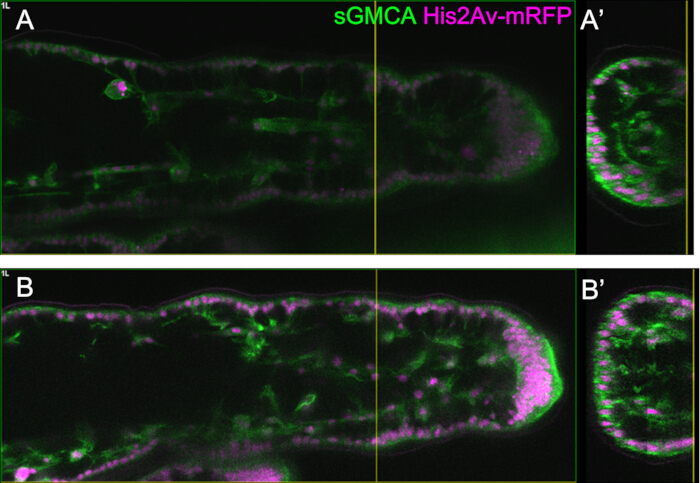
Abbildung 5: Ein Beispiel für die Beinbeobachtung mit der Funktion Bright Z. (A,B) Bilder der entsprechenden Region, Tiefe und des Stadiums des dritten Schenkels des sGMCA (grün) und His2Av-mRFP (magenta), die die Fliege exprimieren, mit (B) oder ohne (A) unter Verwendung der Bright Z-Funktion. (A) Eine XY-Ebene in 59,1 μm Tiefe, die aus der Beobachtung der Tarsalregion im dritten Bein bei 16 h APF extrahiert wurde und ohne Verwendung der Bright Z-Funktion aufgenommen wurde. (A') Die Schnittansicht entspricht der gelben vertikalen Linie in (A). Die senkrechte Linie in (A') zeigt die Brennebene von (A) an. (B) Eine XY-Ebene in einer Tiefe von 61,6 μm, die aus der Beobachtung der Tarsalregion im dritten Schenkel bei 16 h APF extrahiert wurde und mit der Bright Z-Funktion aufgenommen wurde. Sowohl die PMT-Spannung als auch die Laserleistung wurden angepasst. Die Sichtbarkeit des Bildes ist im Vergleich zu (A) verbessert. (B') Die Schnittansicht entspricht der gelben vertikalen Linie in (B). Die gelbe vertikale Linie in (B') zeigt die Brennebene von (B) an. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Ergänzende Datei 1: Ein Beispiel für die konfokale Mikroskopeinstellung für die Live-Bildgebung der Fußwurzelregion von 15-30 h APF. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Film 1: Langzeit-Live-Bildgebung des distalen Teils der Fußwurzel für 44 h. Es wurden die exprimierende Fliege sGMCA (grün) und His2Av-mRFP (magenta) verwendet. Die repräsentativste XY-Ebene wurde aus demselben Datensatz wie Abbildung 3 und Abbildung 4 extrahiert. Pfeilspitzen zeigen Beispiele für künftige gemeinsame Regionen. Sich schnell bewegende Zellen im Gewebe sind Makrophagen-ähnliche Zellen. Das stringartige Signal, das sich entlang der Tarsalsegmente erstreckt, ist ein Teil des Septums. Der Zeitstempel zeigt hh: mm. Distal ist nach rechts und dorsal nach oben. Dieser Film wurde von Hiraiwa et al.15Bitte klicken Sie hier, um diese Datei herunterzuladen.
Diskussion
In diesem Artikel wird ein detailliertes Protokoll für die Langzeit-Live-Bildgebung des Drosophila-Beins im Puppenstadium bereitgestellt. Die imaginale Scheibe des Beins ragt aus dem zentralen Teil heraus und bildet eine röhrenförmige Struktur, und dann erfolgt die endgültige Formbildung des adulten Beins im Puppenstadium in einer Weise, die bisher schwer fassbar war. Frühere Versuche, diesen Prozess zu beobachten, erfolgten hauptsächlich durch fixierte Färbung, Gewebekultur und Rasterelektronenmikroskop 12,13,14. Diese Methoden konnten keine kontinuierlichen Veränderungen in einzelnen Zellen verfolgen, und es wurden nur bruchstückhafte Informationen gewonnen. Mit der in dieser Studie beschriebenen Methode kann der endgültige Formbildungsprozess der Fußwurzelregion als tagelange sequentielle Live-Bildgebung mit einem konfokalen Mikroskop erfolgreich beobachtet und Veränderungen in einzelnen Zellen kontinuierlich verfolgt werden. Die faszinierende Zelldynamik, die durch diese Live-Bildgebung aufgedeckt wird, wurde im jüngsten Berichtausführlich beschrieben 15.
Für eine erfolgreiche Langzeit-Live-Bildgebung ist es entscheidend, die Lebensfähigkeit der Puppe zu erhalten und sicherzustellen, dass ihre Entwicklung nicht beeinträchtigt wird. Bei der hier beschriebenen Methode entwickelte sich die aus dem Puparium entnommene Puppe in vielen Fällen zum pharaten Erwachsenen und zum Erwachsenen (Abbildung 2O,P). Die Zeitpunkte morphologischer Veränderungen des sich entwickelnden Tarsus, die mit dieser Methode beobachtet wurden, stimmten mit früheren Berichtenüberein 12,13,14. Darüber hinaus zeigten die Epithelzellen Veränderungen wie die Dickenreduktion auch in 48-60 h APF (32-44 h nach dem Einbau) (Abbildung 4B'-D'). Diese Tatsachen deuten darauf hin, dass die Puppe intakt bleibt und während der Langzeit-Live-Bildgebung mit der hier beschriebenen Methode fast keine Störung oder Verzögerung in ihrer normalen Entwicklung erfährt. Bitte beachten Sie, dass die Lebensfähigkeit der aus dem Puparium entnommenen Puppe, die einer Live-Bildgebung unterzogen wird, abhängig vom Zeitpunkt der Puppenentfernung, der Handhabung während des Verfahrens, dem Ausmaß der Phototoxizität in der Bildgebung und den verwendeten Fliegenstämmen variieren kann.
Einer der entscheidenden Schritte, um die Unversehrtheit der Puppe und ihre Entwicklung zu gewährleisten, ist die Entfernung der Puppe, ohne die Puppe zu schädigen. Eine stabile Haftung der Puppe auf dem doppelseitigen Klebeband und ein sorgfältiger Umgang mit der Pinzette sind der Schlüssel zum Erfolg. Die Verhinderung des Austrocknens der Puppe ist ebenfalls von entscheidender Bedeutung. In diesem Zusammenhang ist es entscheidend, Lücken zwischen Deckglas und Silikonfett zu vermeiden.
Um eine Austrocknung der Puppe zu vermeiden, wurde bei vielen früheren Methoden das Puparium 1,2,3,4,5,6,7 teilweise entfernt. Für die Betrachtung der gesamten Puppe wird jedoch die vollständige Entfernung der Puppe favorisiert. Obwohl die maximale Überlebenszeit der Puppe nicht bekannt ist, wurden mehrere Methoden, bei denen das Puppenhaar vollständig entfernt wird, berichtet 8,9,10. Der gebräuchlichste Ansatz, um die Puppe bei diesen Methoden mit Feuchtigkeit zu versorgen, ist die Verwendung von angefeuchtetem Filterpapier. Im Vergleich zu den vorherigen Methoden sorgt die hier beschriebene Methode für Feuchtigkeit, indem sie einen Tropfen Wasser auf immer einfachere Weise eingibt. Darüber hinaus beinhalten viele frühere Methoden die Montage der Puppe auf einem Glasobjektträger. Wenn Sie die aus dem Puparium entfernte Puppe auf einen Objektträger montieren, kann es zu einem Problem kommen, bei dem das Drücken des Deckglases gegen die Puppe Stress für die Puppe verursacht, oder ein gekipptes Deckglas führt zu Rauschen, Verzerrungen und Unschärfe in den Bildern. Bei der hier beschriebenen Methode wird eine Glasbodenschale verwendet, die es überflüssig macht, das Deckglas gegen die Puppe zu drücken, so dass das Gewebe so nah wie möglich an seinem natürlichen Zustand betrachtet werden kann. Da der Winkel des Deckglases nicht angepasst werden muss, ist das Setup stabil, einfach zu handhaben und zuverlässiger. Daher erfordert diese Methode fast keine speziellen Fähigkeiten, so dass auch Anfänger erfolgreich Live-Imaging durchführen können.
Die Haupteinschränkungen dieser Methode sind die Tiefe der Beobachtungen und die zeitliche Auflösung. Unter den Bedingungen für die Beobachtung des Tarsus können nur bis zu einer Tiefe von etwa 40 μm klare Bilder aufgenommen werden. Die Verwendung der Bright Z-Funktion hilft, dieses Problem zu lösen. Wie in Abbildung 5 gezeigt, verbesserte beispielsweise die Erhöhung der Laserleistung und der PMT-Spannung mit zunehmender Tiefe durch den Einsatz der Funktion "Helles Z" die Bildqualität in tieferen Positionen. Die Erhöhung der Laserleistung ist jedoch mit einem Kompromiss verbunden, der mit Phototoxizität und Signalverblassung verbunden ist. Daher ist es notwendig, die optimalen Bedingungen zu finden, die mit dem Zweck der Beobachtung übereinstimmen. Die Zeitauflösung spielt auch bei der Beobachtung von sich schnell bewegenden Zellen und Geweben eine Rolle. Die Reduzierung von Slices und die Verringerung des ROI sind die führenden Lösungen für dieses Problem. Die Verwendung moderner Geräte mit verbesserter Detektorempfindlichkeit oder eines konfokalen Spinning-Disk-Mikroskops kann die Zeitauflösung verbessern. Eine weitere Einschränkung bezieht sich auf das Stadium der Puppe. Die Puppe kann erst nach vollständiger Bildung der Puppenkutikula bei 12-13,5 h APF19entfernt werden und kann erst nach 14 h APF leicht entfernt werden. Die früheren Stadien als 12 h APF können teilweise beobachtet werden, indem die Puppe montiert wird, ohne das Puppe15 zu entfernen, obwohl es aufgrund der schnellen Gewebebewegungen und optischen Hindernisse durch das Puppe in diesem Zustand schwierig ist, klare Bilder zu erhalten.
Fehlerbehebung
Schwierigkeiten bei der Entfernung von Puppen
Bei der Entnahme des Pupariums ist die Haftung der ventralen Seite des Pupariums auf dem doppelseitigen Tape wichtig. Klebstoff und Lebensmittel müssen von der Oberfläche des Pupariums entfernt werden, und das anschließende Trocknen ist wichtig, da nasse Oberflächen eine gute Haftung verhindern. Bemerkenswert ist, dass das doppelseitige Klebeband im Materialtisch eine stärkere Haftung auf der Innenseite aufweist. Die innere (stärkere) Seite sollte zum Aufkleben der Puppe verwendet werden. Das Puparium mit einer Präparierschere zu schneiden, anstatt es mit einer Pinzette zu zerreißen, ist hilfreich, wenn die Pupariumentfernung schwierig ist.
Flüssigkeitsaustritt aus der Puppe
Es ist wichtig, das Puparium zu entfernen, ohne die Puppe zu beschädigen. Das Austreten der Puppenkörperflüssigkeit deutet auf eine Schädigung der Puppe hin (Abbildung 2K). Solche Puppen sollten bei der Live-Bildgebung vermieden werden. Um Puppenschäden beim Entfernen der Puppe zu vermeiden, empfiehlt sich neben einer vorsichtigen Handhabung auch die Verwendung einer Pinzette mit relativ breiten Spitzen.
Schlechte Bildqualität
Wenn das Fluoreszenzsignal zu schwach ist, gibt es viele Möglichkeiten, die Helligkeit anzupassen, z. B. die PMT-Spannung zu erhöhen, die Lochblende (C.A.) zu öffnen, die Scangeschwindigkeit zu verlangsamen und die Laserleistung zu erhöhen. Bitte beachten Sie, dass jede Methode Nebenwirkungen hat: Eine Erhöhung der PMT-Spannung kann das Rauschen erhöhen, das Öffnen der Lochblende verringert die Auflösung der Z-Achse, eine Verlangsamung der Scangeschwindigkeit verlängert die Scanzeit und eine Erhöhung der Laserleistung erhöht das Risiko von Phototoxizität und Bleichen. Geeignete Einstellungen müssen in Abhängigkeit von der Region of Interest, der Art und dem Expressionsniveau der Fluoreszenzreporter und der gewünschten Länge der Live-Bildgebung gefunden werden. Insgesamt wird empfohlen, die Laserleistung für die Langzeit-Live-Bildgebung zu minimieren.
Verblassen der Fluoreszenz
Das Verblassen der Fluoreszenz ist in der Langzeit-Live-Bildgebung unvermeidlich. Es wird empfohlen, die Laserleistung nur minimal zu verwenden, um dieses Problem zu vermeiden. Um das Fading zu kompensieren, empfiehlt sich bei der Verarbeitung der erfassten Live-Bilddaten das ImageJ-Plugin "AutoEnhance"16 .
Dank der vollständigen Entfernung des Pupariums ist diese Methode sehr gut auf andere Gewebe anwendbar, indem einfach der ROI und die Ausrichtung der Puppe geändert werden. Obwohl es sich nicht um Live-Bildgebung handelt, wurden bei Hiraiwa et al. der proximale Teil des Beins, der Rüssel, das Kopfepithel in der Nähe der Antenne und das Epithel des dorsalen Thorax mit dieser Methode beobachtet. Eine solche Anwendbarkeit auf ein breites Spektrum von Geweben kann die weitere Integration mit anderen Techniken, wie z. B. der optischen Induktion von Genen, erleichtern. Diese Methode kann auch auf andere cyclorrhaphanische (Puparium-bildende) Arten als Drosophila angewendet werden. Darüber hinaus könnte es möglicherweise auch für andere Insektenarten verwendet werden, wenn diese eine durchsichtige Puppenkutikula haben. Dieser Artikel enthält detaillierte Anweisungen für Drosophila-Forscher , um Live-Bildgebung der Puppe durchzuführen, um die Zelldynamik in lebendem Gewebe zu erfassen.
Offenlegungen
Die Autoren erklären, dass keine konkurrierenden Interessen bestehen.
Danksagungen
Wir danken Dr. Masayuki Miura (Universität Tokio) und Dr. Yuya Fujisawa (Universität Tokio) für ihre technische Beratung, und wir danken dem Bloomington Stock Center für die Fliegenressourcen.
Materialien
| Name | Company | Catalog Number | Comments |
| 35 mm/glass base dish | IWAKI | 3911-035 | |
| Cleaning wipes | NIPPON PAPER CRECIA | S-200 | |
| Dumont #3c Forceps | Fine Science Tools | 11231-20 | |
| Dumont #5SF | Fine Science Tools | 11252-00 | |
| Eppendorf Research plus 2-20 µL | Eppendorf | 3123000098 | |
| Fly strain: His2Av-mRFP, sGMCA | Bloomington Drosophila Stock Center | 59023 | |
| FV3000 | EVIDENT | inverted confocal microscope | |
| FV31S-SW | EVIDENT | software for FV3000 | |
| G40L | Shin-Etsu Silicone | silicone grease | |
| Micro Cover Glass 18 x 18 mm 0.13-0.17 mm | MATSUNAMI | C018181 | |
| Micro Slide Glass 76 x 26 mm 0.9-1.2 mm | MATSUNAMI | S7213 | |
| NEO-SABLE Size 0 round, fine | Pentel | XZBNR-0 | paintbrush |
| SIL300CS-30CC | EVIDENT | silicone oil | |
| Stereomicroscope System SZX7 | EVIDENT | ||
| Terumo syringe 50 mL | Terumo | SS-50ESZ | |
| Transparent double sided tape | Scotch | 665-1-12 | Since the inner layer has stronger adhesion than the outer layer, the inner layer should be used to fix pupae. |
| UPLSAPO10x | EVIDENT | ||
| UPLSAPO40XS | EVIDENT | silicone immersion lens | |
| Vannas Spring Scissors - 2.5mm Cutting Edge | Fine Science Tools | 15000-08 | optional |
Referenzen
- Koto, A., Kuranaga, E., Miura, M. Temporal regulation of Drosophila IAP1 determines caspase functions in sensory organ development. J Cell Biol. 187 (2), 219-231 (2009).
- Ninov, N., Martín-Blanco, E. Live imaging of epidermal morphogenesis during the development of the adult abdominal epidermis of Drosophila. Nat Protoc. 2 (12), 3074-3080 (2007).
- Chiba, M., et al. Activatable photosensitizer for targeted ablation of lacZ-positive cells with single-cell resolution. ACS Cent Sci. 5 (11), 1676-1681 (2019).
- Umetsu, D., et al. Local increases in mechanical tension shape compartment boundaries by biasing cell intercalations. Curr Biol. 24 (16), 1798-1805 (2014).
- Tran, N. V., et al. Programmed disassembly of a microtubule-based membrane protrusion network coordinates 3D epithelial morphogenesis in Drosophila. EMBO J. 43 (6), 568-594 (2024).
- Hellerman, M. B., Choe, R. H., Johnson, R. I. Live-imaging of the Drosophila pupal eye. J Vis Exp. (95), e52120 (2015).
- O'Connor, J. T., Shannon, E. K., Hutson, M. S., Page-McCaw, A. Mounting Drosophila pupae for laser ablation and live imaging of the dorsal thorax. STAR Protoc. 3 (2), 101396 (2022).
- Ziserman, D., Roegiers, F. Live-cell imaging of sensory organ precursor cells in intact Drosophila pupae. J Vis Exp. (51), e2706 (2011).
- Tögel, M., Pass, G., Paululat, A. In vivo imaging of Drosophila wing heart development during pupal stages. Int J Dev Biol. 57 (1-2), 13-24 (2013).
- Weavers, H., Franz, A., Wood, W., Martin, P. Long-term in vivo tracking of inflammatory cell dynamics within Drosophila pupae. J Vis Exp. (136), e57871 (2018).
- Kojima, T. Developmental mechanism of the tarsus in insect legs. Curr Opin Insect Sci. 19, 36-42 (2017).
- Mirth, C., Akam, M. Joint development in the Drosophila leg: Cell movements and cell populations. Dev Biol. 246 (2), 391-406 (2002).
- Mirth, C. Ecdysteroid control of metamorphosis in the differentiating adult leg structures of Drosophila melanogaster. Dev Biol. 278 (1), 163-174 (2005).
- Tajiri, R., Misaki, K., Yonemura, S., Hayashi, S. Dynamic shape changes of ECM-producing cells drive morphogenesis of ball-and-socket joints in the fly leg. Development. 137 (12), 2055-2063 (2010).
- Hiraiwa, S., et al. Unveiling the cell dynamics during the final shape formation of the tarsus in Drosophila adult leg by live imaging. Dev Genes Evol. , (2024).
- . ImageJ plugin page Available from: https://signaling.riken.jp/en/en-tools/imagej/629/ (2024)
- Pandey, R., Heidmann, S., Lehner, C. F. Epithelial re-organization and dynamics of progression through mitosis in Drosophila separase complex mutants. J Cell Sci. 118 (4), 733-742 (2005).
- Kiehart, D. P., Galbraith, C. G., Edwards, K. A., Rickoll, W. L., Montague, R. A. Multiple forces contribute to cell sheet morphogenesis for dorsal closure in Drosophila. J Cell Biol. 149 (2), 471-490 (2000).
- Ashburner, M. . Drosophila: A Laboratory Handbook. , (1989).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten