Method Article
הדמיה חיה לטווח ארוך של התפתחות רגל גולם דרוזופילה לאחר הסרת פופריום
In This Article
Summary
כאן, מוצג פרוטוקול להדמיה חיה ארוכת טווח של רגל הדרוזופילה בשלב הגולם, הכולל הסרה מלאה של הגולם. ניתן ליישם פרוטוקול זה גם על רקמות אחרות.
Abstract
במהלך העשורים האחרונים חלה התקדמות משמעותית בהבנת המנגנונים לקביעת גורל התא. עם זאת, התהליך שבו תאים שנקבעו על ידי הגורל יוצרים צורות אורגניזמיות תלת-ממדיות נותר לא ברור. ההתקדמות האחרונה במיקרוסקופיה קונפוקלית אפשרה את המאמצים להתבונן בדינמיקה של התאים במהלך ההתפתחות באמצעות הדמיה חיה. גולם הגולם Drosophila melanogaster אידיאלי להדמיה חיה בשל חוסר התנועה שלו, ציפורן הגולם השקופה והזמינות של קווי דיווח פלואורסצנטיים. אתגר עיקרי להדמיה הוא הגולם, הקוטיקולה המקיפה את הגולם, החוסמת את ההדמיה האופטית. בעוד ששיטות קודמות כללו הסרה חלקית או מלאה של הגולם, שמירה על כדאיות הגולם לתקופות ממושכות לאחר הליך זה נותרה מאתגרת. כאן, מוצגת שיטה פשוטה להדמיה חיה של ימים ארוכים של רגל הדרוזופילה בשלב הגולם, הכוללת הסרה מלאה של הגולם. השיטה כוללת הוצאת הגולם מגולם המודבק לסרט דו צדדי, ולאחר מכן הרכבת תא קטן על צלחת עם תחתית זכוכית כדי לסגור את הגולם וטיפת מים. הגדרה זו פשוטה, אמינה ותומכת בהישרדות ממושכת של הגולם על ידי מניעת התייבשות. הדמיה חיה ארוכת טווח של גולם הדרוזופילה תרמה באופן משמעותי ללכידת האופן שבו הרגל הבוגרת עוברת שינויים מבניים תלת מימדיים דרמטיים במשך 2-3 ימים. שינויים אלה כוללים היווצרות חולפת של מבנה מסקרן (המבנה דמוי הפרתנון) על ידי תאי אפיתל, היצרות מהירה של רקמות, היווצרות מפרקים והתארכות זיפים. שיטה זו ישימה לתצפית על רקמות שונות וניתן לשלב אותה עם טכניקות אחרות, כגון אינדוקציה גנטית אופטית, כדי לקדם את ההבנה של דינמיקת התא במהלך היווצרות הצורה הסופית של רקמות בשלב הגולם.
Introduction
למרות ההתקדמות הניכרת בעשורים האחרונים בהבהרת המנגנון של קביעת גורל התא, האופן שבו תאים שנקבעו על ידי גורל בונים צורות אורגניזמים תלת-ממדיות עדיין חמקמק. הודות לשיפורים הטכנולוגיים במיקרוסקופיה קונפוקלית, הניסיונות לחשוף את הדינמיקה של התא במהלך הפיתוח באמצעות הדמיה חיה הולכים וגוברים בשנים האחרונות 1,2. הגולם Drosophila melanogaster מועדף להדמיה חיה בגלל התכונות המתאימות שלו: חוסר תנועה, שקיפות של ציפורן הגולם וזמינות של קווי דיווח פלואורסצנטיים 3,4,5. המכשול הגדול ביותר לביצוע הדמיה חיה של גולם הדרוזופילה הוא הגולם, ציפורן הזחל הסופית המעוותת והשזופה המקיפה את הגולם. כדי למנוע חסימה אופטית, הגולם הוסר באופן חלקי או מלא בשיטות שדווחו בעבר 1,2,3,4,5,6,7,8,9,10. הסרה מוחלטת של הגולם ממקסמת את אזור התצפית ואת התחולה על רקמות שונות. עם זאת, הגולם ללא הגולם שלו מת בדרך כלל תוך כחצי יום, ככל הנראה עקב התייבשות. לכן, שמירה על לחות הגולם היא חיונית להדמיה חיה ממושכת. בעוד שמשך הזמן המדויק של הישרדות הגולם לאחר הסרה מלאה של הגולם בשיטות קודמות אינו ברור, דוגמאות מדווחות נמשכו בדרך כלל עד כ-20 שעות. מכיוון ששלב הגולם נמשך כארבעה ימים, שיטה להדמיה חיה ארוכה עוד יותר הייתה צפויה לתרום ללכידת כל תהליך היווצרות צורת הרקמה.
הרגל הבוגרת של דרוזופילה היא מודל מצוין לחקר תהליך היווצרות צורת רקמה תלת מימדית. זה נובע מהפרימורדיה בצורת דיסק (דיסק רגל) שנוצר בשלבי הזחל. האזורים המתאימים לכל קטע ברגל הבוגרת נקבעים על ידי שלב11 הקדם-גולמי. לאחר מכן, דיסק הרגליים בולט מהחלק המרכזי כדי ליצור מבנה צינורי נפוח כ-11 שעות לאחר היווצרות הגולם (APF). כיצד רקמה זו, בצורתה הפשוטה, משיגה את צורתה הסופית של הרגל הבוגרת בשלבים הבאים נותרה לא ברורה במשך זמן רב. מספר מחקרים הניגשים לנושא זה פורסמו 12,13,14. מכיוון שהם צפו ברקמות קבועות או מתורבתות, לא ניתן היה לעקוב אחר שינויים מתמשכים בתאים בודדים, והמידע שהתקבל היה מקוטע במקצת. כדי להבין את תהליך העיצוב במלואו, חיוני להתבונן בשינויים בתאים בודדים באופן רציף באמצעות הדמיה חיה ארוכת טווח.
מחקר שנערך לאחרונה חשף את העיוות הדינמי של מבנים תלת מימדיים ברמות הרקמה והתאים על ידי הדמיה חיה לטווח ארוך (איור 1). הממצא המסקרן ביותר במחקר זה הוא היווצרות חולפת של מבנה מורכב באופן בלתי צפוי על ידי תאי אפיתל. מבנה זה, המכונה "מבנה דמוי פרתנון", כולל הקרנות אפיקובזאליות וקשרים דמויי רשת בסיסית של תאי אפיתל. חשוב לציין, היווצרות והיעלמות של מבנה זה חופפות להיצרות מהירה של רקמות15. היווצרות הצורה שלאחר מכן, כולל היווצרות מפרקים והתארכות זיפים, נמשכה 2-3 ימים. הדמיה חיה לטווח ארוך לכדה ביעילות את כל הסיפור של האירועים הרצופים הללו.
מאמר זה מספק שיטה שלב אחר שלב לביצוע הדמיה חיה של רגל הדרוזופילה במשך ימים שלמים בשלב הגולם עם הסרה מלאה של הגולם. השיטה קלה לביצוע וניתן ליישם אותה על רקמות שונות אחרות.
Protocol
פרוטוקול זה משתמש בזני Drosophila melanogaster המבטאים מדווחים פלואורסצנטיים15. פרטי הריאגנטים והציוד ששימשו במחקר מפורטים בטבלת החומרים.
1. הכנת הגולם
- בעזרת מכחול, אספו גלמים לבנים של הזן הרצוי של Drosophila melanogaster מבקבוקונים והכניסו אותם לצלחות או לבקבוקונים ריקים (איור 2A).
הערה: במחקר זה, "גלמים לבנים" מתייחסים לשלב שבין הרגע שבו הזחל הופך לחסר תנועה לחלוטין ולפני שהגולם משחים. שלב זה נמשך כ-30 דקות ב-25 מעלות צלזיוס. - דגרו על גלמים לבנים במשך 14 שעות לפחות בטמפרטורה של 25 מעלות צלזיוס עד שהם מתפתחים לשלב שצריך לצפות בו (איור 2B).
הערה: ניתן להסיר את הגולם רק לאחר שציפורן הגולם נוצרה במלואה ב-12-13.5 שעות APF ולהסיר אותה בקלות רק לאחר 14 שעות APF. - נגב את הדבק והעיף אוכל הרחק מהגולם בעזרת מכחול ספוג במים מזוקקים.
הערה: הצד הגחוני של הגולם צריך להיות נקי במיוחד כדי להשיג הידבקות מספקת לסרט הדו-צדדי בשלבים מאוחרים יותר. - הניחו את הגלמים על מגבוני ניקוי למשך מספר דקות לייבוש.
הערה: הלחות שנותרה על הגולם תמנע הידבקות טובה לסרט דו צדדי. - תקן חתיכת סרט דו צדדי על מגלשת זכוכית.
- הניחו את הגלמים המיובשים על סרט דו-צדדי כשצד הגחון כלפי מטה (איור 2C).
- דחפו בעדינות את הצד הגבי של הגלמים בעזרת מברשת צבע מיובשת כדי להשיג הידבקות טובה יותר לסרט הדו-צדדי.
- תחת מיקרוסקופ סטריאו, פתחו בזהירות את האופרקולום עם זוג מלקחיים (איור 2 D,E).
הערה: האופרקולום הוא האזור האנטרודורסלי של הגולם שממנו יוצא הזבוב הבוגר, ובכך נפתח בקלות. - מקצה האופרקולום הפתוח, הכניסו את אחד מקצות המלקחיים לתוך החלל שבין הגולם לגולם (איור 2F).
הערה: היזהר לא לפגוע בציפורן הגולם עם קצה המלקחיים. - אחוז בגולם בעזרת מלקחיים ומשוך אותו החוצה עד שהוא נפתח.
- הרם את השברים הקרועים של הגולם בעזרת מלקחיים והדביק אותם לסרט דו צדדי (איור 2G).
- חזור על שלבים 1.10-1.11 עד שפתח הגולם מגיע לקצה האחורי, ומשאיר חלק קטן מהגולם (איור 2 H,I).
הערה: אם נוזל היה יוצא מגולם, הוא היה ניזוק (איור 2K). כדי לצפות בהתפתחות תקינה, הימנע מהדמיית גלמים פגומים.
2. הגדרת הדמיה
- שים 1 מיקרוליטר מים מזוקקים או שמן סיליקון (בעת שימוש בעדשת טבילה מסיליקון) בתחתית צלחת עם תחתית זכוכית.
- השרו מכחול במים המזוקקים וגרפו בעדינות את הגולם (איור 2J).
- הניחו את הגולם כשהצד הגחוני כלפי מטה על המים המזוקקים או שמן הסיליקון (איור 2L).
- בעזרת מיקרופיפטה, הניחו 10 מיקרוליטר מהמים המזוקקים ליד קצה חלק הזכוכית של צלחת הזכוכית התחתונה (איור 2L).
- הניחו עיגול של שומן סיליקון עם מזרק סביב קצה חלק הזכוכית של צלחת תחתית הזכוכית (איור 2M).
- שים כיסוי על שומן הסיליקון כדי לאטום אותו (איור 2M). ההרכבה מודגמת באיור 2N.
הערה: ודא שאין רווחים בין הכיסוי לשומן הסיליקון.
3. הדמיה קונפוקלית
- הפעל מיקרוסקופ לייזר קונפוקלי הפוך ותוכנת הדמיה.
- הניחו את המנה על הבמה המקבל של מיקרוסקופ קונפוקלי הפוך.
- מצא את הגלמים עם עדשת אובייקט בהגדלה נמוכה בתצפית השדה הבהיר. ודא שהגלמים אינם מראים דליפה של נוזל הגוף.
- מרכז את האזור הרצוי של הגולם לצפייה באזור העניין (ROI).
הערה: הצד האנטרולטרלי של הטרסוס ברגל הראשונה והשנייה, והצד הגחוני של הטרסוס ברגל השלישית, מכוונים לכיוון הצד הגחוני של הגולם. לכן ניתן לראות את החלק האורכי של הטרסוס לאורך הציר האחורי ברגל הראשונה והשנייה, ואילו ברגל השלישית ניתן לראות את אלה לאורך הציר האנטרופוסטריורי. - שנה את עדשת האובייקט לזו להדמיה חיה.
הערה: אם נעשה שימוש בעדשת טבילה במים, המים בין העדשה לצלחת תחתית הזכוכית יתייבשו במהלך התצפית ארוכת הטווח. מומלץ להשתמש בעדשה ללא טבילה או טבילה בשמן סיליקון. - התאם את התנאים לתצפית הרצויה והתחל ברכישת נתונים.
הערה: כדי למנוע כל נזק לגולם, עוצמות הלייזר צריכות להיות מינימליות ככל שניתן להשיג תמונות ברורות. מזעור החזר ההשקעה והגדלת גודל הצעד מועילים בחיסכון בזמן לרכישת Z stack. יש לקחת בחשבון את השינוי העתידי של הרקמה כאשר מחליטים על עומק ערימת Z. במקרה של תצפית רגליים ב-15-25 שעות APF, מכיוון שהרגל מצטמצמת מאוד, החלק הקרוב ביותר לכיסוי (אפיתל לרוחב) נע במהירות עמוק יותר. בהתחשב בתנועה זו, יש להגדיר ערימות Z עמוקות במיוחד מהראשונה. דוגמה להגדרת המיקרוסקופ הקונפוקלי להדמיה חיה של אזור טרסל הרגל בין 15-30 שעות APF מסופקת בקובץ משלים 1. דהיית הקרינה היא בלתי נמנעת במהלך הדמיה חיה לטווח ארוך. כדי להקל על בעיה זו, רצוי להשתמש בכוח לייזר מינימלי. התוסף ImageJ "AutoEnhance"16 מומלץ לעיבוד נתוני הדמיה בזמן אמת כדי לפצות על אפקטים של דהייה.
תוצאות
כאן, מתוארת דוגמה להדמיה חיה של 44 שעות של הרגל הבוגרת המתפתחת של דרוזופילה בשלב הגולם. זבובים המבטאים His2Av-mRFP17 (גרעיני תיוג) ו-sGMCA18 (חלבון קושר אקטין מתויג GFP מוזין, תיוג אקטין) נאספו בשלב הגולם הלבן והודגרו במשך 15 שעות ב-25 מעלות צלזיוס. הגולם הוסר והורכב בהתאם לפרוטוקול (איור 2). תמונות מחסנית Z של הטרסוס והפרטרסוס, ליד קצה הרגל, התקבלו בהצלחה כל 15 דקות מ-16 שעות עד 60 שעות APF בטמפרטורת החדר (לא מחמיר, אבל קרוב ל-25 מעלות צלזיוס). המחצית הראשונה של סדרת התמונות מוצגת באיור 3, החצי השני באיור 4, והסרט כולו בסרט 1. כאשר רקמת הרגליים הצטמצמה במהירות, תאי האפיתל יצרו באופן ארעי מבנה מסקרן, המבנה דמוי הפרתנון, המאופיין על ידי הקרנות אפיקובזאליות וחיבורים בסיסיים (איור 3). הקטנת עובי האפיתל נצפתה גם לאחר שהמתאר כמעט הושלם (איור 4). התהליך כולו נסקר באיור 1.
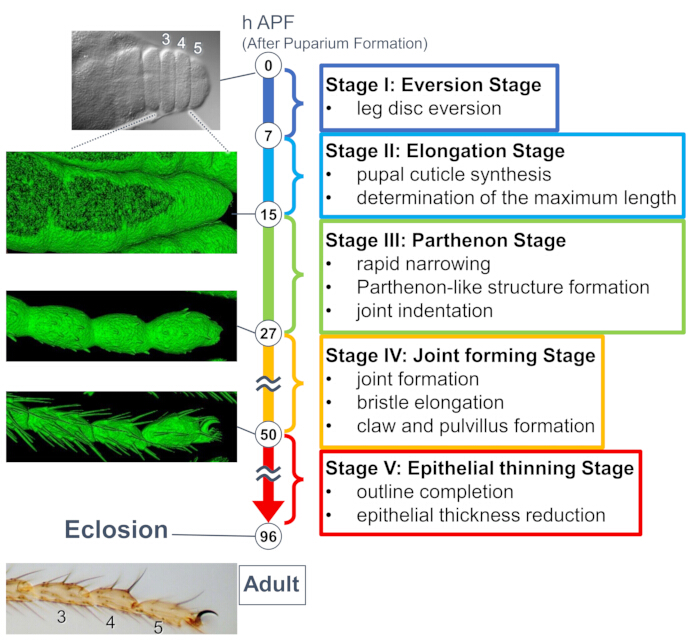
איור 1: סקירה כללית של היווצרות הצורה הסופית של הטרסוס הבוגר Drosophila במהלך שלב הגולם. התהליך כולו חולק לחמישה שלבים בהתבסס על השינויים המורפולוגיים הן ברמת הרקמה והן ברמת התא שנצפו בניסויי הדמיה חיים ארוכי טווח. תמונות מייצגות או תמונות מעובדות על פני השטח (אות sGMCA) המתאימות למספר נקודות זמן מוצגות בצד שמאל. תיאורים קצרים של האירועים בכל שלב כתובים בצד ימין. נתון זה שונה מ-Hiraiwa et al.15. ראה גם סרט 1. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
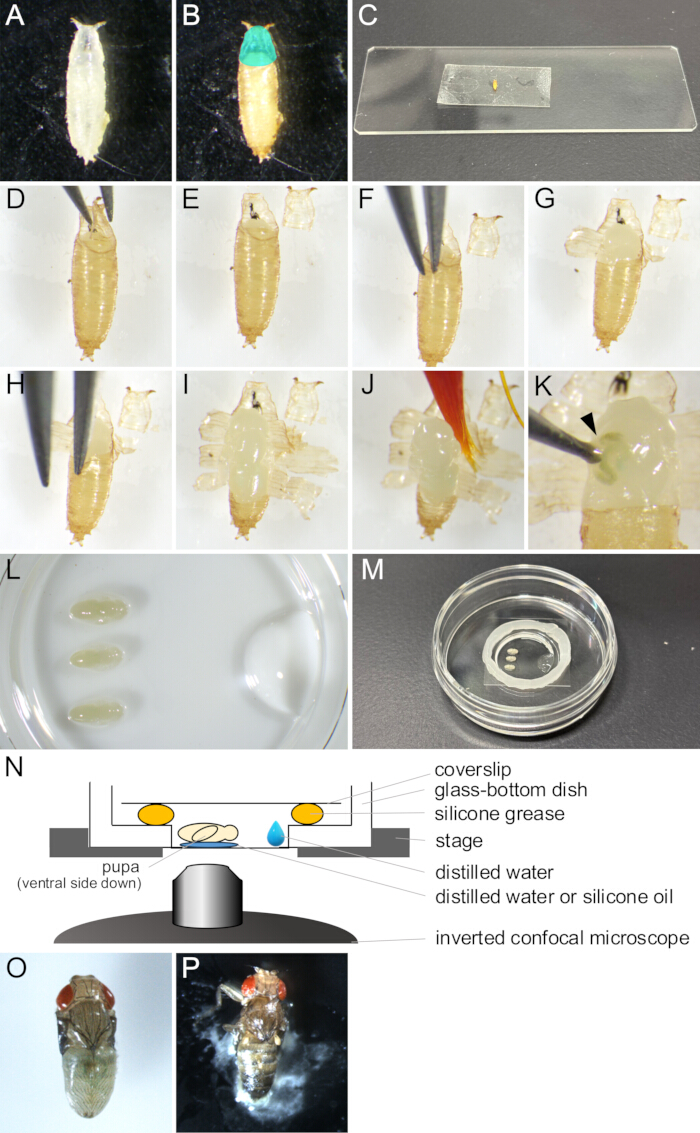
איור 2: הסרת Puparium והרכבת הרכבה עבור הדמיה חיה. (A) גולם לבן שנאסף בצלחת. (B) הגולם הופיע ב-(A) אחרי דגירה במשך 15 שעות בטמפרטורה של 25 מעלות צלזיוס. האזור בצבע ציאן מציין את האופרקולום. (C) תצלום שמראה גולם מודבק לפיסת סרט דו-צדדי. (ד-ג'יי) סדרת תמונות המציגות את הליך הסרת הגולם. (D) האופרקולום מורם בעזרת מלקחיים. (E) האופרקולום מוסר. (F) קצה מלקחיים מוחדר בין ציפורן הגולם לבין הגולם. (ז) הגולם פתוח חלקית. (H) מוחדר שוב קצה מלקחיים. (I) הגולם נפתח והשאיר רק חלק קטן מהקצה האחורי. (J) הגולם מורם על ידי מכחול. (K) דוגמה לדליפת נוזל גוף של הגולם. הנוזל היוצא מהפצע שננעץ על ידי קצה מלקחיים מסומן על ידי ראש חץ. (ל-נ) תמונות ואיורים המציגים את מכלול התושבת. (L) תמונה שצופה מהצד ההפוך ומראה גלמים מונחים ומים מזוקקים על תחתית צלחת עם תחתית זכוכית. (M) המנה לאחר השלמת הרכבת ההרכבה. גריז סיליקון הונח לאורך הקצה סביב חלק הזכוכית, וכיסוי הונח על השומן כדי לאטום אותו. (N) שרטוט סכמטי של מכלול ההרכבה של גולם הדרוזופילה להדמיה חיה לטווח ארוך. (O) גולם רכוב התפתח כמעט בוגר. (P) גולם רכוב הסוגר אותו. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
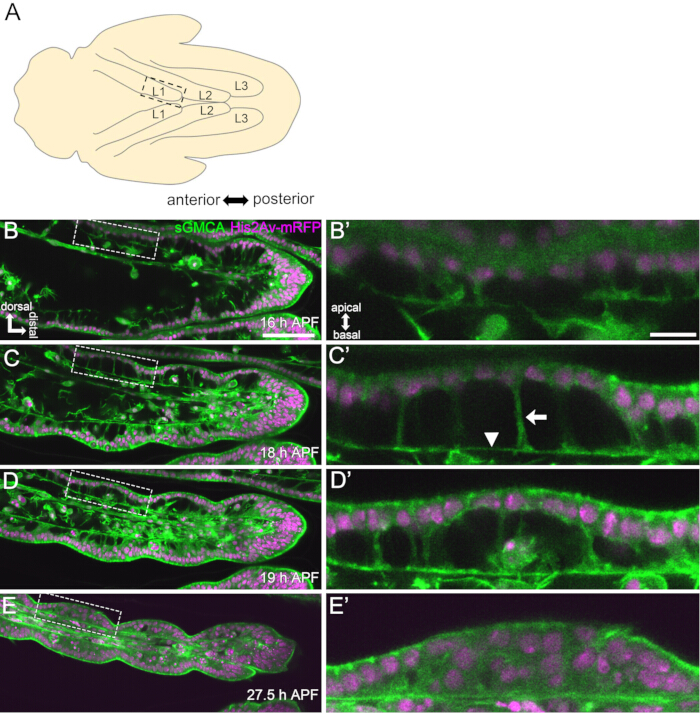
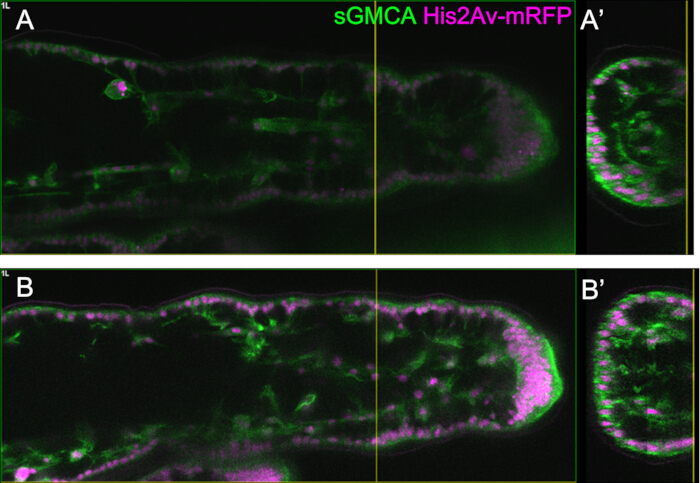
איור 3: שינויי צורה דינמיים בתאי האפיתל הטרסליים ב-APF של 16-27.5 שעות. (A) איור של הגולם שנראה מהצד הגחוני. המלבן המקווקו מתאים לאזור הנצפה ב-(B-E). L1: רגל ראשונה, L2: רגל שנייה, L3: רגל שלישית. (B,C,D,E) סטילס מהדמיה חיה של החלק הדיסטלי של הטרסוס ב-sGMCA (ירוק) ו-His2Av-mRFP (מג'נטה) המבטא זבוב. הרקמה מצטמצמת במהירות, והכניסה של אזורי המפרקים מתקדמת. (ב',ג',ד',ה') הגדלה של אזורים המוקפים בקווים מקווקווים ב- (B,C,D,E), בהתאמה. החץ וראש החץ ב-(C') מראים דוגמה להקרנות אפיקובזאליות ולמיקום הקשרים הבסיסיים, בהתאמה. המבנה דמוי הפרתנון מתחיל להיווצר ב-(B'), נוצר במלואו ב-(C'), מתחיל להיעלם ב-(D') והופך להיות קשה לראייה ב-(E'). דיסטלי מימין וגב למעלה בכל הדמויות. השלבים מוצגים בפינות הימניות התחתונות ב- (B,C,D,E). פסי קנה מידה: B, C, D, E: 50 מיקרומטר; B',C',D',E': 10 מיקרומטר. נתון זה שונה מ-Hiraiwa et al.15. ראה גם סרט 1. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
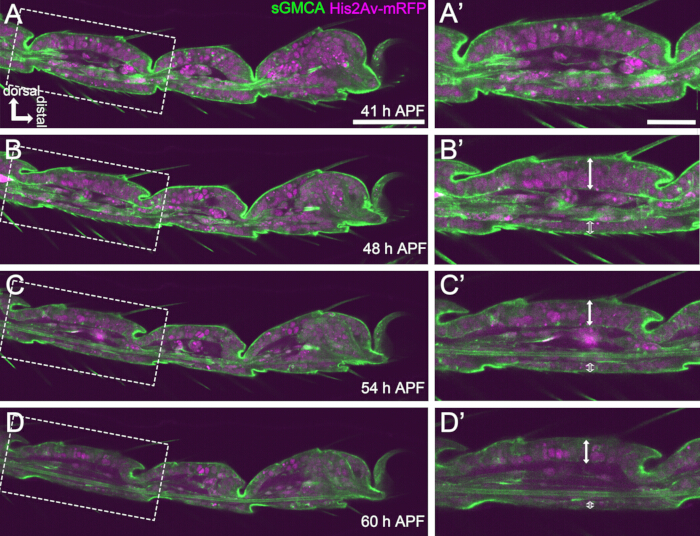
איור 4: שינויי צורה בשכבת תאי האפיתל הטרסליים ב-APF של 41-60 שעות. (A,B,C,D) תמונות סטילס מאותו מערך נתונים רציף של הדמיה חיה כמו איור 3. מלבנים מקווקווים ב- (A,B,C,D) מוגדלים ב-(A',B',C',D'), בהתאמה. בסביבות 48 שעות APF (A-B'), היווצרות הצורה החיצונית, כגון התארכות הזיפים, הטפרים והפולווילי, כמעט הושלמה. החלק התחתון של המפרק המוחדר נע קרוב אליו, ולאחר מכן, היווצרות מבנה הכדור והשקע התקדמה לאחר כ-54 שעות APF. ההבדל המורפולוגי בין האפיתל הגבי והגחוני ניכר (חיצים כפולים וחצים כפולים פתוחים ב-B',C',D'). לאחר 54 שעות APF (C-D'), שכבת האפיתל הפחיתה את עוביה מבלי לשנות כמעט את קווי המתאר של הקטעים. הגב נמצא למעלה ודיסטלי מימין בכל הדמויות. פסי קנה מידה: A, B, C, D: 50 מיקרומטר; A',B',C',D': 20 מיקרומטר.נתון זה צוטט מ-Hiraiwa et al.15. ראה גם סרט 1. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
איור 5: דוגמה לתצפית על הרגליים באמצעות פונקציית Bright Z. (א,ב) תמונות של האזור, העומק והשלב המתאימים של הרגל השלישית של sGMCA (ירוק) ו-His2Av-mRFP (מג'נטה) המבטאים זבוב, עם (B) או בלי (A) באמצעות פונקציית Bright Z. (A) מישור XY בעומק 59.1 מיקרומטר שחולץ מהתצפית על אזור הטרסל ברגל השלישית ב-16 שעות APF שנרכש ללא שימוש בפונקציית Bright Z. (א') תצוגת החתך תואמת לקו האנכי הצהוב ב-(A). הקו האנכי ב-(A') מציין את מישור המוקד של (A). (B) מישור XY בעומק 61.6 מיקרומטר שחולץ מהתצפית על אזור הטרסל ברגל השלישית ב-16 שעות APF שנרכש באמצעות פונקציית Bright Z. גם מתח PMT וגם עוצמת הלייזר הותאמו. נראות התמונה משופרת בהשוואה ל-(A). (ב') תצוגת החתך תואמת לקו האנכי הצהוב ב-(B). הקו האנכי הצהוב ב-(B') מציין את מישור המוקד של (B). אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
קובץ משלים 1: דוגמה להגדרת המיקרוסקופ הקונפוקלי להדמיה חיה של אזור טרסל הרגל בין 15-30 שעות APF. אנא לחץ כאן להורדת קובץ זה.
סרט 1: הדמיה חיה לטווח ארוך של החלק הדיסטלי של הטרסוס למשך 44 שעות. נעשה שימוש בזבוב המבטא sGMCA (ירוק) ו-His2Av-mRFP (מג'נטה). מישור ה-XY המייצג ביותר חולץ מאותו מערך נתונים כמו איור 3 ואיור 4. ראשי חץ מציינים דוגמאות לאזורי מפרקים עתידיים. תאים הנעים במהירות ברקמה הם תאים דמויי מקרופאגים. האות דמוי המיתר המשתרע לאורך מקטעי הטרסל הוא חלק מהמחיצה. חותמת הזמן מראה hh: mm. דיסטלי מימין, וגב למעלה. סרט זה עובד מ-Hiraiwa et al.15אנא לחץ כאן להורדת קובץ זה.
Discussion
במאמר זה ניתן פרוטוקול מפורט להדמיה חיה ארוכת טווח של רגל הדרוזופילה בשלב הגולם. הדיסק הדמיוני של הרגל בולט מהחלק המרכזי ויוצר מבנה צינורי, ואז היווצרות הצורה הסופית של הרגל הבוגרת מתרחשת בשלב הגולם באופן שהיה חמקמק. ניסיונות קודמים לצפות בתהליך זה היו בעיקר על ידי צביעה קבועה, תרבית רקמות ומיקרוסקופ אלקטרונים סורק 12,13,14. שיטות אלה לא יכלו לעקוב אחר שינויים מתמשכים בתאים בודדים, והתקבל רק מידע מקוטע. בשיטה המתוארת במחקר זה, ניתן לצפות בהצלחה בתהליך היווצרות הצורה הסופי של אזור הטרסל כהדמיה חיה רציפה של ימים על ידי מיקרוסקופ קונפוקלי, וניתן לעקוב אחר שינויים בתאים בודדים באופן רציף. דינמיקת תאים מסקרנת שנחשפה על ידי הדמיה חיה זו תוארה בפירוט בדוח האחרון15.
להדמיה חיה מוצלחת לטווח ארוך, חיוני לשמור על כדאיות הגולם ולהבטיח שהתפתחותו תישאר ללא פגיעה. בשיטה המתוארת כאן, הגולם שהוסר מהגולם התפתח לבוגר הפארט ולבוגר במקרים רבים (איור 2O,P). התזמונים של השינויים המורפולוגיים של הטרסוס המתפתח שנצפו בשיטה זו היו עקביים עם דיווחים קודמים 12,13,14. יתר על כן, תאי האפיתל הראו שינויים כמו הפחתת העובי אפילו ב-48-60 שעות APF (32-44 שעות לאחר ההרכבה) (איור 4B'-D'). עובדות אלה מצביעות על כך שהגולם נשאר שלם וכמעט ולא חווה הפרעה או עיכוב בהתפתחותו התקינה במהלך הדמיה חיה ארוכת טווח בשיטה המתוארת כאן. שימו לב כי הכדאיות של הגולם שהוסר מהגולם הנתון להדמיה חיה יכולה להשתנות בהתאם לעיתוי הסרת הגולם, הטיפול בהליך, מידת הפוטוטוקסיות בהדמיה וזני הזבובים בהם נעשה שימוש.
אחד הצעדים הקריטיים להבטחת שלמות הגולם והתפתחותו הוא הוצאת הגולם מבלי לפגוע בגולם. הידבקות יציבה של הגולם לסרט הדו-צדדי וטיפול זהיר במלקחיים הם המפתחות להצלחה. מניעת התייבשות של הגולם היא גם קריטית. בהקשר זה, הימנעות מפערים בין הכיסוי לשומן הסיליקון היא קריטית.
כדי למנוע התייבשות של הגולם, שיטות קודמות רבות כללו הסרה חלקית של הגולם 1,2,3,4,5,6,7. עם זאת, להתבוננות בגולם כולו, עדיף הסרה מוחלטת של הגולם. למרות שזמן ההישרדות המרבי של הגולם אינו ידוע, דווח על מספר שיטות שבהן הגולם מוסר במלואו 8,9,10. הגישה הנפוצה ביותר לספק לחות לגולם בשיטות אלו היא שימוש בנייר סינון לח. בהשוואה לשיטות הקודמות, זו המתוארת כאן מספקת לחות על ידי הנחת טיפת מים בצורה פשוטה וקלה יותר. בנוסף, שיטות קודמות רבות כוללות הרכבת הגולם על מגלשת זכוכית. בעת הרכבת הגולם שהוסר על מגלשת זכוכית, יכולה להיות בעיה שבה לחיצת הכיסוי על הגולם גורמת ללחץ על הגולם, או כיסוי מוטה מכניס רעש, עיוותים וחוסר בהירות בתמונות. השיטה המתוארת כאן משתמשת בכלי עם תחתית זכוכית, המבטל את הצורך ללחוץ את הכיסוי על הגולם, ומאפשר התבוננות ברקמות קרוב ככל האפשר למצבן הטבעי. מכיוון שאין צורך לכוונן את זווית זכוכית הכיסוי, ההתקנה יציבה, קלה לטיפול ואמינה יותר. לכן, שיטה זו כמעט ואינה דורשת מיומנויות מיוחדות, מה שמאפשר אפילו למתחילים לבצע בהצלחה הדמיה חיה.
המגבלות העיקריות של שיטה זו הן עומק התצפיות ורזולוציות הזמן. בתנאים לתצפית על הטרסוס, ניתן לקבל תמונות ברורות רק בעומק של עד כ -40 מיקרומטר. השימוש בפונקציית Bright Z עוזר לטפל בבעיה זו. לדוגמה, כפי שמוצג באיור 5, הגדלת עוצמת הלייזר ומתח ה-PMT ככל שהעומק גדל על ידי שימוש בפונקציית Bright Z שיפרה את איכות התמונות במיקומים עמוקים יותר. עם זאת, הגדלת עוצמת הלייזר מגיעה עם פשרה הכרוכה בפוטוטוקסיות ודעיכת אותות. לכן, יש צורך למצוא את התנאים האופטימליים המתאימים למטרת התצפית. רזולוציית הזמן חשובה גם כאשר מתבוננים בתאים ורקמות הנעים במהירות. צמצום פרוסות וצמצום החזר ROI הם הפתרונות המובילים לנושא זה. שימוש בציוד עדכני עם רגישות גלאי משופרת או מיקרוסקופ קונפוקלי של דיסק מסתובב עשוי לשפר את רזולוציית הזמן. מגבלה נוספת מתייחסת לשלב הגולם. ניתן להסיר את הגולם רק לאחר שהציפורן הגולמית נוצרה במלואה ב-12-13.5 שעות APF19וניתן להסיר אותה בקלות רק לאחר 14 שעות APF. ניתן לצפות בשלבים המוקדמים יותר מ-12 שעות APF באופן חלקי על ידי הרכבת הגולם מבלי להסיר את הגולם15, למרות שקשה להשיג תמונות ברורות עקב תנועות רקמות מהירות ומכשולים אופטיים על ידי הגולם במצב זה.
פתרון בעיות
קושי בהסרת הגולם
בעת הסרת הגולם, חשוב להיצמד לצד הגחון של הגולם לסרט הדו-צדדי. יש להסיר דבק ומזון ממשטח הגולם, וייבוש לאחר מכן חשוב מכיוון שמשטחים רטובים מונעים הידבקות טובה. יש לציין כי לסרט הדו צדדי בטבלת החומרים יש הידבקות חזקה יותר בצד הפנימי. יש להשתמש בצד הפנימי (החזק יותר) כדי להדביק את הגולם. חיתוך הגולם במספריים לדיסקציה במקום לקרוע אותו במלקחיים מועיל כאשר הסרת הגולם קשה.
דליפת נוזלים מהגולם
זה קריטי להסיר את הגולם מבלי לפגוע בגולם. דליפה של נוזל גוף הגולם מצביעה על נזק לגולם (איור 2K). יש להימנע מגולם כזה מהדמיה חיה. כדי למנוע נזק לגולם בזמן הוצאת הגולם, בנוסף לטיפול זהיר, מומלץ להשתמש במלקחיים עם קצוות רחבים יחסית.
איכות תמונה ירודה
כאשר האות הפלואורסצנטי חלש מדי, ישנן דרכים רבות לכוונן את הבהירות, כגון הגדלת מתח ה-PMT, פתיחת חור הסיכה (C.A.), האטת מהירות הסריקה והגדלת עוצמת הלייזר. אנא זכור שלכל שיטה יש תופעות לוואי: הגדלת מתח ה-PMT עלולה להגביר את הרעש, פתיחת החור מפחיתה את רזולוציית ציר ה-Z, האטת מהירות הסריקה מאריכה את זמן הסריקה, והגדלת עוצמת הלייזר מגבירה את הסיכון לפוטוטוקסיות והלבנה. יש למצוא הגדרות מתאימות בהתאם לאזור העניין, הסוגים ורמות הביטוי של מדווחים פלואורסצנטיים ואורך ההדמיה החי הרצוי. בסך הכל, מומלץ למזער את עוצמת הלייזר להדמיה חיה לטווח ארוך.
דהיית הקרינה
דעיכת הקרינה היא בלתי נמנעת בהדמיה חיה לטווח ארוך. מומלץ להשתמש בכוח לייזר מינימלי כדי להימנע מבעיה זו. כדי לפצות על דהייה, מומלץ להשתמש בתוסף ImageJ "AutoEnhance"16 בעת עיבוד נתוני ההדמיה החיה שנרכשו.
הודות להסרה מוחלטת של הגולם, שיטה זו ישימה מאוד לרקמות אחרות רק על ידי שינוי ההחזר על ההשקעה והכיוון של הגולם. ואכן, למרות שלא מדובר בהדמיה חיה, החלק הפרוקסימלי של הרגל, החרטום, אפיתל הראש ליד האנטנה והאפיתל של בית החזה הגבי נצפו בשיטה זו ב-Hiraiwa et al.15. יישום כזה על מגוון רחב של רקמות עשוי להקל על אינטגרציה נוספת עם טכניקות אחרות, כגון אינדוקציה אופטית של גנים. שיטה זו עשויה להיות ישימה גם על מינים של ציקלורפאן (יוצרי גולם) שאינם דרוזופילה. יתר על כן, הוא יכול לשמש למיני חרקים אחרים אם יש להם ציפורן גולם שקופה. מאמר זה מספק הוראות מפורטות לחוקרי דרוזופילה לבצע הדמיה חיה של הגולם כדי ללכוד דינמיקה של תאים ברקמות חיות.
Disclosures
המחברים מצהירים שאין ניגודי אינטרסים.
Acknowledgements
אנו אסירי תודה לד"ר מסאיוקי מיורה (אוניברסיטת טוקיו) ולד"ר יויה פוג'יסאווה (אוניברסיטת טוקיו) על הייעוץ הטכני, ואנו מודים למרכז המניות של בלומינגטון על משאבי הטיסה.
Materials
| Name | Company | Catalog Number | Comments |
| 35 mm/glass base dish | IWAKI | 3911-035 | |
| Cleaning wipes | NIPPON PAPER CRECIA | S-200 | |
| Dumont #3c Forceps | Fine Science Tools | 11231-20 | |
| Dumont #5SF | Fine Science Tools | 11252-00 | |
| Eppendorf Research plus 2-20 µL | Eppendorf | 3123000098 | |
| Fly strain: His2Av-mRFP, sGMCA | Bloomington Drosophila Stock Center | 59023 | |
| FV3000 | EVIDENT | inverted confocal microscope | |
| FV31S-SW | EVIDENT | software for FV3000 | |
| G40L | Shin-Etsu Silicone | silicone grease | |
| Micro Cover Glass 18 x 18 mm 0.13-0.17 mm | MATSUNAMI | C018181 | |
| Micro Slide Glass 76 x 26 mm 0.9-1.2 mm | MATSUNAMI | S7213 | |
| NEO-SABLE Size 0 round, fine | Pentel | XZBNR-0 | paintbrush |
| SIL300CS-30CC | EVIDENT | silicone oil | |
| Stereomicroscope System SZX7 | EVIDENT | ||
| Terumo syringe 50 mL | Terumo | SS-50ESZ | |
| Transparent double sided tape | Scotch | 665-1-12 | Since the inner layer has stronger adhesion than the outer layer, the inner layer should be used to fix pupae. |
| UPLSAPO10x | EVIDENT | ||
| UPLSAPO40XS | EVIDENT | silicone immersion lens | |
| Vannas Spring Scissors - 2.5mm Cutting Edge | Fine Science Tools | 15000-08 | optional |
References
- Koto, A., Kuranaga, E., Miura, M. Temporal regulation of Drosophila IAP1 determines caspase functions in sensory organ development. J Cell Biol. 187 (2), 219-231 (2009).
- Ninov, N., Martín-Blanco, E. Live imaging of epidermal morphogenesis during the development of the adult abdominal epidermis of Drosophila. Nat Protoc. 2 (12), 3074-3080 (2007).
- Chiba, M., et al. Activatable photosensitizer for targeted ablation of lacZ-positive cells with single-cell resolution. ACS Cent Sci. 5 (11), 1676-1681 (2019).
- Umetsu, D., et al. Local increases in mechanical tension shape compartment boundaries by biasing cell intercalations. Curr Biol. 24 (16), 1798-1805 (2014).
- Tran, N. V., et al. Programmed disassembly of a microtubule-based membrane protrusion network coordinates 3D epithelial morphogenesis in Drosophila. EMBO J. 43 (6), 568-594 (2024).
- Hellerman, M. B., Choe, R. H., Johnson, R. I. Live-imaging of the Drosophila pupal eye. J Vis Exp. (95), e52120 (2015).
- O'Connor, J. T., Shannon, E. K., Hutson, M. S., Page-McCaw, A. Mounting Drosophila pupae for laser ablation and live imaging of the dorsal thorax. STAR Protoc. 3 (2), 101396 (2022).
- Ziserman, D., Roegiers, F. Live-cell imaging of sensory organ precursor cells in intact Drosophila pupae. J Vis Exp. (51), e2706 (2011).
- Tögel, M., Pass, G., Paululat, A. In vivo imaging of Drosophila wing heart development during pupal stages. Int J Dev Biol. 57 (1-2), 13-24 (2013).
- Weavers, H., Franz, A., Wood, W., Martin, P. Long-term in vivo tracking of inflammatory cell dynamics within Drosophila pupae. J Vis Exp. (136), e57871 (2018).
- Kojima, T. Developmental mechanism of the tarsus in insect legs. Curr Opin Insect Sci. 19, 36-42 (2017).
- Mirth, C., Akam, M. Joint development in the Drosophila leg: Cell movements and cell populations. Dev Biol. 246 (2), 391-406 (2002).
- Mirth, C. Ecdysteroid control of metamorphosis in the differentiating adult leg structures of Drosophila melanogaster. Dev Biol. 278 (1), 163-174 (2005).
- Tajiri, R., Misaki, K., Yonemura, S., Hayashi, S. Dynamic shape changes of ECM-producing cells drive morphogenesis of ball-and-socket joints in the fly leg. Development. 137 (12), 2055-2063 (2010).
- Hiraiwa, S., et al. Unveiling the cell dynamics during the final shape formation of the tarsus in Drosophila adult leg by live imaging. Dev Genes Evol. , (2024).
- . ImageJ plugin page Available from: https://signaling.riken.jp/en/en-tools/imagej/629/ (2024)
- Pandey, R., Heidmann, S., Lehner, C. F. Epithelial re-organization and dynamics of progression through mitosis in Drosophila separase complex mutants. J Cell Sci. 118 (4), 733-742 (2005).
- Kiehart, D. P., Galbraith, C. G., Edwards, K. A., Rickoll, W. L., Montague, R. A. Multiple forces contribute to cell sheet morphogenesis for dorsal closure in Drosophila. J Cell Biol. 149 (2), 471-490 (2000).
- Ashburner, M. . Drosophila: A Laboratory Handbook. , (1989).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved