Method Article
蛹摘出後の ショウジョウバエ の蛹の脚の発達の長期ライブイメージング
要約
ここでは、蛹の完全除去を含む、蛹期の ショウジョウバエ の脚の長期ライブイメージングのためのプロトコルが提示されます。このプロトコールは、他の組織にも適用できます。
要約
過去数十年にわたって、細胞運命決定のメカニズムの理解において大きな進歩が見られました。しかし、運命決定細胞が立体的な生物形状を形成する過程は未だ解明されていません。近年の共焦点顕微鏡の進歩により、ライブイメージングを通じて発生中の細胞動態を観察する取り組みが容易になりました。 Drosophila melanogaster の蛹は、その不動性、透明な蛹のキューティクル、および蛍光レポーターラインの利用可能性により、ライブイメージングに理想的です。イメージングの主な課題は、蛹、つまり蛹を取り囲むキューティクルであり、光学イメージングを妨げます。以前の方法では、蛹の部分的または完全な除去が含まれていましたが、この手順後も長期間にわたって蛹の生存能力を維持することは依然として困難でした。ここでは、蛹の段階で ショウジョウバエ の脚を数日間ライブイメージングするための簡単な方法を紹介します。この方法は、両面テープに接着された蛹から蛹を取り除き、続いてガラス底皿に小さなチャンバーを組み立てて蛹と一滴の水を囲むことを含む。このセットアップは簡単で信頼性が高く、乾燥を防ぐことで蛹の生存期間を延ばすことができます。 ショウジョウバエ の蛹の長期ライブイメージングは、成虫の脚が2〜3日で劇的な3次元構造変化を遂げる様子を捉えるのに大きく貢献しています。これらの変化には、上皮細胞による興味深い構造(パルテノン神殿様構造)の一時的な形成、急速な組織狭窄、関節形成、剛毛の伸長などがあります。この方法は、さまざまな組織の観察に適用でき、光学的遺伝子誘導などの他の手法と組み合わせて、蛹期の組織の最終形状形成中の細胞ダイナミクスの理解を深めることができる可能性があります。
概要
細胞の運命決定のメカニズムの解明は、過去数十年にわたって大きな進歩を遂げてきましたが、運命決定された細胞がどのようにして3次元の生物形状を構築するのかは、いまだに解明されていません。近年、共焦点顕微鏡の技術向上により、ライブイメージングにより発生過程の細胞動態を明らかにする試みが増加しています1,2。Drosophila melanogaster の蛹は、その適切な特徴(不動性、蛹のキューティクルの透明性、および蛍光レポーターライン3,4,5の利用可能性)のために、ライブイメージングに好まれています。ショウジョウバエの蛹のライブイメージングを行う上での最大の障害は、蛹(蛹の場合)、つまり蛹を囲む変形して日焼けした最終的な幼虫のキューティクルです。光学的閉塞を避けるために、蛹は以前に報告された方法1,2,3,4,5,6,7,8,9,10で部分的または完全に除去されました。蛹を完全に除去することで、観察領域が最大化され、さまざまな組織に適用できます。しかし、蛹のない蛹は、おそらく乾燥が原因で、通常は約半日以内に死にます。したがって、蛹の水分を維持することは、長時間のライブイメージングにとって非常に重要です。以前の方法での蛹の完全除去後の蛹の生存の正確な期間は不明ですが、報告された例は通常、約20時間まで続きました。蛹期は約4日間続くため、さらに長時間のライブイメージングが組織形成の全過程を捉えることに貢献すると期待されていました。
ショウジョウバエの成体脚は、3次元組織形状形成のプロセスを研究するための優れたモデルです。これは、幼虫の段階で形成される円盤状の原基(脚の円盤)に由来します。成体脚の各セグメントに対応する領域は、蛹前期11によって決定される。その後、蛹形成後11時間頃に脚椎間板が中央部から突き出て肥大した管状構造を形成します(APF)。この単純な形状の組織が、その後の段階でどのようにして成体脚の最終的な形状を達成するのかは、長い間明らかになっていません。この問題にアプローチするいくつかの研究が発表されています12,13,14。固定組織や培養組織を観察したため、個々の細胞の連続的な変化を追跡できず、得られる情報はやや断片的でした。シェーピングプロセスを完全に理解するためには、長期のライブイメージングを通じて個々の細胞の変化を連続的に観察することが不可欠です。
最近の研究では、長期ライブイメージングによる組織および細胞レベルの三次元構造の動的変形が明らかになりました(図1)。この研究で最も興味深い発見は、上皮細胞による予想外に複雑な構造の一過性形成です。「パルテノン神殿様構造」と名付けられたこの構造は、上皮細胞の先端基底基底突起と基底メッシュ状の結合を特徴としています。重要なことに、この構造の形成と消失は、急速な組織の狭窄と一致する15。その後、目地形成や毛先伸びなどの形状形成が2〜3日間進行しました。長期のライブイメージングは、これらの数日間にわたる連続したイベントの全体像を効果的に捉えました。
この記事では、蛹の段階で ショウジョウバエ の脚を数日間にわたってライブイメージングし、蛹を完全に除去するための段階的な方法を提供します。この方法は簡単に理解でき、他のさまざまな組織に適用できます。
プロトコル
このプロトコルは、蛍光レポーター15を発現するDrosophila melanogaster株を使用する。本試験で使用した試薬および機器の詳細は、資料表に記載されています。
1.蛹の準備
- 絵筆で、バイアルから Drosophila melanogaster の目的の株の白い蛹を収集し、皿または空のバイアルに入れます(図2A)。
注:この研究では、「白い蛹」とは、幼虫が完全に動かなくなるまでと、蛹が茶色になるまでの段階を指します。このステージは、25°Cで約30分間続きます。 - 白い蛹が観察対象の段階に成長するまで、25°Cで少なくとも14時間インキュベートします(図2B)。
注:蛹は、蛹のキューティクルが12〜13.5時間のAPFで完全に形成された後にのみ除去でき、14時間のAPF後にのみ簡単に除去できます。 - 接着剤を拭き取り、蒸留水に浸した絵筆で蛹から食べ物を飛ばします。
注:蛹の腹側は、後の手順で両面テープに十分に接着するために、特にきれいにする必要があります。 - 蛹をクリーニングワイプに数分間置き、乾かします。
注意: 蛹に水分が残っていると、両面テープへの良好な接着が妨げられます。 - スライドガラスに両面テープを固定します。
- 乾燥した蛹を腹側を下にして両面テープの上に置きます(図2C)。
- 乾いた絵筆で蛹の背側をそっと押して、両面テープへの密着性を高めます。
- 実体顕微鏡下で、一対の鉗子で蓋を慎重に開きます(図2 D、E)。
注:蓋は、成虫のハエが出てくる蛹の前背部であり、したがって容易に開きます。 - 開いた蓋の端から、鉗子の先端の1つを蛹と蛹の間のスペースに挿入します(図2F)。
注意: 鉗子の先端で蛹のキューティクルを傷つけないように注意してください。 - 鉗子で蛹をつかみ、壊れるまで外側に引き抜きます。
- 蛹の破れた破片を鉗子で持ち上げ、両面テープに接着します(図2G)。
- 蛹の開口部が後端に達し、蛹のごく一部が残るまで、手順1.10〜1.11を繰り返します(図2 H、I)。
注意: 蛹から液体が出てきた場合、それは損傷していたでしょう(図2K)。正常な発達を観察するために、損傷した蛹の画像化は避けてください。
2. イメージングのセットアップ
- ガラス底皿の底に1μLの蒸留水またはシリコーンオイル(シリコン浸漬レンズを使用する場合)を入れます。
- 蒸留水に絵筆を浸し、蛹をそっとすくい上げます(図2J)。
- 蛹の腹側を下にして蒸留水またはシリコーンオイルの上に置きます(図2L)。
- マイクロピペットを使用して、ガラス底皿のガラス部分の端近くに10μLの蒸留水を入れます(図2L)。
- ガラス底皿のガラス部分の端にシリンジでシリコングリースの円を置きます(図2M)。
- シリコングリースにカバースリップを貼って密封します(図2M)。アセンブリを 図 2N に示します。
注意: カバースリップとシリコングリースの間に隙間がないことを確認してください。
3. 共焦点イメージング
- 倒立型共焦点レーザー顕微鏡とイメージングソフトウェアの電源を入れます。
- ディッシュを倒立共焦点顕微鏡のステージアクセプターに置きます。
- 明視野観察で低倍率対物レンズで蛹を見つけます。蛹が体液の漏れを示さないようにしてください。
- 観察する蛹の目的の領域を関心領域 (ROI) の中央に配置します。
注:第1脚と第2脚の足根骨の前外側、および第3脚の足根骨の腹側は、蛹の腹側を向いています。したがって、背腹軸に沿った足根骨の縦部分は第1脚と第2脚で観察でき、前後軸に沿った足骨は第3脚で観察できます。 - 対物レンズをライブイメージング用のレンズに交換します。
注意: 水浸レンズを使用すると、長期間の観察中にレンズとガラス底皿の間の水が乾きます。液浸なしまたはシリコーンオイル浸漬レンズをお勧めします。 - 所望の観察条件を調整し、データ取得を開始してください。
注:蛹への害を防ぐために、鮮明な画像が得られる限り、レーザー出力は最小限にする必要があります。ROIを最小化し、ステップサイズを大きくすると、Zスタック集録の時間を節約できます。Zスタックの深さを決定する際には、組織の将来の形質転換を考慮する必要があります。15-25時間のAPFでの脚観察の場合、脚が非常に狭くなるため、カバーガラスに最も近い部分(外側上皮)が急速に深く移動します。この動きを考慮すると、最初から追加の深いZスタックを設定する必要があります。15-30時間のAPFで下肢足根部をライブイメージングするための共焦点顕微鏡設定の例は、 補足ファイル1に記載されています。長時間のライブイメージングでは、蛍光退色は避けられません。この問題を軽減するには、最小限のレーザー出力を使用することをお勧めします。ImageJプラグイン「AutoEnhance」16 は、フェード効果を補正するためのライブイメージングデータの処理に推奨されます。
結果
ここでは、蛹期の発育中のショウジョウバエ成虫の脚の44時間ライブイメージングの例について説明します。His2Av-mRFP17(標識核)およびsGMCA18(GFP標識アクチン結合タンパク質Moesin、標識アクチン)を発現するハエを白色蛹期に採取し、25°Cで15時間インキュベートした。 蛹は、プロトコルに従って取り外して取り付けました(図2)。脚の先端付近にある足根骨と足根前筋のZスタック画像は、室温(厳密ではありませんが、25°C付近)で16時間から60時間のAPFまで15分ごとに取得されました。一連の画像の前半を図3に、後半を図4に、全体の動画を動画1に示します。脚の組織が急速に狭くなると、上皮細胞は一過性に興味深い構造、つまりパルテノン神殿のような構造を形成し、その頂端基底突起と基底結合を特徴とする(図3)。上皮の厚さの減少は、アウトラインがほぼ完成した後でも観察されました(図4)。全体のプロセスを図 1 に示します。
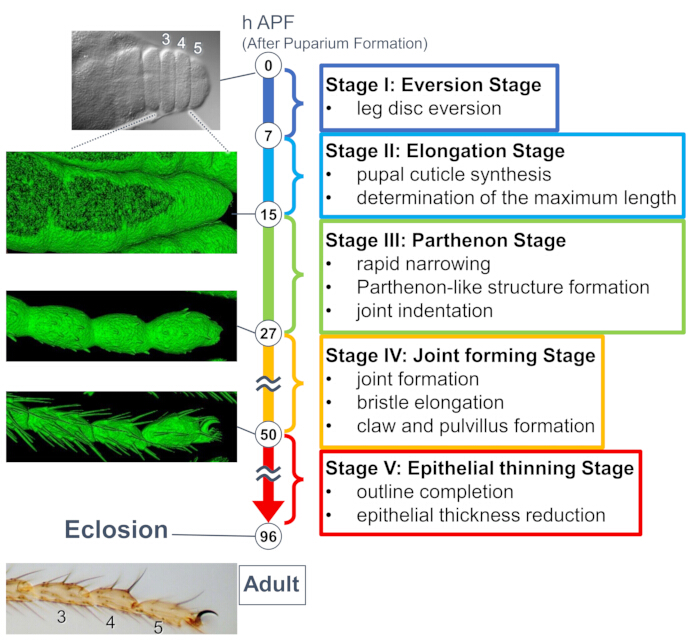
図1:蛹期におけるショウジョウバエ成虫の足根骨の最終的な形状形成の概要。プロセス全体は、長期のライブイメージング実験で観察された組織レベルと細胞レベルの両方での形態学的変化に基づいて、5つの段階に分けられました。左側には、いくつかの時点に対応する代表的な写真または表面レンダリング画像(sGMCA信号)が示されています。右側には、各ステージのイベントの簡単な説明が書かれています。この図は、Hiraiwa et al.15から修正されています。ムービー1も参照してください。この図の拡大版を表示するには、ここをクリックしてください。
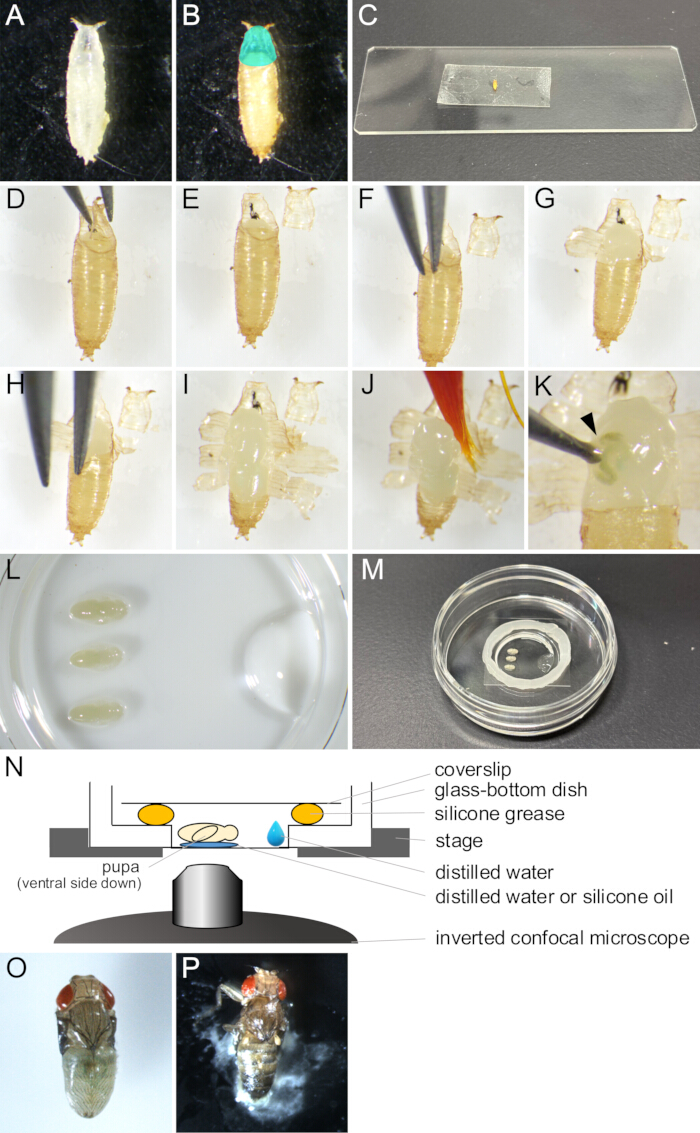
図2:ライブイメージングのための蛹の除去とマウントアセンブリ (A)皿に集められた白い蛹。(B)蛹は、25°Cで15時間インキュベートした後、(A)で示されました。 シアン色に着色された領域は、蓋を示します。(C)両面テープに蛹が接着されている写真。(民主党-日本)蛹の除去手順を示す一連の画像。(D)蓋は鉗子で持ち上げられます。(E)蓋が取り除かれます。(F)鉗子の先端を蛹のキューティクルと蛹の間に挿入します。(G)蛹が部分的に開いている。(H)鉗子の先端を再度挿入します。(I)蛹が開き、後端のごく一部だけが残りました。(J)絵筆で持ち上げられている蛹。(K)蛹の体液漏れの一例。鉗子の先端で突かれた傷口から出てくる液体は、矢印で示されます。(L-N)マウントの組み立てを示す画像とイラスト。(L)ガラス底皿の底に置かれた蛹と蒸留水を示す上側から見た画像。(M)マウント組立完了後のディッシュ。ガラス部分の縁に沿ってシリコングリースを貼り、その上にカバースリップを貼ってシールしました。(N)ショ ウジョウバエ の蛹の長期ライブイメージングのための取り付けアセンブリの概略図。(O)ほぼ成体に発達した騎乗した蛹。(P)マウントされた蛹のeclosing。 この図の拡大版を表示するには、ここをクリックしてください。
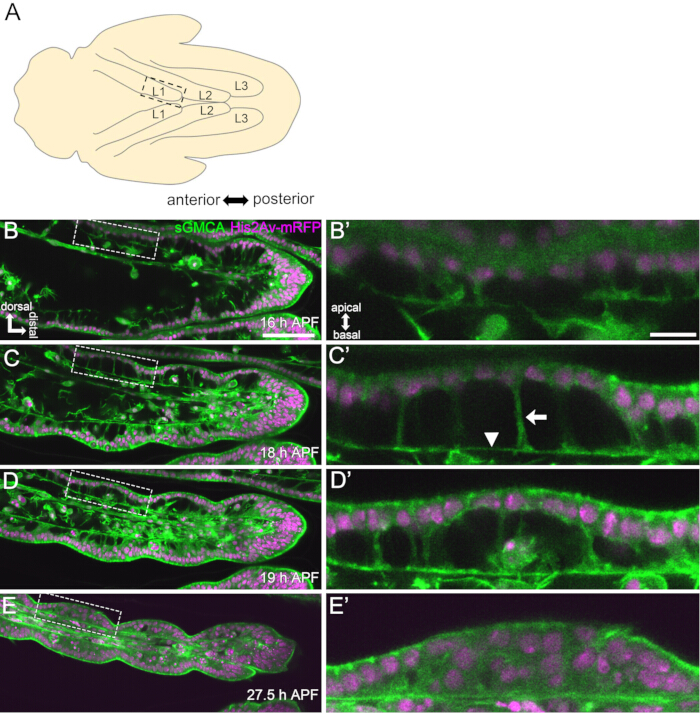
図3:16-27.5時間のAPFにおける足根上皮細胞の動的形状変化 (A)腹側から見た蛹のイラスト。破線の四角形は、(B-E) で観測された領域に対応します。L1:第1レグ、L2:セカンドレグ、L3:第3レグ(B,C,D,E) SGMCA(緑)およびHis2Av-mRFP(マゼンタ)を発現するハエの足根の遠位部のライブイメージングからの静止画。組織は急速に狭くなり、関節領域のくぼみが進行します。(B',C',D',E')(B,C,D,E)の破線で囲まれた領域の倍率。(C')の矢印と矢印は、それぞれ先端基底突起の例と基底結合の位置を示しています。パルテノン神殿のような構造は、(B')で形成され始め、(C')で完全に形成され、(D')で消え始め、(E')で見えにくくなります。遠位は右にあり、背側はすべての図で上部にあります。ステージは(B、C、D、E)の右下隅に示されています。スケールバー:B、C、D、E:50μm;B',C',D',E': 10 μm.この図は、Hiraiwa et al.15から修正されています。ムービー1も参照してください。この図の拡大版を表示するには、ここをクリックしてください。
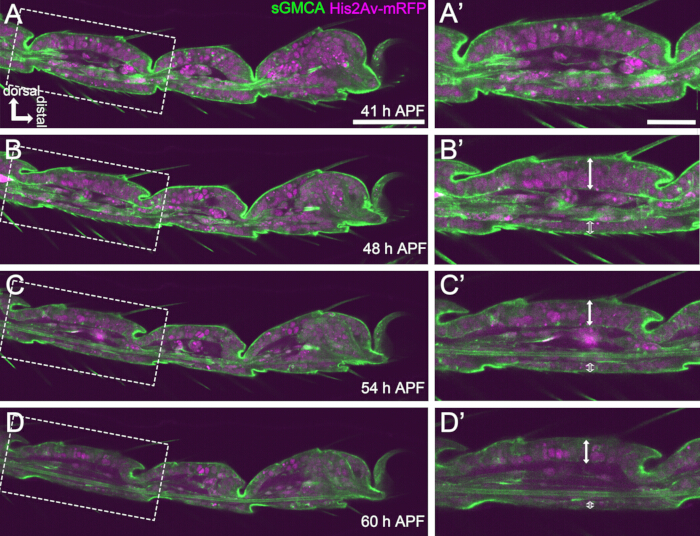
図4:41-60時間のAPFにおける足根上皮細胞層の形状変化(A,B,C,D) 図3と同じライブイメージングのシーケンシャルデータセットからの静止画。(A,B,C,D) の破線の四角形は、それぞれ (A',B',C',D') に拡大されます。48時間APF(A-B')頃までに、剛毛、爪、およびpulvilliの伸長などの外形形成はほぼ完了します。陥入した関節の底部は近位に移動し、その後、約54時間のAPF後にボールとソケットの構造形成が進行しました。背側上皮と腹側上皮の形態学的な違いが明らかになりました(B'、C'、D'の二重矢印と開いた二重矢印)。54時間APF(C-D')後、上皮層はセグメントの輪郭をほとんど変えずにその厚さを減少させました。背側はすべての図で上部にあり、右遠位にあります。スケールバー:A、B、C、D:50μm;A',B',C',D': 20 μm.この図は、Hiraiwa et al.15 から引用されています。ムービー1も参照してください。この図の拡大版を表示するには、ここをクリックしてください。
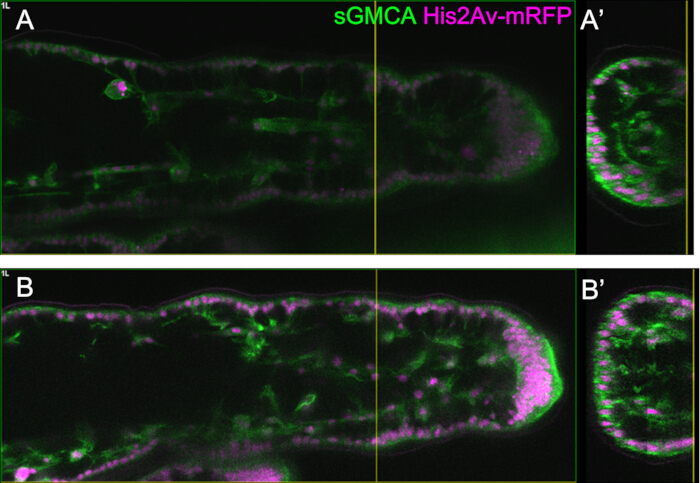
図5: Bright Z関数を使用した脚の観察例。 (A,B)sGMCA(緑)とHis2Av-mRFP(マゼンタ)を発現するフライの第3レグの対応する領域、深さ、およびステージの画像(B)または(A)をBright Z関数を使用して使用。(A)ブライトZ機能を使用せずに取得した16時間APFの第3レグの足根部の観察から抽出された深さ59.1μmのXY平面。(A')断面図は(A)の黄色の縦線に対応しています。(A')の縦線は(A)の焦点面を示します。(B)Bright Z関数を使用して取得した16時間APFの第3レグの足根部の観察から抽出された深さ61.6μmのXY平面。PMT電圧とレーザー出力の両方を調整しました。(A)に比べて画像の視認性が向上しています。(B')断面図は、(B)の黄色の垂直線に対応しています。(B')の黄色の縦線は(B)の焦点面を示しています。 この図の拡大版を表示するには、ここをクリックしてください。
補足ファイル1:15-30時間のAPFからの脚の足根部のライブイメージングのための共焦点顕微鏡設定の例。このファイルをダウンロードするには、ここをクリックしてください。
動画1:足根骨の遠位部分の 44 時間の長期ライブイメージング。sGMCA(緑)とHis2Av-mRFP(マゼンタ)を発現させたフライを使用しました。最も代表的なXY平面は、図3および図4と同じデータセットから抽出されました。矢印は、将来の関節領域の例を示しています。組織内で急速に移動する細胞はマクロファージ様細胞です。足根骨セグメントに沿って伸びる弦状の信号は、中隔の一部です。タイムスタンプは hh: mm と表示されます。遠位は右に、背側は上部にあります。この映画は、Hiraiwa et al.15から改作されています このファイルをダウンロードするには、ここをクリックしてください。
ディスカッション
この記事では、蛹期のショウジョウバエの脚の長期ライブイメージングに関する詳細なプロトコルを提供します。脚の仮想円盤が中央部から突き出して筒状構造を形成し、その後、蛹の段階で成脚の最終的な形状形成が、これまでとらえどころのない方法で起こります。このプロセスを観察する以前の試みは、主に固定染色、組織培養、および走査型電子顕微鏡によるものであった12,13,14。これらの方法では、個々の細胞の連続的な変化を追跡することはできず、断片的な情報しか得られませんでした。本研究で説明した方法により、足根部の最終的な形状形成過程を共焦点顕微鏡による数日間の連続ライブイメージングで観察し、個々の細胞の変化を連続的に追跡することができます。このライブイメージングによって明らかになった興味深い細胞動態は、最近のレポート15で詳細に説明されています。
長期のライブイメージングを成功させるためには、蛹の生存率を維持し、その発育に影響を与えないようにすることが重要です。ここで述べた方法では、蛹から除去された蛹は、多くの場合、ファラテ成体および成体に成長した(図2O,P)。この方法で観察された発育中の足根の形態学的変化のタイミングは、以前の報告と一致していました12,13,14。さらに、上皮細胞は48-60時間のAPF(実装後32-44時間)でも厚さが減少するなどの変化を示しました(図4B'-D')。これらの事実は、蛹が無傷のままであり、ここで説明した方法を使用した長期ライブイメージング中に正常な発達にほとんど混乱や遅延を経験しないことを示唆しています。ライブイメージングにかけられた蛹除去された蛹の生存率は、蛹除去のタイミング、手順での取り扱い、イメージングにおける光毒性の程度、および使用されるハエ株によって異なる可能性があることに注意してください。
蛹の無傷性とその発育を保証するための重要なステップの1つは、蛹を傷つけずに蛹を取り除くことです。蛹を両面テープに安定して接着し、鉗子を丁寧に扱うことが成功の鍵です。蛹の脱水症状を防ぐことも重要です。この点で、カバーガラスとシリコーングリースの間に隙間を空けないことが重要です。
蛹の乾燥を避けるために、以前の多くの方法は、蛹1,2,3,4,5,6,7の部分的な除去を含んでいました。しかし、蛹全体を観察するためには、蛹の完全な除去が好ましい。蛹の最大生存期間は不明ですが、蛹を完全に除去するいくつかの方法が報告されています8,9,10。これらの方法で蛹に水分を供給するための最も一般的なアプローチは、湿らせた濾紙の使用です。前の方法と比較して、ここで説明した方法は、水滴をより簡単かつ簡単に入れることで水分を提供します。さらに、以前の多くの方法では、蛹をスライドガラスに取り付ける必要がありました。蛹を取り外した蛹をスライドガラスに装着する場合、カバーガラスを蛹に押し付けると蛹に負担がかかったり、カバーガラスが傾いているとノイズや歪み、画像が鮮明に写らないなどの問題が生じることがあります。ここで説明する方法は、ガラス底皿を採用しているため、カバーガラスを蛹に押し付ける必要がなくなり、組織をできるだけ自然な状態に近づけて観察することができます。カバーガラスの角度を調整する必要がないため、セットアップが安定し、取り扱いが簡単で、信頼性も向上しています。そのため、この手法は専門的なスキルをほとんど必要とせず、初心者でもライブイメージングを成功させることができます。
この方法の主な制限は、観測の深さと時間分解能です。足根部を観察する条件下では、深さ約40μmまでしか鮮明な画像が得られません。Bright Z関数を使用すると、この問題に対処できます。例えば、 図5に示すように、Bright Z機能を用いて奥行きが大きくなるほどレーザー出力とPMT電圧が増加すると、深い位置での画像品質が向上しました。ただし、レーザー出力の増加には、光毒性と信号のフェージングを含むトレードオフが伴います。そのため、観測の目的に沿った最適な条件を見つける必要があります。時間分解能は、急速に移動する細胞や組織を観察する際にも重要です。スライスの削減とROIの縮小は、この問題に対する主要な解決策です。検出器の感度が向上した最新の装置やスピニングディスク共焦点顕微鏡を使用すると、時間分解能が向上する可能性があります。別の制限は、蛹の段階に関連しています。蛹は、蛹のキューティクルが12〜13.5時間のAPF19で完全に形成された後にのみ除去することができ、14時間のAPFの後にのみ容易に除去することができる。12時間APFよりも早い段階は、蛹15を取り外さずに蛹を装着することにより部分的に観察することができるが、この状態では急速な組織運動および蛹による光学的障害のために鮮明な画像を得ることは困難である。
トラブルシューティング
蛹の除去の難しさ
蛹を取り外す際には、蛹の腹側を両面テープに接着することが重要です。接着剤と食物は蛹の表面から取り除く必要があり、濡れた表面は良好な接着を妨げるため、その後の乾燥が重要です。特に、材料テーブルの両面テープは、内側の接着力が強いです。内側(より強い)側を使用して蛹を接着する必要があります。蛹の除去が難しい場合は、鉗子で引き裂くのではなく、解剖用のハサミで蛹を切ると便利です。
蛹からの体液漏れ
蛹を傷つけずに蛹を取り除くことが重要です。蛹体液の漏れは、蛹の損傷を示しています(図2K)。このような蛹は、ライブイメージングから避けるべきです。蛹を摘出する際の蛹の損傷を防ぐためには、丁寧な取り扱いに加え、先端が比較的幅の広い鉗子の使用がおすすめです。
画質が悪い
蛍光信号が弱すぎる場合は、PMT電圧を上げる、ピンホール(CA)を開く、スキャン速度を遅くする、レーザー出力を上げるなど、明るさを調整する方法はたくさんあります。PMT電圧を上げるとノイズが増加したり、ピンホールを開くとZ軸の解像度が低下したり、スキャン速度を遅くするとスキャン時間が長くなったり、レーザー出力を上げると光毒性や漂白のリスクが高まるなど、すべての方法には副作用があることに注意してください。関心領域、蛍光レポーターの種類と発現レベル、およびライブイメージングの望ましい長さに応じて、適切な設定を見つける必要があります。全体として、レーザー出力は、長期間のライブイメージングのために最小限に抑えることをお勧めします。
蛍光の退色
蛍光の退色は、長期間のライブイメージングでは避けられません。この問題を回避するために、レーザー出力の使用を最小限に抑えることをお勧めします。フェードを補正するために、取得したライブイメージングデータの処理には、ImageJプラグイン「AutoEnhance」16 を推奨します。
蛹を完全に除去したおかげで、この方法は蛹のROIと向きを変更するだけで他の組織に非常に適用できます。実際、これらはライブイメージングではありませんが、この方法では、脚の近位部、吻、アンテナ近くの頭部上皮、および背側胸部の上皮が観察されました.15。このような広範囲の組織への適用性は、遺伝子の光誘導などの他の技術とのさらなる統合を容易にする可能性があります。この方法は、 ショウジョウバエ以外のシクロラファン(蛹形成)種にも適用できる場合があります。さらに、透明な蛹のキューティクルを持っている他の昆虫種にも使用できる可能性があります。この記事では、 ショウジョウバエ の研究者が蛹のライブイメージングを行い、生きた組織の細胞動態を捉えるための詳細な手順を説明します。
開示事項
著者は、競合する利益を宣言しません。
謝辞
技術的なアドバイスをいただいた三浦雅之博士と東京大学の藤澤裕也博士に感謝し、フライリソースを提供してくださったブルーミントンストックセンターに感謝します。
資料
| Name | Company | Catalog Number | Comments |
| 35 mm/glass base dish | IWAKI | 3911-035 | |
| Cleaning wipes | NIPPON PAPER CRECIA | S-200 | |
| Dumont #3c Forceps | Fine Science Tools | 11231-20 | |
| Dumont #5SF | Fine Science Tools | 11252-00 | |
| Eppendorf Research plus 2-20 µL | Eppendorf | 3123000098 | |
| Fly strain: His2Av-mRFP, sGMCA | Bloomington Drosophila Stock Center | 59023 | |
| FV3000 | EVIDENT | inverted confocal microscope | |
| FV31S-SW | EVIDENT | software for FV3000 | |
| G40L | Shin-Etsu Silicone | silicone grease | |
| Micro Cover Glass 18 x 18 mm 0.13-0.17 mm | MATSUNAMI | C018181 | |
| Micro Slide Glass 76 x 26 mm 0.9-1.2 mm | MATSUNAMI | S7213 | |
| NEO-SABLE Size 0 round, fine | Pentel | XZBNR-0 | paintbrush |
| SIL300CS-30CC | EVIDENT | silicone oil | |
| Stereomicroscope System SZX7 | EVIDENT | ||
| Terumo syringe 50 mL | Terumo | SS-50ESZ | |
| Transparent double sided tape | Scotch | 665-1-12 | Since the inner layer has stronger adhesion than the outer layer, the inner layer should be used to fix pupae. |
| UPLSAPO10x | EVIDENT | ||
| UPLSAPO40XS | EVIDENT | silicone immersion lens | |
| Vannas Spring Scissors - 2.5mm Cutting Edge | Fine Science Tools | 15000-08 | optional |
参考文献
- Koto, A., Kuranaga, E., Miura, M. Temporal regulation of Drosophila IAP1 determines caspase functions in sensory organ development. J Cell Biol. 187 (2), 219-231 (2009).
- Ninov, N., Martín-Blanco, E. Live imaging of epidermal morphogenesis during the development of the adult abdominal epidermis of Drosophila. Nat Protoc. 2 (12), 3074-3080 (2007).
- Chiba, M., et al. Activatable photosensitizer for targeted ablation of lacZ-positive cells with single-cell resolution. ACS Cent Sci. 5 (11), 1676-1681 (2019).
- Umetsu, D., et al. Local increases in mechanical tension shape compartment boundaries by biasing cell intercalations. Curr Biol. 24 (16), 1798-1805 (2014).
- Tran, N. V., et al. Programmed disassembly of a microtubule-based membrane protrusion network coordinates 3D epithelial morphogenesis in Drosophila. EMBO J. 43 (6), 568-594 (2024).
- Hellerman, M. B., Choe, R. H., Johnson, R. I. Live-imaging of the Drosophila pupal eye. J Vis Exp. (95), e52120 (2015).
- O'Connor, J. T., Shannon, E. K., Hutson, M. S., Page-McCaw, A. Mounting Drosophila pupae for laser ablation and live imaging of the dorsal thorax. STAR Protoc. 3 (2), 101396 (2022).
- Ziserman, D., Roegiers, F. Live-cell imaging of sensory organ precursor cells in intact Drosophila pupae. J Vis Exp. (51), e2706 (2011).
- Tögel, M., Pass, G., Paululat, A. In vivo imaging of Drosophila wing heart development during pupal stages. Int J Dev Biol. 57 (1-2), 13-24 (2013).
- Weavers, H., Franz, A., Wood, W., Martin, P. Long-term in vivo tracking of inflammatory cell dynamics within Drosophila pupae. J Vis Exp. (136), e57871 (2018).
- Kojima, T. Developmental mechanism of the tarsus in insect legs. Curr Opin Insect Sci. 19, 36-42 (2017).
- Mirth, C., Akam, M. Joint development in the Drosophila leg: Cell movements and cell populations. Dev Biol. 246 (2), 391-406 (2002).
- Mirth, C. Ecdysteroid control of metamorphosis in the differentiating adult leg structures of Drosophila melanogaster. Dev Biol. 278 (1), 163-174 (2005).
- Tajiri, R., Misaki, K., Yonemura, S., Hayashi, S. Dynamic shape changes of ECM-producing cells drive morphogenesis of ball-and-socket joints in the fly leg. Development. 137 (12), 2055-2063 (2010).
- Hiraiwa, S., et al. Unveiling the cell dynamics during the final shape formation of the tarsus in Drosophila adult leg by live imaging. Dev Genes Evol. , (2024).
- . ImageJ plugin page Available from: https://signaling.riken.jp/en/en-tools/imagej/629/ (2024)
- Pandey, R., Heidmann, S., Lehner, C. F. Epithelial re-organization and dynamics of progression through mitosis in Drosophila separase complex mutants. J Cell Sci. 118 (4), 733-742 (2005).
- Kiehart, D. P., Galbraith, C. G., Edwards, K. A., Rickoll, W. L., Montague, R. A. Multiple forces contribute to cell sheet morphogenesis for dorsal closure in Drosophila. J Cell Biol. 149 (2), 471-490 (2000).
- Ashburner, M. . Drosophila: A Laboratory Handbook. , (1989).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved