Method Article
Imaging dal vivo a lungo termine dello sviluppo della zampa pupale di Drosophila dopo la rimozione del pupario
In questo articolo
Riepilogo
Qui, viene presentato un protocollo per l'imaging dal vivo a lungo termine della zampa di Drosophila durante lo stadio pupale, che prevede la rimozione completa del pupario. Questo protocollo può essere applicato anche ad altri tessuti.
Abstract
Negli ultimi decenni, sono stati compiuti progressi significativi nella comprensione dei meccanismi di determinazione del destino cellulare. Tuttavia, il processo attraverso il quale le cellule determinate dal destino formano forme organismiche tridimensionali rimane poco chiaro. I recenti progressi nella microscopia confocale hanno facilitato gli sforzi per osservare la dinamica cellulare durante lo sviluppo attraverso l'imaging dal vivo. La pupa di Drosophila melanogaster è ideale per l'imaging dal vivo grazie alla sua immobilità, alla cuticola pupale trasparente e alla disponibilità di linee reporter fluorescenti. Una sfida primaria per l'imaging è il pupario, la cuticola che circonda la pupa, che ostruisce l'imaging ottico. Mentre i metodi precedenti prevedevano la rimozione parziale o completa del pupario, mantenere la vitalità della pupa per lunghi periodi dopo questa procedura è rimasto difficile. Qui, viene presentato un metodo semplice per l'imaging dal vivo della zampa di Drosophila durante la fase pupale, che prevede la rimozione completa del pupario. Il metodo prevede la rimozione del pupario da una pupa aderente a nastro biadesivo, seguito dall'assemblaggio di una piccola camera su un piatto con fondo di vetro per racchiudere la pupa e una goccia d'acqua. Questa configurazione è semplice, affidabile e supporta una maggiore sopravvivenza delle pupe prevenendo l'essiccazione. L'imaging dal vivo a lungo termine della pupa di Drosophila ha contribuito in modo significativo a catturare il modo in cui la zampa adulta subisce drammatici cambiamenti strutturali tridimensionali nell'arco di 2-3 giorni. Questi cambiamenti includono la formazione transitoria di una struttura intrigante (la struttura simile al Partenone) da parte delle cellule epiteliali, il rapido restringimento dei tessuti, la formazione di articolazioni e l'allungamento delle setole. Questo metodo è applicabile all'osservazione di vari tessuti e può potenzialmente essere combinato con altre tecniche, come l'induzione genica ottica, per far progredire la comprensione della dinamica cellulare durante la formazione della forma finale dei tessuti allo stadio pupale.
Introduzione
Nonostante i notevoli progressi compiuti negli ultimi decenni nel chiarire il meccanismo della determinazione del destino cellulare, il modo in cui le cellule determinate dal destino costruiscono forme strutturali tridimensionali è ancora sfuggente. Grazie ai miglioramenti tecnologici nella microscopia confocale, negli ultimi anni sono aumentati i tentativi di svelare la dinamica cellulare durante lo sviluppo mediante imaging dal vivo 1,2. La pupa di Drosophila melanogaster è stata preferita per l'imaging dal vivo a causa delle sue caratteristiche adatte: immobilità, trasparenza della cuticola pupale e disponibilità di linee reporter fluorescenti 3,4,5. Il più grande ostacolo all'esecuzione di immagini dal vivo della pupa di Drosophila è il pupario (custodia pupale), la cuticola larvale dello stadio finale deformata e abbronzata che circonda la pupa. Per evitare l'ostruzione ottica, il pupario è stato parzialmente o completamente rimosso nei metodi precedentemente riportati 1,2,3,4,5,6,7,8,9,10. La rimozione completa del pupario massimizza l'area di osservazione e l'applicabilità a vari tessuti. Tuttavia, la pupa senza il suo pupario muore in genere entro circa mezza giornata, presumibilmente a causa dell'essiccazione. Pertanto, il mantenimento dell'umidità della pupa è fondamentale per l'imaging dal vivo prolungato. Mentre la durata esatta della sopravvivenza delle pupe dopo la rimozione completa del pupario nei metodi precedenti non è chiara, gli esempi riportati duravano in genere fino a circa 20 ore. Poiché lo stadio pupale dura circa quattro giorni, ci si aspettava che un metodo per l'imaging dal vivo ancora più lungo contribuisse a catturare l'intero processo di formazione della forma dei tessuti.
La gamba adulta di Drosophila è un modello eccellente per studiare il processo di formazione della forma tridimensionale dei tessuti. Deriva dai primordi a forma di disco (disco delle zampe) che si formano durante gli stadi larvali. Le regioni corrispondenti a ciascun segmento della zampa adulta sono determinate dallo stadioprepupale 11. Quindi, il disco della gamba sporge dalla parte centrale per formare una struttura tubolare gonfia circa 11 ore dopo la formazione del pupario (APF). Come questo tessuto, con la sua forma semplice, raggiunga la sua forma finale della zampa adulta nelle fasi successive è rimasto poco chiaro per molto tempo. Diversi studi su questo tema sono stati pubblicati 12,13,14. Poiché osservavano tessuti fissi o in coltura, non era possibile tracciare cambiamenti continui nelle singole cellule e le informazioni ottenute erano in qualche modo frammentate. Per comprendere appieno il processo di modellazione, è essenziale osservare continuamente i cambiamenti nelle singole cellule attraverso l'imaging dal vivo a lungo termine.
Uno studio recente ha svelato la deformazione dinamica delle strutture tridimensionali a livello tissutale e cellulare mediante imaging dal vivo a lungo termine (Figura 1). La scoperta più intrigante di questo studio è la formazione transitoria di una struttura inaspettatamente complessa da parte delle cellule epiteliali. Questa struttura, chiamata "struttura simile al Partenone", presenta proiezioni apicobasali e connessioni basali a rete di cellule epiteliali. È importante sottolineare che la formazione e la scomparsa di questa struttura coincide con un rapido restringimento dei tessuti15. La successiva formazione della forma, compresa la formazione dell'articolazione e l'allungamento delle setole, è proseguita per 2-3 giorni. L'imaging dal vivo a lungo termine ha catturato efficacemente l'intera storia di questi eventi sequenziali durati giorni.
Questo articolo fornisce un metodo passo dopo passo per eseguire l'imaging dal vivo della zampa di Drosophila durante lo stadio pupale con la rimozione completa del pupario. Il metodo è facile da seguire e può essere applicato a vari altri tessuti.
Protocollo
Questo protocollo utilizza ceppi di Drosophila melanogaster che esprimono reporter fluorescenti15. I dettagli dei reagenti e delle attrezzature utilizzate nello studio sono elencati nella tabella dei materiali.
1. Preparazione della pupa
- Con un pennello, raccogliere le pupe bianche del ceppo desiderato di Drosophila melanogaster dalle fiale e metterle in piatti o fiale vuote (Figura 2A).
NOTA: In questo studio, "pupe bianche" si riferisce allo stadio tra quando la larva diventa completamente immobile e prima che il pupario diventi marrone. Questa fase dura circa 30 minuti a 25 °C. - Incubare le pupe bianche per almeno 14 ore a 25 °C fino a quando non si sviluppano nello stadio da osservare (Figura 2B).
NOTA: Il pupario può essere rimosso solo dopo che la cuticola pupale è stata completamente formata a 12-13,5 h APF e facilmente rimosso solo dopo 14 h APF. - Pulisci la colla e allontana il cibo dal pupario con un pennello imbevuto di acqua distillata.
NOTA: Il lato ventrale del pupario deve essere particolarmente pulito per ottenere un'adesione sufficiente al nastro biadesivo nelle fasi successive. - Posizionare le pupe sulle salviette detergenti per alcuni minuti ad asciugare.
NOTA: L'umidità residua sul pupario impedirebbe una buona adesione a un nastro biadesivo. - Fissa un pezzo di nastro biadesivo su un vetrino.
- Posizionare le pupe essiccate su un nastro biadesivo con il lato ventrale rivolto verso il basso (Figura 2C).
- Spingere delicatamente il lato dorsale delle pupe con un pennello asciutto per ottenere una migliore adesione al nastro biadesivo.
- Sotto uno stereomicroscopio, aprire con cautela l'opercolo con un paio di pinze (Figura 2 D,E).
NOTA: L'opercolo è la regione antero-dorsale del pupario da cui fuoriesce la mosca adulta, aprendosi così facilmente. - Dal bordo dell'opercolo aperto, inserire una delle punte della pinza nello spazio tra la pupa e il pupario (Figura 2F).
NOTA: Fare attenzione a non danneggiare la cuticola pupale con la punta del forcipe. - Afferrare il pupario con una pinza e tirarlo verso l'esterno finché non si apre.
- Sollevare i frammenti strappati del pupario con una pinza e farli aderire al nastro biadesivo (Figura 2G).
- Ripetere i passaggi 1.10-1.11 fino a quando l'apertura del pupario raggiunge l'estremità posteriore, lasciando una piccola porzione del pupario (Figura 2 H,I).
NOTA: Se il liquido fosse uscito da una pupa, sarebbe stato danneggiato (Figura 2K). Per osservare il normale sviluppo, evitare di eseguire l'imaging di pupe danneggiate.
2. Configurazione dell'imaging
- Mettere 1 μL di acqua distillata o olio di silicone (quando si utilizza una lente a immersione in silicone) sul fondo di un piatto con fondo di vetro.
- Immergere un pennello nell'acqua distillata e raccogliere delicatamente la pupa (Figura 2J).
- Posizionare la pupa con il lato ventrale rivolto verso il basso sull'acqua distillata o sull'olio di silicone (Figura 2L).
- Con una micropipetta, mettere 10 μl di acqua distillata vicino al bordo della parte di vetro del piatto con fondo di vetro (Figura 2L).
- Posizionare un cerchio di grasso siliconico con una siringa attorno al bordo della parte di vetro del piatto con fondo di vetro (Figura 2M).
- Applicare un vetrino coprioggetti sul grasso siliconico per sigillarlo (Figura 2M). L'assemblaggio è illustrato nella Figura 2N.
NOTA: Assicurarsi che non vi siano spazi vuoti tra il vetrino coprioggetti e il grasso al silicone.
3. Imaging confocale
- Accendi un microscopio laser confocale invertito e un software di imaging.
- Posizionare il piatto sul tavolino accettore di un microscopio confocale invertito.
- Trova le pupe con un obiettivo a basso ingrandimento nell'osservazione in campo chiaro. Assicurarsi che le pupe non mostrino alcuna perdita di liquido corporeo.
- Centrare l'area desiderata della pupa da osservare nella regione di interesse (ROI).
NOTA: I lati anterolaterali del tarso nella prima e nella seconda zampa, e il lato ventrale del tarso nella terza zampa, sono orientati verso il lato ventrale della pupa. Pertanto, la sezione longitudinale del tarso lungo l'asse dorso-ventrale può essere osservata nella prima e nella seconda zampa, mentre quella lungo l'asse anteroposteriore può essere osservata nella terza gamba. - Sostituire la lente dell'obiettivo con quella per l'imaging dal vivo.
NOTA: Se si utilizza una lente a immersione in acqua, l'acqua tra la lente e il piatto con fondo di vetro si asciugherà durante l'osservazione a lungo termine. Si consiglia una lente ad immersione senza immersione o ad immersione in olio di silicone. - Regolare le condizioni per l'osservazione desiderata e avviare l'acquisizione dei dati.
NOTA: Per evitare danni alla pupa, le potenze del laser dovrebbero essere minime per quanto possibile ottenere immagini chiare. Ridurre al minimo il ROI e aumentare le dimensioni dei passi è utile per risparmiare tempo per l'acquisizione dello stack Z. La futura trasformazione del tessuto dovrebbe essere considerata quando si decide la profondità della pila Z. Nel caso dell'osservazione della gamba a 15-25 h APF, poiché la gamba si restringe molto, la parte più vicina al vetrino coprioggetti (epitelio laterale) si sposta rapidamente più in profondità. Considerando questo movimento, gli stack Z extra profondi dovrebbero essere impostati fin dall'inizio. Un esempio dell'impostazione del microscopio confocale per l'imaging dal vivo della regione tarsale della gamba da 15-30 ore APF è fornito nel file supplementare 1. Lo sbiadimento della fluorescenza è inevitabile durante l'imaging dal vivo a lungo termine. Per mitigare questo problema, è consigliabile utilizzare una potenza laser minima. Il plug-in ImageJ "AutoEnhance"16 è consigliato per l'elaborazione di dati di imaging in tempo reale per compensare gli effetti di dissolvenza.
Risultati
Qui viene descritto un esempio di imaging dal vivo 44 ore della zampa adulta di Drosophila in via di sviluppo allo stadio pupale. I moscerini che esprimono His2Av-mRFP17 (nuclei marcatori) e sGMCA18 (proteina legante l'actina Moesina marcata con GFP, actina marcante) sono stati raccolti allo stadio di pupa bianca e incubati per 15 ore a 25 °C. Il pupario è stato rimosso e montato secondo il protocollo (Figura 2). Le immagini Z stack del tarso e del pretarso, vicino alla punta della zampa, sono state ottenute con successo ogni 15 minuti da 16 h a 60 h APF a temperatura ambiente (non rigorosa, ma vicina a 25 °C). La prima metà della serie di immagini è mostrata nella Figura 3, la seconda metà nella Figura 4 e il filmato dell'intera immagine nel Filmato 1. Mentre il tessuto delle gambe si restringeva rapidamente, le cellule epiteliali formavano transitoriamente una struttura intrigante, la struttura simile al Partenone, caratterizzata dalle sue proiezioni apicobasali e dalle connessioni basali (Figura 3). La riduzione dello spessore epiteliale è stata osservata anche dopo che il contorno era quasi completato (Figura 4). L'intero processo è illustrato nella Figura 1.
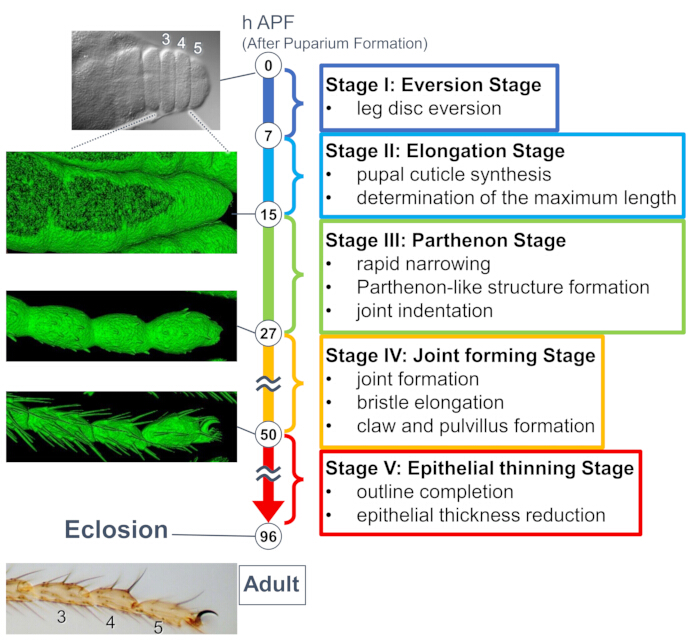
Figura 1: La panoramica della formazione della forma finale del tarso adulto di Drosophila durante lo stadio pupale. L'intero processo è stato suddiviso in cinque fasi basate sui cambiamenti morfologici a livello tissutale e cellulare osservati negli esperimenti di imaging dal vivo a lungo termine. Sul lato sinistro vengono mostrate foto rappresentative o immagini renderizzate in superficie (segnale sGMCA) corrispondenti a diversi punti temporali. Brevi descrizioni degli eventi di ogni tappa sono scritte sul lato destro. Questa cifra è stata modificata da Hiraiwa et al.15. Vedere anche Filmato 1. Clicca qui per visualizzare una versione più grande di questa figura.
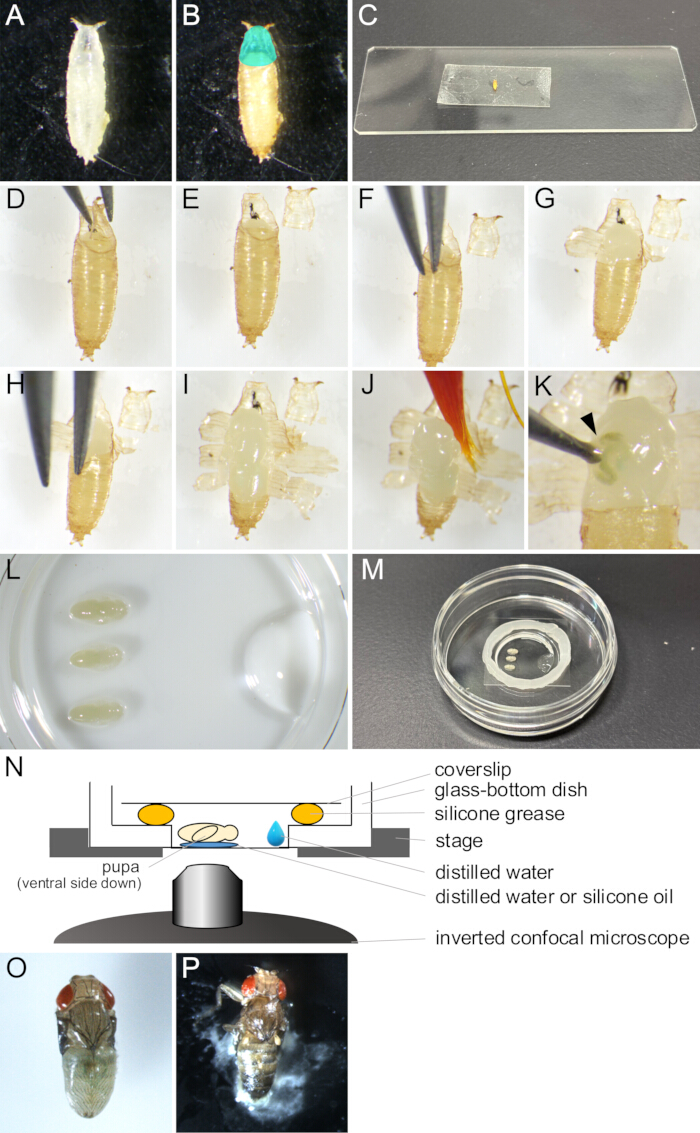
Figura 2: Rimozione del pupario e montaggio per l'imaging dal vivo. (A) Una pupa bianca raccolta in un piatto. (B) La pupa è apparsa in (A) dopo un'incubazione di 15 ore a 25 °C. La regione colorata di ciano indica l'opercolo. (C) Una fotografia che mostra una pupa attaccata a un pezzo di nastro biadesivo. (D-J) Serie di immagini che mostrano la procedura di rimozione del pupario. (D) L'opercolo viene sollevato con una pinza. (E) L'opercolo viene rimosso. (F) Una punta di pinza viene inserita tra la cuticola pupale e il pupario. (G) Il pupario è parzialmente aperto. (H) Viene inserita nuovamente la punta di una pinza. (I) Il pupario si aprì, lasciando solo una piccola parte dell'estremità posteriore. (J) La pupa viene sollevata con un pennello. (K) Un esempio di perdita di liquido corporeo della pupa. Il liquido che fuoriesce dalla ferita colpita dalla punta di una pinza è indicato da una punta di freccia. (L-N) Immagini e illustrazioni che mostrano il montaggio della montatura. (L) Un'immagine vista dall'alto che mostra pupe posizionate e acqua distillata sul fondo di un piatto con fondo di vetro. (M) La parabola dopo il completamento dell'assemblaggio della montatura. Il grasso siliconico è stato messo lungo il bordo intorno alla parte di vetro e un vetrino coprioggetti è stato posizionato sul grasso per sigillarlo. (N) Disegno schematico del gruppo di montaggio della pupa di Drosophila per l'imaging dal vivo a lungo termine. (O) Una pupa montata si sviluppò quasi adulta. (P) Una pupa montata che si chiude. Clicca qui per visualizzare una versione più grande di questa figura.
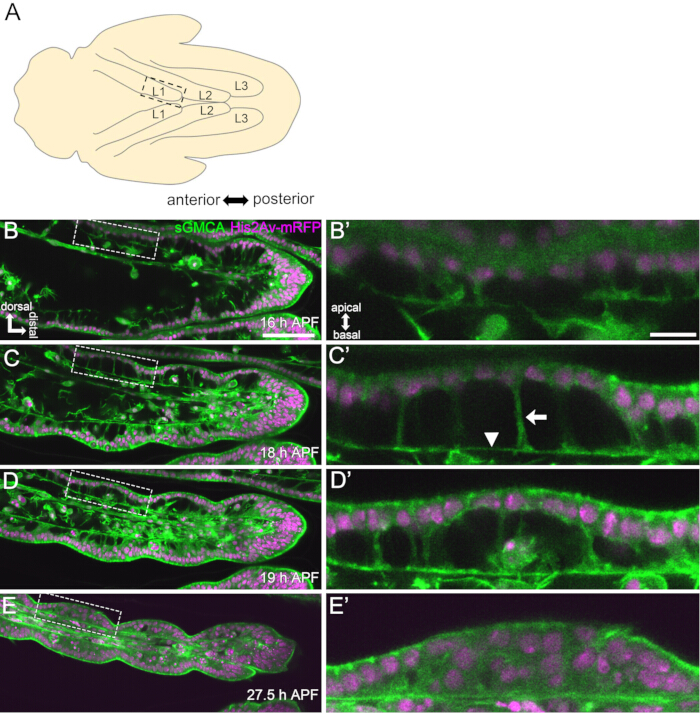
Figura 3: Cambiamenti dinamici di forma nelle cellule epiteliali tarsali in 16-27,5 ore APF. (A) Un'illustrazione della pupa vista dal lato ventrale. Il rettangolo tratteggiato corrisponde alla regione osservata in (B-E). L1: prima gamba, L2: seconda gamba, L3: terza gamba. (B,C,D,E) Immagini dal vivo della parte distale del tarso nella mosca che esprime sGMCA (verde) e His2Av-mRFP (magenta). Il tessuto si restringe rapidamente e la rientranza delle regioni articolari progredisce. (B',C',D',E') Ingrandimento delle regioni circondate dalle linee tratteggiate in (B,C,D,E), rispettivamente. La freccia e la punta della freccia in (C') mostrano rispettivamente un esempio di proiezioni apicobasali e la posizione delle connessioni basali. La struttura simile al Partenone inizia a formarsi in (B'), si forma completamente in (C'), inizia a scomparire in (D') e diventa difficile da vedere in (E'). La parte distale è a destra e quella dorsale verso l'alto in tutte le figure. Le fasi sono mostrate negli angoli in basso a destra in (B,C,D,E). Barre di scala: B,C,D,E: 50 μm; B',C',D',E': 10 μm. Questa cifra è stata modificata da Hiraiwa et al.15. Vedere anche Filmato 1. Clicca qui per visualizzare una versione più grande di questa figura.
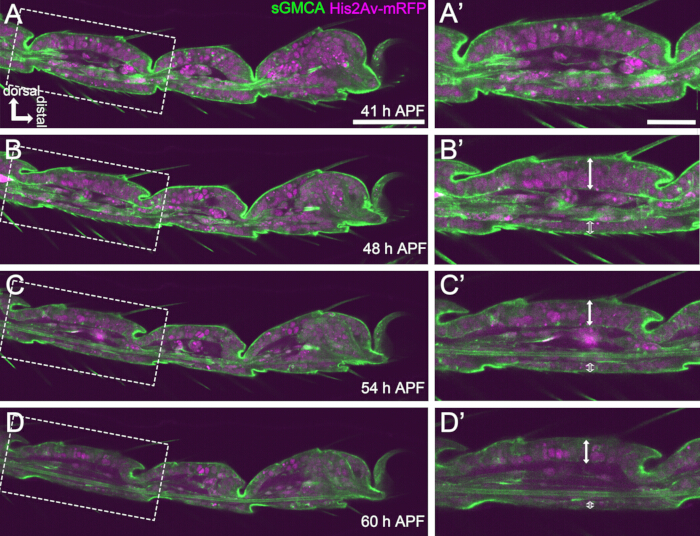
Figura 4: Cambiamenti di forma nello strato di cellule epiteliali tarsali in 41-60 ore APF. (A,B,C,D) Immagini fisse dallo stesso set di dati sequenziali di imaging dal vivo della Figura 3. I rettangoli tratteggiati in (A,B,C,D) vengono ingranditi rispettivamente in (A',B',C',D'). Entro circa 48 ore di APF (A-B'), la formazione della forma esterna, come l'allungamento di setole, artigli e pulvilli, è quasi completa. La parte inferiore dell'articolazione invaginata si è mossa prossimalmente e quindi la formazione della struttura sferica è progredita dopo circa 54 ore di APF. La differenza morfologica tra l'epitelio dorsale e quello ventrale divenne evidente (doppie frecce e doppie frecce aperte in B',C',D'). Dopo 54 ore di APF (C-D'), lo strato epiteliale ha diminuito il suo spessore senza modificare quasi mai il contorno dei segmenti. La dorsale è in alto e distale a destra in tutte le figure. Barre scala: A,B,C,D: 50 μm; A',B',C',D': 20 μm.Questa cifra è stata citata da Hiraiwa et al.15. Vedere anche Filmato 1. Clicca qui per visualizzare una versione più grande di questa figura.
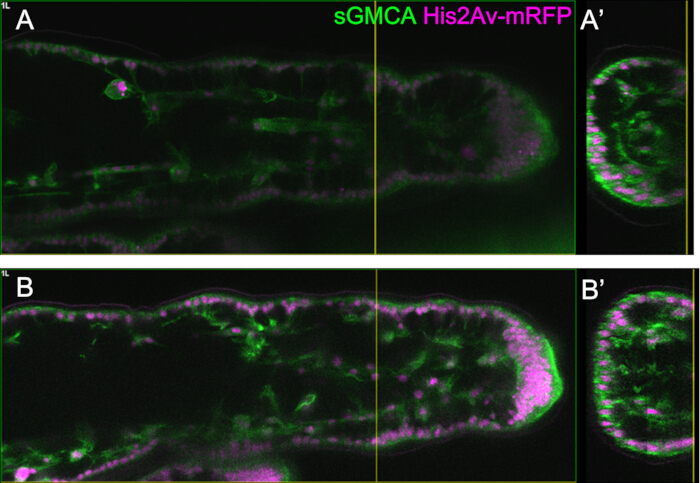
Figura 5: Un esempio di osservazione delle gambe utilizzando la funzione Z luminosa. (A,B) Immagini della regione, della profondità e dello stadio corrispondenti della terza gamba della mosca che esprime sGMCA (verde) e His2Av-mRFP (magenta), con (B) o senza (A) utilizzando la funzione Z luminosa. (A) Un piano XY a 59,1 μm di profondità estratto dall'osservazione della regione tarsale nel terzo segmento a 16 ore di APF acquisito senza utilizzare la funzione Bright Z. (A') La vista in sezione trasversale corrisponde alla linea verticale gialla in (A). La linea verticale in (A') indica il piano focale di (A). (B) Un piano XY a 61,6 μm di profondità estratto dall'osservazione della regione tarsale nel terzo segmento a 16 h APF acquisito utilizzando la funzione Bright Z. Sono state regolate sia la tensione PMT che la potenza del laser. La visibilità dell'immagine è migliorata rispetto a (A). (B') La vista in sezione corrisponde alla linea verticale gialla in (B). La linea verticale gialla in (B') indica il piano focale di (B). Clicca qui per visualizzare una versione più grande di questa figura.
File supplementare 1: Un esempio dell'impostazione del microscopio confocale per l'imaging dal vivo della regione tarsale della gamba da 15-30 h APF. Clicca qui per scaricare questo file.
Filmato 1: Imaging dal vivo a lungo termine della parte distale del tarso per 44 ore. Sono stati utilizzati il moscerino che esprime sGMCA (verde) e His2Av-mRFP (magenta). Il piano XY più rappresentativo è stato estratto dallo stesso set di dati della Figura 3 e della Figura 4. Le punte di freccia indicano esempi di future regioni congiunte. Le cellule che si muovono rapidamente nel tessuto sono cellule simili ai macrofagi. Il segnale simile a una corda che si estende lungo i segmenti tarsali è una parte del setto. Il timestamp mostra hh: mm. Distale è a destra e dorsale verso l'alto. Questo film è stato adattato da Hiraiwa et al.15Clicca qui per scaricare questo file.
Discussione
In questo articolo, viene fornito un protocollo dettagliato per l'imaging dal vivo a lungo termine della zampa di Drosophila allo stadio pupale. Il disco immaginale della zampa sporge dalla parte centrale per formare una struttura tubolare, e quindi la formazione della forma finale della zampa adulta avviene nello stadio pupale in un modo che era stato sfuggente. I precedenti tentativi di osservare questo processo sono stati principalmente mediante colorazione fissa, coltura tissutale e microscopio elettronico a scansione 12,13,14. Questi metodi non potevano tracciare i cambiamenti continui nelle singole cellule e si ottenevano solo informazioni frammentarie. Con il metodo descritto in questo studio, il processo di formazione della forma finale della regione tarsale può essere osservato con successo come l'imaging sequenziale dal vivo di giorni con un microscopio confocale e i cambiamenti nelle singole cellule possono essere monitorati continuamente. Le intriganti dinamiche cellulari rivelate da queste immagini dal vivo sono state descritte in dettaglio nel recente rapporto15.
Per il successo dell'imaging dal vivo a lungo termine, è fondamentale mantenere la vitalità della pupa e garantire che il suo sviluppo rimanga inalterato. Nel metodo qui descritto, la pupa rimossa dal pupario si è sviluppata nell'adulto del falato e in molti casi nell'adulto (Figura 2O,P). I tempi dei cambiamenti morfologici del tarso in via di sviluppo osservati con questo metodo erano coerenti con i rapporti precedenti 12,13,14. Inoltre, le cellule epiteliali hanno mostrato cambiamenti come la riduzione dello spessore anche in 48-60 h APF (32-44 h dopo il montaggio) (Figura 4B'-D'). Questi fatti suggeriscono che la pupa rimane intatta e non subisce quasi nessuna interruzione o ritardo nel suo normale sviluppo durante l'imaging dal vivo a lungo termine utilizzando il metodo qui descritto. Si prega di notare che la vitalità della pupa rimossa dal pupario sottoposta a imaging dal vivo può variare a seconda dei tempi della rimozione del pupario, della manipolazione nella procedura, dell'entità della fototossicità nell'imaging e dei ceppi di mosca utilizzati.
Uno dei passaggi critici per garantire l'integrità della pupa e il suo sviluppo è la rimozione del pupario senza danneggiare la pupa. L'adesione stabile della pupa al nastro biadesivo e l'attenta manipolazione delle pinze sono le chiavi del successo. Anche prevenire la disidratazione della pupa è fondamentale. A questo proposito, evitare spazi vuoti tra il vetrino coprioggetti e il grasso siliconico è fondamentale.
Per evitare l'essiccazione della pupa, molti metodi precedenti prevedevano la rimozione parziale del pupario 1,2,3,4,5,6,7. Per l'osservazione dell'intera pupa, tuttavia, è favorita la rimozione completa del pupario. Sebbene il tempo massimo di sopravvivenza della pupa non sia noto, sono stati riportati diversi metodi in cui il pupario viene completamente rimosso 8,9,10. L'approccio più comune per fornire umidità alla pupa in questi metodi è l'uso di carta da filtro inumidita. Rispetto ai metodi precedenti, quello qui descritto fornisce umidità mettendo una goccia d'acqua in modo più semplice e facile. Inoltre, molti metodi precedenti prevedono il montaggio della pupa su un vetrino. Quando si monta la pupa rimossa su un vetrino, può esserci un problema in cui premere il vetrino coprioggetti contro la pupa provoca stress alla pupa, oppure un vetrino coprioggetti inclinato introduce rumore, distorsioni e mancanza di chiarezza nelle immagini. Il metodo qui descritto impiega un piatto con fondo di vetro, che elimina la necessità di premere il vetrino coprioggetti contro la pupa, consentendo l'osservazione dei tessuti il più vicino possibile al loro stato naturale. Poiché non è necessario regolare l'angolazione del vetro di copertura, la configurazione è stabile, facile da maneggiare e più affidabile. Pertanto, questo metodo non richiede quasi nessuna competenza specializzata, consentendo anche ai principianti di eseguire con successo l'imaging dal vivo.
I principali limiti di questo metodo sono la profondità delle osservazioni e le risoluzioni temporali. Nelle condizioni per l'osservazione del tarso, è possibile ottenere immagini nitide solo fino a circa 40 μm di profondità. L'uso della funzione Z luminosa aiuta a risolvere questo problema. Ad esempio, come mostrato nella Figura 5, l'aumento della potenza del laser e della tensione PMT all'aumentare della profondità utilizzando la funzione Z luminosa ha migliorato la qualità delle immagini in posizioni più profonde. Tuttavia, l'aumento della potenza del laser comporta un compromesso che coinvolge la fototossicità e lo sbiadimento del segnale. Pertanto, è necessario trovare le condizioni ottimali che si allineino con lo scopo dell'osservazione. La risoluzione temporale è importante anche quando si osservano cellule e tessuti in rapido movimento. La riduzione delle fette e il restringimento del ROI sono le soluzioni principali per questo problema. L'utilizzo di apparecchiature aggiornate con una migliore sensibilità del rivelatore o di un microscopio confocale a disco rotante può migliorare la risoluzione temporale. Un'altra limitazione riguarda lo stadio della pupa. Il pupario può essere rimosso solo dopo che la cuticola pupale è stata completamente formata a 12-13,5 h APF19e può essere facilmente rimosso solo dopo 14 h APF. Gli stadi precedenti alle 12 ore di APF possono essere parzialmente osservati montando la pupa senza rimuovere il pupario15, anche se ottenere immagini chiare è difficile a causa dei rapidi movimenti dei tessuti e degli ostacoli ottici da parte del pupario in questa condizione.
Risoluzione dei problemi
Difficoltà nella rimozione del pupario
Durante la rimozione del pupario, è importante l'adesione del lato ventrale del pupario al nastro biadesivo. La colla e il cibo devono essere rimossi dalla superficie del pupario e la successiva asciugatura è importante poiché le superfici bagnate impediscono una buona adesione. In particolare, il nastro biadesivo nella tabella dei materiali ha un'adesione più forte sul lato interno. Il lato interno (più forte) dovrebbe essere usato per far aderire la pupa. Tagliare il pupario con le forbici da dissezione invece di strapparlo con una pinza è utile quando la rimozione del pupario è difficile.
Perdita di liquido dalla pupa
È fondamentale rimuovere il pupario senza danneggiare la pupa. La fuoriuscita del liquido corporeo della pupa indica un danno alla pupa (Figura 2K). Tale pupa dovrebbe essere evitata dall'imaging dal vivo. Per evitare danni alle pupe durante la rimozione del pupario, oltre a un'attenta manipolazione, si consiglia l'uso di pinze con punte relativamente larghe.
Scarsa qualità dell'immagine
Quando il segnale fluorescente è troppo debole, ci sono molti modi per regolare la luminosità, come aumentare la tensione PMT, aprire il foro stenopeico (C.A.), rallentare la velocità di scansione e aumentare la potenza del laser. Si ricorda che ogni metodo ha effetti collaterali: l'aumento della tensione PMT può aumentare il rumore, l'apertura del foro stenopeico riduce la risoluzione dell'asse Z, il rallentamento della velocità di scansione allunga il tempo di scansione e l'aumento della potenza del laser aumenta il rischio di fototossicità e sbiancamento. È necessario trovare le impostazioni appropriate a seconda della regione di interesse, del tipo e dei livelli di espressione dei reporter fluorescenti e della durata desiderata dell'imaging dal vivo. Nel complesso, si consiglia di ridurre al minimo la potenza del laser per l'imaging dal vivo a lungo termine.
Sbiadimento della fluorescenza
Il fading della fluorescenza è inevitabile nell'imaging dal vivo a lungo termine. Si consiglia un uso minimo della potenza del laser per evitare questo problema. Per compensare lo sbiadimento, si consiglia il plug-in ImageJ "AutoEnhance"16 durante l'elaborazione dei dati di imaging in tempo reale acquisiti.
Grazie alla rimozione completa del pupario, questo metodo è altamente applicabile ad altri tessuti semplicemente modificando il ROI e l'orientamento della pupa. Infatti, anche se non si tratta di immagini dal vivo, la parte prossimale della gamba, la proboscide, l'epitelio della testa vicino all'antenna e l'epitelio del torace dorsale sono stati osservati con questo metodo in Hiraiwa et al.15. Tale applicabilità a un'ampia gamma di tessuti può facilitare un'ulteriore integrazione con altre tecniche, come l'induzione ottica dei geni. Questo metodo può essere applicabile anche a specie ciclorrhaphan (che formano puparium) diverse da Drosophila. Inoltre, potrebbe potenzialmente essere utilizzato per altre specie di insetti se hanno una cuticola pupale trasparente. Questo articolo fornisce istruzioni dettagliate ai ricercatori di Drosophila per eseguire l'imaging dal vivo della pupa per catturare la dinamica cellulare nei tessuti vivi.
Divulgazioni
Gli autori dichiarano di non avere interessi concorrenti.
Riconoscimenti
Siamo grati al Dr. Masayuki Miura (Università di Tokyo) e al Dr. Yuya Fujisawa (Università di Tokyo) per la consulenza tecnica, e ringraziamo il Bloomington Stock Center per le risorse di volo.
Materiali
| Name | Company | Catalog Number | Comments |
| 35 mm/glass base dish | IWAKI | 3911-035 | |
| Cleaning wipes | NIPPON PAPER CRECIA | S-200 | |
| Dumont #3c Forceps | Fine Science Tools | 11231-20 | |
| Dumont #5SF | Fine Science Tools | 11252-00 | |
| Eppendorf Research plus 2-20 µL | Eppendorf | 3123000098 | |
| Fly strain: His2Av-mRFP, sGMCA | Bloomington Drosophila Stock Center | 59023 | |
| FV3000 | EVIDENT | inverted confocal microscope | |
| FV31S-SW | EVIDENT | software for FV3000 | |
| G40L | Shin-Etsu Silicone | silicone grease | |
| Micro Cover Glass 18 x 18 mm 0.13-0.17 mm | MATSUNAMI | C018181 | |
| Micro Slide Glass 76 x 26 mm 0.9-1.2 mm | MATSUNAMI | S7213 | |
| NEO-SABLE Size 0 round, fine | Pentel | XZBNR-0 | paintbrush |
| SIL300CS-30CC | EVIDENT | silicone oil | |
| Stereomicroscope System SZX7 | EVIDENT | ||
| Terumo syringe 50 mL | Terumo | SS-50ESZ | |
| Transparent double sided tape | Scotch | 665-1-12 | Since the inner layer has stronger adhesion than the outer layer, the inner layer should be used to fix pupae. |
| UPLSAPO10x | EVIDENT | ||
| UPLSAPO40XS | EVIDENT | silicone immersion lens | |
| Vannas Spring Scissors - 2.5mm Cutting Edge | Fine Science Tools | 15000-08 | optional |
Riferimenti
- Koto, A., Kuranaga, E., Miura, M. Temporal regulation of Drosophila IAP1 determines caspase functions in sensory organ development. J Cell Biol. 187 (2), 219-231 (2009).
- Ninov, N., Martín-Blanco, E. Live imaging of epidermal morphogenesis during the development of the adult abdominal epidermis of Drosophila. Nat Protoc. 2 (12), 3074-3080 (2007).
- Chiba, M., et al. Activatable photosensitizer for targeted ablation of lacZ-positive cells with single-cell resolution. ACS Cent Sci. 5 (11), 1676-1681 (2019).
- Umetsu, D., et al. Local increases in mechanical tension shape compartment boundaries by biasing cell intercalations. Curr Biol. 24 (16), 1798-1805 (2014).
- Tran, N. V., et al. Programmed disassembly of a microtubule-based membrane protrusion network coordinates 3D epithelial morphogenesis in Drosophila. EMBO J. 43 (6), 568-594 (2024).
- Hellerman, M. B., Choe, R. H., Johnson, R. I. Live-imaging of the Drosophila pupal eye. J Vis Exp. (95), e52120 (2015).
- O'Connor, J. T., Shannon, E. K., Hutson, M. S., Page-McCaw, A. Mounting Drosophila pupae for laser ablation and live imaging of the dorsal thorax. STAR Protoc. 3 (2), 101396 (2022).
- Ziserman, D., Roegiers, F. Live-cell imaging of sensory organ precursor cells in intact Drosophila pupae. J Vis Exp. (51), e2706 (2011).
- Tögel, M., Pass, G., Paululat, A. In vivo imaging of Drosophila wing heart development during pupal stages. Int J Dev Biol. 57 (1-2), 13-24 (2013).
- Weavers, H., Franz, A., Wood, W., Martin, P. Long-term in vivo tracking of inflammatory cell dynamics within Drosophila pupae. J Vis Exp. (136), e57871 (2018).
- Kojima, T. Developmental mechanism of the tarsus in insect legs. Curr Opin Insect Sci. 19, 36-42 (2017).
- Mirth, C., Akam, M. Joint development in the Drosophila leg: Cell movements and cell populations. Dev Biol. 246 (2), 391-406 (2002).
- Mirth, C. Ecdysteroid control of metamorphosis in the differentiating adult leg structures of Drosophila melanogaster. Dev Biol. 278 (1), 163-174 (2005).
- Tajiri, R., Misaki, K., Yonemura, S., Hayashi, S. Dynamic shape changes of ECM-producing cells drive morphogenesis of ball-and-socket joints in the fly leg. Development. 137 (12), 2055-2063 (2010).
- Hiraiwa, S., et al. Unveiling the cell dynamics during the final shape formation of the tarsus in Drosophila adult leg by live imaging. Dev Genes Evol. , (2024).
- . ImageJ plugin page Available from: https://signaling.riken.jp/en/en-tools/imagej/629/ (2024)
- Pandey, R., Heidmann, S., Lehner, C. F. Epithelial re-organization and dynamics of progression through mitosis in Drosophila separase complex mutants. J Cell Sci. 118 (4), 733-742 (2005).
- Kiehart, D. P., Galbraith, C. G., Edwards, K. A., Rickoll, W. L., Montague, R. A. Multiple forces contribute to cell sheet morphogenesis for dorsal closure in Drosophila. J Cell Biol. 149 (2), 471-490 (2000).
- Ashburner, M. . Drosophila: A Laboratory Handbook. , (1989).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon