Method Article
果 蝇 蛹切除后蛹腿部发育的长期实时成像
摘要
在这里,提出了一种方案,用于在蛹阶段对果 蝇 腿进行长期实时成像,包括完全去除蛹。该方案也可以应用于其他组织。
摘要
在过去的几十年里,在了解细胞命运决定的机制方面取得了重大进展。然而,命运决定的细胞形成三维生物形状的过程仍不清楚。共聚焦显微镜的最新进展有助于通过实时成像观察发育过程中的细胞动力学。 黑腹果蝇蛹 是实时成像的理想选择,因为它具有固定性、透明的蛹角质层和荧光报告细胞系的可用性。成像的主要挑战是蛹,即围绕蛹的角质层,它阻碍了光学成像。虽然以前的方法涉及部分或完全去除蛹,但在此手术后长时间保持蛹活力仍然具有挑战性。在这里,提出了一种简单的方法,用于在蛹阶段对 果蝇 腿部进行为期数天的实时成像,包括完全去除蛹。该方法包括从粘附在双面胶带上的蛹中取出蛹,然后在玻璃底盘上组装一个小腔室以包裹蛹和一滴水。这种设置简单、可靠,并通过防止干燥来支持延长蛹的存活时间。 果蝇 蛹的长期实时成像为捕捉成肢如何在 2-3 天内经历巨大的三维结构变化做出了重大贡献。这些变化包括上皮细胞短暂形成有趣的结构(帕台农神庙样结构)、组织快速变窄、关节形成和刷毛伸长。该方法适用于各种组织的观察,并有可能与其他技术(例如光学基因诱导)相结合,以促进对蛹期组织最终形状形成过程中细胞动力学的理解。
引言
尽管过去几十年来在阐明细胞命运决定的机制方面取得了长足的进步,但命运决定的细胞如何构建三维生物形状仍然难以捉摸。由于共聚焦显微镜的技术进步,近年来通过实时成像揭示显影过程中细胞动力学的尝试一直在增加 1,2。黑腹果蝇蛹因其合适的特性而受到实时成像的青睐:不动、蛹角质层透明以及荧光报告细胞系的可用性 3,4,5。对果蝇蛹进行实时成像的最大障碍是蛹(蛹壳),即围绕蛹的变形和晒黑的最终龄幼虫角质层。为避免视阻,在先前报道的方法 1,2,3,4,5,6,7,8,9,10 中部分或完全去除了蛹。完全去除蛹可最大限度地扩大观察区域和对各种组织的适用性。然而,没有蛹的蛹通常会在大约半天内死亡,可能是由于干燥。因此,保持蛹的水分对于延长实时成像至关重要。虽然在以前的方法中完全去除蛹后蛹存活的确切持续时间尚不清楚,但报道的实例通常持续长达约 20 小时。由于蛹期持续约 4 天,因此预计一种更长的实时成像方法将有助于捕获组织形状形成的整个过程。
果蝇成年腿是研究三维组织形状形成过程的优秀模型。它来源于幼虫阶段形成的圆盘状原基(腿盘)。对应于成肢中每个节段的区域由前蛹阶段11 决定。然后,腿盘在蛹形成 (APF) 后约 11 小时从中央部分突出,形成膨胀的管状结构。这种形状简单的组织如何在后续阶段实现成人腿部的最终形状,长期以来一直不清楚。已经发表了几项接近这个问题的研究 12,13,14。由于他们观察到固定或培养的组织,因此无法追踪单个细胞的连续变化,并且获得的信息有些碎片化。为了充分了解塑造过程,必须通过长期实时成像连续观察单个细胞的变化。
最近的一项研究通过长期实时成像揭示了组织和细胞水平上三维结构的动态变形(图 1)。这项研究中最有趣的发现是上皮细胞瞬时形成一个出乎意料的复杂结构。这种结构被称为“帕台农神庙样结构”,具有上皮细胞的顶基底突起和基底网状连接。重要的是,这种结构的形成和消失与组织快速变窄相吻合15。随后的形状形成,包括关节形成和刷毛伸长,持续 2-3 天。长期实时成像有效地捕捉了这些长达几天的连续事件的整个故事。
本文提供了一种分步方法,用于在蛹阶段对果 蝇 腿进行为期数天的实时成像,并完全去除蛹。该方法易于遵循,可应用于各种其他组织。
研究方案
该方案使用表达荧光报告基因的 黑腹果蝇 菌株15。材料 表中列出了研究中使用的试剂和设备的详细信息。
1. 蛹的准备
- 用画笔从小瓶中收集所需黑 腹果蝇 菌株的白色蛹,并将它们放入培养皿或空小瓶中(图 2A)。
注意:在这项研究中,“白色蛹”是指幼虫完全不动和蛹变成棕色之间的阶段。该阶段在 25 °C 下持续约 30 分钟。 - 将白色蛹在 25 °C 下孵育至少 14 小时,直到它们发育成要观察的阶段(图 2B)。
注意:只有在 12-13.5 小时 APF 中蛹角质层完全形成后才能去除蛹,并且只有在 14 小时 APF 后才能轻松去除。 - 用浸泡在蒸馏水中的画笔擦去胶水,将食物从蛹中飞走。
注意:蛹的腹侧应特别干净,以便在后续步骤中实现对双面胶带的充分粘合。 - 将蛹放在清洁湿巾上几分钟晾干。
注意:蛹上残留的水分会妨碍对双面胶带的良好粘合。 - 将一块双面胶带固定在载玻片上。
- 将干燥的蛹放在双面胶带上,腹侧朝下(图 2C)。
- 用干画笔轻轻推动蛹的背面,以达到更好的附着力。
- 在立体显微镜下,用一对镊子小心地打开鳃盖(图 2 D、E)。
注意:鳃盖是成蝇从蛹的前背区域出来,因此很容易打开。 - 从打开的鳃盖边缘,将镊子的一个尖端插入蛹和蛹之间的空间(图 2F)。
注意:小心不要用镊子的尖端损坏蛹的角质层。 - 用镊子抓住蛹并向外拉,直到它破裂。
- 用镊子提起撕裂的蛹碎片,并将它们粘在双面胶带上(图 2G)。
- 重复步骤 1.10-1.11,直到蛹的开口到达后端,留下一小部分蛹(图 2 H,I)。
注意:如果液体从蛹中流出,它就会受损(图 2K)。为了观察正常发育,请避免对受损的蛹进行成像。
2. 成像设置
- 将 1 μL 蒸馏水或硅油(使用硅浸透镜时)放在玻璃底培养皿的底部。
- 将画笔浸泡在蒸馏水中,轻轻舀起蛹(图 2J)。
- 将蛹腹侧朝下放在蒸馏水或硅油上(图 2L)。
- 用微量移液器,将 10 μL 蒸馏水放在玻璃底培养皿的玻璃部分边缘附近(图 2L)。
- 用注射器在玻璃底培养皿的玻璃部分边缘周围放置一圈硅脂(图 2M)。
- 在硅脂上盖上盖玻片以密封它(图 2M)。该组件如图 2N 所示。
注意:确保盖玻片和硅脂之间没有间隙。
3. 共聚焦成像
- 打开倒置共聚焦激光显微镜和成像软件。
- 将培养皿放在倒置共聚焦显微镜的载物台接收器上。
- 在明场观察中用低倍率物镜找到蛹。确保蛹没有出现任何体液泄漏。
- 将蛹的所需区域居中,以感兴趣区域 (ROI) 进行观察。
注意:第一和第二腿的跗骨前外侧和第三腿的跗骨腹侧朝向蛹的腹侧。因此,在第一和第二条腿中可以观察到沿背腹轴的跗骨纵切面,而在第三条腿中可以观察到沿前后轴的纵切面。 - 将物镜更改为用于实时成像的物镜。
注意:如果使用水浸透镜,在长期观察过程中,透镜和玻璃底皿之间的水会变干。建议使用免浸或硅油浸透镜。 - 调整所需观察的条件并开始数据采集。
注意:为防止对蛹造成任何伤害,激光功率应尽可能小,以获得清晰的图像。最小化 ROI 和增加步长有助于节省 Z 堆栈采集的时间。在决定 Z 堆栈的深度时,应考虑组织的未来转变。在 15-25 小时 APF 的腿部观察的情况下,由于腿部非常狭窄,因此最靠近盖玻片的部分(外侧上皮)迅速变深。考虑到这种运动,应该从第一个开始设置超深的 Z 堆栈。 补充文件 1 中提供了用于 15-30 小时 APF 腿部跗骨区域实时成像的共聚焦显微镜设置示例。在长期实时成像过程中,荧光衰落是不可避免的。为了缓解此问题,建议使用最小的激光功率。建议使用 ImageJ 插件“AutoEnhance”16 来处理实时成像数据以补偿淡化效果。
结果
在这里,描述了在蛹期发育中的 果蝇 成腿的 44 小时实时成像示例。在白色蛹期收集表达 His2Av-mRFP17 (标记核) 和 sGMCA18 (GFP 标记的肌动蛋白结合蛋白 Moesin,标记肌动蛋白) 的果蝇,并在 25 °C 下孵育 15 小时。 根据协议去除并安装蛹(图 2)。在室温(不严格,但接近 25 °C)下,从 16 小时到 60 小时 APF 每 15 分钟成功获得腿尖附近的跗骨和前跗骨的 Z 堆栈图像。该系列图像的前半部分如图 3 所示,后半部分如图 4 所示, 整个视频的影片如图 1 所示。随着腿部组织迅速变窄,上皮细胞瞬时形成一个有趣的结构,即帕台农神庙样结构,其特征是其顶基底突起和基底连接(图 3)。即使在轮廓几乎完成后,仍观察到上皮厚度的减少(图4)。整个过程如图 1 所示。
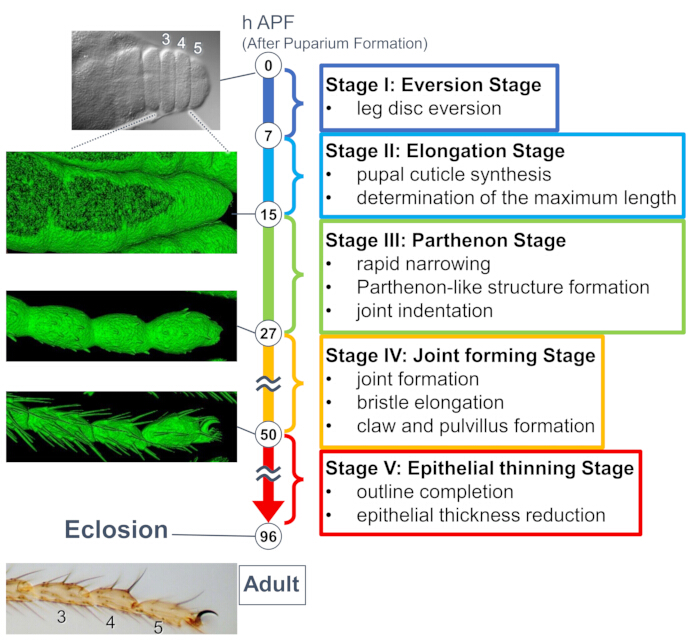
图 1:果蝇成跗在蛹阶段的最终形状形成概述。根据在长期实时成像实验中观察到的组织和细胞水平的形态变化,将整个过程分为五个阶段。对应于几个时间点的代表性照片或表面渲染图像(sGMCA 信号)显示在左侧。每个阶段的事件的简要描述写在右侧。该图是从 Hiraiwa et al.15 修改而来的。另请参阅影片 1。请单击此处查看此图的较大版本。
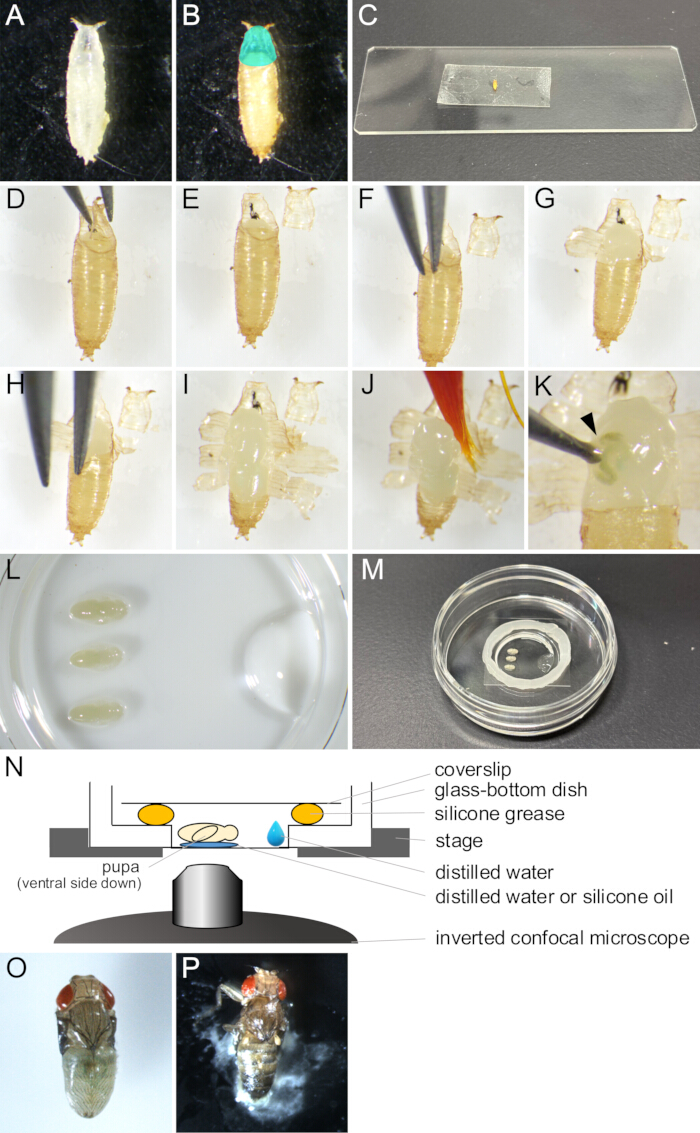
图 2:用于实时成像的蛹去除和安装组件。 (A) 在培养皿中收集的白色蛹。(B) 在 25 °C 下孵育 15 小时后,(A) 中的蛹显示。 青色区域表示鳃盖。(C) 一张显示蛹粘附在一张双面胶带上的照片。(D-J)显示蛹切除手术的一系列图像。(D) 用镊子提起鳃盖。(E) 鳃盖被切除。(F) 在蛹角质层和蛹之间插入镊子尖端。(G) 蛹部分打开。(H) 再次插入镊子尖端。(I) 蛹张开,只留下后端的一小部分。(J) 被画笔抬起的蛹。(K) 蛹体液渗漏的一个例子。用镊子尖端戳出的伤口流出的液体由箭头指示。(L-N)显示安装组件的图像和插图。(L) 从正面查看的图像,显示将蛹和蒸馏水放在玻璃底培养皿的底部。(M) 安装组件完成后的培养皿。沿着玻璃部分周围的边缘涂上硅脂,并在润滑脂上盖上盖玻片以密封它。(N) 用于长期实时成像的 果蝇 蛹安装组件的示意图。(O) 一个已安装的蛹发育得接近成年。(P) 上蛹脱落。 请单击此处查看此图的较大版本。
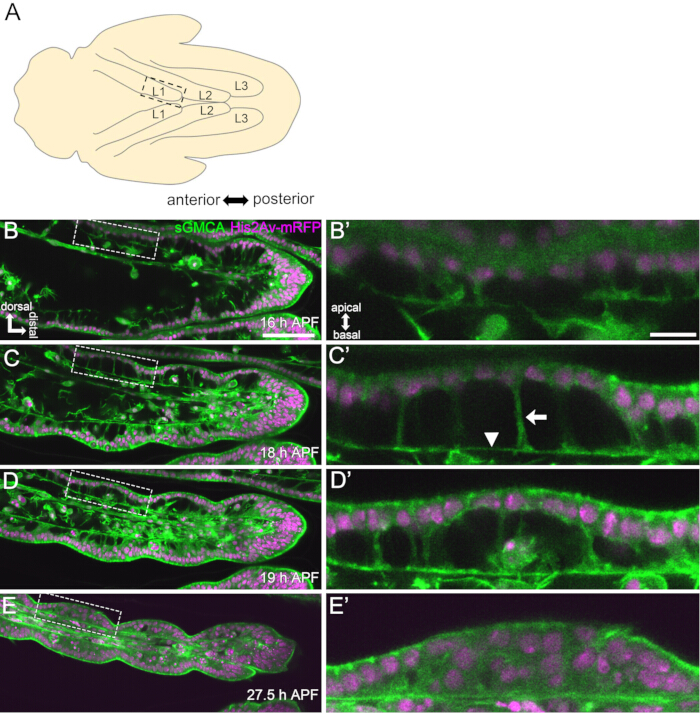
图 3:16-27.5 小时 APF 中睑上皮细胞的动态形状变化。(A) 从腹侧看到的蛹示意图。虚线矩形对应于在 (B-E) 中观察到的区域。L1:第一条腿,L2:第二条腿,L3:第三条腿。(B,C,D,E) sGMCA(绿色)和 His2Av-mRFP(洋红色)表达蝇的跗骨远端部分的实时成像静止图像。组织迅速变窄,关节区域的压痕进展。(B',C',D',E')分别放大 (B,C,D,E) 中虚线包围的区域。(C') 中的箭头和箭头分别显示了顶基底投影的示例和基底连接的位置。帕台农神庙状结构在 (B') 开始形成,在 (C') 完全形成,在 (D') 开始消失,在 (E') 变得难以看到。在所有图形中,远端在右侧,背侧在顶部。阶段显示在 (B,C,D,E) 的右下角。比例尺:B、C、D、E:50 μm;B',C',D',E':10 μm。该图是从 Hiraiwa et al.15 修改而来的。另请参阅影片 1。请单击此处查看此图的较大版本。
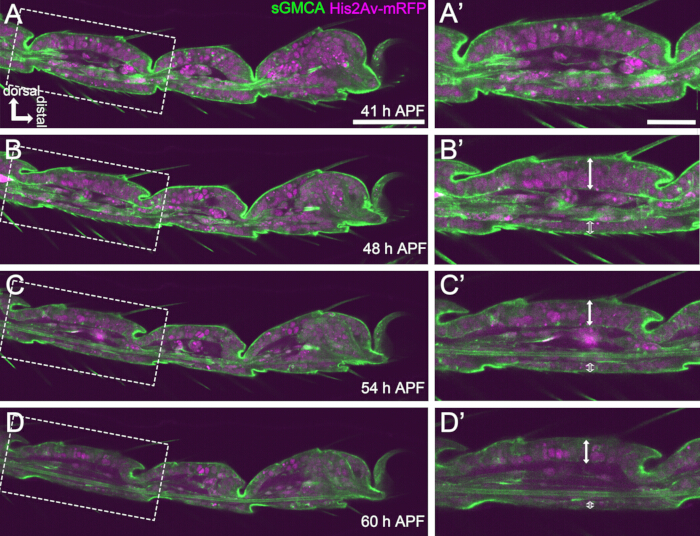
图 4:41-60 小时 APF 中睑上皮细胞层的形状变化。(A、B、C、D) 来自与图 3 相同的实时成像序列数据集的静止图像。(A,B,C,D) 中的虚线矩形分别在 (A',B',C',D') 中放大。到大约 48 小时 APF (A-B'),外部形状的形成,例如刷毛、爪和绒毛的伸长,几乎完成。内陷关节底部向近端移动,然后,球窝结构形成在大约 54 小时 APF 后进行。背上皮和腹上皮之间的形态差异变得明显(B'、C'、D' 中的双箭头和开放双箭头)。54 h APF (C-D') 后,上皮层厚度减小,但节段轮廓几乎没有改变。在所有图形中,背侧在顶部,远端在右侧。比例尺:A、B、C、D:50 μm;A',B',C',D':20 μm.该图引用自 Hiraiwa 等人15。另请参阅影片 1。请单击此处查看此图的较大版本。
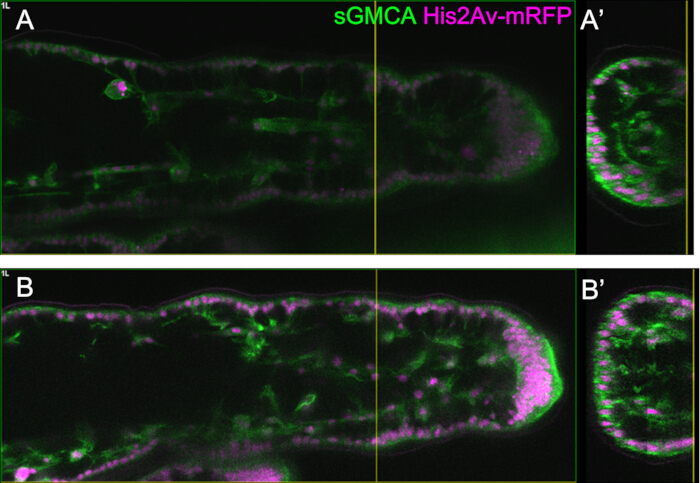
图 5:使用 Bright Z 功能进行腿部观察的示例。(A,B)使用亮 Z 功能,sGMCA(绿色)和 His2Av-mRFP(洋红色)的第三条腿(品红色)的相应区域、深度和阶段的图像,有 (B) 或没有 (A)。(A) 在未使用 Bright Z 函数的情况下,在 16 h APF 时从第三条腿的跗骨区域的观察中提取的 59.1 μm 深的 XY 平面。(一')横截面图对应于 (A) 中的黄色垂直线。(A') 中的垂直线表示 (A) 的焦平面。(B) 使用 Bright Z 函数在 16 h APF 时从第三条腿的跗骨区域的观察中提取的 61.6 μm 深的 XY 平面。PMT 电压和激光功率均已调整。与 (A) 相比,图像的可见性有所提高。(B')剖面图对应于 (B) 中的黄色垂直线。(B') 中的黄色垂直线表示 (B) 的焦平面。请单击此处查看此图的较大版本。
补充文件 1:用于 15-30 小时 APF 腿部跗骨区域实时成像的共聚焦显微镜设置示例。请点击此处下载此文件。
电影 1:跗骨远端部分的长期实时成像 44 小时。使用表达 sGMCA (绿色) 和 His2Av-mRFP (品红色) 的果蝇。最具代表性的 XY 平面是从与图 3 和图 4 相同的数据集中提取的。箭头表示未来关节区域的示例。组织中快速移动的细胞是巨噬细胞样细胞。沿跗节段延伸的弦状信号是隔膜的一部分。时间戳显示 hh: mm。远端在右侧,背侧在顶部。本电影改编自 Hiraiwa et al.15请单击此处下载此文件。
讨论
在本文中,提供了对蛹期果蝇腿进行长期实时成像的详细方案。腿部想象盘从中央部分突出,形成管状结构,然后成年腿的最终形状形成以一种难以捉摸的方式发生在蛹期。以前观察这一过程的尝试主要是通过固定染色、组织培养和扫描电子显微镜 12,13,14。这些方法无法跟踪单个细胞的连续变化,只能获得零碎的信息。使用本研究中描述的方法,可以通过共聚焦显微镜进行为期数天的连续实时成像,成功地观察到跗骨区域的最终形状形成过程,并且可以连续跟踪单个细胞的变化。这种实时成像揭示的有趣的细胞动力学已在最近的报告15 中进行了详细描述。
为了成功进行长期实时成像,保持蛹的活力并确保其发育不受影响至关重要。在这里描述的方法中,去除的蛹在许多情况下发展成噬菌体成虫和成虫(图 2O,P)。通过这种方法观察到的发育中的跗骨形态变化的时间与以前的报道一致 12,13,14。此外,即使在 48-60 小时 APF (安装后 32-44 小时) (图 4B'-D'),上皮细胞也显示出厚度减少等变化(图 4B'-D')。这些事实表明,蛹保持完整,并且在使用此处描述的方法进行长期实时成像期间,其正常发育几乎没有中断或延迟。请注意,经实时成像去除的蛹的活力可能会有所不同,具体取决于去除蛹的时间、手术中的处理、成像中的光毒性程度以及使用的苍蝇菌株。
保证蛹的完整性及其发育的关键步骤之一是在不伤害蛹的情况下去除蛹。蛹与双面胶带的稳定粘附和镊子的小心处理是成功的关键。防止蛹脱水也很重要。在这方面,避免盖玻片和硅脂之间有任何间隙至关重要。
为避免蛹干燥,以前的许多方法都涉及部分去除蛹 1,2,3,4,5,6,7。然而,为了观察整个蛹,完全去除蛹是有利的。虽然蛹的最长存活时间尚不清楚,但已经报道了几种完全去除蛹的方法 8,9,10。在这些方法中,为蛹提供水分的最常见方法是使用湿润的滤纸。与以前的方法相比,这里描述的方法通过以更简单、更容易的方式滴入一滴水来提供水分。此外,以前的许多方法涉及将蛹安装在载玻片上。将去除的蛹安装在载玻片上时,可能会出现将盖玻片压在蛹上会对蛹造成压力的问题,或者倾斜的盖玻片会在图像中引入噪声、失真和不清晰。此处描述的方法采用玻璃底培养皿,无需将盖玻片压在蛹上,从而可以尽可能接近其自然状态观察组织。由于无需调整盖板玻璃的角度,因此设置稳定、易于作且更可靠。因此,这种方法几乎不需要专业技能,即使是初学者也能成功进行实时成像。
这种方法的主要局限性是观测深度和时间分辨率。在观察跗骨的条件下,只能获得最深约 40 μm 的清晰图像。使用 Bright Z 功能有助于解决此问题。例如,如图 5 所示,通过采用 Bright Z 功能随着深度的增加而增加激光功率和 PMT 电压,可以提高较深位置的图像质量。然而,增加激光功率需要权衡光毒性和信号衰落。因此,有必要找到与观察目的相一致的最佳条件。在观察快速移动的细胞和组织时,时间分辨率也很重要。减少切片和缩小 ROI 是解决此问题的主要解决方案。使用具有更高检测器灵敏度的最新设备或转盘式共聚焦显微镜可能会提高时间分辨率。另一个限制与蛹的阶段有关。只有在 12-13.5 小时 APF19中蛹角质层完全形成后才能去除蛹,并且只有在 14 小时 APF 后才能轻松去除。通过安装蛹而不去除蛹15,可以部分观察到比 12 小时 APF 的早期阶段,即使在这种情况下由于快速组织运动和蛹的光学障碍而难以获得清晰的图像。
故障 排除
难以去除蛹
在去除蛹时,蛹腹侧与双面胶带的粘附很重要。必须从蛹表面去除胶水和食物,随后的干燥很重要,因为潮湿的表面会妨碍良好的粘附。值得注意的是,料表中的双面胶带在内侧具有更强的粘合力。应使用内侧(较强)的一侧来粘附蛹。当难以去除蛹时,用解剖剪刀剪断蛹而不是用镊子撕扯它是有帮助的。
液体从蛹渗漏
在不伤害蛹的情况下去除蛹至关重要。蛹体液泄漏表明蛹受损(图 2K)。应避免在实时成像中使用此类蛹。为了防止在去除蛹时蛹损伤,除了小心处理外,建议使用尖端相对宽的镊子。
图像质量差
当荧光信号太弱时,有很多方法可以调节亮度,例如提高 PMT 电压、打开针孔 (C.A.)、减慢扫描速度、增加激光功率。请注意,每种方法都有副作用:增加 PMT 电压可能会增加噪声,打开针孔会降低 Z 轴分辨率,减慢扫描速度会延长扫描时间,增加激光功率会增加光毒性和漂白的风险。必须根据感兴趣的区域、荧光报告基因的种类和表达水平以及所需的实时成像长度找到适当的设置。总体而言,建议将激光功率降至最低,以便进行长期实时成像。
荧光褪色
荧光的褪色在长期实时成像中是不可避免的。建议尽量减少使用激光功率以避免此问题。为了补偿褪色,在处理获取的实时成像数据时,建议使用 ImageJ 插件“AutoEnhance”16 。
由于完全去除了蛹,这种方法只需通过改变蛹的 ROI 和方向即可高度适用于其他组织。事实上,即使这些不是实时成像,Hiraiwa 等人也通过这种方法观察到了腿部的近端部分、长鼻、天线附近的头部上皮和背胸的上皮15。这种对广泛组织的适用性可能有助于与其他技术进一步整合,例如基因的光学诱导。该方法也可能适用于 果蝇以外的 cyclorrhaphan(形成蛹)物种。此外,如果其他昆虫物种具有透明的蛹角质层,则它有可能用于其他昆虫物种。本文为 果蝇 研究人员提供了详细的说明,以对蛹进行实时成像以捕获活组织中的细胞动力学。
披露声明
作者声明没有利益冲突。
致谢
我们感谢 Masayuki Miura 博士(东京大学)和 Yuya Fujisawa 博士(东京大学)提供的技术建议,并感谢布卢明顿股票中心的苍蝇资源。
材料
| Name | Company | Catalog Number | Comments |
| 35 mm/glass base dish | IWAKI | 3911-035 | |
| Cleaning wipes | NIPPON PAPER CRECIA | S-200 | |
| Dumont #3c Forceps | Fine Science Tools | 11231-20 | |
| Dumont #5SF | Fine Science Tools | 11252-00 | |
| Eppendorf Research plus 2-20 µL | Eppendorf | 3123000098 | |
| Fly strain: His2Av-mRFP, sGMCA | Bloomington Drosophila Stock Center | 59023 | |
| FV3000 | EVIDENT | inverted confocal microscope | |
| FV31S-SW | EVIDENT | software for FV3000 | |
| G40L | Shin-Etsu Silicone | silicone grease | |
| Micro Cover Glass 18 x 18 mm 0.13-0.17 mm | MATSUNAMI | C018181 | |
| Micro Slide Glass 76 x 26 mm 0.9-1.2 mm | MATSUNAMI | S7213 | |
| NEO-SABLE Size 0 round, fine | Pentel | XZBNR-0 | paintbrush |
| SIL300CS-30CC | EVIDENT | silicone oil | |
| Stereomicroscope System SZX7 | EVIDENT | ||
| Terumo syringe 50 mL | Terumo | SS-50ESZ | |
| Transparent double sided tape | Scotch | 665-1-12 | Since the inner layer has stronger adhesion than the outer layer, the inner layer should be used to fix pupae. |
| UPLSAPO10x | EVIDENT | ||
| UPLSAPO40XS | EVIDENT | silicone immersion lens | |
| Vannas Spring Scissors - 2.5mm Cutting Edge | Fine Science Tools | 15000-08 | optional |
参考文献
- Koto, A., Kuranaga, E., Miura, M. Temporal regulation of Drosophila IAP1 determines caspase functions in sensory organ development. J Cell Biol. 187 (2), 219-231 (2009).
- Ninov, N., Martín-Blanco, E. Live imaging of epidermal morphogenesis during the development of the adult abdominal epidermis of Drosophila. Nat Protoc. 2 (12), 3074-3080 (2007).
- Chiba, M., et al. Activatable photosensitizer for targeted ablation of lacZ-positive cells with single-cell resolution. ACS Cent Sci. 5 (11), 1676-1681 (2019).
- Umetsu, D., et al. Local increases in mechanical tension shape compartment boundaries by biasing cell intercalations. Curr Biol. 24 (16), 1798-1805 (2014).
- Tran, N. V., et al. Programmed disassembly of a microtubule-based membrane protrusion network coordinates 3D epithelial morphogenesis in Drosophila. EMBO J. 43 (6), 568-594 (2024).
- Hellerman, M. B., Choe, R. H., Johnson, R. I. Live-imaging of the Drosophila pupal eye. J Vis Exp. (95), e52120 (2015).
- O'Connor, J. T., Shannon, E. K., Hutson, M. S., Page-McCaw, A. Mounting Drosophila pupae for laser ablation and live imaging of the dorsal thorax. STAR Protoc. 3 (2), 101396 (2022).
- Ziserman, D., Roegiers, F. Live-cell imaging of sensory organ precursor cells in intact Drosophila pupae. J Vis Exp. (51), e2706 (2011).
- Tögel, M., Pass, G., Paululat, A. In vivo imaging of Drosophila wing heart development during pupal stages. Int J Dev Biol. 57 (1-2), 13-24 (2013).
- Weavers, H., Franz, A., Wood, W., Martin, P. Long-term in vivo tracking of inflammatory cell dynamics within Drosophila pupae. J Vis Exp. (136), e57871 (2018).
- Kojima, T. Developmental mechanism of the tarsus in insect legs. Curr Opin Insect Sci. 19, 36-42 (2017).
- Mirth, C., Akam, M. Joint development in the Drosophila leg: Cell movements and cell populations. Dev Biol. 246 (2), 391-406 (2002).
- Mirth, C. Ecdysteroid control of metamorphosis in the differentiating adult leg structures of Drosophila melanogaster. Dev Biol. 278 (1), 163-174 (2005).
- Tajiri, R., Misaki, K., Yonemura, S., Hayashi, S. Dynamic shape changes of ECM-producing cells drive morphogenesis of ball-and-socket joints in the fly leg. Development. 137 (12), 2055-2063 (2010).
- Hiraiwa, S., et al. Unveiling the cell dynamics during the final shape formation of the tarsus in Drosophila adult leg by live imaging. Dev Genes Evol. , (2024).
- . ImageJ plugin page Available from: https://signaling.riken.jp/en/en-tools/imagej/629/ (2024)
- Pandey, R., Heidmann, S., Lehner, C. F. Epithelial re-organization and dynamics of progression through mitosis in Drosophila separase complex mutants. J Cell Sci. 118 (4), 733-742 (2005).
- Kiehart, D. P., Galbraith, C. G., Edwards, K. A., Rickoll, W. L., Montague, R. A. Multiple forces contribute to cell sheet morphogenesis for dorsal closure in Drosophila. J Cell Biol. 149 (2), 471-490 (2000).
- Ashburner, M. . Drosophila: A Laboratory Handbook. , (1989).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。