Method Article
Imagerie en direct à long terme du développement de la patte de la drosophile après l’ablation du puparium
Dans cet article
Résumé
Ici, un protocole est présenté pour l’imagerie en direct à long terme de la patte de la drosophile pendant le stade nymphal, impliquant l’ablation complète du puparium. Ce protocole peut également être appliqué à d’autres tissus.
Résumé
Au cours des dernières décennies, des progrès significatifs ont été réalisés dans la compréhension des mécanismes de détermination du destin cellulaire. Cependant, le processus par lequel les cellules déterminées par le destin forment des formes d’organisme tridimensionnelles reste incertain. Les progrès récents de la microscopie confocale ont facilité les efforts d’observation de la dynamique cellulaire au cours du développement grâce à l’imagerie en direct. La chrysalide de Drosophila melanogaster est idéale pour l’imagerie en direct en raison de son immobilité, de sa cuticule nymphale transparente et de la disponibilité de lignes rapporteures fluorescentes. L’un des principaux défis de l’imagerie est le puparium, la cuticule entourant la nymphe, qui obstrue l’imagerie optique. Alors que les méthodes précédentes impliquaient l’ablation partielle ou complète du puparium, le maintien de la viabilité nymphale pendant de longues périodes après cette procédure est resté difficile. Ici, une méthode simple est présentée pour l’imagerie en direct de la patte de la drosophile pendant le stade nymphal, impliquant l’ablation complète du puparium. La méthode consiste à retirer le puparium d’une chrysalide collée à du ruban adhésif double face, puis à assembler une petite chambre sur un plat à fond de verre pour enfermer la chrysalide et une goutte d’eau. Cette configuration est simple, fiable et favorise la survie prolongée des nymphes en empêchant la dessiccation. L’imagerie en direct à long terme de la chrysalide de la drosophile a contribué de manière significative à capturer comment la patte adulte subit des changements structurels tridimensionnels spectaculaires sur 2-3 jours. Ces changements comprennent la formation transitoire d’une structure intrigante (la structure de type Parthénon) par les cellules épithéliales, le rétrécissement rapide des tissus, la formation d’articulations et l’allongement des poils. Cette méthode est applicable à l’observation de divers tissus et peut potentiellement être combinée avec d’autres techniques, telles que l’induction optique de gènes, pour faire progresser la compréhension de la dynamique cellulaire lors de la formation finale de la forme finale des tissus au stade nymphal.
Introduction
Malgré les progrès considérables réalisés au cours des dernières décennies dans l’élucidation du mécanisme de détermination du destin cellulaire, la façon dont les cellules déterminées par le destin construisent des formes d’organisme tridimensionnelles est encore insaisissable. Grâce aux améliorations technologiques de la microscopie confocale, les tentatives de dévoilement de la dynamique cellulaire au cours du développement par imagerie en direct se sont multipliées ces dernières années 1,2. La chrysalide de Drosophila melanogaster a été privilégiée pour l’imagerie en direct en raison de ses caractéristiques appropriées : immobilité, transparence de la cuticule de la nymphe et disponibilité de lignes rapporteures fluorescentes 3,4,5. Le plus grand obstacle à la réalisation d’une imagerie en direct de la chrysalide de la drosophile est la puparium (boîte nymphale), la cuticule larvaire du dernier stade déformée et bronzée entourant la nymphe. Pour éviter l’obstruction optique, le puparium a été partiellement ou complètement éliminé selon les méthodes précédemment rapportées 1,2,3,4,5,6,7,8,9,10. L’ablation complète du puparium maximise la zone d’observation et l’applicabilité à divers tissus. Cependant, la chrysalide sans son puparium meurt généralement en une demi-journée environ, probablement en raison de la dessiccation. Par conséquent, le maintien de l’humidité de la nymphe est crucial pour une imagerie en direct prolongée. Bien que la durée exacte de la survie des nymphes après l’élimination complète du puparium dans les méthodes précédentes ne soit pas claire, les exemples rapportés duraient généralement jusqu’à environ 20 heures. Étant donné que le stade nymphal dure environ quatre jours, une méthode d’imagerie en direct encore plus longue devait contribuer à capturer l’ensemble du processus de formation de la forme des tissus.
La patte adulte de la drosophile est un excellent modèle pour étudier le processus de formation de la forme tridimensionnelle des tissus. Il dérive des primordiums en forme de disque (disque de patte) formés au cours des stades larvaires. Les régions correspondant à chaque segment de la patte adulte sont déterminées par le stade prénymphal11. Ensuite, le disque de la jambe dépasse de la partie centrale pour former une structure tubulaire gonflée environ 11 h après la formation du puparium (APF). La façon dont ce tissu, avec sa forme simple, atteint sa forme finale de la patte adulte dans les stades ultérieurs est restée longtemps incertaine. Plusieurs études abordant cette question ont été publiées 12,13,14. Comme ils ont observé des tissus fixés ou cultivés, les changements continus dans les cellules individuelles n’ont pas pu être retracés et les informations obtenues étaient quelque peu fragmentées. Pour bien comprendre le processus de mise en forme, il est essentiel d’observer en permanence les changements dans les cellules individuelles grâce à l’imagerie en direct à long terme.
Une étude récente a dévoilé la déformation dynamique des structures tridimensionnelles aux niveaux tissulaire et cellulaire par imagerie en direct à long terme (Figure 1). La découverte la plus intrigante de cette étude est la formation transitoire d’une structure complexe inattendue par les cellules épithéliales. Cette structure, appelée « structure de type parthénon », présente des projections apicobasales et des connexions de cellules épithéliales en forme de maillage basal. Il est important de noter que la formation et la disparition de cette structure coïncident avec un rétrécissement rapide des tissus15. La formation ultérieure de la forme, y compris la formation des articulations et l’allongement des poils, s’est poursuivie pendant 2 à 3 jours. L’imagerie en direct à long terme a permis de capturer toute l’histoire de ces événements séquentiels qui ont duré plusieurs jours.
Cet article fournit une méthode étape par étape pour effectuer une imagerie en direct de la patte de la drosophile pendant le stade nymphal avec élimination complète de la nymphe. La méthode est facile à suivre et peut être appliquée à divers autres tissus.
Protocole
Ce protocole utilise des souches de Drosophila melanogaster exprimant des rapporteurs fluorescents15. Les détails des réactifs et de l’équipement utilisés dans l’étude sont énumérés dans la table des matériaux.
1. Préparation de la chrysalide
- À l’aide d’un pinceau, prélevez des pupes blanches de la souche désirée de Drosophila melanogaster dans des flacons et mettez-les dans des plats ou des flacons vides (figure 2A).
REMARQUE : Dans cette étude, les « pupes blanches » font référence à l’étape entre le moment où la larve devient complètement immobile et celui où le puparium devient brun. Cette étape dure environ 30 min à 25 °C. - Incuber les pupes blanches pendant au moins 14 h à 25 °C jusqu’à ce qu’elles atteignent le stade à observer (figure 2B).
REMARQUE : Le puparium ne peut être enlevé qu’après que la cuticule de la nymphe a été complètement formée à 12-13,5 h APF et facilement enlevé seulement après 14 h APF. - Essuyez la colle et la nourriture pour les mouches du puparium avec un pinceau imbibé d’eau distillée.
REMARQUE : La face ventrale du puparium doit être particulièrement propre pour obtenir une adhérence suffisante au ruban adhésif double face dans les étapes ultérieures. - Placez les pupes sur des lingettes nettoyantes pendant plusieurs minutes pour qu’elles sèchent.
REMARQUE : L’humidité restante sur le puparium empêcherait une bonne adhérence à un ruban adhésif double face. - Fixez un morceau de ruban adhésif double face sur une lame de verre.
- Placez les pupes séchées sur un ruban adhésif double face, le côté ventral vers le bas (figure 2C).
- Poussez doucement la face dorsale des pupes avec un pinceau séché pour obtenir une meilleure adhérence au ruban adhésif double face.
- À l’aide d’un stéréomicroscope, ouvrez soigneusement l’opercule à l’aide d’une pince (Figure 2 D,E).
REMARQUE : L’opercule est la région antéro-dorsale du puparium d’où sort la mouche adulte, s’ouvrant ainsi facilement. - À partir du bord de l’opercule ouvert, insérez l’une des extrémités de la pince dans l’espace entre la chrysalide et le puparium (Figure 2F).
REMARQUE : Veillez à ne pas endommager la cuticule de la nymphe avec la pointe de la pince. - Saisissez le puparium avec une pince et tirez-le vers l’extérieur jusqu’à ce qu’il s’ouvre.
- Soulevez les fragments déchirés du puparium à l’aide d’une pince et collez-les sur du ruban adhésif double face (Figure 2G).
- Répétez les étapes 1.10-1.11 jusqu’à ce que l’ouverture du puparium atteigne l’extrémité postérieure, en laissant une petite partie du puparium (Figure 2 H,I).
REMARQUE : Si du liquide s’était échappé d’une nymphe, celle-ci aurait été endommagée (figure 2K). Pour observer un développement normal, évitez d’imager les pupes endommagées.
2. Configuration de l’imagerie
- Mettez 1 μL d’eau distillée ou d’huile de silicone (si vous utilisez une lentille d’immersion en silicone) au fond d’un plat à fond de verre.
- Trempez un pinceau dans l’eau distillée et ramassez doucement la chrysalide (Figure 2J).
- Placez la nymphe avec la face ventrale vers le bas sur l’eau distillée ou l’huile de silicone (Figure 2L).
- À l’aide d’une micropipette, placez 10 μL d’eau distillée près du bord de la partie en verre de la parabole à fond de verre (figure 2L).
- Placez un cercle de graisse silicone à l’aide d’une seringue sur le pourtour de la partie en verre du plat à fond de verre (Figure 2M).
- Appliquez une lamelle sur la graisse silicone pour la sceller (Figure 2M). L’assemblage est illustré à la figure 2N.
REMARQUE : Assurez-vous qu’il n’y a pas d’espace entre la lamelle et la graisse silicone.
3. Imagerie confocale
- Allumez un microscope laser confocal inversé et un logiciel d’imagerie.
- Placez la parabole sur la platine d’un microscope confocal inversé.
- Trouvez les pupes avec une lentille d’objectif à faible grossissement dans l’observation en fond clair. Assurez-vous que les pupes ne montrent aucune fuite de liquide corporel.
- Centrez la zone souhaitée de la chrysalide à observer dans la région d’intérêt (ROI).
REMARQUE : Les côtés antérolatéraux du tarse dans la première et la deuxième patte, et la face ventrale du tarse dans la troisième patte, sont orientés vers la face ventrale de la nymphe. Par conséquent, la section longitudinale du tarse le long de l’axe dorso-ventral peut être observée dans la première et la deuxième jambe, tandis que celles le long de l’axe antéropostérieur peuvent être observées dans la troisième jambe. - Remplacez l’objectif par celui de l’imagerie en direct.
REMARQUE : Si une lentille à immersion dans l’eau est utilisée, l’eau entre la lentille et le plat à fond de verre se dessèchera pendant l’observation à long terme. Il est recommandé d’utiliser une lentille sans immersion ou à immersion dans l’huile de silicone. - Ajustez les conditions pour l’observation souhaitée et lancez l’acquisition des données.
REMARQUE : Pour éviter tout dommage à la nymphe, les puissances laser doivent être minimales pour que des images claires puissent être obtenues. La minimisation du retour sur investissement et l’augmentation de la taille des pas sont utiles pour gagner du temps lors de l’acquisition de la pile Z. La transformation future du tissu doit être prise en compte lors du choix de la profondeur de l’empilement Z. Dans le cas d’une observation de la patte à 15-25 h APF, comme la jambe se rétrécit beaucoup, la partie la plus proche de la lamelle (épithélium latéral) se déplace rapidement plus profondément. Compte tenu de ce mouvement, les piles Z extra profondes doivent être définies dès le premier. Un exemple de réglage du microscope confocal pour l’imagerie en direct de la région tarsienne de la jambe de 15 à 30 h APF est fourni dans le fichier supplémentaire 1. L’évanouissement par fluorescence est inévitable lors de l’imagerie en direct à long terme. Pour atténuer ce problème, il est conseillé d’utiliser une puissance laser minimale. Le plug-in ImageJ « AutoEnhance"16 est recommandé pour le traitement des données d’imagerie en direct afin de compenser les effets de décoloration.
Résultats
Ici, un exemple d’imagerie en direct de 44 heures de la patte adulte de la drosophile en développement au stade nymphal est décrit. Des mouches exprimant His2Av-mRFP17 (noyaux de marquage) et sGMCA18 (protéine de liaison à l’actine Moesin, marquage de l’actine) ont été prélevées au stade de nymphe blanche et incubées pendant 15 h à 25 °C. Le puparium a été retiré et monté selon le protocole (Figure 2). Des images de la pile Z du tarse et du prétarse, près de l’extrémité de la patte, ont été obtenues toutes les 15 min de 16 h à 60 h d’APF à température ambiante (non stricte, mais proche de 25 °C). La première moitié de la série d’images est montrée dans la figure 3, la seconde moitié dans la figure 4 et le film dans l’ensemble dans le film 1. Au fur et à mesure que le tissu de la jambe se rétrécissait rapidement, les cellules épithéliales formaient transitoirement une structure intrigante, la structure de type Parthénon, caractérisée par ses projections apicobasales et ses connexions basales (Figure 3). La réduction de l’épaisseur de l’épithélium a été observée même après que le contour ait été presque terminé (Figure 4). L’ensemble du processus est présenté à la figure 1.
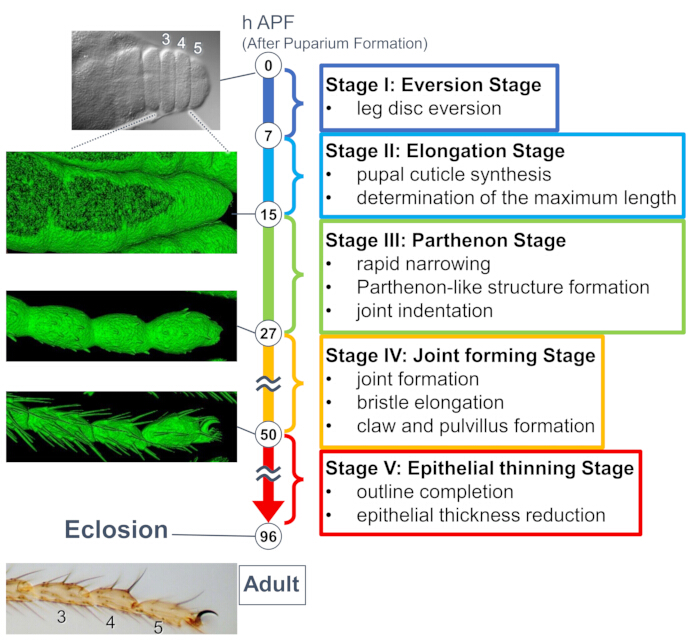
Figure 1 : Vue d’ensemble de la formation finale de la forme finale du tarse adulte de la drosophile au stade nymphal. L’ensemble du processus a été divisé en cinq étapes en fonction des changements morphologiques aux niveaux tissulaire et cellulaire observés dans les expériences d’imagerie en direct à long terme. Des photos représentatives ou des images rendues en surface (signal sGMCA) correspondant à plusieurs points temporels sont affichées sur le côté gauche. De brèves descriptions des événements de chaque étape sont écrites sur le côté droit. Cette figure a été modifiée à partir de Hiraiwa et al.15. Voir aussi Film 1. Veuillez cliquer ici pour voir une version agrandie de cette figure.
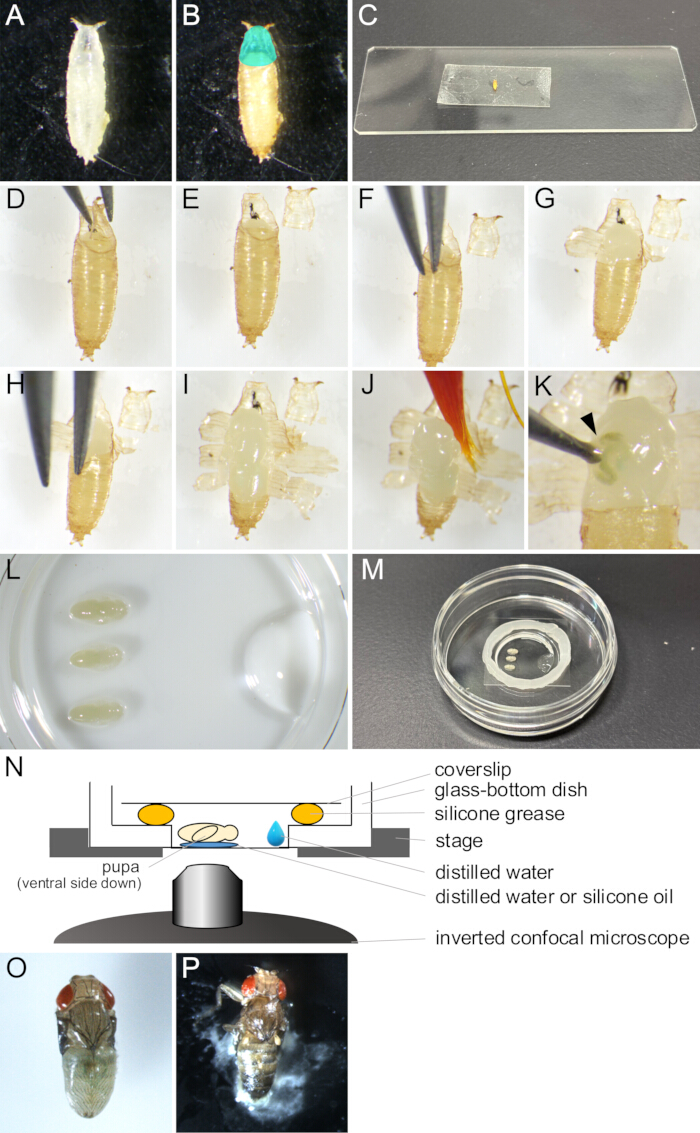
Figure 2 : Retrait du puparium et montage pour l’imagerie en direct. (A) Une chrysalide blanche recueillie dans une boîte. (B) La nymphe s’est manifestée en (A) après une incubation de 15 h à 25 °C. La région de couleur cyan indique l’opercule. (C) Une photographie montrant une nymphe collée à un morceau de ruban adhésif double face. (D-J) Série d’images montrant la procédure d’élimination du puparium. (D) L’opercule est soulevé à l’aide d’une pince. (E) L’opercule est enlevé. (F) L’extrémité d’une pince est insérée entre la cuticule de la nymphe et le puparium. (G) Le puparium est partiellement ouvert. (H) Une pointe de pince est insérée à nouveau. (I) Le puparium s’est ouvert, ne laissant qu’une petite partie de l’extrémité postérieure. (J) La nymphe soulevée par un pinceau. (K) Un exemple de fuite de liquide corporel de la nymphe. Le liquide sortant de la plaie percée par la pointe d’une pince est indiqué par une pointe de flèche. (L-N) Images et illustrations montrant l’assemblage du support. (L) Une image vue du haut montrant des pupes placées et de l’eau distillée au fond d’un plat à fond de verre. (M) La parabole une fois l’assemblage du support terminé. De la graisse silicone a été placée le long du bord autour de la partie en verre, et une lamelle a été placée sur la graisse pour la sceller. (N) Schéma de l’ensemble de montage de la chrysalide de la drosophile pour l’imagerie en direct à long terme. (O) Une chrysalide montée s’est développée presque à l’âge adulte. (P) Une fermeture de nymphe montée. Veuillez cliquer ici pour voir une version agrandie de cette figure.
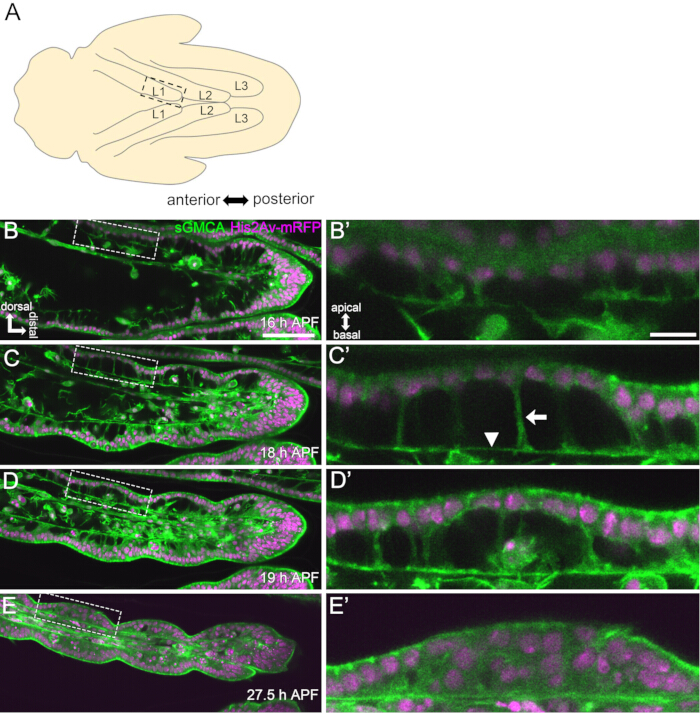
Figure 3 : Changements de forme dynamiques dans les cellules épithéliales du tarse en 16-27,5 h APF. (A) Une illustration de la nymphe vue de la face ventrale. Le rectangle pointillé correspond à la région observée en (B-E). L1 : première patte, L2 : deuxième patte, L3 : troisième patte. (B,C,D,E) Images fixes de l’imagerie en direct de la partie distale du tarse chez le sGMCA (vert) et His2Av-mRFP (magenta) exprimant la mouche. Le tissu se rétrécit rapidement et l’indentation des régions articulaires progresse. (B',C',D',E') Grossissement des régions entourées par les lignes pointillées en (B, C, D, E), respectivement. La flèche et la pointe de flèche en (C') montrent un exemple de projections apicobasales et la position des connexions basales, respectivement. La structure de type Parthénon commence à se former en (B'), est entièrement formée en (C'), commence à disparaître en (D') et devient difficile à voir en (E'). La partie distale est à droite et la dorsale en haut sur toutes les figures. Les étapes sont représentées dans les coins inférieurs droits en (B, C, D, E). Barres d’échelle : B,C,D,E : 50 μm ; B',C',D',E' : 10 μm. Cette figure a été modifiée à partir de Hiraiwa et al.15. Voir aussi Film 1. Veuillez cliquer ici pour voir une version agrandie de cette figure.
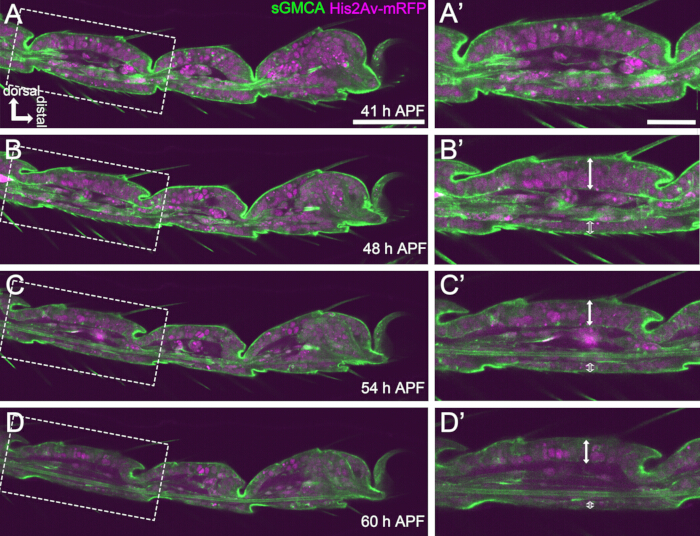
Figure 4 : Changements de forme dans la couche de cellules épithéliales tarsiennes en 41-60 h APF. (A, B, C, D) Images fixes du même ensemble de données séquentielles d’imagerie en direct que la figure 3. Les rectangles en pointillés dans (A,B,C,D) sont agrandis en (A',B',C',D'), respectivement. Vers 48 h APF (A-B'), la formation de la forme externe, telle que l’allongement des poils, des griffes et des pulvilli, est presque terminée. Le bas de l’articulation invaginée s’est déplacé vers la proximale, puis la formation de la structure à rotule a progressé après environ 54 h d’APF. La différence morphologique entre l’épithélium dorsal et ventral est apparue (flèches doubles et doubles flèches ouvertes en B',C',D'). Après 54 h APF (C-D'), la couche épithéliale a diminué son épaisseur sans guère modifier le contour des segments. La dorsale est en haut et distale à droite dans toutes les figures. Barres d’échelle : A, B, C, D : 50 μm ; A',B',C',D' : 20 μm.Ce chiffre a été cité d’après Hiraiwa et al.15. Voir aussi Film 1. Veuillez cliquer ici pour voir une version agrandie de cette figure.
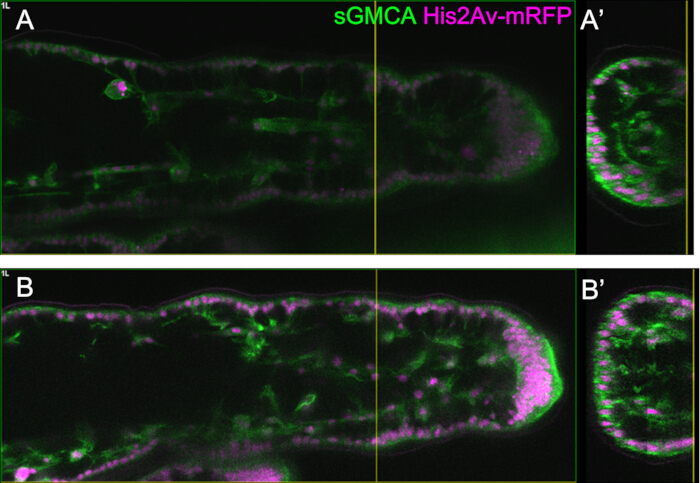
Figure 5 : Un exemple d’observation de la jambe à l’aide de la fonction Bright Z. (A,B) Images de la région, de la profondeur et de l’étage correspondants de la troisième patte du sGMCA (vert) et du His2Av-mRFP (magenta) exprimant le vol, avec (B) ou sans (A) à l’aide de la fonction Bright Z. (A) Un plan XY à 59,1 μm de profondeur extrait de l’observation de la région tarsienne dans la troisième jambe à 16 h APF acquise sans utiliser la fonction Bright Z. (A') La vue en coupe correspond à la ligne verticale jaune de (A). La ligne verticale en (A') indique le plan focal de (A). (B) Un plan XY à 61,6 μm de profondeur extrait de l’observation de la région tarsienne dans la troisième jambe à 16 h APF acquise à l’aide de la fonction Bright Z. La tension PMT et la puissance laser ont été ajustées. La visibilité de l’image est améliorée par rapport à (A). (B') La vue en coupe correspond à la ligne verticale jaune de (B). La ligne verticale jaune en (B') indique le plan focal de (B). Veuillez cliquer ici pour voir une version agrandie de cette figure.
Fichier supplémentaire 1 : Un exemple de réglage du microscope confocal pour l’imagerie en direct de la région tarsienne de la jambe à partir de 15-30 h APF. Veuillez cliquer ici pour télécharger ce fichier.
Vidéo 1 : Imagerie en direct à long terme de la partie distale du tarse pendant 44 h. La mouche exprimant sGMCA (vert) et His2Av-mRFP (magenta) a été utilisée. Le plan XY le plus représentatif a été extrait du même ensemble de données que les figures 3 et 4. Les pointes de flèches indiquent des exemples de futures régions conjointes. Les cellules qui se déplacent rapidement dans le tissu sont des cellules de type macrophage. Le signal en forme de corde qui s’étend le long des segments tarsiens fait partie du septum. L’horodatage indique hh : mm. Distal est à droite et dorsal en haut. Ce film a été adapté de Hiraiwa et al.15Veuillez cliquer ici pour télécharger ce fichier.
Discussion
Dans cet article, un protocole détaillé pour l’imagerie en direct à long terme de la patte de la drosophile au stade nymphal est fourni. Le disque imaginal de la patte dépasse de la partie centrale pour former une structure tubulaire, puis la formation finale de la forme de la patte adulte se produit au stade nymphal d’une manière qui était insaisissable. Les tentatives précédentes d’observation de ce processus étaient principalement par coloration fixe, culture tissulaire et microscope électronique à balayage 12,13,14. Ces méthodes ne permettaient pas de suivre les changements continus dans les cellules individuelles, et seules des informations fragmentaires ont été obtenues. Avec la méthode décrite dans cette étude, le processus de formation de la forme finale de la région tarsienne peut être observé avec succès sous forme d’imagerie séquentielle en direct pendant des jours par un microscope confocal, et les changements dans les cellules individuelles peuvent être suivis en continu. La dynamique cellulaire intrigante révélée par cette imagerie en direct a été décrite en détail dans le récent rapport15.
Pour une imagerie en direct à long terme réussie, il est crucial de maintenir la viabilité de la chrysalide et de s’assurer que son développement n’est pas affecté. Dans la méthode décrite ici, la chrysalide enlevée par le pubarium s’est transformée en pharate adulte et en adulte dans de nombreux cas (Figure 2O,P). Les chronologies des changements morphologiques du tarse en développement observées par cette méthode étaient cohérentes avec les rapports précédents 12,13,14. De plus, les cellules épithéliales ont montré des changements tels que la réduction de l’épaisseur même en 48-60 h APF (32-44 h après le montage) (Figure 4B'-D'). Ces faits suggèrent que la nymphe reste intacte et ne subit presque aucune perturbation ou retard dans son développement normal lors de l’imagerie en direct à long terme à l’aide de la méthode décrite ici. Veuillez noter que la viabilité de la pupupe retirée du pupatarium soumise à l’imagerie en direct peut varier en fonction du moment de l’élimination du puparium, de la manipulation dans le cadre de la procédure, de l’étendue de la phototoxicité de l’imagerie et des souches de mouches utilisées.
L’une des étapes essentielles pour garantir l’intégrité de la chrysalide et son développement consiste à retirer le puparium sans nuire à la nymphe. Une adhérence stable de la chrysalide sur le ruban adhésif double face et une manipulation soigneuse des pinces sont les clés du succès. La prévention de la déshydratation de la chrysalide est également cruciale. À cet égard, il est essentiel d’éviter tout espace entre la lamelle et la graisse silicone.
Pour éviter la dessiccation de la nymphe, de nombreuses méthodes précédentes impliquaient l’élimination partielle du puparium 1,2,3,4,5,6,7. Cependant, pour observer l’ensemble de la nymphe, l’ablation complète du puparium est privilégiée. Bien que la durée maximale de survie de la nymphe ne soit pas connue, plusieurs méthodes d’élimination complète du puparium ont été signalées 8,9,10. L’approche la plus courante pour fournir de l’humidité à la nymphe dans ces méthodes est l’utilisation de papier filtre humidifié. Par rapport aux méthodes précédentes, celle décrite ici fournit de l’humidité en mettant une goutte d’eau de manière plus simple et plus facile. De plus, de nombreuses méthodes précédentes impliquent de monter la chrysalide sur une lame de verre. Lors du montage de la chrysalide retirée du pupatium sur une lame de verre, il peut y avoir un problème où le fait d’appuyer la lamelle contre la chrysalide provoque un stress sur la nymphe, ou une lamelle inclinée introduit du bruit, des distorsions et un manque de clarté dans les images. La méthode décrite ici utilise une boîte à fond de verre, ce qui élimine le besoin de presser la lamelle contre la nymphe, ce qui permet d’observer les tissus aussi près que possible de leur état naturel. Comme il n’est pas nécessaire d’ajuster l’angle de la vitre de protection, la configuration est stable, facile à manipuler et plus fiable. Par conséquent, cette méthode ne nécessite presque aucune compétence spécialisée, ce qui permet même aux débutants d’effectuer avec succès des images en direct.
Les principales limites de cette méthode sont la profondeur des observations et les résolutions temporelles. Dans les conditions d’observation du tarse, des images claires ne peuvent être obtenues que jusqu’à environ 40 m de profondeur. L’utilisation de la fonction Bright Z permet de résoudre ce problème. Par exemple, comme le montre la figure 5, l’augmentation de la puissance laser et de la tension PMT à mesure que la profondeur augmente en utilisant la fonction Bright Z améliore la qualité des images à des positions plus profondes. Cependant, l’augmentation de la puissance du laser s’accompagne d’un compromis impliquant la phototoxicité et l’évanouissement du signal. Par conséquent, il est nécessaire de trouver les conditions optimales qui s’alignent avec le but de l’observation. La résolution temporelle est également importante lors de l’observation de cellules et de tissus en mouvement rapide. La réduction des tranches et la réduction du retour sur investissement sont les principales solutions à ce problème. L’utilisation d’un équipement moderne avec une sensibilité de détecteur améliorée ou d’un microscope confocal à disque rotatif peut améliorer la résolution temporelle. Une autre limitation concerne le stade de la nymphe. Le puparium ne peut être enlevé qu’après que la cuticule de la nymphe ait été complètement formée à 12-13,5 h APF19et ne peut être facilement enlevé qu’après 14 h APF. Les stades précoces de 12 h APF peuvent être partiellement observés en montant la chrysalide sans retirer le puparium15, même si l’obtention d’images claires est difficile en raison des mouvements tissulaires rapides et des obstacles optiques du puparium dans cet état.
Dépannage
Difficulté dans l’élimination du puparium
Lors de l’enlèvement du puparium, l’adhérence de la face ventrale du puparium au ruban adhésif double face est importante. La colle et les aliments doivent être retirés de la surface du puparium, et le séchage ultérieur est important car les surfaces humides empêchent une bonne adhérence. Notamment, le ruban adhésif double face dans la table des matériaux a une adhérence plus forte sur la face intérieure. Le côté intérieur (plus fort) doit être utilisé pour faire adhérer la nymphe. Couper le puparium avec des ciseaux de dissection au lieu de le déchirer avec une pince est utile lorsque l’élimination du puparium est difficile.
Fuite de liquide de la nymphe
Il est essentiel d’enlever le puparium sans endommager la nymphe. Une fuite de liquide corporel de la nymphe indique des dommages à la nymphe (figure 2K). Une telle chrysalide doit être évitée de l’imagerie en direct. Pour éviter d’endommager la nymphe lors de l’ablation du puparium, il est recommandé, en plus d’une manipulation soigneuse, d’utiliser des pinces à pointes relativement larges.
Mauvaise qualité d’image
Lorsque le signal fluorescent est trop faible, il existe de nombreuses façons d’ajuster la luminosité, telles que l’augmentation de la tension PMT, l’ouverture du sténopé (C.A.), le ralentissement de la vitesse de balayage et l’augmentation de la puissance du laser. N’oubliez pas que chaque méthode a des effets secondaires : l’augmentation de la tension PMT peut augmenter le bruit, l’ouverture du sténopé réduit la résolution de l’axe Z, le ralentissement de la vitesse de balayage allonge le temps de balayage et l’augmentation de la puissance du laser augmente le risque de phototoxicité et de blanchiment. Il faut trouver des réglages appropriés en fonction de la région d’intérêt, des types et des niveaux d’expression des rapporteurs fluorescents et de la durée souhaitée de l’imagerie en direct. Dans l’ensemble, il est recommandé de minimiser la puissance du laser pour l’imagerie en direct à long terme.
Évanouissement de la fluorescence
L’évanouissement de la fluorescence est inévitable dans l’imagerie en direct à long terme. Une utilisation minimale de la puissance laser est conseillée pour éviter ce problème. Pour compenser la décoloration, il est recommandé d’utiliser le plug-in ImageJ « AutoEnhance »16 lors du traitement des données d’imagerie en direct acquises.
Grâce à l’élimination complète du puparium, cette méthode est très applicable à d’autres tissus simplement en modifiant le ROI et l’orientation de la nymphe. En effet, même s’il ne s’agit pas d’imagerie en direct, la partie proximale de la patte, le proboscis, l’épithélium de la tête près de l’antenne et l’épithélium du thorax dorsal ont été observés par cette méthode chez Hiraiwa et al.15. Une telle applicabilité à un large éventail de tissus peut faciliter une intégration plus poussée avec d’autres techniques, telles que l’induction optique de gènes. Cette méthode peut également s’appliquer à des espèces de cyclorrhaphans (formant des pupariums) autres que la drosophile. De plus, il pourrait potentiellement être utilisé pour d’autres espèces d’insectes s’ils ont une cuticule nymphale transparente. Cet article fournit des instructions détaillées aux chercheurs sur la drosophile pour effectuer une imagerie en direct de la chrysalide afin de capturer la dynamique cellulaire dans les tissus vivants.
Déclarations de divulgation
Les auteurs ne déclarent aucun intérêt concurrent.
Remerciements
Nous sommes reconnaissants au Dr Masayuki Miura (Université de Tokyo) et au Dr Yuya Fujisawa (Université de Tokyo) pour leurs conseils techniques, et nous remercions le Bloomington Stock Center pour les ressources sur les mouches.
matériels
| Name | Company | Catalog Number | Comments |
| 35 mm/glass base dish | IWAKI | 3911-035 | |
| Cleaning wipes | NIPPON PAPER CRECIA | S-200 | |
| Dumont #3c Forceps | Fine Science Tools | 11231-20 | |
| Dumont #5SF | Fine Science Tools | 11252-00 | |
| Eppendorf Research plus 2-20 µL | Eppendorf | 3123000098 | |
| Fly strain: His2Av-mRFP, sGMCA | Bloomington Drosophila Stock Center | 59023 | |
| FV3000 | EVIDENT | inverted confocal microscope | |
| FV31S-SW | EVIDENT | software for FV3000 | |
| G40L | Shin-Etsu Silicone | silicone grease | |
| Micro Cover Glass 18 x 18 mm 0.13-0.17 mm | MATSUNAMI | C018181 | |
| Micro Slide Glass 76 x 26 mm 0.9-1.2 mm | MATSUNAMI | S7213 | |
| NEO-SABLE Size 0 round, fine | Pentel | XZBNR-0 | paintbrush |
| SIL300CS-30CC | EVIDENT | silicone oil | |
| Stereomicroscope System SZX7 | EVIDENT | ||
| Terumo syringe 50 mL | Terumo | SS-50ESZ | |
| Transparent double sided tape | Scotch | 665-1-12 | Since the inner layer has stronger adhesion than the outer layer, the inner layer should be used to fix pupae. |
| UPLSAPO10x | EVIDENT | ||
| UPLSAPO40XS | EVIDENT | silicone immersion lens | |
| Vannas Spring Scissors - 2.5mm Cutting Edge | Fine Science Tools | 15000-08 | optional |
Références
- Koto, A., Kuranaga, E., Miura, M. Temporal regulation of Drosophila IAP1 determines caspase functions in sensory organ development. J Cell Biol. 187 (2), 219-231 (2009).
- Ninov, N., Martín-Blanco, E. Live imaging of epidermal morphogenesis during the development of the adult abdominal epidermis of Drosophila. Nat Protoc. 2 (12), 3074-3080 (2007).
- Chiba, M., et al. Activatable photosensitizer for targeted ablation of lacZ-positive cells with single-cell resolution. ACS Cent Sci. 5 (11), 1676-1681 (2019).
- Umetsu, D., et al. Local increases in mechanical tension shape compartment boundaries by biasing cell intercalations. Curr Biol. 24 (16), 1798-1805 (2014).
- Tran, N. V., et al. Programmed disassembly of a microtubule-based membrane protrusion network coordinates 3D epithelial morphogenesis in Drosophila. EMBO J. 43 (6), 568-594 (2024).
- Hellerman, M. B., Choe, R. H., Johnson, R. I. Live-imaging of the Drosophila pupal eye. J Vis Exp. (95), e52120 (2015).
- O'Connor, J. T., Shannon, E. K., Hutson, M. S., Page-McCaw, A. Mounting Drosophila pupae for laser ablation and live imaging of the dorsal thorax. STAR Protoc. 3 (2), 101396 (2022).
- Ziserman, D., Roegiers, F. Live-cell imaging of sensory organ precursor cells in intact Drosophila pupae. J Vis Exp. (51), e2706 (2011).
- Tögel, M., Pass, G., Paululat, A. In vivo imaging of Drosophila wing heart development during pupal stages. Int J Dev Biol. 57 (1-2), 13-24 (2013).
- Weavers, H., Franz, A., Wood, W., Martin, P. Long-term in vivo tracking of inflammatory cell dynamics within Drosophila pupae. J Vis Exp. (136), e57871 (2018).
- Kojima, T. Developmental mechanism of the tarsus in insect legs. Curr Opin Insect Sci. 19, 36-42 (2017).
- Mirth, C., Akam, M. Joint development in the Drosophila leg: Cell movements and cell populations. Dev Biol. 246 (2), 391-406 (2002).
- Mirth, C. Ecdysteroid control of metamorphosis in the differentiating adult leg structures of Drosophila melanogaster. Dev Biol. 278 (1), 163-174 (2005).
- Tajiri, R., Misaki, K., Yonemura, S., Hayashi, S. Dynamic shape changes of ECM-producing cells drive morphogenesis of ball-and-socket joints in the fly leg. Development. 137 (12), 2055-2063 (2010).
- Hiraiwa, S., et al. Unveiling the cell dynamics during the final shape formation of the tarsus in Drosophila adult leg by live imaging. Dev Genes Evol. , (2024).
- . ImageJ plugin page Available from: https://signaling.riken.jp/en/en-tools/imagej/629/ (2024)
- Pandey, R., Heidmann, S., Lehner, C. F. Epithelial re-organization and dynamics of progression through mitosis in Drosophila separase complex mutants. J Cell Sci. 118 (4), 733-742 (2005).
- Kiehart, D. P., Galbraith, C. G., Edwards, K. A., Rickoll, W. L., Montague, R. A. Multiple forces contribute to cell sheet morphogenesis for dorsal closure in Drosophila. J Cell Biol. 149 (2), 471-490 (2000).
- Ashburner, M. . Drosophila: A Laboratory Handbook. , (1989).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon