Method Article
번데기 제거 후 Drosophila Pupal 다리 발달의 장기 라이브 이미징
요약
여기에서는 번데기를 완전히 제거하는 번데기 단계에서 초파리 다리의 장기 라이브 이미징을 위한 프로토콜이 제시됩니다. 이 프로토콜은 다른 조직에도 적용할 수 있습니다.
초록
지난 수십 년 동안 세포의 운명 결정 메커니즘을 이해하는 데 상당한 진전이 이루어졌습니다. 그러나 운명에 의해 결정된 세포가 3차원 유기체 모양을 형성하는 과정은 불분명합니다. 최근 컨포칼 현미경의 발전으로 라이브 이미징을 통해 개발 중 세포 역학을 관찰하려는 노력이 촉진되었습니다. Drosophila melanogaster 번데기는 움직이지 않고 번데기가 투명하며 형광 리포터 라인의 가용성으로 인해 라이브 이미징에 이상적입니다. 이미징의 주요 과제는 번데기를 둘러싼 큐티클인 번데기(puparium)로, 이는 광학 이미징을 방해합니다. 이전 방법은 번데기를 부분적으로 또는 완전히 제거하는 것이었지만 이 절차 후 장기간 번데기 생존력을 유지하는 것은 여전히 어려운 과제였습니다. 여기에서는 번데기를 완전히 제거하는 번데기 단계에서 초파리 다리를 며칠 동안 실시간으로 촬영할 수 있는 간단한 방법을 제시합니다. 이 방법은 양면 테이프에 붙어 있는 번데기에서 번데기를 제거한 다음, 유리 바닥 접시에 작은 방을 조립하여 번데기와 물 한 방울을 둘러싸는 것입니다. 이 설정은 간단하고 신뢰할 수 있으며 건조를 방지하여 번데기 생존을 연장합니다. 번데기( Drosophila pupa)의 장기 실시간 이미징은 성인 다리가 2-3일에 걸쳐 극적인 3차원 구조 변화를 겪는 방법을 포착하는 데 크게 기여했습니다. 이러한 변화에는 상피 세포에 의한 흥미로운 구조(파르테논 신전과 같은 구조)의 일시적인 형성, 빠른 조직 협착, 관절 형성 및 강모 신장이 포함됩니다. 이 방법은 다양한 조직의 관찰에 적용할 수 있으며 잠재적으로 광학 유전자 유도와 같은 다른 기술과 결합하여 번데기 단계에서 조직의 최종 형태 형성 동안 세포 역학에 대한 이해를 높일 수 있습니다.
서문
지난 수십 년 동안 세포의 운명 결정 메커니즘을 밝히는 데 상당한 진전이 있었음에도 불구하고, 운명에 의해 결정된 세포가 어떻게 3차원 유기체 형태를 형성하는지는 여전히 파악하기 어렵습니다. 컨포칼 현미경의 기술적 개선 덕분에, 최근 몇 년 동안 라이브 이미징에 의한 개발 중 세포 역학을 밝히려는 시도가 증가하고 있습니다 1,2. Drosophila melanogaster 번데기는 부동성, 번데기 표피의 투명도, 형광 리포터 라인 3,4,5의 가용성과 같은 적절한 기능으로 인해 라이브 이미징에 선호되었습니다. Drosophila pupa의 라이브 이미징을 수행하는 데 가장 큰 장애물은 번데기를 둘러싼 변형되고 검게 그을린 최종 instar 유충 표피인 번데기(번데기 케이스)입니다. 광학적 방해를 피하기 위해, 번데기는 이전에 보고된 방법 1,2,3,4,5,6,7,8,9,10에서 부분적으로 또는 완전히 제거되었다. 번데기를 완전히 제거하면 관찰 영역과 다양한 조직에 대한 적용 가능성이 극대화됩니다. 그러나 번데기가 없는 번데기는 일반적으로 건조로 인해 약 반나절 이내에 죽습니다. 따라서 번데기 수분을 유지하는 것은 확장된 라이브 이미징에 매우 중요합니다. 이전 방법에서 번데기를 완전히 제거한 후 번데기가 정확히 생존하는 기간은 불분명하지만, 보고된 사례는 일반적으로 약 20시간까지 지속되었습니다. 번데기 단계는 약 4일 동안 지속되기 때문에 더 긴 라이브 이미징 방법이 조직 형태 형성의 전체 과정을 캡처하는 데 기여할 것으로 예상되었습니다.
Drosophila 성인 다리는 3차원 조직 형태 형성 과정을 연구하기 위한 훌륭한 모델입니다. 그것은 애벌레 단계에서 형성된 디스크 모양의 primordia (다리 디스크)에서 파생됩니다. 성체 다리의 각 분절에 해당하는 영역은 번데기전 단계 11에 의해 결정된다. 그런 다음 다리 디스크가 중앙 부분에서 돌출되어 번데기 형성(APF) 후 약 11시간 후에 부풀어 오른 관 구조를 만듭니다. 단순한 모양을 가진 이 조직이 어떻게 후속 단계에서 성인 다리의 최종 모양을 이루는지는 오랫동안 불분명한 상태로 남아 있습니다. 이 문제에 접근하는 여러 연구가 발표되었다 12,13,14. 연구진은 고정되거나 배양된 조직을 관찰했기 때문에 개별 세포의 지속적인 변화를 추적할 수 없었고, 얻은 정보는 다소 단편적이었습니다. 형성 과정을 완전히 이해하려면 장기간의 라이브 이미징을 통해 개별 세포의 변화를 지속적으로 관찰하는 것이 필수적입니다.
최근 연구에서는 장기간의 실시간 이미징을 통해 조직 및 세포 수준에서 3차원 구조의 동적 변형을 밝혔습니다(그림 1). 이 연구에서 가장 흥미로운 발견은 상피 세포에 의한 예기치 않게 복잡한 구조의 일시적인 형성입니다. "파르테논 신전과 같은 구조"라고 불리는 이 구조는 상피 세포의 아피코기저 돌기와 기저 그물망과 같은 연결을 특징으로 합니다. 중요한 것은 이 구조의 형성과 소멸이 조직이 빠르게 좁아지는 시기와 일치한다는 것이다15. 관절 형성 및 강모 신장을 포함한 후속 형상 형성은 2-3일 동안 진행되었습니다. 장기간의 실시간 이미징은 며칠 동안 연속적으로 발생하는 사건의 전체 스토리를 효과적으로 포착했습니다.
이 문서에서는 번데기를 완전히 제거한 상태에서 번데기 단계에서 초파리 다리의 며칠 동안 라이브 이미징을 수행하는 단계별 방법을 제공합니다. 이 방법은 따라하기 쉽고 다양한 다른 조직에 적용할 수 있습니다.
프로토콜
이 프로토콜은 형광 리포터를 발현하는 Drosophila melanogaster 균주를 사용합니다15. 연구에 사용된 시약 및 장비의 세부 정보는 재료 표에 나열되어 있습니다.
1. 번데기의 준비
- 붓을 사용하여 바이알에서 원하는 Drosophila melanogaster 균주의 흰 번데기를 모아 접시나 빈 바이알에 넣습니다(그림 2A).
참고: 이 연구에서 "흰 번데기"는 유충이 완전히 움직일 수 없게 되는 시점과 번데기가 갈색이 되기 전까지의 단계를 나타냅니다. 이 단계는 25°C에서 약 30분 동안 지속됩니다. - 흰 번데기가 관찰할 단계로 성장할 때까지 25°C에서 최소 14시간 동안 배양합니다(그림 2B).
알림: 번데기는 번데기 표피가 12-13.5 h APF에서 완전히 형성된 후에만 제거할 수 있으며 14 h APF 후에만 쉽게 제거할 수 있습니다. - 접착제를 닦고 증류수에 적신 붓으로 번데기에서 음식을 날려 보냅니다.
알림: 번데기의 복부 쪽은 이후 단계에서 양면 테이프에 충분한 접착력을 얻기 위해 특히 깨끗해야 합니다. - 번데기를 청소용 물티슈에 몇 분 동안 올려 놓고 말리십시오.
알림: 번데기에 수분이 남아 있으면 양면 테이프에 대한 접착력이 좋지 않습니다. - 유리 슬라이드에 양면 테이프 조각을 고정합니다.
- 말린 번데기를 복부 쪽이 아래로 향하게 하여 양면 테이프에 놓습니다(그림 2C).
- 마른 붓으로 번데기의 등쪽을 부드럽게 밀어 양면 테이프에 더 잘 접착됩니다.
- 실체 현미경으로 한 쌍의 집게로 수술을 조심스럽게 엽니다(그림 2 D,E).
참고: operculum은 성충 파리가 나오는 번데기의 앞쪽 영역이므로 쉽게 열립니다. - 열린 수술의 가장자리에서 집게의 끝 중 하나를 번데기와 번데기 사이의 공간에 삽입합니다(그림 2F).
알림: 집게 끝으로 번데기 큐티클이 손상되지 않도록 주의하십시오. - 집게로 번데기를 잡고 부서질 때까지 바깥쪽으로 당깁니다.
- 번데기의 찢어진 조각을 집게로 들어 올려 양면 테이프에 붙입니다(그림 2G).
- 번데기의 개구부가 뒤쪽 끝에 도달하여 번데기의 작은 부분을 남길 때까지 1.10-1.11 단계를 반복합니다(그림 2 H,I).
알림: 번데기에서 액체가 나왔다면 손상되었을 것입니다(그림 2K). 정상적인 발달을 관찰하려면 손상된 번데기를 촬영하지 마십시오.
2. 이미징 설정
- 유리 바닥 접시 바닥에 증류수 또는 실리콘 오일(실리콘 침지 렌즈 사용 시) 1μL를 넣습니다.
- 붓을 증류수에 담그고 번데기를 부드럽게 퍼냅니다(그림 2J).
- 배쪽 쪽이 아래를 향하도록 번데기를 증류수 또는 실리콘 오일에 놓습니다(그림 2L).
- 마이크로피펫을 사용하여 증류수 10μL를 유리 바닥 접시의 유리 부분 가장자리 근처에 놓습니다(그림 2L).
- 유리 바닥 접시의 유리 부분 가장자리 주위에 주사기로 실리콘 그리스를 원형으로 놓습니다(그림 2M).
- 실리콘 그리스에 커버슬립을 씌워 밀봉합니다(그림 2M). 어셈블리는 그림 2N에 나와 있습니다.
알림: 커버슬립과 실리콘 그리스 사이에 틈이 없는지 확인하십시오.
3. 컨포칼 이미징
- 도립 컨포칼 레이저 현미경 및 이미징 소프트웨어를 켭니다.
- 접시를 무대 위에 놓습니다.tage 도립 컨포칼 현미경의 수용자.
- 명시야 관찰에서 저배율 대물렌즈로 번데기를 찾으십시오. 번데기에 체액이 누출되지 않는지 확인하십시오.
- 관심 영역(ROI)에서 관찰할 번데기의 원하는 영역을 중앙에 배치합니다.
참고: 첫 번째 다리와 두 번째 다리에 있는 부절의 전외측과 세 번째 다리에 있는 부절의 복부 쪽은 번데기의 복부 쪽을 향하고 있습니다. 따라서 배복부 축을 따라 있는 부절의 세로 부분은 첫 번째 다리와 두 번째 다리에서 관찰할 수 있는 반면, 전후 축을 따라 있는 부분은 세 번째 다리에서 관찰할 수 있습니다. - 대물 렌즈를 라이브 이미징용 렌즈로 변경합니다.
알림: 침수 렌즈를 사용하면 렌즈와 유리 바닥 접시 사이의 물이 장기 관찰 중에 건조됩니다. no-immersion 또는 silicone oil immersion lens를 사용하는 것이 좋습니다. - 원하는 관측값을 위한 조건을 조정하고 데이터 수집을 시작합니다.
알림: 번데기에 대한 해를 방지하기 위해 선명한 이미지를 얻을 수 있는 한 레이저 출력은 최소한이어야 합니다. ROI를 최소화하고 스텝 크기를 늘리면 Z 스택 수집 시간을 절약하는 데 도움이 됩니다. Z 스택의 깊이를 결정할 때 조직의 미래 변형을 고려해야 합니다. 15-25시간 APF에서 다리 관찰의 경우, 다리가 매우 좁아지기 때문에 커버슬립에 가장 가까운 부분(측면 상피)이 빠르게 더 깊숙이 이동합니다. 이러한 움직임을 고려하여 처음부터 추가 딥 Z 스택을 설정해야 합니다. 15-30 h APF에서 다리 족근 영역의 실시간 이미징을 위한 컨포칼 현미경 설정의 예가 보충 파일 1에 제공됩니다. 형광 퇴색은 장시간의 라이브 이미징 중에 불가피합니다. 이 문제를 완화하려면 최소한의 레이저 출력을 사용하는 것이 좋습니다. ImageJ 플러그인 "AutoEnhance"16 는 페이딩 효과를 보정하기 위해 라이브 이미징 데이터를 처리하는 데 권장됩니다.
결과
여기에서는 번데기 단계에서 발달 중인 초파리 성인 다리의 44시간 라이브 이미징의 예가 설명됩니다. His2Av-mRFP17 (표지핵) 및 sGMCA18 (GFP 표지 액틴 결합 단백질 Moesin, 표지 액틴)을 발현하는 파리를 흰 번데기 단계에서 수집하여 25°C에서 15시간 동안 배양했습니다. 번데기는 프로토콜에 따라 제거 및 장착되었습니다(그림 2). 다리 끝 부근에 있는 족근 및 척골의 Z 스택 이미지는 실온(엄격하지는 않지만 25°C에 가까운)에서 16시간에서 60시간 APF까지 15분마다 성공적으로 획득되었습니다. 일련의 이미지 중 전반부는 그림 3에, 후반부는 그림 4에, 전체의 영상은 영화 1에 표시되어 있습니다. 다리 조직이 급격히 좁아짐에 따라 상피 세포는 일시적으로 흥미로운 구조를 형성했는데, 파르테논 신전과 같은 구조는 apicobasal 돌기와 기저 연결을 특징으로 합니다(그림 3). 상피 두께의 감소는 윤곽이 거의 완성된 후에도 관찰되었습니다(그림 4). 전체 프로세스는 그림 1에 요약되어 있습니다.
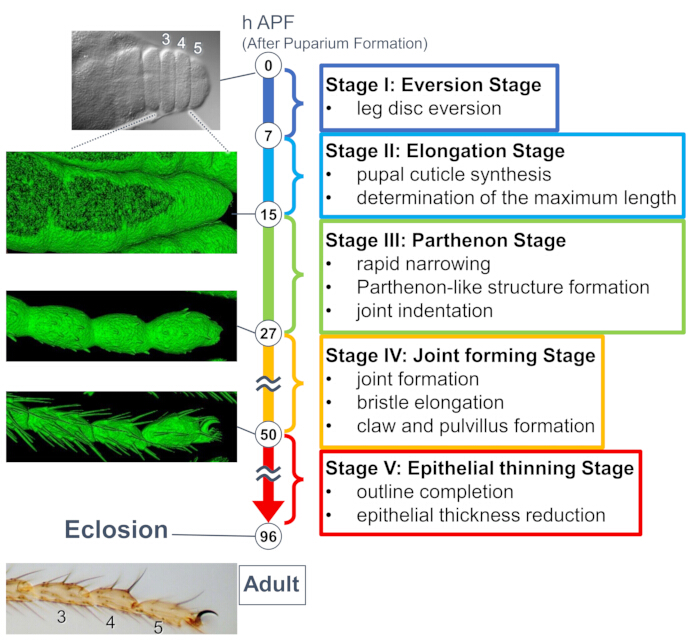
그림 1: 번데기 단계에서 Drosophila 성인 족절의 최종 형태 형성에 대한 개요. 전체 과정은 장기간의 실시간 이미징 실험에서 관찰된 조직 및 세포 수준에서의 형태학적 변화를 기반으로 5단계로 나뉘었습니다. 여러 시점에 해당하는 대표 사진 또는 표면 렌더링 이미지(sGMCA 신호)가 왼쪽에 표시됩니다. 각 스테이지의 이벤트에 대한 간략한 설명은 오른쪽에 쓰여 있습니다. 이 그림은 Hiraiwa et al.15에서 수정되었습니다. 영화 1을 참조하십시오. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
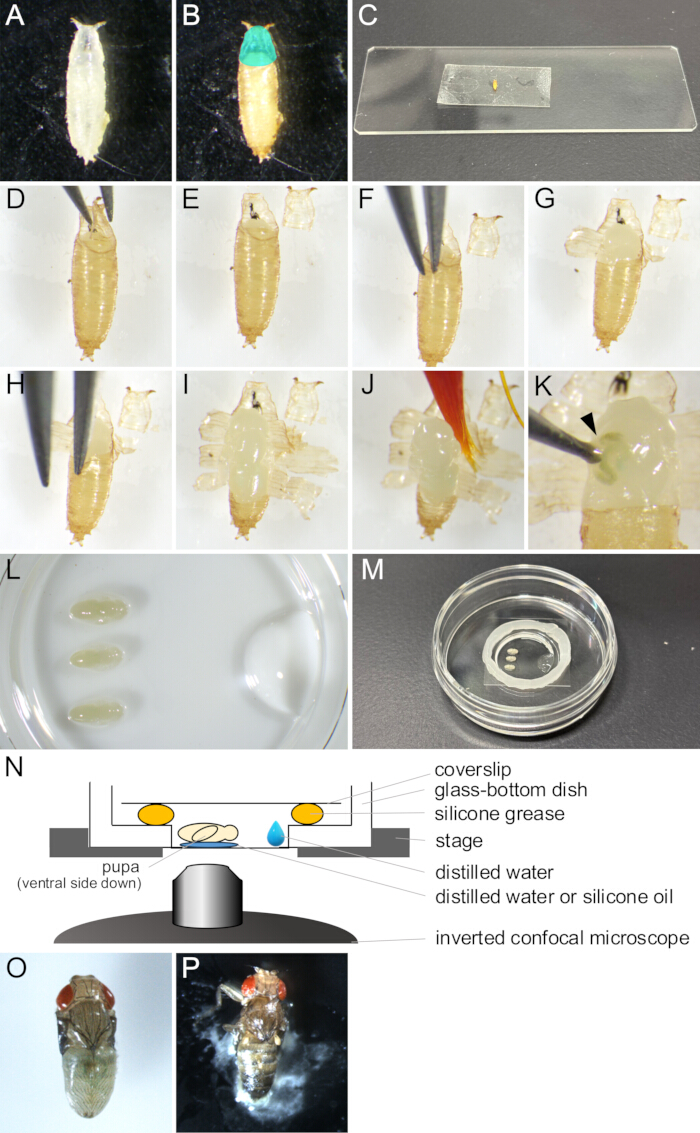
그림 2: 라이브 이미징을 위한 번데기 제거 및 장착 어셈블리. (A) 접시에 담긴 흰 번데기. (B) 번데기는 25°C에서 15시간 동안 배양한 후 (A)에서 나타났습니다. 청록색으로 표시된 영역은 operculum을 나타냅니다. (C) 번데기가 양면 테이프에 붙어 있는 모습을 보여주는 사진. (D-J) 번데기 제거 절차를 보여주는 일련의 이미지. (D) 집게로 수술을 들어 올립니다. (E) 수술이 제거된 경우 (F) 번데기 표피와 번데기 사이에 집게 끝을 삽입합니다. (G) 번데기가 부분적으로 열려 있습니다. (H) 겸자 끝을 다시 삽입합니다. (I) 번데기가 열리고 뒤쪽 끝의 작은 부분만 남았습니다. (J) 붓으로 들어 올리는 번데기. (K) 번데기의 체액 누출의 예. 겸자 끝으로 찔린 상처에서 나오는 액체는 화살촉으로 표시됩니다. (L-N) 마운트 어셈블리를 보여주는 이미지 및 그림. (L) 유리 바닥 접시 바닥에 번데기와 증류수를 올려 놓은 것을 위에서 본 이미지. (M) 마운트 조립 완료 후의 접시. 유리 부분 주위의 가장자리를 따라 실리콘 그리스를 바르고 그리스에 커버 슬립을 놓아 밀봉했습니다. (N) 장기 라이브 이미징을 위한 Drosophila pupa의 장착 어셈블리의 개략도. (O) 기마 번데기가 거의 성체로 발달했습니다. (P) 탑재된 번데기 eclosing. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
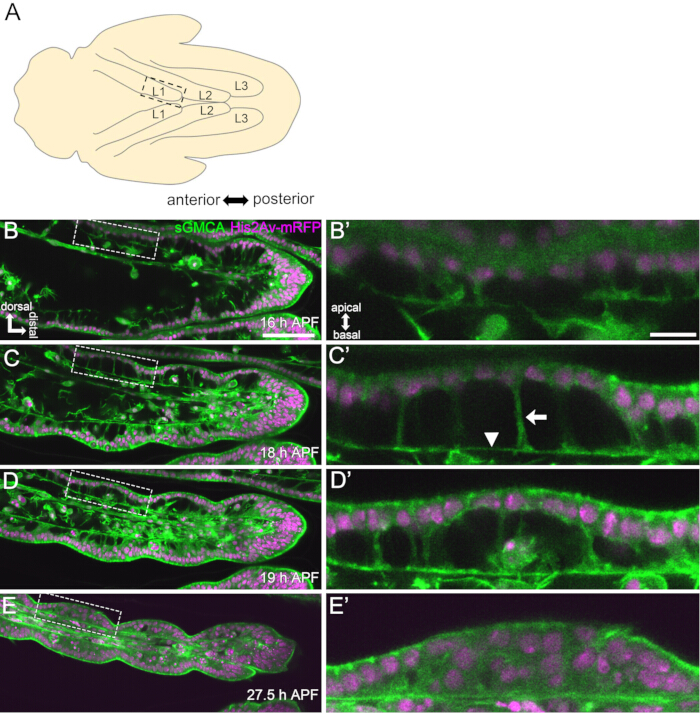
그림 3: 16-27.5 h APF에서 족근 상피 세포의 동적 모양 변화.(A) 복부 쪽에서 본 번데기의 그림. 파선 사각형은 (B-E)에서 관찰된 영역에 해당합니다. L1: 첫 번째 다리, L2: 두 번째 다리, L3: 세 번째 다리. (B,C,D,E) 파리를 표현하는 sGMCA(녹색) 및 His2Av-mRFP(자홍색)에서 족절의 원위부의 라이브 이미징 스틸. 조직이 급격히 좁아지고 관절 부위의 움푹 들어간 곳이 진행됩니다. (B',C',D',E') 각각 (B,C,D,E)에서 파선으로 둘러싸인 영역의 확대. (C')의 화살표와 화살촉은 각각 apicobasal 투영의 예와 기저 연결의 위치를 보여줍니다. 파르테논 신전과 같은 구조는 (B')에서 형성되기 시작하고, (C')에서 완전히 형성되고, (D')에서 사라지기 시작하고, (E')에서는 보기 어려워집니다. 원위부는 모든 그림에서 오른쪽에 있고 등쪽은 맨 위에 있습니다. 스테이지는 (B,C,D,E)의 오른쪽 하단 모서리에 표시됩니다. 기준자: B,C,D,E: 50 μm; B',C',D',E': 10 μm. 이 그림은 Hiraiwa et al.15에서 수정되었습니다. 영화 1을 참조하십시오. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
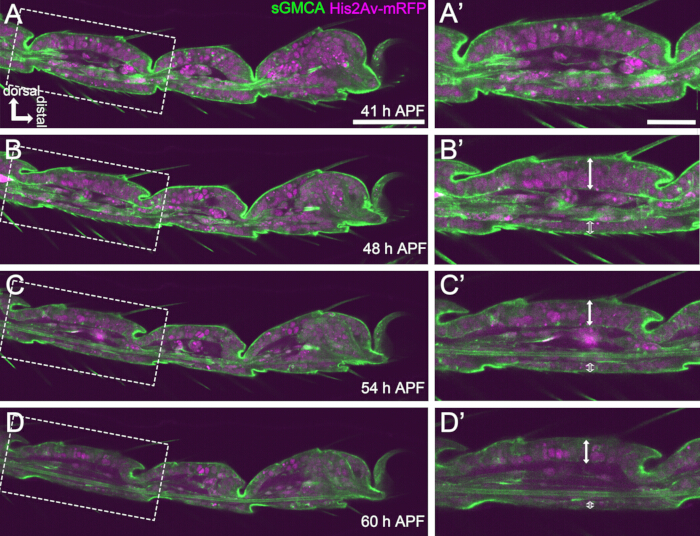
그림 4: 41-60시간 APF에서 족근 상피 세포층의 모양 변화.(A,B,C,D) 그림 3과 동일한 실시간 이미징의 동일한 순차적 데이터 세트의 스틸 이미지. (A,B,C,D)의 파선 사각형은 각각 (A',B',C',D')로 확대됩니다. 약 48시간 APF(A-B')가 되면 강모, 발톱 및 풀빌리의 신장과 같은 외부 형상 형성이 거의 완료됩니다. 침범된 관절의 바닥은 근방으로 움직였고, 그 다음에는 약 54시간 APF 후에 볼-소켓 구조 형성이 진행되었습니다. 등쪽 상피와 복부 상피 사이의 형태학적 차이가 명백해졌습니다(B',C',D'의 이중 화살표와 열린 이중 화살표). 54시간 APF(C-D') 후 상피층은 분절의 윤곽을 거의 변경하지 않고 두께를 줄였습니다. 등쪽은 모든 그림에서 위쪽에 있고 오른쪽에 있습니다. 기준자: A,B,C,D: 50 μm; A',B',C',D': 20μm.이 수치는 Hiraiwa et al.15에서 인용되었습니다. 영화 1을 참조하십시오. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
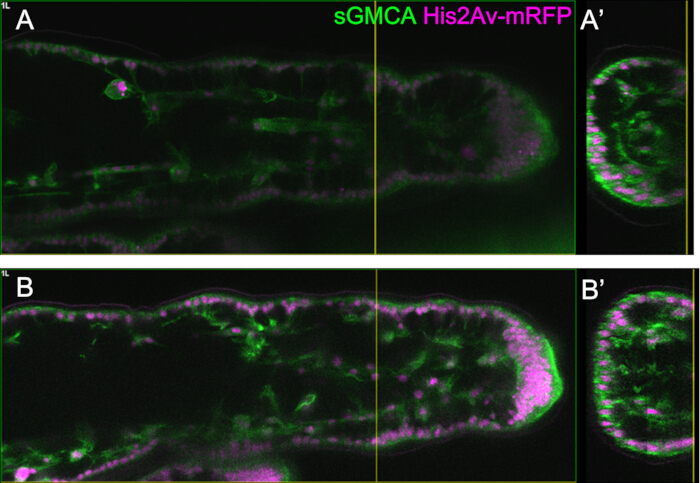
그림 5: Bright Z 기능을 사용한 다리 관찰의 예. (A,B) Bright Z 기능을 사용하여 (B) 또는 (A) 없이 파리를 표현하는 sGMCA(녹색) 및 His2Av-mRFP(자홍색)의 세 번째 다리의 해당 영역, 깊이 및 단계의 이미지. (A) Bright Z 기능을 사용하지 않고 획득한 16시간 APF에서 세 번째 다리의 족골 영역 관찰에서 추출한 59.1μm 깊이의 XY 평면. (ᅡ') 횡단면 보기는 (A)의 노란색 수직선에 해당합니다. (A')의 수직선은 (A)의 초점면을 나타냅니다. (B) Bright Z 기능을 사용하여 획득한 16시간 APF에서 세 번째 다리의 족근 영역 관찰에서 추출한 61.6μm 깊이의 XY 평면. PMT 전압과 레이저 출력이 모두 조정되었습니다. (A)에 비해 이미지의 가시성이 향상되었습니다. (나') 단면도는 (B)의 노란색 수직선에 해당합니다. (B')의 노란색 수직선은 (B)의 초점면을 나타냅니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
보충 파일 1: 15-30시간 APF에서 다리 족근 영역의 실시간 이미징을 위한 컨포칼 현미경 설정의 예. 이 파일을 다운로드하려면 여기를 클릭하십시오.
영화 1: 44시간 동안 부절의 원위부에 대한 장기 라이브 이미징. 파리를 표현하는 sGMCA(녹색)와 His2Av-mRFP(자홍색)를 사용하였다. 가장 대표적인 XY 평면은 그림 3 및 그림 4와 동일한 데이터 세트에서 추출되었습니다. 화살촉은 미래의 접합 영역의 예를 나타냅니다. 조직에서 빠르게 움직이는 세포는 대식세포와 같은 세포입니다. 족골 분절을 따라 뻗어 있는 끈 모양의 신호는 중격의 일부입니다. 타임스탬프는 hh: mm을 표시합니다. 원위부는 오른쪽에, 등쪽은 위쪽에 있습니다. 이 영화는 Hiraiwa et al.15이 파일을 다운로드하려면 여기를 클릭하십시오.
토론
이 기사에서는 번데기 단계에서 초파리 다리의 장기 라이브 이미징을 위한 자세한 프로토콜을 제공합니다. 다리 상상 디스크는 중앙 부분에서 돌출되어 관 구조를 형성한 다음 성인 다리의 최종 모양 형성이 번데기 단계에서 파악하기 어려운 방식으로 발생합니다. 이 과정을 관찰하기 위한 이전의 시도는 주로 고정 염색, 조직 배양 및 주사 전자 현미경 12,13,14에 의해 이루어졌습니다. 이러한 방법은 개별 세포의 지속적인 변화를 추적할 수 없었으며 단편적인 정보만 얻었습니다. 이 연구에서 설명한 방법을 사용하면 컨포칼 현미경으로 족근 영역의 최종 형상 형성 과정을 며칠 동안의 순차적 라이브 이미징으로 성공적으로 관찰할 수 있으며 개별 세포의 변화를 지속적으로 추적할 수 있습니다. 이 실시간 이미징에 의해 밝혀진 흥미로운 세포 역학은 최근 보고서15에 자세히 설명되어 있습니다.
성공적인 장기 라이브 이미징을 위해서는 번데기의 생존 능력을 유지하고 번데기의 발달에 영향을 미치지 않도록 하는 것이 중요합니다. 여기에 설명된 방법에서, 번데기를 제거한 번데기는 많은 경우 성견과 성체로 발전했습니다(그림 2O,P). 이 방법으로 관찰된 발달 중인 족근의 형태학적 변화 시기는 이전 보고서 12,13,14와 일치했습니다. 또한, 상피 세포는 48-60시간 APF(장착 후 32-44시간)에서도 두께 감소와 같은 변화를 보였습니다(그림 4B'-D'). 이러한 사실은 번데기가 손상되지 않은 상태로 유지되고 여기에 설명된 방법을 사용하여 장기간 라이브 이미징을 수행하는 동안 정상적인 발달에 거의 방해나 지연이 없음을 시사합니다. 라이브 이미징에 적용된 번데기를 제거한 번데기의 생존 가능성은 번데기 제거 시기, 절차에서의 취급, 이미징의 광독성 정도 및 사용된 파리 균주에 따라 달라질 수 있습니다.
번데기의 온전함과 발달을 보장하기 위한 중요한 단계 중 하나는 번데기에 해를 끼치지 않고 번데기를 제거하는 것입니다. 번데기가 양면 테이프에 안정적으로 접착되고 집게를 조심스럽게 다루는 것이 성공의 열쇠입니다. 번데기의 탈수를 예방하는 것도 중요합니다. 이와 관련하여 커버슬립과 실리콘 그리스 사이의 틈을 피하는 것이 중요합니다.
번데기의 건조를 피하기 위해 이전의 많은 방법에는 번데기 1,2,3,4,5,6,7의 부분적 제거가 포함되었습니다. 그러나 번데기 전체를 관찰하기 위해서는 번데기를 완전히 제거하는 것이 좋습니다. 번데기의 최대 생존 시간은 알려져 있지 않지만, 번데기를 완전히 제거하는 몇 가지 방법이 보고되었습니다 8,9,10. 이러한 방법에서 번데기에 수분을 제공하는 가장 일반적인 방법은 축축한 여과지를 사용하는 것입니다. 이전 방법과 비교하여 여기에 설명 된 방법은 더 간단하고 쉬운 방법으로 물 한 방울을 넣어 수분을 공급합니다. 또한 이전의 많은 방법에는 번데기를 유리 슬라이드에 장착하는 것이 포함됩니다. 번데기에서 제거한 번데기를 유리 슬라이드에 장착할 때 번데기에 커버슬립을 누르면 번데기에 스트레스가 가해지거나 기울어진 커버슬립으로 인해 이미지의 노이즈, 왜곡 및 선명도 부족이 발생하는 문제가 있을 수 있습니다. 여기에 설명된 방법은 유리 바닥 접시를 사용하여 번데기에 대해 커버 슬립을 누를 필요가 없으므로 가능한 한 자연 상태에 가깝게 조직을 관찰할 수 있습니다. 커버 유리의 각도를 조정할 필요가 없기 때문에 설정이 안정적이고 다루기 쉬우며 더 신뢰할 수 있습니다. 따라서 이 방법은 전문 기술이 거의 필요하지 않아 초보자도 성공적으로 라이브 이미징을 수행할 수 있습니다.
이 방법의 주요 한계는 관찰의 깊이와 시간 해상도입니다. 족절을 관찰하기 위한 조건에서 선명한 이미지는 약 40μm 깊이까지만 얻을 수 있습니다. Bright Z 기능을 사용하면 이 문제를 해결하는 데 도움이 됩니다. 예를 들어, 그림 5에서 볼 수 있듯이 Bright Z 기능을 사용하여 깊이가 증가함에 따라 레이저 출력과 PMT 전압을 높이면 더 깊은 위치에서 이미지 품질이 향상되었습니다. 그러나 레이저 출력을 높이면 광독성 및 신호 페이딩과 관련된 절충안이 있습니다. 따라서 관찰의 목적에 부합하는 최적의 조건을 찾아야 합니다. 시간 분해능은 빠르게 움직이는 세포와 조직을 관찰할 때도 중요합니다. 슬라이스를 줄이고 ROI를 줄이는 것이 이 문제에 대한 주요 솔루션입니다. 검출기 감도가 향상된 최신 장비나 회전 디스크 컨포칼 현미경을 사용하면 시간 분해능을 향상시킬 수 있습니다. 또 다른 제한은 번데기의 단계와 관련이 있습니다. 번데기는 번데기 표피가 12-13.5 h APF19에서 완전히 형성된 후에만 제거할 수 있으며 14 h APF 후에만 쉽게 제거할 수 있습니다. 12시간 APF보다 초기 단계는 번데기를 제거하지 않고 번데기를 장착하여 부분적으로 관찰할 수 있습니다(15).
문제 해결
번데기 제거의 어려움
번데기를 제거하는 동안 번데기의 복부 쪽을 양면 테이프에 접착하는 것이 중요합니다. 번데기 표면에서 접착제와 음식물을 제거해야 하며, 젖은 표면이 좋은 접착력을 방해하기 때문에 후속 건조가 중요합니다. 특히 재료 테이블의 양면 테이프는 내부에서 더 강한 접착력을 가지고 있습니다. 번데기를 부착하려면 안쪽(더 강한) 쪽을 사용해야 합니다. 번데기를 집게로 찢는 대신 해부 가위로 자르면 번데기 제거가 어려울 때 도움이 됩니다.
번데기에서 유체 누출
번데기에 해를 끼치지 않고 번데기를 제거하는 것이 중요합니다. 번데기 체액의 누출은 번데기의 손상을 나타냅니다(그림 2K). 이러한 번데기는 라이브 이미징을 피해야 합니다. 번데기를 제거하는 동안 번데기 손상을 방지하기 위해 조심스럽게 다루는 것 외에도 끝이 비교적 넓은 집게를 사용하는 것이 좋습니다.
이미지 품질이 좋지 않습니다.
형광 신호가 너무 약할 경우 PMT 전압 증가, 핀홀(C.A.) 개방, 스캔 속도 저하, 레이저 출력 증가 등 밝기를 조정하는 방법에는 여러 가지가 있습니다. PMT 전압을 높이면 노이즈가 증가할 수 있고, 핀홀을 열면 Z축 해상도가 낮아지고, 스캔 속도가 느려지면 스캔 시간이 길어지고, 레이저 출력을 높이면 광독성 및 표백의 위험이 증가하는 등 모든 방법에는 부작용이 있음을 기억하십시오. 관심 영역, 형광 리포터의 종류 및 발현 수준, 원하는 라이브 이미징 길이에 따라 적절한 설정을 찾아야 합니다. 전반적으로 레이저 출력은 장기 라이브 이미징을 위해 최소화하는 것이 좋습니다.
형광의 퇴색
형광의 퇴색은 장기간의 라이브 이미징에서 불가피합니다. 이 문제를 피하기 위해 레이저 출력을 최소한으로 사용하는 것이 좋습니다. 페이딩을 보상하려면 획득한 라이브 이미징 데이터를 처리할 때 ImageJ 플러그인 "AutoEnhance"16 을 사용하는 것이 좋습니다.
번데기를 완전히 제거한 덕분에 이 방법은 번데기의 ROI와 방향을 수정하는 것만으로도 다른 조직에 적용할 수 있습니다. 실제로, 비록 이것이 라이브 이미징은 아니지만, 다리의 근위부,, 더듬이 근처의 머리 상피, 등쪽 흉부의 상피는 Hiraiwa et al.15에서 이 방법으로 관찰되었습니다. 광범위한 조직에 대한 이러한 적용 가능성은 유전자의 광학 유도와 같은 다른 기술과의 추가 통합을 촉진할 수 있습니다. 이 방법은 초파리 이외의 cyclorrhaphan (puparium forming) 종에도 적용 할 수 있습니다. 또한, 투명한 번데기 표피를 가지고 있는 경우 다른 곤충 종에 잠재적으로 사용될 수 있습니다. 이 문서에서는 초파리 연구자가 번데기의 실시간 이미징을 수행하여 살아있는 조직의 세포 역학을 캡처하는 데 도움이 되는 자세한 지침을 제공합니다.
공개
저자는 경쟁 이익이 없음을 선언합니다.
감사의 말
기술적 조언을 해주신 Masayuki Miura 박사(도쿄대학)와 Yuya Fujisawa 박사(도쿄대학)에게 감사드리며, 플라이 자원에 대해 블루밍턴 스톡 센터(Bloomington Stock Center)에도 감사드립니다.
자료
| Name | Company | Catalog Number | Comments |
| 35 mm/glass base dish | IWAKI | 3911-035 | |
| Cleaning wipes | NIPPON PAPER CRECIA | S-200 | |
| Dumont #3c Forceps | Fine Science Tools | 11231-20 | |
| Dumont #5SF | Fine Science Tools | 11252-00 | |
| Eppendorf Research plus 2-20 µL | Eppendorf | 3123000098 | |
| Fly strain: His2Av-mRFP, sGMCA | Bloomington Drosophila Stock Center | 59023 | |
| FV3000 | EVIDENT | inverted confocal microscope | |
| FV31S-SW | EVIDENT | software for FV3000 | |
| G40L | Shin-Etsu Silicone | silicone grease | |
| Micro Cover Glass 18 x 18 mm 0.13-0.17 mm | MATSUNAMI | C018181 | |
| Micro Slide Glass 76 x 26 mm 0.9-1.2 mm | MATSUNAMI | S7213 | |
| NEO-SABLE Size 0 round, fine | Pentel | XZBNR-0 | paintbrush |
| SIL300CS-30CC | EVIDENT | silicone oil | |
| Stereomicroscope System SZX7 | EVIDENT | ||
| Terumo syringe 50 mL | Terumo | SS-50ESZ | |
| Transparent double sided tape | Scotch | 665-1-12 | Since the inner layer has stronger adhesion than the outer layer, the inner layer should be used to fix pupae. |
| UPLSAPO10x | EVIDENT | ||
| UPLSAPO40XS | EVIDENT | silicone immersion lens | |
| Vannas Spring Scissors - 2.5mm Cutting Edge | Fine Science Tools | 15000-08 | optional |
참고문헌
- Koto, A., Kuranaga, E., Miura, M. Temporal regulation of Drosophila IAP1 determines caspase functions in sensory organ development. J Cell Biol. 187 (2), 219-231 (2009).
- Ninov, N., Martín-Blanco, E. Live imaging of epidermal morphogenesis during the development of the adult abdominal epidermis of Drosophila. Nat Protoc. 2 (12), 3074-3080 (2007).
- Chiba, M., et al. Activatable photosensitizer for targeted ablation of lacZ-positive cells with single-cell resolution. ACS Cent Sci. 5 (11), 1676-1681 (2019).
- Umetsu, D., et al. Local increases in mechanical tension shape compartment boundaries by biasing cell intercalations. Curr Biol. 24 (16), 1798-1805 (2014).
- Tran, N. V., et al. Programmed disassembly of a microtubule-based membrane protrusion network coordinates 3D epithelial morphogenesis in Drosophila. EMBO J. 43 (6), 568-594 (2024).
- Hellerman, M. B., Choe, R. H., Johnson, R. I. Live-imaging of the Drosophila pupal eye. J Vis Exp. (95), e52120 (2015).
- O'Connor, J. T., Shannon, E. K., Hutson, M. S., Page-McCaw, A. Mounting Drosophila pupae for laser ablation and live imaging of the dorsal thorax. STAR Protoc. 3 (2), 101396 (2022).
- Ziserman, D., Roegiers, F. Live-cell imaging of sensory organ precursor cells in intact Drosophila pupae. J Vis Exp. (51), e2706 (2011).
- Tögel, M., Pass, G., Paululat, A. In vivo imaging of Drosophila wing heart development during pupal stages. Int J Dev Biol. 57 (1-2), 13-24 (2013).
- Weavers, H., Franz, A., Wood, W., Martin, P. Long-term in vivo tracking of inflammatory cell dynamics within Drosophila pupae. J Vis Exp. (136), e57871 (2018).
- Kojima, T. Developmental mechanism of the tarsus in insect legs. Curr Opin Insect Sci. 19, 36-42 (2017).
- Mirth, C., Akam, M. Joint development in the Drosophila leg: Cell movements and cell populations. Dev Biol. 246 (2), 391-406 (2002).
- Mirth, C. Ecdysteroid control of metamorphosis in the differentiating adult leg structures of Drosophila melanogaster. Dev Biol. 278 (1), 163-174 (2005).
- Tajiri, R., Misaki, K., Yonemura, S., Hayashi, S. Dynamic shape changes of ECM-producing cells drive morphogenesis of ball-and-socket joints in the fly leg. Development. 137 (12), 2055-2063 (2010).
- Hiraiwa, S., et al. Unveiling the cell dynamics during the final shape formation of the tarsus in Drosophila adult leg by live imaging. Dev Genes Evol. , (2024).
- . ImageJ plugin page Available from: https://signaling.riken.jp/en/en-tools/imagej/629/ (2024)
- Pandey, R., Heidmann, S., Lehner, C. F. Epithelial re-organization and dynamics of progression through mitosis in Drosophila separase complex mutants. J Cell Sci. 118 (4), 733-742 (2005).
- Kiehart, D. P., Galbraith, C. G., Edwards, K. A., Rickoll, W. L., Montague, R. A. Multiple forces contribute to cell sheet morphogenesis for dorsal closure in Drosophila. J Cell Biol. 149 (2), 471-490 (2000).
- Ashburner, M. . Drosophila: A Laboratory Handbook. , (1989).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유