Method Article
التصوير المقطعي التسلسلي ثنائي الفوتون لدماغ القرمزية بالكامل للتحليلات التشريحية العصبية
In This Article
Summary
التصوير المقطعي التسلسلي ثنائي الفوتون (STPT) هو تقنية لتصوير كتلة من الأنسجة في شكلها ثلاثي الأبعاد من خلال الجمع بين التصوير ثنائي الفوتون والتحكم التلقائي في المرحلة والتقطيع الدقيق. نصف هنا بروتوكولا لتنفيذه لأدمغة لفهم ميزاتها الهيكلية بشكل أفضل.
Abstract
التصوير المقطعي التسلسلي ثنائي الفوتون (STPT) هو تقنية لتصوير كتلة من الأنسجة في شكلها ثلاثي الأبعاد من خلال الجمع بين التصوير ثنائي الفوتون والتحكم التلقائي في المرحلة والتقطيع الدقيق. لقد نجحنا في تنفيذ هذه التقنية لتتبع الإسقاطات المحورية في دماغ. هنا ، يتم وصف الإجراءات التجريبية التفصيلية التي أدت إلى تصوير حجمي موثوق به لدماغ مارموسيت بأكمله. كانت إحدى العمليات الرئيسية للتصوير الناجح هي إزالة السحايا المحيطة بالدماغ ، والتي تتداخل مع التقطيع. من المزايا الكبيرة لهذه المنهجية أنه يمكن استخدام الأقسام المقطعة لتلوين إضافي. في الإعداد الأصلي ، يتم خلط الأقسام المقطعة في الحمام المائي. يمكن محاذاة هذه الأقسام بشكل صحيح في ترتيبها الأصلي وفقا لأنماط الأوعية الدموية في القشرة. مثال على علم الأنسجة الفعال هو تصور بنية المايلين عن طريق انعكاس الضوء البسيط ، والذي يمكن دمجه مع تلطيخ Nissl لتحديد الحدود التشريحية. يمكن أيضا استخدام هذه الأقسام للكشف المناعي عن المتتبعات السابقة والارتجاعية غير الفلورية ، والتي يمكن تسجيلها في بيانات STPT لطبقات من بيانات متعددة.
Introduction
في الدراسات التشريحية العصبية ، يواجه الباحثون الحاجة إلى مراقبة هياكل ترتيب الميكرومتر (على سبيل المثال ، المحاور والعروات) في سياق الدماغ بأكمله. عادة ما يتم التعامل مع هذه المهمة الصعبة من خلال الفحص البصري للأقسام التسلسلية والبحث عن منطقة الاهتمام للتصوير التفصيلي والتحليلات وتسجيل الصور. ومع ذلك ، مع التقدم التكنولوجي ، أصبح من الممكن تصوير الدماغ بأكمله بدقة عالية لتحليل الدماغ بالكامل. في دراسة رائدة أجراها Oh et al.1 ، تلقت المئات من أدمغة الفئران حقن التتبع لتحليل الشبكات العصبية ، والتي تمت معالجتها بواسطة تقنية التصوير المقطعي ثنائي الفوتون (STPT)2. كانت خاصية هذه الدراسة هي أنهم اختاروا متتبعات التصلب لقياس "الاتصال". بينما توفر أدوات التتبع الأمامية معلومات مكانية مفصلة للغاية حول التوزيع المحوري ، فقد اعتمد علماء التشريح العصبي على التجزئة اليدوية الشاقة لتحليلها. من خلال أتمتة الإجراءات التحليلية المختلفة ، بما في ذلك خطوة التجزئة هذه ، نجحوا في "الإنتاج الضخم" لبيانات التتبع عالية الدقة الجاهزة للاستخدام للاستخدامات متعددة الأغراض. فعالية نهجهم واضحة ، بالنظر إلى مجموعة متنوعة من الدراسات التي استخدمت بيانات التتبعالخاصة بهم 3،4،5 ودماغهم القياسي6.
تاريخيا ، اجتذب الاتصال العصبي لأدمغة الرئيسيات غير البشرية انتباه العديد من علماء التشريح العصبي منذ تطوير طريقة التنكس في الخمسينيات من القرن العشرين ، إلى طرق نقل المواد الأمامية / الرجعية في السبعينيات إلى الإستراتيجية الفيروسية الحالية7،8. على هذا النحو ، توجد أجزاء كبيرة من الأدبيات التي تبحث في الروابط العصبية للرئيسيات. على وجه الخصوص ، قام العديد من الباحثين بالتحقيق في الاتصال القشري المعقد لدماغ المكاك ، وتم تنسيق نتائجهم للجدولة (على سبيل المثال ، CoCoMac9). على الرغم من فائدتها ، إلا أن هذه الدراسات الكلاسيكية كان لها العديد من القيود. أولا ، نظرا لأن كل دراسة تركز فقط على مناطق دماغية محدودة ، فإن المعلومات التي تم الحصول عليها تصبح حتما مجزأة. ثانيا ، تستخدم كل دراسة طرقا وشروطا مختلفة. وبالتالي ، يصبح التقييم الكمي عبر الدراسات معقدا. ثالثا ، عادة ما يتم عرض الاتصال إما ككاميرا لوسيدا للأقسام التمثيلية أو كجدول / رسم بياني شبه كمي لمناطق الدماغ المحددة من قبل المؤلف. بمعنى آخر ، يتم استخراج معلومات محدودة جدا فقط من بنية دماغية معقدة لعرضها في الأدبيات المنشورة. مع تطور تقنيات التصوير بالرنين المغناطيسي (MRI) ، أصبحت دراسات الدماغ بالكامل بدقة منخفضة بارزة. ومع ذلك ، هناك فجوة كبيرة بين مستويات التفاصيل بين ما نعرفه عن الروابط العصبية في الفئران وتلك الموجودة في الرئيسيات.
مع وضع هذه الخلفية في الاعتبار ، شرعنا في إجراء تتبع شامل لأدمغة الديديةالشائعة 10،11. على الرغم من أنه أصغر بكثير وأكثر سلاسة من دماغ المكاك ، إلا أن نظيره المرموسي يظهر علامات واضحة على الرئيسيات ، مثل وجود منطقة MT ومناطق الفص الجبهي الحبيبية ، ولم يتم تحديد أي منهما بوضوح في القوارض12،13. هنا ، كان الحجم الصغير ميزة كبيرة لأنه حتى دماغ يزن عشر مرات من دماغ الفأر. لحسن الحظ ، يمكننا تصوير دماغ بالكامل مع الحد الأدنى من التحديثات للإصدار الأصلي من برنامج التشغيل TissueCyte1000 (يشار إليه من الآن فصاعدا باسم نظام تصوير الأنسجة بالكامل) ، وهو المجهر المتاح تجاريا لتصوير STPT2. كان هذا التحديث للسماح بحركة إضافية للمرحلة قبل التقطيع. الإصدار الحالي كاف الآن لمعالجة دماغ. تشارك هذه المقالة بروتوكولا للتعامل مع دماغ لتصوير STPT. يتم أيضا توفير بروتوكول ما بعد التصوير الذي يعزز فائدة هذه الطريقة.
Protocol
تم تنفيذ جميع الإجراءات التجريبية وفقا لدليل المعهد الوطني للصحة لرعاية واستخدام المختبر (منشورات المعاهد الوطنية للصحة رقم 80-23) المنقحة في عام 1996 و "المبادئ التوجيهية لرعاية واستخدام في مجال العلوم الفسيولوجية" للجمعية الفسيولوجية اليابانية ، وتمت الموافقة عليها من قبل لجنة التجريبية في RIKEN (W2020-2-009 (2)).
1. حقن التتبع
- إجراء حقن متتبعات الفلورسنت وغير الفلورية في دماغ وفقا للإجراءات المبلغ عنهاسابقا 14.
- فيما يتعلق بالجمع بين طريقة STPT ، تأكد من أن مضان أدوات التتبع قوي بما يكفي لاكتشافها دون تحسين. اعتماد نظام TET-Off مزدوجالمتجه 10 لتحسين التعبير.
ملاحظة: يمكن أيضا حقن أدوات التتبع غير الفلورية واكتشافها بعد الانتهاء من STPT باستخدام الشرائح المنتجة. تشمل أمثلة أدوات التتبع غير الفلورية أمين ديكستران البيوتينيل (BDA) ، الذي يعبر عن AAV في AAV2 الرجعية للكشف عن نوى خلية الإدخال10 ، بالإضافة إلى علامة smFP-tag المستندة إلى GFP (انظر أدناه).
- فيما يتعلق بالجمع بين طريقة STPT ، تأكد من أن مضان أدوات التتبع قوي بما يكفي لاكتشافها دون تحسين. اعتماد نظام TET-Off مزدوجالمتجه 10 لتحسين التعبير.
- إصلاح التروية والحصول على دماغ بعد 4 أسابيع.
- لتخدير المارموسيت، يتم تطبيق ميديتوميدين (0.04 ملغم/كغ)، وميدازولام (0.4 ملغم/كغ)، وبوتورفانول (0.4 ملغم/كغ)، يسمى MMB، عن طريق الحقن العضلي، متبوعا بالحقن داخل الصفاق من ثيوبنتال الصوديوم (100 ملغم/كغ).
- بعد التأكد من فقدان منعكس الألم ، افتح تجويف الصدر لكشف القلب وقطع الأذين الأيمن للسماح للدم والمثبت بالخروج.
- ثم قم بقطع البطين الأيسر لإدخال إبرة التروية لشطف الدم أولا بمحلول البادئة (250 ملي مولار سكروز ، 5 ملي مولار MgCl2 في 0.02 M عازلة فوسفات [PB ، درجة الحموضة 7.4]) لبضع دقائق (~ 50-100 مل) ، متبوعا بالتثبيت باستخدام 4٪ بارافورمالدهيد / 0.1 M عازلة فوسفات (PB ؛ 2-3 أضعاف وزن أكثر من ~ 20 دقيقة).
- التروية الجيدة أمر بالغ الأهمية للحصول على نتيجة جيدة. عند إدخال إبرة التروية ، قم بدفعها على طول الحاجز باتجاه الشريان الأورطي لتأمين تدفق جيد للمثبت. يصبح طرف الإبرة مرئيا عندما يصل إلى الشريان الأورطي. تراجع حتى يصبح الطرف بالكاد مرئيا حتى لا يتجاوز الشريان السباتي.
- حافظ على الدماغ في 4٪ بارافورمالدهيد / 0.1 M PB لمدة 48 ساعة عند 4 درجات مئوية وانقله إلى 50 ملي مولار PB. إذا لم يتم استخدامه على الفور ، فقم بتخزين الدماغ في 0.75٪ جلايسين / 0.1 M PB لمنع التألق الذاتي بسبب الإفراط في التثبيت.
2. تحضير العينة (الشكل 1)
- احتضان الدماغ الثابت بالكولاجيناز (1 مجم / مل في 3 ملي مولار CaCl2 في 10 مل من محلول ملحي مخزن [TBS]) عند 37 درجة مئوية لمدة 1 ساعة.
ملاحظة: قم بتسخين الدماغ مسبقا عند 37 درجة مئوية لمدة 5 دقائق قبل الحضانة. - افركي سطح الدماغ بعناية بقطعة قطن لتقشير مادة البيا والسحايا الأخرى (الشكل 1 أ ، فيديو تكميلي). استخدم ملقطا دقيقا لتقشير السحايا المنفصلة.
ملاحظة: من المهم إزالة السحايا المحيطة بالدماغ المتوسط ، بما في ذلك القولون العلوي أو تلك الموجودة في الجزء العلوي من المهاد. من الصعب فضح هذه الهياكل المخبأة في أعماق الداخل. ومع ذلك ، قم بإزالة السحايا قدر الإمكان. خلاف ذلك ، غالبا ما تظل غير مقطوعة ، وتطفو ، وتتداخل مع التصوير والتقطيع (الشكل 2 أ). - توخي الحذر الشديد عندما يتعرض الدماغ للتصوير بالرنين المغناطيسي خارج الجسم الحي قبل التضمين ، حيث يتم غمر الدماغ في محلولالفلور 15. يمكن أن يشكل الفلور المتبقي ، إذا تم دمجها معا ، فقاعات هواء صغيرة تحت الهدف أثناء التصوير. لتجنب ذلك ، احتفظ بالدماغ في PB لمدة أسبوع واحد قبل التضمين.
ملاحظة: عادة ما تكون خطوة الانتظار هذه غير ضرورية ولكنها ضرورية عند دمجها مع التصوير بالرنين المغناطيسي خارج الجسم الحي . - قم بإعداد المخزن المؤقت NaBH4 عن طريق إذابة 0.2 جم من NaBH4 في 100 مل من محلول بورات 50 ملي مولار (درجة الحموضة 9.2) الدافئ إلى 40 درجة مئوية. اترك الغطاء مفكوكا للسماح لغاز ثاني أكسيد الكربونبالخروج . احتفظ بالمحلول طوال الليل مع فك الغطاء. لف الزجاجة بورق الألمنيوم لحمايتها من الضوء حتى الاستخدام.
- اصنع الاغاروز المؤكسد عن طريق تقليب 2.25 جم من الاغاروز و 0.21 جم من NaIO4 في 100 مل من PB لمدة 2-3 ساعات. قم بتصفية المحلول بشفط الفراغ واغسله بثلاثة تغييرات في PB. أعد تعليق الاغاروز في 50 مل من PB.
- قم بإذابة الاغاروز تماما في فرن الميكروويف وتبرد إلى 60-65 درجة مئوية.
- ضع الدماغ في غرفة مخصصة وقم بتضمين الدماغ في الاغاروز. احرص على إدخال الاغاروز في التجويف الموجود أسفل الجسم الثفني (الشكل 1 ب).
ملاحظة: قم بتسخين الدماغ أولا في درجة حرارة الغرفة ثم عند 65 درجة مئوية لمدة 5 دقائق للسماح للأغروز بالاستقرار على سطح الدماغ دون أن يتصلب. - قم بتفكيك الغرفة واغمر كتلة الاغاروز في المخزن المؤقت NaBH4 طوال الليل عند 4 درجات مئوية.
- قم بتغيير المخزن المؤقت إلى PB عدة مرات على مدار 1-2 أسابيع عند 4 درجات مئوية.
ملاحظة: يصبح التألق الذاتي للأنسجة ضعيفا جدا إذا كان التبادل المؤقت غير مكتمل. - اصنع مرحلة زجاجية منزلقة عن طريق إرفاق أربعة مغناطيسات نيوديميوم بمزيج فوري من الإيبوكسي.
- قم بتركيب كتلة الاغاروز على المسرح باستخدام مادة لاصقة قوية (على سبيل المثال ، الغراء الفائق) (الشكل 1 ج).
3. معالجة الأنسجة
- قم بتشغيل نظام تصوير الأنسجة بالكامل وفقا لتعليمات الشركة المصنعة. كما تم نشر بروتوكول مفصل16. يستخدم الإجراء الحالي بشكل أساسي ل TissueCyte1000 ولكن يمكن تطبيقه على نماذج أخرى ، مثل TissueCyte 1600FC.
- تختلف العملية قليلا بين النماذج ، ولكن اتبع النقاط أدناه التي تعتبر مهمة بشكل عام.
- يمكن معالجة دماغ بأكمله من الأطراف الأمامية إلى الخلفية دون أي تغييرات في الأجهزة. تأكد من عدم تجاوز حدود تحريك المرحلة عند وضع الدماغ.
- اضبط زاوية الشفرات للتأكد من أن أعماق السطح عند طرفي الشفرة في حدود 10 ميكرومتر. بسبب تكوين النخاع الكثيف ، حتى اختلاف العمق البالغ 10 ميكرومتر يمكن أن يؤدي إلى اختراقات ليزر مختلفة من خلال المادة البيضاء البالغة. للسبب نفسه ، اضبط مستوى التصوير على حوالي 25-35 ميكرومتر من السطح.
- استخدم شفرة خزفية (موصى بها) لقطع الدماغ بالكامل على فترات 50 ميكرومتر (~ أكثر من 650 شريحة).
- تظل السحايا غير مقطوعة وتتداخل مع التقطيع إذا لم تتم إزالتها بشكل صحيح (الشكل 2). يصعب إزالة بعض السحايا (على سبيل المثال ، تلك المحيطة بالحصين أو اللب). استخرج هذه السحايا يدويا عن طريق ملقط دقيق عند ملاحظتها.
4. التقنيات النسيجية المساعدة
- استرجاع القسم
- استعادة شرائح الأنسجة لإجراء تلطيخ نسيجي مختلف. قم بمحاذاة هذه الأقسام بدقة بترتيب التقطيع. تتبع الأوعية الدموية عبر الطبقات القشرية للمحاذاة (الشكل 3).
- اقطع الاغاروز الزائد من كل قسم لتحسين المناولة
ملاحظة: لا يجب أن تكون هذه العملية مفرطة. يعمل الاغاروز على تثبيت أجزاء الأنسجة في مكانها دون التدخل في المعالجة النسيجية. - التصوير بإضاءة خلفية
- قم بتركيب الأقسام على زجاج منزلق وجففها.
- أعد ترطيب القسم باستخدام PBS وضع الغطاء للتصوير.
- لاحظ نمط تكوين النخاع بدون تلطيخ عند تصوير القسم بواسطة مجهر مضان (الشكل 4) في وضع المجال الساطع. اضبط وقت التعرض بحيث يكون انعكاس الضوء مرئيا.
ملاحظة: يمكن استخدام أي مجهر إذا كان بإمكانه استخدام إضاءة المجال المظلم. - قم بإزالة الغطاء وانتقل إلى تلطيخ نيسل أو أي تلطيخ آخر. أي إجراء تلطيخ قياسي كاف.
- استخدم هذه الطريقة لمقارنة أنماط التلوين المختلفة مباشرة مع أنماط تكوين النخاع (الشكل 4).
- تصوير BDA
- انظر الجدول 1 للاطلاع على إجراء مفصل.
- أولا ، عالج الأقسام بمحلول Dent's (20٪ DMSO ، 80٪ ميثانول). يعزز الميثانول المتضمن في محلول Dent بشكل كبير إشارات BDA في المحاور.
- استخدم طريقة تضخيم إشارة التيراميد (TSA) لتعزيز إشارة BDA ليتم اكتشافها بالفلورسنت17.
ملاحظة: يمكن شراء محلول TSA-biotin من البائع ، لكن الكاشف الداخلي أرخص بكثير وأكثر فعالية. - للتسجيل في صورة STPT، التقط صورة بإضاءة خلفية بعد تركيب القسم على زجاج منزلق مع وسائط التثبيت.
- تلطيخ بروتين الفلورسنت الوحش السباغيتي (smFP)
ملاحظة: بروتينات الفلورسنت "وحش السباغيتي" (smFPs) هي عائلة من متغيرات GFP غير الفلورية مع علامات حاتمة متعددة18. إنها توفر إشارات فلورية ممتازة عند الكشف عن المناعة وهي مناسبة كمتتبعات مصاحبة لمتتبعات الفلورسنت. انظر الجدول 2 للحصول على تركيبات AAV المتاحة من Addgene.- اتبع الإجراء التفصيلي الوارد في الجدول 1.
5. معالجة بيانات ما بعد التصوير
- اختبار سلامة البيانات
ملاحظة: يقوم STPT بإنشاء عدد كبير من ملفات الصور. عندما يتم تقسيم دماغ البالغ إكليليا على فترات 50 ميكرومتر ، عادة ما تكون هناك حاجة إلى أكثر من 650 قسما لتغطية الدماغ بأكمله. تتكون بيانات كل قسم من سلسلة من صور التجانب التي تم التقاطها في ثلاث قنوات. يتم تخزين ملفات الصور هذه في مجلد واحد مع ملف بيانات التعريف الذي يسجل موضع كل لوحة. لتقليل المقدار الإجمالي للبيانات ووقت المعالجة ، يتم إجراء التصوير في كتل من عمليات التشغيل ، يتغير خلالها عدد خطوات X و Y للتجانب تدريجيا. عادة ما تشكل 20-30 كتلة من الجري ، كل منها يشتمل على تصوير 30-50 قسما ، مجموعة البيانات الكاملة لدماغ واحد. للاستفادة من هذه البيانات ، يلزم إجراء العديد من خطوات معالجة الصور ، بما في ذلك خياطة الصور المبلطة ، وتجزئة إشارات الفلورسنت ، وتسجيل البيانات الحجمية في قالب قياسي ، من بين أمور أخرى.- قم بتنفيذ خطوات معالجة الصور بشكل فردي باستخدام أدوات برمجية مختلفة أو من خلال خطوط أنابيب مخصصة مصممة خصيصا لتلبية الاحتياجات المحددة للباحثين. تفاصيل معالجة الصور خارج نطاق هذه الورقة ويمكن العثور عليها في منشورات أخرى11،19.
- بغض النظر عن الإجراء المستخدم ، تأكد من تنظيم البيانات باستمرار.
ملاحظة: نظرا لأن عملية التصوير بأكملها تتضمن العديد من كتل الجري وتمتد لعدة أيام ، فليس من غير المألوف إلغاء الجري في منتصف الطريق وإعادة تشغيله من جديد. في مثل هذه الحالات ، يمكن أن تتعطل بنية البيانات ، مما يعيق التنفيذ السليم لخط أنابيب معالجة الصور. - لتقليل مخاطر تعطيل بنية البيانات، قم بتشغيل برنامج Python نصي للتحقق من سلامة بنية البيانات (kn_pipeline_check_mosaic.py) المتوفرة في GitHub (github.com/watkarbey/STPT_depo).
- تسجيل الصورة الملطخة على صورة STPT
ملاحظة: يمكن إجراء التحويل غير الخطي للصورة الملطخة إلى صورة STPT باستخدام المكون الإضافي bUnwarpJ الخاص ب ImageJ.- اضبط حجم صور الهدف (STPT) والصور المصدر (الملطخة) بحيث تكون متساوية تقريبا.
- ثنائي كل صورة لتصور أشكال الأقسام.
- قم بتشغيل bUnwarpJ. تذكر أن تتحقق من خيار حفظ التحويلات .
- ابدأ تشغيل bUnwarpJ مرة أخرى. حدد الصورة الأصلية قبل التصفية الثنائية كصورة المصدر. ثم انقر فوق تحميل التحويل المرن واختر التحويل المحفوظ.
النتائج
في الإعداد النموذجي المستخدم هنا ، يمكن تصوير الدماغ الكامل لمارموسيت بالغ (الشكل 5) بدقة ~ 1.3 × 1.3 ميكرومتر / بكسل مع فاصل مقطع 50 ميكرومتر في حوالي أسبوع واحد. هذا يصل إلى ~ 650 صورة إكليلية في ثلاث قنوات بعد خياطة الصورة. مع عدسة موضوعية 16x (Nikon 16xW CFI75 LWD; NA = 0.80) ، مجال رؤية لقطة واحدة حوالي 1 × 1 مم. يتم الحصول على صورة السطح الإكليلي بالكامل عن طريق خياطة هذه اللقطات (الشكل 5 أ). المحاذاة في الاتجاه Z ممتازة ويتم الحصول على صورة ثلاثية الأبعاد جيدة ببساطة عن طريق تكديس بيانات الصورة الإكليلية (الشكل 5B ، E). للتوحيد القياسي ، يمكن استخدام قالب STPT لدماغ11 للتسجيل ثلاثي الأبعاد (الشكل 5F). يعد تحويل البيانات هذا أحد الجوانب الرئيسية للتشريح العصبي للدماغ بأكمله ، حيث يتم تعيين إحداثيات مساحة مطلقة لمنطقة الاهتمام بشكل مستقل عن التعليقات التوضيحية التشريحية. بمجرد تسجيل عينة الدماغ في الفضاء القياسي ، يمكن للمرء بسهولة إخراج المناطق الفرعية ذات الأهمية لمزيد من التحليل (الشكل 5F ، G). على وجه الخصوص ، يمكن تحويل المناطق القشرية إلى خريطة مسطحة باستخدام معلمة محددة مسبقا (الشكل 5H).
يمكن استخدام الأقسام التي تم إنشاؤها أثناء التصوير لأغراض نسيجية مختلفة. كما هو موضح في الشكل 4 أ ، ب ، يوفر التصوير بإضاءة خلفية بدون تلطيخ نمطا مشابها جدا لتلوين المايلين الأصلي. يمكن أن يكون هذا بديلا ممتازا لتلوين المايلين. علاوة على ذلك ، إذا تم الحصول على الصورة ذات الإضاءة الخلفية قبل تلطيخ Nissl ، فيمكن استخدام نفس القسم للحصول على أنماط كل من تلطيخ المايلين و Nissl ، وبالتالي توفير معلومات مفيدة لتحديد المناطق والطبقات (الشكل 5C-E). يمكن أيضا استخدام هذه الأقسام للتلوين المناعي. في الشكل 5J ، تم تلطيخ القسم المحيط بمركز الحقن بجسم مضاد NeuN لتقدير كفاءة نقل فيروس AAV. إنها أيضا استراتيجية جيدة لحقن أدوات التتبع غير الفلورية بالإضافة إلى متتبعات الفلورسنت واكتشافها نسيجيا بعد استرجاع القسم. في دراستنا السابقة ، قمنا بدمج المتتبعات الخضراء الأمامية مع ناقل "cre" الرجعي ، والذي تم اكتشافه لاحقا بواسطة الجسم المضاد المضادل cre 10. في مثال على الشكل 6A-E ، تم حقن BDA في الجانب المقابل لجهاز التتبع الأخضر (البرسيم) واكتشفه بالفلورسنت. لاحظ أنه يمكن تسجيل إشارات BDA الحمراء في صورة TissueCyte ليتم توطينها في إحداثيات الدماغ بأكمله. في مثال آخر للشكل 6F-I ، تم حقن smFP-myc في المنطقة الجدارية (الشكل 6G) ، بينما تم حقن المتتبع الأخضر في المنطقة الأمامية. بهذه الطريقة ، يمكن حقن متتبعات متعددة في نفس دون التدخل في التصوير. من المزايا الكبيرة لاستخدام أقسام STPT للتلوين الإضافي أنه يمكن تحديد العلاقة بين متتبعات الفلورسنت وغير الفلورية لنفس الدماغ. على هذا النحو ، تمكنا من تحديد المعاملة بالمثل للتوقعات القشرية بدقةعالية 10. ميزة أخرى هي أنه يمكن تعيين الإحداثيات ثلاثية الأبعاد للأقسام الملطخة مرة أخرى إلى بيانات STPT ثم إلى القالب القياسي. وبالتالي ، قد لا يكون من الضروري استخدام جميع الأقسام المستردة للتلطيخ. للحصول على تفسير أفضل ، يمكن تحديد الأقسام للتلوين لإضافة المزيد من السياق إلى بيانات STPT.
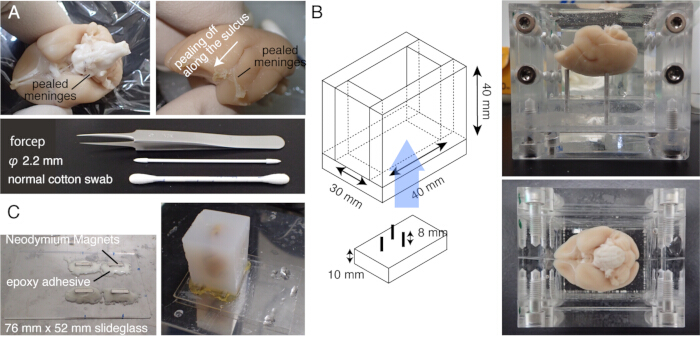
الشكل 1: تحضير عينة ل STPT. (أ) إزالة السحايا باستخدام مسحات قطنية. يمكن إزالة السحايا المحيطة بجذع الدماغ بواسطة ملقط رفيع الرؤوس. تتم إزالة السحايا المحيطة بدماغ يدويا عن طريق فركها بمسحات قطنية. تظهر الصورة السحايا المقلدة من داخل التلم الجانبي. (ب) صندوق الأكريل المستخدم في تضمين الاغاروز. المسامير متحركة وتستخدم لضبط زاوية الدماغ لتكون قريبة من الموضع الثابتالتجسيمي 20. (ج) شريحة مغناطيسية مصنوعة من زجاج منزلق مقاس 76 مم × 52 مم وأربعة مغناطيسات نيوديميوم متصلة بمادة لاصقة إيبوكسي. يتم إرفاق كتلة الاغاروز بالمرحلة المغناطيسية بالغراء الفائق. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
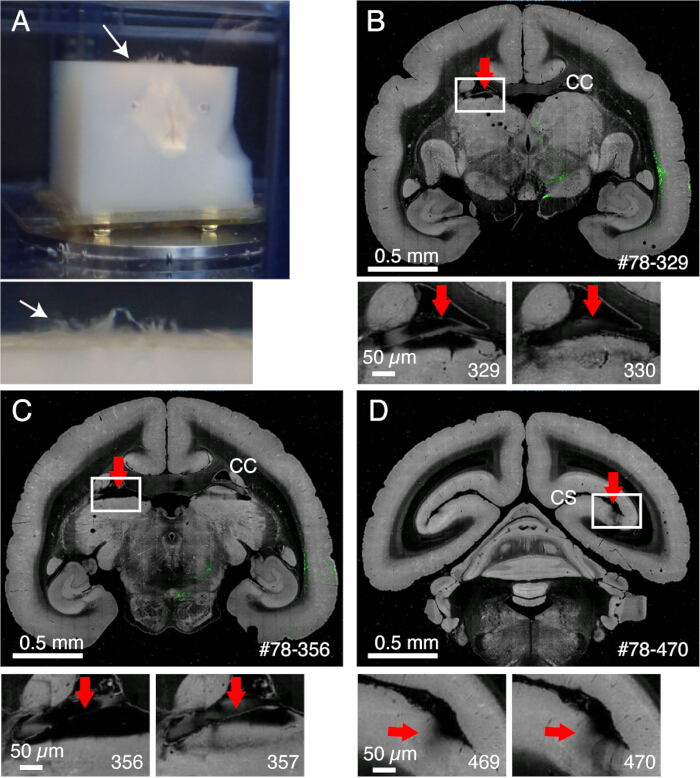
الشكل 2: تأثير السحايا على التصوير. (أ) السحايا التي تظل غير مقطوعة تطفو ، كما هو موضح في السهم الأبيض. في هذا المثال ، يظهر نتوء واسع النطاق للسحايا لأنه لم تتم إزالتها قبل تضمين الاغاروز. عادة ، تظل السحايا غير مقطوعة فقط في العديد من المناطق الصعبة. (ب) مثال على التقطيع السيئ بسبب وجود السحايا بين الجسم الثفني والجزء العلوي من المهاد. في هذه الحالة ، أدى التقطيع السيئ إلى تناوب شريحة عميقة (329) وشريحة طبيعية نسبيا (330). # 78-329 تعني العينة رقم 78 ، القسم رقم 329 في بوابة بيانات Brain / MINDS (C) مثال آخر على التصوير السيئ. في الحالة الأسوأ ، قد تنفجر النواة اللبية التي يظهرها السهم الأحمر تماما. قضبان المقياس: 0.5 مم (اللوحة العلوية) ، 0.5 ميكرومتر (اللوحة السفلية). (د) مثال آخر على التصوير السيئ. يصعب إزالة السحايا العميقة داخل التلم الكالكارين. الظلال التي شوهدت في القسمين 469 و 470 ناتجة عن السحايا العائمة التي جاءت تحت الهدف. قضبان المقياس: 0.5 مم (اللوحة العلوية) ، 0.5 ميكرومتر (اللوحة السفلية). الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
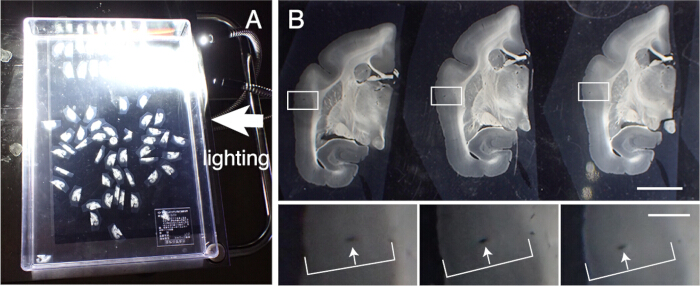
الشكل 3: محاذاة أقسام الأنسجة بالترتيب. (أ) يمكن محاذاة ما يصل إلى 50 قسما إكليليا من بشكل صحيح بالترتيب في حاوية بلاستيكية (31 سم × 22.5 سم). لتصور الهياكل التفصيلية ، يتم وضع الحاوية على ورق أسود وتضيء من الجانب. تتم محاذاة هذه الأقسام أولا بالترتيب تقريبا ثم تخضع لمحاذاة دقيقة. (ب) تستخدم المحاذاة الدقيقة الأوعية الدموية كعلامة. تحتوي القشرة الدماغية على العديد من الأوعية الدموية التي تمتد عموديا عبر الطبقات القشرية. يتم تحديدها على أنها ثقوب ممدودة تغير مواقعها بشكل منهجي داخل الطبقات القشرية (الأسهم البيضاء). باستخدام هذه الطريقة ، يمكن محاذاة المقاطع ذات الفواصل الزمنية 50 ميكرومتر بدقة. يمكن تحديد ثقوب الأوعية الدموية هذه في صور قسم SPTP للتأكيد. شريط المقياس: 5 مم (اللوحة العلوية) ، 1 مم (اللوحة السفلية). الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
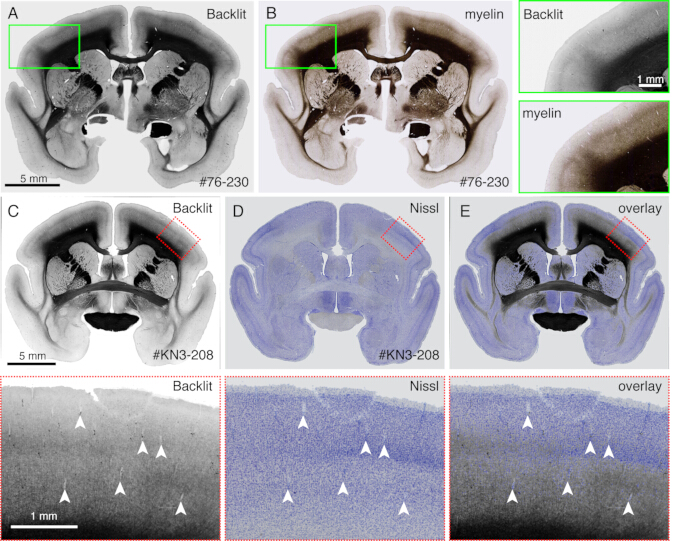
الشكل 4: صورة بإضاءة خلفية كبديل لتلوين المايلين. (أ ، ب) تم استخدام القسم المماثل للتصوير بإضاءة خلفية وتلوين المايلين. أولا ، تم تركيب القسم على الزجاج المنزلق ، وتجفيفه ، وإعادة ترطيبه باستخدام PBS ، والغطاء ، والتصوير باستخدام مجهر ضوئي (جدول المواد). بعد إزالة الغطاء ، تم استخدام نفس القسم لتلوين المايلين21 وتم تصويره باستخدام مجهر فلوري. تمت إعادة تسجيل الصورة ذات الإضاءة الخلفية إلى صورة المايلين باستخدام المكون الإضافي bUnwarpJ الخاص ب ImageJ. تعرض المربعات الخضراء طرق العرض المكبرة لكل صورة. لاحظ أن هذه الصور تظهر أنماطا متطابقة تقريبا ، باستثناء أن تلطيخ المايلين يصور الهياكل الليفية بشكل أفضل. (C-E) تم استخدام القسم المماثل للتصوير بإضاءة خلفية وتلوين Nissl. تم تسجيل قناع العتبة المنخفضة للصورة ذات الإضاءة الخلفية لأول مرة باستخدام قناع العتبة المنخفضة لصورة Nissl باستخدام المكون الإضافي bUnwarpJ ، وتم تحويل الصورة الأصلية باستخدام نفس المعلمة. لاحظ أن الأوعية الدموية (رؤوس الأسهم البيضاء) متطابقة جيدا بين الصورتين. نظرا لأن هاتين الصورتين لنفس القسم ، فإن المطابقة تكاد تكون مثالية ، ويمكن للمرء أن يقارن بشكل مباشر بين أنماط المايلين والنيسل لتحديد الطبقات القشرية. قضبان المقياس: 5 مم (الألواح من الدرجة الأولى). الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
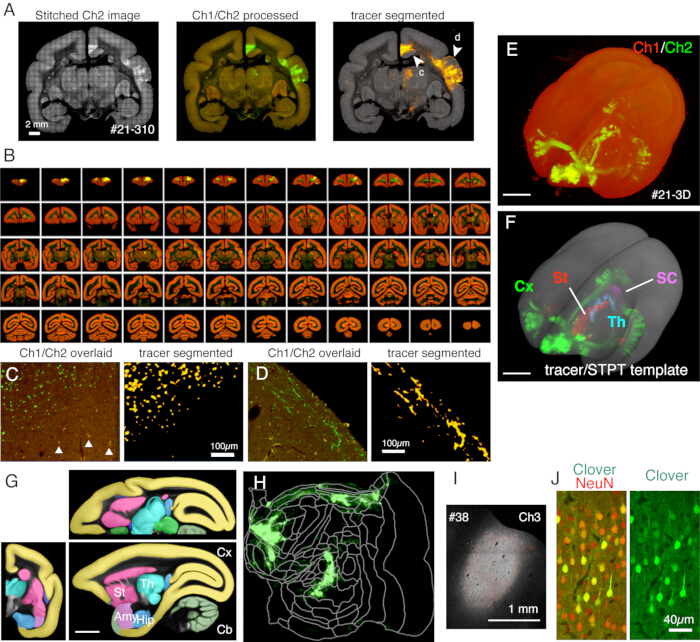
الشكل 5: النتيجة النموذجية لتصوير STPT. (أ) تبليط بسيط لصور Ch2 (خضراء) لقسم مثال (القسم 310 من العينة # 21). بدون تصحيح الخلفية، تكون حدود كل لوحة مرئية. في العمود الأوسط ، تم خياطة البلاط بتصحيح الخلفية ل Ch1 (أحمر) و Ch2 (أخضر) ، على التوالي. لتقليل إشارات lipofuscin (انظر اللوحة C) ، تم طرح إشارات Ch1 من Ch2 وعرضت باللون الأخضر. لتقليل إشارات lipofuscin ل Ch1 ، تم استخدام الأمر "إزالة القيم الخارجية.." قبل الخياطة بواسطة ImageJ. في العمود الأيمن ، تم تقسيم إشارات التتبع حسب خط أنابيب معالجةالصور 11. تظهر رؤوس الأسهم (c، d) المواقع التي تظهر فيها طرق العرض المكبرة في اللوحات C و D. شريط المقياس: 2 مم. (B) نظرة عامة على الأقسام التسلسلية للعينة #21. أنتجت STPT 635 صورة إكليلية عالية الدقة لهذه العينة. (ج) عرض تكبير عالي يبين رأس السهم c في اللوحة A. هذا تراكب بسيط من Ch1 (أحمر) و Ch2 (أخضر) بدون مزيد من المعالجة. تظهر المثلثات إشارات مضان ليبوفوسين ، والتي تظهر طيفا واسع النطاق. تميز خوارزمية تجزئة التتبع بدقة إشارات التتبع عن خلفية lipofuscin على الرغم من الشكل المشابه جدا (اللوحة اليمنى). شريط المقياس: 100 ميكرومتر. (D) مثال آخر على عرض التكبير العالي. لاحظ أن ألياف المحور العصبي الدقيقة في الطبقة 1 يمكن أن تكون مرئية جيدا. شريط المقياس: 100 ميكرومتر. (ه) إعادة بناء ثلاثية الأبعاد لصور STPT الأصلية. تم استخدام الصور الإكليلية منخفضة الدقة البالغ عددها 635 كما هو موضح في اللوحة B كمكدس tiff للتصور ثلاثي الأبعاد باستخدام الفلوريندر22. شريط المقياس: 5 مم. (F) إعادة بناء ثلاثية الأبعاد لإشارات التتبع المجزأة المسجلة في قالب STPT (رمادي). تم عرض إشارات التتبع في مناطق مختلفة من الدماغ بألوان مختلفة. تم قطع هذه المناطق باستخدام التعليق التوضيحي الموضح في اللوحة G. شريط المقياس: 5 مم. (G) قالب STPT متراكب مع تعليق توضيحي لمناطق الدماغ المختلفة. شريط المقياس: 5 مم. (H) تم عرض إشارة التتبع القشرية الموضحة في اللوحة F في شكل خريطة مسطحة. (ط) تحديد موقع الحقن بواسطة مضان Ch3 ، وهو أقل حساسية لمضان التتبع ويظل غير مشبع. شريط المقياس: 1 مم (J) أظهر تلطيخ القسم المحيط بمركز الحقن بالجسم المضاد NeuN أن ما يقرب من 30٪ من الخلايا العصبية تظهر تعبيرا قويا عن التألق الأخضر البرسيم. شريط المقياس: 40 ميكرومتر. القشرة ، القديس ؛ المخطط ، ال ؛ المهاد ، ساوث كارولينا ؛ القولون الفائق. ايمي; اللوزة ، الورك. الحصين ، سي بي ؛ المخيخ. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
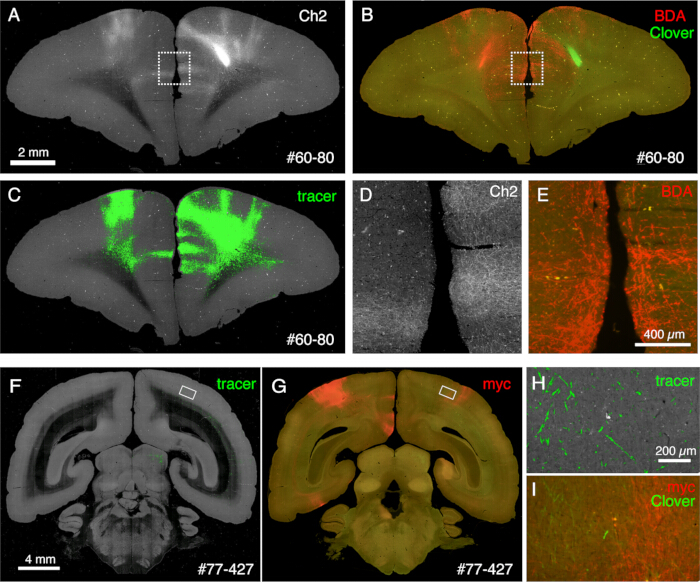
الشكل 6: علم الأنسجة بعد STPT الذي يظهر العديد من المتتبعات غير الفلورية. (أ-ج) مقارنة صورة STPT مع الصورة الملطخة ب BDA. في هذه العينة ، يتم حقن BDA في الجانب المقابل لحقن البرسيم. تظهر اللوحان A و C صورة Ch2 وتجزئة التتبع لبيانات STPT. توضح اللوحة B تلطيخ ما بعد STPT ل BDA. يتضاءل مضان البرسيم بسبب معالجة الميثانول في القسم. شريط المقياس: 2 مم. (D ، E) يتم تكبير الصناديق المنقطة في اللوحات A و B. شريط المقياس: 100 ميكرومتر (F ، G) مقارنة صورة STPT مع تلطيخ الأجسام المضادة لعلامة myc. في هذه العينة ، يتم حقن البرسيم إلى PFC ، بينما يتم حقن AAV-smFP-myc في القشرة الجدارية المقابلة. يتم تكبير المستطيلات البيضاء في اللوحات H و I. شريط المقياس: 4 مم. (H) يظهر تجزئة التتبع باللون الأخضر. شريط المقياس: 200 ميكرومتر. (I) يظهر تلطيخ myc باللون الأحمر. يظهر مضان البرسيم باللون الأخضر. شريط المقياس: 200 ميكرومتر. الإشارات الخضراء في اللوحات H و I موجودة في وضع مماثل ولكنها ليست متطابقة لأن STPT يسترجع فقط ~ 10 ميكرومتر القسم البصري. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
| بروتوكول تلطيخ الفلورسنت BDA | |
| إزالة الاغاروز | |
| غسل TBS | 10 دقائق (2x) |
| 1٪ H2O2 في محلول Dent | 10 دقائق |
| غسل TBS | وجيز |
| 0.5٪ حجب TNB | 1 ساعة |
| StAvHRP (1:4000) في البنك الوطني | 2 بين عشية وضحاها |
| غسل TNT | 10 دقائق (3x) |
| بيوتين TSA (1: 4000) في 0.1 متر بورات (درجة الحموضة 8.5) + 0.003٪ H2O2 | 2 ساعة |
| غسل TNT | 10 دقائق (3x) |
| Cy3-ستربتافيدين (1: 1000) في TNT | 3 ساعات |
| غسل TNT | 10 دقائق (2x) |
| غسل TBS | احتفظ بالقسم حتى التركيب |
| قم بتركيب القسم على زجاج منزلق باستخدام وسيط تثبيت مضاد للبهتان | |
| بروتوكول تلطيخ الفلورسنت المضاد ل MYC | |
| إزالة الاغاروز | |
| غسل TBS | 10 دقائق (2x) |
| الحظر في الوسيط المعرف | 1 ساعة |
| Anti-Myc (1: 4000) في IB | 2 خلال الليل |
| غسل TNT | 10 دقائق (3x) |
| مضاد للفأر Cy3 (1: 1000) في TNT | 3 ساعات |
| غسل TNT | 10 دقائق (2x) |
| غسل TBS | احتفظ بالقسم حتى التركيب |
| قم بتركيب القسم على زجاج منزلق باستخدام وسيط تثبيت مضاد للبهتان | |
| المخازن المؤقتة/الحلول | تكوين |
| 0.5٪ البنك الوطني | كاشف حجب TSA بنسبة 0.5٪ في TS7.5 |
| حل دنت | 20٪ DMSO ، 80٪ ميثانول |
| المخزن المؤقت الغاطس (IB) | 10٪ FBS، 2٪ BSA 0.5٪ TritonX100 في TBS |
| TBS (محلول ملحي مخزن في Tris) | 25 ملي تريس ، 137 ملي كلوريد الصوديوم ، 2.7 ملي كلوريد كلوريد (درجة الحموضة 7.4) |
| تي إن تي | 0.05 ٪ Tween20 في TS7.5 |
| TS7.5 | 0.1 م TRIS-HCl ، درجة الحموضة 7.5 ، 0.15 م كلوريد الصوديوم |
الجدول 1: تلطيخ الفلورسنت BDA وبروتوكول تلطيخ الفلورسنت المضاد ل myc
| البلازميد لتتبع AAV | Addgene No. | الجسم المضاد الموصى به | التخفيف المقترح | النتيجة المتوقعة |
| pAAV-EF1_Cre | 201198 | استنساخ ميليبور 2D8 | 1:1000 | جيد للخلايا |
| pAAVCam1.3_smFP_Myc | 201205 | MBL M192 My3 (الماوس) | 1:4000 | ممتازة |
| pAAVCam1.3_smFP_HA | 201206 | CST C29F4 (أرنب) | 1:1000 | جيد للخلايا |
| pAAVCam1.3_smFP_FLAG | 201207 | MBL PM020B (أرنب) | 1:1000 | موافق |
| AAVTRE3_smFP_Myc | 201208 | |||
| AAVTRE3_smFP_HA | 201209 | |||
| AAVTRE3_smFP_FLAG | 201210 |
الجدول 2: قائمة بلازميدات Addgene المتاحة لإنتاج أجهزة التتبع غير الفلورية. يستهدف بناء cre النواة وهو مناسب للتتبع الرجعي المغلف ب AAV2 الرجعية. smFP_HA البناء جيد للكشف عن جسم الخلية (والارتجاع).
فيديو تكميلي: منظر مجهر لإزالة السحايا. الرجاء النقر هنا لتنزيل هذا الفيديو.
Discussion
أوضحت هذه المقالة الحلول العملية للتعامل مع أدمغة لمعالجة الدماغ بالكامل بالإضافة إلى التقنيات النسيجية المساعدة التي تعزز فائدة تقنية STPT. تكمن قوة "التشريح العصبي للدماغ بالكامل" باستخدام STPT في أنه يمكنك الحصول على إحداثيات ثلاثية الأبعاد لأي منطقة ذات أهمية ، سواء كانت مشروحة تشريحيا أم لا. من خلال التسجيل عالي الدقة من 3D إلى 3D ، من الممكن تحويل هذه الإحداثيات إلى قالب قياسي لتراكب مجموعات البيانات المتعددة. بهذه الطريقة ، يعمل القالب القياسي كوسيط لتكامل البيانات. كان هذا جانبا أساسيا من مشروع رسم خرائط قشرة الفص الجبهي (PFC)رقم 10 ، حيث تم تحليل البيانات التي تم الحصول عليها من العديد من الأفراد. علاوة على ذلك ، يمكن مقارنة المعلومات المعينة بالقالب القياسي مع العديد من البيانات التي تم تعيينها بالفعل ، سواء كانت Nissl أو أنماط المايلين أو بيانات التتبع أو بيانات التصوير بالرنين المغناطيسي (بما في ذلك التصوير بالرنين المغناطيسي للانتشار) أو التعليقات التوضيحيةالتشريحية 11. الأهم من ذلك ، يمكن مقارنتها أيضا بالبيانات المستقبلية التي سيتم الحصول عليها من خلال التكنولوجيا التي لم تظهر بعد. توجد حاليا قوالب متعددة لدماغ ، والتي تستند إلى تلطيخ Nissl23 و MRI23،24،25،26،27،28 و STPT11. ولكن يمكن تحويلها إلى إحداثيات بعضها البعض بناء على تباينات الصور والمعلمات المحسوبة مسبقا11. يساهم تكامل البيانات على نطاق الدماغ بأكمله عبر الدراسات في فهم الدماغ كنظام بشكل أفضل. الشرط الأساسي لنجاح هذه الاستراتيجية هو الحصول على بيانات موثوقة عبر الدماغ. أدناه ، تتم مناقشة الخطوات الحاسمة والمشاكل المحتملة المرتبطة بالبروتوكول الحالي.
واحدة من أكثر عمليات تصوير STPT ضعفا هي تقطيع الأنسجة. كما ذكرنا أعلاه ، غالبا ما تظل السحايا غير مقطوعة ويمكن أن تتداخل مع التقطيع. على وجه الخصوص ، النواة اللبية والقولون العلوي هما أكثر منطقتين في الدماغ تضررا: اعتمادا على دقة إزالة السحايا وتضمينها في الاغاروز ، يمكن تجريدها من كتلة الأنسجة أثناء التقطيع. يصعب الاقتراب من هذه المناطق العميقة من الخارج ويمكن أن تنكسر بسهولة أثناء إزالة السحايا. تعد إزالة السحايا بعناية ولكن شاملة أمرا بالغ الأهمية للتصوير الناجح. مصدر قلق آخر هو قلب الأجزاء المقطعة إلى الخلف على كتلة الأنسجة ، والذي يحدث أحيانا عندما تظل الأقسام متصلة حتى بعد التقطيع. يمكن تقليله عن طريق تشكيل الكتلة بحيث تقطع الشفرة بشكل غير مباشر في النهاية.
من خلال التصوير العميق في كتلة الأنسجة ، يتجنب STPT نتوء سطحه. في حين أن إشارات الفلورسنت يمكن أن تمر عبر المنطقة القشرية بسهولة إلى حد ما ، إلا أنها تتضاءل بشكل كبير في المناطق النخاعي. لذلك ، يجب تحديد عمق التصوير بعناية لتحقيق التوازن بين التصوير المتسق عبر سطح الكتلة بأكمله وسطوع الإشارات في المنطقة الغنية بالمايلين ، مثل المادة البيضاء. في الإعداد المستخدم هنا ، نهدف عادة إلى 25-35 ميكرومتر من السطح. يجب أيضا التحذير من أن السطح المقطوع قد يتقلص بشكل غير متساو بعد ساعات طويلة من التخزين. لتقليل منطقة التصوير ، قمنا بتقسيم جلسة التصوير إلى 20-30 جولة مع إعدادات مرحلة مختلفة لمدة 5-6 أيام. إما أن نجعل الفاصل الزمني بين الجري أقل من 2 ساعة أو نؤكد عمق السطح ونضبط ارتفاع المرحلة قبل كل تشغيل.
في هذا البروتوكول ، تم تضخيم إشارة BDA بطريقة TSA. هذه الطريقة فعالة للغاية ويمكنها اكتشاف إشارات BDA المنقولة مسبقا حتى عند الدقة المنخفضة نسبيا (على سبيل المثال ، الشكل 6 ب). يتوفر بيوتين TSA تجاريا من Akoya Biosciences ، لكن الحل محلي الصنع يظهر تحسينا أفضل بكثير. من ناحية أخرى ، يتطلب تخفيف الجسم المضاد والمحلول تعديلا دقيقا للحصول على النتيجة المثلى. المعالجة المسبقة للقسم بمحلول الميثانول أمر بالغ الأهمية. بدون معالجة مسبقة ، بالكاد يتم اكتشاف إشارات BDA في المحاور النخاعي.
عند استخدام متتبع التجميل ، غالبا ما يكون من الصعب تحديد الموقع الدقيق للحقن بسبب تشبع إشارات التألق. في إعداد نظام تصوير الأنسجة بالكامل المستخدم في هذه الدراسة ، نستخدم القناة الزرقاء لتحديد الخلايا المصابة (الشكل 5I). حتى عندما تكون القنوات الحمراء والخضراء مشبعة ، عادة ما يكون كل خلية عصبية مصابة قابلة للاكتشاف في القناة الزرقاء. هذا صحيح أيضا مع Allen Mouse Brain Connectivity Atlas1. يعد فحص خلايا المنشأ أمرا مهما لأن العدوى تنطوي أحيانا على طبقات معينة فقط. لقد واجهنا مثل هذه العدوى الجزئية بشكل متكرر لأطلس اتصال دماغ الفأر ، ربما بسبب استخدام طريقة الرحلان الأيوني29. يمكن أن يكون الانتشار الجانبي للمتتبعات الفيروسية متغيرا إلى حد ما اعتمادا على الحقن. يمكن أن يؤثر هذا التباين على نتيجة التتبع ويحتاج إلى تطبيع دقيق.
يعد التسجيل الناجح للصورة ثلاثية الأبعاد التي تم الحصول عليها في القالب القياسي عملية رئيسية للتشريح العصبي للدماغ بأكمله. يمكن أن يكون تسجيل صورة STPT في قالب STPT دقيقا جدا ، وقد لاحظنا فقط انحرافات لعدد قليل من الفوكسل (50 ميكرومتر متساوي المكعب) للحدود ذات تباين الصورةالعالي 10. ومع ذلك ، هناك حد لما يمكن أن يفعله التسجيل. بسبب عملية إزالة السحايا ، تحتوي عينات STPT بشكل عام على فجوات بين نصفي الكرة الأرضية وبين القشرة والدماغ الأوسط / الدماغ الخلفي ، في حين أن أنسجة المخ معبأة بإحكام في صور التصوير بالرنين المغناطيسي في الجسم الحي . يصعب تعديل هذه الاختلافات عن طريق التسجيل. تخلو قشرة Marmoset في الغالب من التلم ، لكن التلم داخل الجدارية عميق جدا في بعض الأفراد. سيتم فقد مثل هذا التلم (يحدث الاندماج من أعلى إلى أعلى) عند التسجيل. على الرغم من أن التسجيل هو أسلوب قوي ، إلا أنه من الضروري العودة إلى البيانات الأولية لتأكيد النتيجة التي تم الحصول عليها.
يعد إنشاء بيانات الصور الضخمة قوة وقيودا على هذه التقنية. في حين أنه يعزز اكتمال مجموعة البيانات ، فإنه يتطلب إدارة دقيقة للبيانات المكتسبة وتطوير خط أنابيب آلي لمعالجة الصور من أجل تفسير البيانات بكفاءة. في المستقبل ، قد يؤدي تطبيق الذكاء الاصطناعي التوليدي (الذكاء الاصطناعي) في إنشاء خطوط أنابيب معالجة الصور إلى تبسيط هذه العملية بشكل كبير. كما تم إجراء التصوير المنهجي للدماغ بالكامل باستخدام الطرق القائمة على الماسح الضوئيللشرائح 21،30. بالمقارنة مع هذه الطرق ، لا يتطلب STPT حسابا إضافيا لإعادة البناء ثلاثي الأبعاد. بالاقتران مع التقسيم البصري ، أظهرنا أن STPT لديها القدرة على إعادة بناء حتى الأجزاء المحورية عبر الأقسام31. مع المزيج الإضافي من تقنيات إزالة الأنسجة ، طور Economo et al. طريقة لتصوير مجمل الخلايا العصبية ذات العلامات المتناثرة32،33. توفر أحدث إصدارات TissueCyte الآن خيارات ليزر إضافي لتعزيز إثارة بروتينات الفلورسنت الحمراء أو وحدة التقاط القسم للاسترداد التلقائي للأقسام. مع هذه التطورات ، سيصبح نهج الدماغ بأكمله أكثر كفاءة ، مما يوفر أساسا لفهم شامل لدماغ الرئيسيات ، بما في ذلك دماغ البشر.
Disclosures
المؤلفون ليس لديهم ما يكشفون عنه.
Acknowledgements
نشكر بشدة الموظفين الفنيين في مختبر ياموري ومرافق (RRD) على مساعدتهم. نشكر مركز التعاون RIKEN CBS-Olympus على المساعدة الفنية في الحصول على الصور متحدة البؤر. تم دعم هذا العمل من قبل برنامج البحث العلمي في المجالات المبتكرة (رقم المنحة 22123009) من MEXT ، اليابان ، من قبل Brain / MINDS و Brain / MINDS2.0 من AMED ، اليابان (JP15dm0207001 ، JP23wm0625001 ، و JP24wm0625218) ، و JSPS KAKENHI رقم المنحة 24K09678 إلى A.W.
Materials
| Name | Company | Catalog Number | Comments |
| Agarose type I | Sigma | A6013 | |
| All-in-one fluorescence microscope | Keyence | BZ-X series | This study used BZ-X710 |
| anti-mouse Cy3 | Jackson Immuno Research Laboratories, Inc. | 115-165-003 | |
| anti-myc antibody | MBL | M192 | mouse monoclonal |
| Butorphanol | Meiji Animal Health | Vetorphale | |
| Ceramic blade | TissueVision | N/A | |
| Collagenase type I | Wako Chemical | #031-17601 | Aliquot into 100 µL x 10 of 100 mg/mL in PBS |
| Cotton swab (HUBY-340) | HUBY | BB-013SP | micro cotton swabs |
| Custom-made chamber | N/A | N/A | The chamber consist of four side plates and one bottom plates, all made of 1 cm thick acrylic plates, which can be securely fastened together using screw bolts. An additional acrylic plate is placed inside the chamber, with three metal poles inserted through it to hold the marmoset brain in an inverted position. |
| Cy3-Streptavidin | Jackson Immuno Research Laboratories, Inc. | 016-160-084 | |
| Dumont #5 forceps, Inox | N/A | N/A | |
| Epoxy instant mix | Locktite | N/A | |
| FIJI | NIH | https://imagej.net/software/fiji/downloads | |
| kn_pipeline_check_mosaic.py | N/A | N/A | github.com/watkarbey/STPT_depo; This is a checking script for TissueCyte data. |
| Medetomidine | Zenoaq | Domitor | |
| Midazolam | Sandoz | N/A | |
| NaBH4 | Sigma | #452882 | |
| NaIO4 | Sigma | S1878 | |
| Perfusion needle | Natsume Seisakusho Co., Ltd | KN-348, 20G-50 | |
| Slideglass (76 mm x 52 mm) | Matsunami | S9111 | |
| StAvHRP | Jackson Immuno Research Laboratories, Inc. | 016-030-084 | HRP-streptavidin (titration needs to be carefully determined) |
| TissueCyte1000 | TissueVision | https://www.tissuevision.com/tissuecyte | |
| TSA blocking reagent | Kiko Tech | FP1012 | Refer to TSA-biotin kit (Akoya Biosciences) |
| TSA-biotin | House-made | N/A | See Okamoto et al (ref. 16) |
| VECTASHIELD HardSet Mounting Medium | Vector laboratories Inc | N/A | Antifade mounting medium |
References
- Oh, S. W., Harris, J. A., Ng, L., Winslow, B., Cain, N., et al. A mesoscale connectome of the mouse brain. Nature. 508 (7495), 207-214 (2014).
- Ragan, T., et al. Serial two-photon tomography for automated ex vivo mouse brain imaging. Nat Methods. 9 (3), 255-258 (2012).
- Liang, Z., Arefin, T. M., Lee, C. H., Zhang, J. Using mesoscopic tract-tracing data to guide the estimation of fiber orientation distributions in the mouse brain from diffusion MRI. Neuroimage. 270, 119999(2023).
- Watakabe, A., Hirokawa, J. Cortical networks of the mouse brain elaborate within the gray matter. Brain Struct Funct. 223 (8), 3633-3652 (2018).
- Ypma, R. J. F., Bullmore, E. T. Statistical analysis of tract-tracing experiments demonstrates a dense, complex cortical network in the mouse. PLoS Comput Biol. 12 (9), e1005104(2016).
- Wang, Q., et al. The Allen mouse brain common coordinate framework: A 3D reference atlas. Cell. 181 (4), 936-953.e20 (2020).
- Köbbert, C., Apps, R., Bechmann, I., Lanciego, J. L., Mey, J., Thanos, S. Current concepts in neuroanatomical tracing. Prog Neurobiol. 62 (4), 327-351 (2000).
- Lanciego, J. L., Wouterlood, F. G. Neuroanatomical tract-tracing techniques that did go viral. Brain Struct Funct. 225 (4), 1193-1224 (2020).
- Bakker, R., Wachtler, T., Diesmann, M. CoCoMac 2.0 and the future of tract-tracing databases. Front Neuroinform. 6, (2012).
- Watakabe, A., et al. Local and long-distance organization of prefrontal cortex circuits in the marmoset brain. Neuron. 111 (14), 2258-2273.e10 (2023).
- Skibbe, H., et al. The Brain/MINDS marmoset connectivity resource: An open-access platform for cellular-level tracing and tractography in the primate brain. PLoS Biol. 21 (6), e3002158(2023).
- Mitchell, J. F., Leopold, D. A. The marmoset monkey as a model for visual neuroscience. Neurosci Res. 93, 20-46 (2015).
- Okano, H. Current status of and perspectives on the application of marmosets in neurobiology. Annu Rev Neurosci. 44, 27-48 (2021).
- Watakabe, A., et al. Comparative analyses of adeno-associated viral vector serotypes 1, 2, 5, 8 and 9 in marmoset, mouse and macaque cerebral cortex. Neurosci Res. 93, 144-157 (2015).
- Hata, J., et al. Multi-modal brain magnetic resonance imaging database covering marmosets with a wide age range. Sci Data. 10, 221(2023).
- Liwang, J. K., Bennett, H. C., Pi, H. -J., Kim, Y. Protocol for using serial two-photon tomography to map cell types and cerebrovasculature at single-cell resolution in the whole adult mouse brain. STAR Protoc. 4 (1), 102048(2023).
- Okamoto, S., et al. Exclusive labeling of direct and indirect pathway neurons in the mouse neostriatum by an adeno-associated virus vector with Cre/lox system. STAR Protoc. 2 (1), 100230(2021).
- Viswanathan, S., et al. High-performance probes for light and electron microscopy. Nat Methods. 12 (6), 568-576 (2015).
- Kuan, L., et al. Neuroinformatics of the Allen mouse brain connectivity atlas. Methods. 73, 4-17 (2015).
- Paxinos, G., Watson, C., Petrides, M., Rosa, M., Tokuno, H. The Marmoset Brain in Stereotaxic Coordinates. , Academic Press. London, Waltham, MA. (2012).
- Abe, H., et al. 3D reconstruction of brain section images for creating axonal projection maps in marmosets. J Neurosci Methods. 286, 102-113 (2017).
- Wan, Y., et al. FluoRender: Joint freehand segmentation and visualization for many-channel fluorescence data analysis. BMC Bioinformatics. 18 (1), 280(2017).
- Majka, P., et al. Towards a comprehensive atlas of cortical connections in a primate brain: Mapping tracer injection studies of the common marmoset into a reference digital template. J Comp Neurol. 524 (11), 2161-2181 (2016).
- Liu, C., Yen, C. C. -C., Szczupak, D., Tian, X., Glen, D., Silva, A. C. Marmoset brain mapping V3: Population multi-modal standard volumetric and surface-based templates. Neuroimage. 226, 117620(2021).
- Liu, C., et al. A digital 3D atlas of the marmoset brain based on multi-modal MRI. Neuroimage. 169, 106-116 (2018).
- Liu, C., et al. A resource for the detailed 3D mapping of white matter pathways in the marmoset brain. Nat Neurosci. 23 (2), 271-280 (2020).
- Woodward, A., et al. The Brain/MINDS 3D digital marmoset brain atlas. Sci Data. 5, 180009(2018).
- Saleem, K. S., Avram, A. V., Glen, D., Schram, V., Basser, P. J. The subcortical atlas of the marmoset ("SAM") monkey based on high-resolution MRI and histology. Cereb Cortex. 34 (4), bhae120(2024).
- Watakabe, A., Hirokawa, J. Cortical networks of the mouse brain elaborate within the gray matter. Brain Struct Funct. 223 (8), 3633-3652 (2018).
- Lin, M. K., et al. A high-throughput neurohistological pipeline for brain-wide mesoscale connectivity mapping of the common marmoset. eLife. 8, e40042(2019).
- Skibbe, H., et al. PAT-probabilistic axon tracking for densely labeled neurons in large 3-D micrographs. IEEE Trans Med Imaging. 38 (1), 69-78 (2019).
- Economo, M. N., et al. A platform for brain-wide imaging and reconstruction of individual neurons. eLife. 5, e10566(2016).
- Winnubst, J., et al. Reconstruction of 1,000 projection neurons reveals new cell types and organization of long-range connectivity in the mouse brain. Cell. 179 (1), 268-281.e13 (2019).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved