Method Article
טומוגרפיה טורית של שני פוטונים של כל המוח המרמוסטי לניתוחים נוירואנטומיים
In This Article
Summary
דימות טומוגרפיה טורית של שני פוטונים (STPT) היא טכניקה לדימוי מסה של רקמה בצורתה התלת-ממדית על ידי שילוב של דימות דו-פוטוני עם בקרת במה אוטומטית וחיתוך מיקרוטום. כאן אנו מתארים פרוטוקול ליישומו עבור מוחות מרמוסטים כדי להבין טוב יותר את התכונות המבניות שלהם.
Abstract
טומוגרפיה טורית של שני פוטונים (STPT) היא טכניקה לדימוי מסה של רקמה בצורתה התלת-ממדית על ידי שילוב של הדמיה דו-פוטונית עם בקרת במה אוטומטית וחיתוך מיקרוטום. יישמנו בהצלחה את הטכניקה הזו למעקב אחר הקרנות אקסונליות במוח המרמוסט. כאן מתוארים ההליכים הניסיוניים המפורטים שהביאו להדמיה נפחית אמינה של כל המוח המרמוסט. תהליך מפתח לדימות מוצלח היה הסרת קרומי המוח המקיפים את המוח, מה שמפריע לחיתוך. יתרון גדול של מתודולוגיה זו הוא שניתן להשתמש בחלקים החתוכים להכתמה נוספת. במערך המקורי, החלקים החתוכים מקושקשים באמבט המים. חלקים אלה יכולים להיות מיושרים כראוי בסדר המקורי שלהם על פי דפוסי כלי הדם בקליפת המוח. דוגמה להיסטולוגיה יעילה היא הדמיה של מבנה המיאלין על ידי השתקפות אור פשוטה, אשר ניתן לשלב עם צביעת Nissl כדי להגדיר גבולות אנטומיים. סעיפים אלה יכולים לשמש גם לזיהוי אימונולוגי של עוקבים אנטרוגרדיים שאינם פלואורסצנטיים ומדרדרים, אשר ניתן לרשום לנתוני STPT עבור שכבות של נתונים מרובים.
Introduction
במחקרים נוירו-אנטומיים, חוקרים מתמודדים עם הצורך לצפות במבנים מסדר מיקרומטרי (למשל, אקסונים ובוטון) בהקשר של המוח כולו. משימה קשה זו ניגשת בדרך כלל על ידי בדיקה חזותית של החלקים הסידוריים וחיפוש אזור העניין עבור הדמיה מפורטת, ניתוחים והקלטה של תמונות. עם התקדמות טכנולוגית, עם זאת, זה הופך להיות אפשרי לדמיין את המוח כולו ברזולוציה גבוהה עבור ניתוח המוח כולו. במחקר פורץ דרך שנערך על ידי Oh et al.1, מאות מוחות עכברים קיבלו זריקות נותב לאנליזה קונקטומית, אשר עובדו על ידי טומוגרפיה טורית של שני פוטונים (STPT) בטכניקת הדמיה2. המאפיין של מחקר זה היה שהם בחרו עוקבים אנטרוגרדיים כדי לכמת "קישוריות". בעוד שעוקבים אנטרוגרדיים מספקים מידע מרחבי מפורט מאוד על התפלגות אקסונלית, נוירואנטומיסטים הסתמכו על סגמנטציה ידנית מייגעת לצורך ניתוחו. על ידי אוטומציה של הליכים אנליטיים שונים, כולל שלב פילוח זה, הם הצליחו ב"ייצור המוני" של נתוני נותב מוכנים לשימוש ברזולוציה גבוהה לשימושים רב-תכליתיים. יעילות הגישה שלהם ברורה, בהתחשב במגוון מחקרים שהשתמשו בנתוני המעקב שלהם 3,4,5 ובמוח הסטנדרטי שלהם6.
מבחינה היסטורית, הקישוריות העצבית של מוחות פרימטים לא אנושיים משכה את תשומת לבם של נוירואנטומיסטים רבים מאז פיתוח שיטת הניוון בשנות החמישים, לשיטות הובלת חומרים אנטרוגרדיות/מדרדרות בשנות השבעים ועד לאסטרטגיה הנגיפית הנוכחית 7,8. לפיכך, קיימות יצירות ספרות עצומות החוקרות קשרים עצביים של פרימטים. בפרט, חוקרים רבים חקרו את הקישוריות הקורטיקורטית המורכבת של מוח המקוק, והתוצאות שלהם נאספו עבור טאבולציה (למשל, CoCoMac9). למרות שהם שימושיים, למחקרים קלאסיים אלה היו מספר מגבלות. ראשית, מאחר שכל מחקר מתמקד רק באזורי מוח מוגבלים, המידע המתקבל הופך באופן בלתי נמנע למקוטע. שנית, כל מחקר משתמש בשיטות ובתנאים שונים. לפיכך, ההערכה הכמותית על פני מחקרים הופכת מורכבת. שלישית, הקישוריות מוצגת בדרך כלל כמצלמה לוסידה של חלקים מייצגים או כטבלה/גרף כמותי למחצה עבור אזורי מוח המוגדרים על ידי המחבר. במילים אחרות, רק מידע מוגבל מאוד ממבנה מוח מורכב מופק להצגה בספרות שפורסמה. עם התפתחות טכניקות דימות תהודה מגנטית (MRI), מחקרי מוח שלם ברזולוציה נמוכה הפכו לבולטים. אולם קיים פער גדול בין רמות הפירוט בין מה שאנו יודעים על קשרים עצביים בעכברים לבין אלה שבפרימטים.
עם רקע כזה, יצאנו לבצע מעקב אנטרוגרדי מקיף של מוחות המרמוסטהנפוצים 10,11. אף על פי שהוא קטן וחלק בהרבה ממוחו של המקוק, מקבילו המרמוסטי מציג סימנים ברורים של פרימטים, כגון נוכחות של אזור MT והאזורים הקדם-מצחיים הגרגיריים, שאף אחד מהם אינו מוגדר בבירור במכרסמים12,13. כאן, הגודל הקטן היה יתרון גדול, כי אפילו המוח המרמוסטי שוקל פי עשרה ממוח העכבר. למרבה המזל, יכולנו לדמיין את כל המוח המרמוסטי עם עדכונים מינימליים של הגרסה המקורית של תוכנת ההפעלה TissueCyte1000 (מעתה תיקרא מערכת דימות רקמות שלמה), המיקרוסקופ הזמין מסחרית עבור דימות STPT2. עדכון זה נועד לאפשר תנועה נוספת של הבמה לפני החיתוך. הגרסה הנוכחית מספיקה כעת לעיבוד המוח המרמוסט. מאמר זה חולק פרוטוקול לטיפול במוח המרמוסט עבור דימות STPT. פרוטוקול ההדמיה שלאחר ההדמיה המשפר עוד יותר את התועלת של שיטה זו מסופק גם.
Protocol
כל הליכי הניסוי בוצעו בעקבות מדריך המכון הלאומי לבריאות לטיפול ושימוש בחיות מעבדה (פרסומי NIH מס '80-23) שתוקן בשנת 1996 ו"עקרונות מנחים לטיפול ושימוש בבעלי חיים בתחום המדע הפיזיולוגי" של האגודה הפיזיולוגית היפנית, ואושרו על ידי ועדת בעלי החיים הניסיוניים של RIKEN (W2020-2-009(2)).
1. הזרקת Tracer
- לבצע זריקות של נותבים פלואורסצנטיים ולא פלואורסצנטיים למוח המרמוסט על פי נהלים שדווחו בעבר14.
- לגבי השילוב עם שיטת STPT, ודא כי הפלואורסצנטיות של העוקבים חזקה מספיק כדי להתגלות ללא שיפור. אמץ מערכת TET-Off דו-וקטורית10 לביטוי משופר.
הערה: ניתן גם להזריק ולזהות עוקבים שאינם פלואורסצנטיים לאחר ביצוע STPT באמצעות הפרוסות המיוצרות. דוגמאות לנותבים שאינם פלואורסצנטיים כוללות Biotinylated Dextran Amine (BDA), AAV המבטא cre-expressing ברטרו AAV2 לזיהוי מדרדר של גרעיני תא הקלט10, כמו גם AAV מבוססי smFP מבוססי GFP (ראה להלן).
- לגבי השילוב עם שיטת STPT, ודא כי הפלואורסצנטיות של העוקבים חזקה מספיק כדי להתגלות ללא שיפור. אמץ מערכת TET-Off דו-וקטורית10 לביטוי משופר.
- זילוח לתקן ולקבל את המוח marmoset לאחר 4 שבועות.
- כדי להרדים את המרמוסט, יש לתת מדטומידין (0.04 מ"ג/ק"ג), מידזולאם (0.4 מ"ג/ק"ג) ובוטורפנול (0.4 מ"ג/ק"ג), הנקראים MMB, תוך שרירית, ולאחר מכן הזרקה תוך-צפקית של נתרן תיאופנטל (100 מ"ג/ק"ג).
- לאחר אישור כי רפלקס הכאב אבד, לחתוך לפתוח את חלל החזה כדי לחשוף את הלב לחתוך את אטריום ימין כדי לאפשר את הדם קיבוע לצאת.
- לאחר מכן חתכו את החדר השמאלי כדי להחדיר את מחט הזילוח לשטיפת הדם הראשונה בתמיסת הקידומת (250 מ"מ סוכרוז, 5 מ"מ MgCl2 בחיץ פוספט 0.02 מ"ל [PB, pH 7.4]) למשך מספר דקות (~ 50-100 מ"ל), ולאחר מכן קיבוע עם 4% פרפורמלדהיד/0.1 מ"ל חיץ פוספט (PB; פי 2-3 ממשקל החיה מעל ~20 דקות).
- זילוח טוב הוא קריטי לתוצאה טובה. בעת החדרת מחט הזילוח, מקדמים אותה לאורך המחיצה לכיוון אבי העורקים כדי להבטיח זרימה טובה של הקיבוע. קצה המחט הופך גלוי כאשר הוא מגיע אבי העורקים. יש לסגת לאחור עד שהקצה בקושי נראה לעין כדי שלא יעקוף את עורק התרדמה.
- שמור על המוח ב 4% paraformaldehyde / 0.1 M PB במשך 48 שעות ב 4 ° C ולהעביר ל 50 mM PB. אם לא נעשה שימוש מיידי, יש לאחסן את המוח ב-0.75% גליצין/0.1 M PB כדי למנוע אוטופלואורסצנטיות עקב קיבוע יתר.
2. הכנת הדגימה (איור 1)
- לדגור על המוח הקבוע עם collagenase (1 מ"ג / מ"ל ב 3 mM CaCl2 ב 10 מ"ל של מלח חוצץ tris [TBS]) ב 37 ° C במשך 1 שעות.
הערה: חממו את המוח בטמפרטורה של 37°C למשך 5 דקות לפני הדגירה. - שפשפו בזהירות את משטח המוח עם צמר גפן כדי לקלף את חומר הפייה ושאר קרומי המוח (איור 1A, וידאו משלים). השתמשו במלקחיים עדינים כדי לקלף את קרומי המוח המנותקים.
הערה: חשוב להסיר את קרומי המוח המקיפים את המוח האמצעי, כולל הקוליקולוס העליון או אלה שבראש התלמוס. קשה לחשוף את המבנים האלה החבויים עמוק בפנים. עם זאת, להסיר את קרומי המוח ככל האפשר. אחרת, לעתים קרובות הם נשארים לא חתוכים, צפים למעלה ומפריעים לדימות ולחיתוך (איור 2A). - נקוט משנה זהירות כאשר המוח נתון ל- MRI ex vivo לפני ההטבעה, שבמהלכו המוח שקוע בתמיסת פלואור15. שאריות הפלואור, אם הן מוטמעות זו בזו, עלולות ליצור בועות אוויר זעירות מתחת למטרה בזמן ההדמיה. כדי להימנע מכך, שמור את המוח ב- PB במשך שבוע לפני ההטבעה.
הערה: שלב המתנה זה בדרך כלל אינו הכרחי אך הוא קריטי בשילוב עם MRI ex vivo . - הכינו את חיץ NaBH4 על ידי המסת 0.2 גרם של NaBH4 ב-100 מ"ל של חיץ בוראט של 50 מילימטר (pH 9.2) שחומם ל-40 מעלות צלזיוס. השאירו את המכסה רופף כדי לאפשר לגזCO2 לצאת. יש לשמור את התמיסה למשך הלילה כשהמכסה רופף. עטפו את הבקבוק ברדיד אלומיניום כדי להגן עליו מפני אור עד לשימוש.
- הפוך agarose מחומצן על ידי ערבוב 2.25 גרם של agarose ו 0.21 גרם של NaIO4 ב 100 מ"ל של PB במשך 2-3 שעות. סנן את הפתרון עם שאיבת ואקום ולשטוף אותו עם שלושה שינויים של PB. להשעות מחדש את agarose ב 50 מ"ל של PB.
- ממיסים לחלוטין את האגרוז בתנור מיקרוגל ומצננים ל 60-65 מעלות צלזיוס.
- הכניסו את המוח לחדר מותאם אישית והטמיעו את המוח באגרוז. הקפידו להחדיר את האגרוז לחלל שמתחת לכפיס המוח (איור 1B).
הערה: חממו את המוח תחילה בטמפרטורת החדר ולאחר מכן בטמפרטורה של 65°C למשך 5 דקות כדי לאפשר לאגרוז להתיישב על פני השטח של המוח מבלי להתמצק. - יש לפרק את התא ולטבול את גוש האגרוז במאגר NaBH4 למשך הלילה בטמפרטורה של 4°C.
- שנה את המאגר ל- PB מספר פעמים במשך 1-2 שבועות ב 4 ° C.
הערה: אוטופלואורסצנטיות הרקמה הופכת חלשה מאוד אם חילוף המאגר אינו שלם. - צור שלב זכוכית שקופיות על ידי חיבור ארבעה מגנטים ניאודימיום עם תערובת מיידית אפוקסי.
- הרכיבו את גוש האגרוז על הבמה בעזרת דבק חזק (למשל, דבק-על) (איור 1C).
3. עיבוד רקמות
- הפעל את כל מערכת הדמיית הרקמה בהתאם להוראות היצרן. פרוטוקול מפורט מתפרסם גם16. ההליך הנוכחי משמש בעיקר עבור TissueCyte1000 אך ניתן ליישם אותו על מודלים אחרים, כגון TissueCyte 1600FC.
- הפעולה שונה במקצת בין הדגמים, אך עקוב אחר הנקודות להלן שהן בדרך כלל חשובות.
- ניתן לעבד את כל המוח המרמוסטי באופן קורונלי מהקצה הקדמי לקצה האחורי ללא כל שינוי בחומרה. ודא כי גבולות הזזת השלב אינם חורגים בעת הצבת המוח.
- כוונן את זווית הלהבים כדי להבטיח שעומק פני השטח בשני קצות הלהב יהיה בטווח של 10 מיקרומטר. בגלל מיאלינציה צפופה, אפילו הפרש של 10 מיקרומטר בעומק יכול להוביל לחדירות לייזר שונות דרך חומר לבן מרמוסט בוגר. מאותה סיבה, הגדר את מישור ההדמיה על 25-35 מיקרומטר מפני השטח.
- השתמש בלהב קרמי (מומלץ) כדי לחתוך את המוח כולו במרווחים של 50 מיקרומטר (~ מעל 650 פרוסות).
- קרומי המוח נשארים לא חתוכים ומפריעים לחיתוך אם לא מסירים אותם כראוי (איור 2). חלק מקרומי המוח (למשל, אלה המקיפים את ההיפוקמפוס או הפולווינר) קשים להסרה. יש לחלץ ידנית את קרומי המוח הללו באמצעות מלקחיים עדינים כאשר מבחינים בהם.
4. טכניקות היסטולוגיות עזר
- אחזור מקטעים
- לשחזר את פרוסות הרקמה לבצע צביעה היסטולוגית שונים. יישרו מקטעים אלה במדויק לפי סדר החיתוך. עקבו אחר כלי הדם על פני שכבות קליפת המוח לצורך יישור (איור 3).
- יש לנתק את עודפי האגרוז מכל קטע לטיפול טוב יותר.
הערה: תהליך זה לא צריך להיות מוגזם. האגרוז משמש להחזקת מקטעי רקמה במקומם מבלי להפריע לעיבוד ההיסטולוגי. - הדמיה עם תאורה אחורית
- הרכיבו את המקטעים על זכוכית מגלשה וייבשו.
- יש לייבש מחדש את המקטע עם PBS ולמקם את הכיסוי להדמיה.
- שימו לב לתבנית מיאלינציה ללא כתמים כאשר החלק מצולם על-ידי מיקרוסקופ פלואורסצנטי (איור 4) במצב שדה בהיר. התאימו את זמן החשיפה כך שהשתקפות האור תהיה גלויה.
הערה: ניתן להשתמש בכל מיקרוסקופ אם הוא יכול להשתמש בתאורת שדה כהה. - הסירו את הכיסוי והמשיכו לצביעת ניסל או כל כתם אחר. כל הליך צביעה סטנדרטי מספיק.
- השתמשו בשיטה זו כדי להשוות ישירות דפוסי צביעה שונים עם דפוסי המיאלינציה (איור 4).
- הדמיית BDA
- ראו טבלה 1 לנוהל מפורט.
- ראשית, טפל בחלקים עם תמיסת דנט (20% DMSO, 80% מתנול). מתנול הכלול בתמיסה של דנט משפר באופן דרמטי את אותות ה-BDA באקסונים.
- השתמש בשיטת הגברת אות טירמיד (TSA) כדי לשפר את אות BDA כך שיזוהה פלואורסצנטית17.
הערה: ניתן לרכוש פתרון TSA-ביוטין מהספק, אך מגיב הבית הוא הרבה יותר זול ויעיל. - כדי להירשם לתמונת STPT, צלם תמונה עם תאורה אחורית לאחר הרכבת המקטע לזכוכית שקופיות עם מדיית ההרכבה.
- מכתים חלבון פלואורסצנטי מפלצת ספגטי (smFP)
הערה: החלבונים הפלואורסצנטיים "מפלצת הספגטי" (smFPs) הם משפחה של גרסאות GFP לא פלואורסצנטיות עם תגי אפיטופ מרובים18. הם מספקים אותות פלואורסצנטיים מצוינים עם זיהוי חיסוני ומתאימים כעוקבים נלווים לעוקבים פלואורסצנטיים. ראה טבלה 2 עבור מבני AAV הזמינים מ- Addgene.- בצע את ההליך המפורט המופיע בטבלה 1.
5. עיבוד נתונים לאחר הדמיה
- בדיקת תקינות נתונים
הערה: STPT יוצר מספר עצום של קובצי תמונה. כאשר מוחו של מרמוסט בוגר נחתך באופן קורונלי במרווחים של 50 מיקרומטר, נדרשים בדרך כלל יותר מ-650 מקטעים כדי לכסות את המוח כולו. הנתונים של כל מקטע מורכבים מסדרה של תמונות אריחים שצולמו בשלושה ערוצים. קובצי תמונה אלה מאוחסנים בתיקייה אחת יחד עם קובץ מטא-נתונים המתעד את המיקום של כל אריח. כדי למזער את כמות הנתונים הכוללת ואת זמן העיבוד, הדמיה מתבצעת בלוקים של ריצות, שבמהלכן מספר X ו- Y צעדים עבור אריחים משתנה בהדרגה. בדרך כלל, 20-30 בלוקים של ריצות, שכל אחד מהם כולל הדמיה של 30-50 חלקים, מהווים את מערך הנתונים המלא עבור מוח יחיד. כדי להשתמש בנתונים אלה, נדרשים מספר שלבי עיבוד תמונה, כולל תפירה של התמונות הפרושות, פילוח אותות פלואורסצנטיים ורישום הנתונים הנפחיים לתבנית סטנדרטית, בין היתר.- בצעו את שלבי עיבוד התמונה בנפרד באמצעות כלי תוכנה שונים או באמצעות צינורות ייעודיים המותאמים לצרכים הספציפיים של החוקרים. פירוט עיבוד התמונה חורג מתחום מאמר זה וניתן למצוא אותם בפרסומים אחרים11,19.
- ללא קשר להליך שבו נעשה שימוש, ודא שהנתונים מאורגנים באופן עקבי.
הערה: מכיוון שכל תהליך ההדמיה כולל בלוקים רבים של ריצות ונמשך מספר ימים, אין זה נדיר שריצה מתבטלת באמצע הדרך ומתחילה מחדש. במקרים כאלה, מבנה הנתונים יכול להיות משובש, מעכב את הביצוע הנכון של צינור עיבוד התמונה. - כדי למזער את הסיכון להפרעה במבנה הנתונים, הפעל סקריפט Python כדי לבדוק את תקינות מבנה הנתונים (kn_pipeline_check_mosaic.py) הזמין ב- GitHub (github.com/watkarbey/STPT_depo).
- התאמת התמונה המוכתמת לתמונת STPT
הערה: ניתן לבצע טרנספורמציה לא ליניארית של התמונה המוכתמת לתמונת STPT באמצעות תוסף bUnwarpJ של ImageJ.- התאימו את גודל תמונות היעד (STPT) ותמונות המקור (המוכתמות) כך שיהיו שוות בקירוב.
- בצע בינאריזציה של כל תמונה כדי להציג באופן חזותי את צורות המקטעים.
- הפעל bUnwarpJ. זכור לבדוק את האפשרות שמור המרות .
- הפעל את bUnwarpJ שוב. בחרו בתמונה המקורית לפני הבינאריות כתמונת המקור. לאחר מכן לחץ על טען טרנספורמציה אלסטית ובחר את הטרנספורמציה שנשמרה.
תוצאות
במערך הטיפוסי שבו משתמשים כאן, ניתן לצלם את כל המוח של מרמוסט בוגר (איור 5) ברזולוציה של ~1.3 x 1.3 מיקרומטר/פיקסל עם מרווח של 50 מיקרומטר תוך כשבוע. זה מסתכם ב~ 650 תמונות קורונליות בשלושה ערוצים לאחר תפירת תמונה. עם עדשת 16x אובייקטיבית (Nikon 16xW CFI75 LWD; NA = 0.80), שדה הראייה של ירייה בודדת הוא בערך 1 x 1 מ"מ. התמונה של כל משטח העטרה מתקבלת על-ידי תפירת היריות האלה (איור 5A). היישור בכיוון Z מצוין, ותמונה תלת-ממדית טובה מתקבלת פשוט על-ידי הערמת נתוני תמונת העטרה (איור 5B,E). לצורך סטנדרטיזציה, תבנית STPT עבור מוח מרמוסט11 יכולה לשמש לרישום תלת-ממדי (איור 5F). טרנספורמציית נתונים זו היא אחד ההיבטים המרכזיים של הנוירואנטומיה של המוח כולו, שבו אזור עניין מוקצה לקואורדינטת מרחב מוחלטת שאינה תלויה בביאור אנטומי. ברגע שמוח הדגימה נרשם במרחב הסטנדרטי, אפשר להוציא בקלות את תת-האזורים המעניינים לניתוח נוסף (איור 5F,G). בפרט, אזורי קליפת המוח יכולים להפוך למפה שטוחה באמצעות פרמטר קבוע מראש (איור 5H).
הקטעים שנוצרו במהלך ההדמיה יכולים לשמש למטרות היסטולוגיות שונות. כפי שניתן לראות באיור 4A,B, ההדמיה עם תאורה אחורית ללא כתמים מספקת דפוס דומה מאוד לצביעת המיאלין האותנטית. זו יכולה להיות חלופה מצוינת לצביעת מיאלין. יתר על כן, אם התמונה עם התאורה האחורית מתקבלת לפני צביעת Nissl, ניתן להשתמש באותו קטע כדי לקבל את הדפוסים של צביעת המיאלין והניסל, ובכך לספק מידע שימושי לזיהוי אזורים ושכבות (איור 5C-E). חלקים אלה יכולים לשמש גם עבור צביעה אימונולוגית. באיור 5J, החלק סביב מרכז ההזרקה היה מוכתם בנוגדן NeuN כדי להעריך את יעילות ההולכה של נגיף AAV. זוהי גם אסטרטגיה טובה להזריק עוקבים שאינם פלואורסצנטיים בנוסף לעוקבים פלואורסצנטיים ולזהות אותם היסטולוגית לאחר שליפת חתך. במחקר הקודם שלנו, שילבנו נותבים ירוקים אנטרוגרדיים עם וקטור "cre" מדרדר, אשר זוהה מאוחר יותר על ידי נוגדן anti-cre10. בדוגמה של איור 6A-E, BDA הוזרק לצד הנגדי של הנותב הירוק (תלתן) וזיהה אותו באופן פלואורסצנטי. שים לב כי אותות BDA אדומים ניתן לרשום את התמונה TissueCyte כדי להיות מקומי בכל קואורדינטת המוח. בדוגמה אחרת של איור 6F-I, smFP-myc הוזרק לאזור הקודקוד (איור 6G), בעוד שהנותב הירוק הוזרק לאזור המצחי. בדרך זו, ניתן להזריק עוקבים מרובים לאותו בעל חיים מבלי להפריע להדמיה. יתרון גדול של שימוש במקטעי STPT לצביעה נוספת הוא שניתן לקבוע את הקשר בין העוקבים הפלואורסצנטיים והלא פלואורסצנטיים עבור אותו מוח. כך, הצלחנו לקבוע את ההדדיות של הקרנות קורטיקוקורטליות בדיוקגבוה 10. יתרון נוסף הוא שניתן למפות את הקואורדינטות התלת-ממדיות של הקטעים המוכתמים בחזרה לנתוני STPT ולאחר מכן לתבנית הסטנדרטית. לכן, ייתכן שלא יהיה צורך להשתמש בכל החלקים שאוחזרו עבור צביעה. לפרשנות טובה יותר, ניתן לבחור קטעים לצביעה כדי להוסיף הקשר נוסף לנתוני STPT.
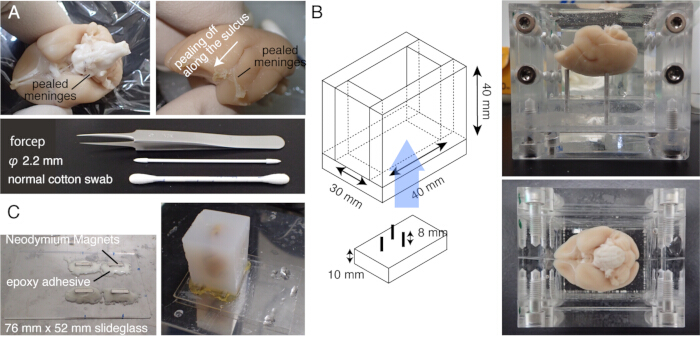
איור 1: הכנת דגימה להסרת קרום המוח STPT. (A) באמצעות צמר גפן. את קרומי המוח המקיפים את גזע המוח ניתן להסיר על ידי מלקחיים עדינים. קרומי המוח המקיפים את מוח המרמוסט מוסרים באופן ידני על ידי שפשוף עם צמר גפן. בתמונה נראים קרומי המוח המקושטים מתוך החריץ הצידי. (B) קופסת האקריל המשמשת להטמעת אגרוז. הפינים ניתנים להזזה ומשמשים להתאמת זווית המוח כך שתהיה קרובה למצב הקבוע באופן סטריאוטקסי20. (C) שקופית מגנטית עשויה זכוכית שקופיות בגודל 76 מ"מ x 52 מ"מ וארבעה מגנטים מסוג ניאודימיום המחוברים באמצעות דבק אפוקסי. בלוק האגרוז מחובר לשלב המגנטי עם דבק על. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
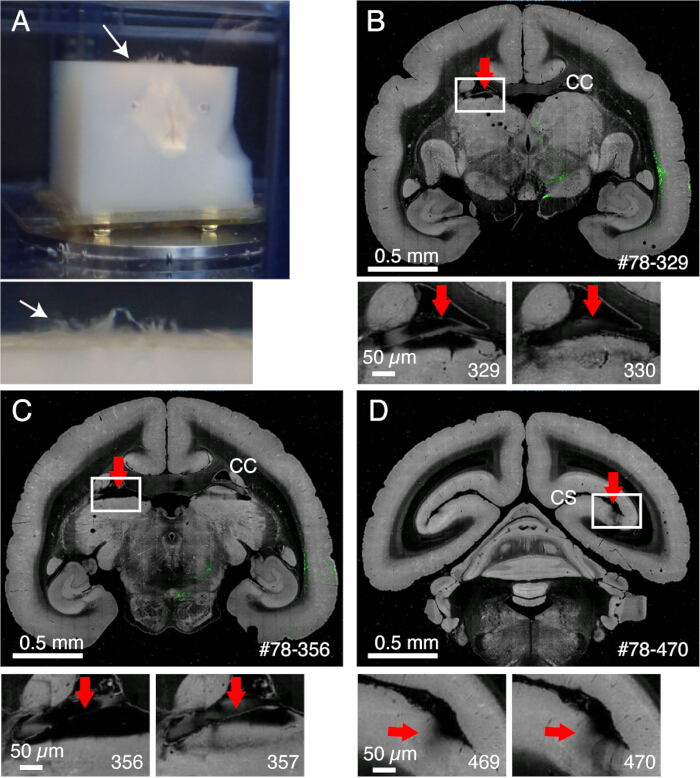
איור 2: ההשפעה של קרומי המוח על ההדמיה. (A) קרומי המוח שנותרו לא חתוכים צפים למעלה, כפי שמוצג על-ידי החץ הלבן. בדוגמה זו נראית בליטה נרחבת של קרומי המוח מכיוון שהם לא הוסרו לפני הטבעה של אגרוז. בדרך כלל, קרומי המוח נשארים לא חתוכים רק עבור כמה אזורים קשים. (B) דוגמה לחיתוך גרוע עקב נוכחות של קרומי המוח בין כפיס המוח לבין החלק העליון של התלמוס. במקרה זה, חיתוך גרוע הוביל לסירוגין של פרוסה עמוקה (329) ופרוסה רגילה יחסית (330). #78-329 מייצג מדגם מס '78 סעיף מס '329 בפורטל הנתונים מוח/מוחות (C) דוגמה נוספת לדימות גרוע. במקרה גרוע יותר, הגרעין הפולווינרי המוצג על ידי החץ האדום עשוי לרדת לחלוטין. פסי קנה מידה: 0.5 מ"מ (פנל עליון), 0.5 מיקרומטר (פנל תחתון). (D) דוגמה נוספת להדמיה גרועה. קשה להסיר את קרומי המוח עמוק בתוך סולקוס הקלקרין. הצללים הנראים בסעיפים 469 ו-470 נגרמים על ידי קרומי המוח הצפים שבאו תחת המטרה. פסי קנה מידה: 0.5 מ"מ (פנל עליון), 0.5 מיקרומטר (פנל תחתון). אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
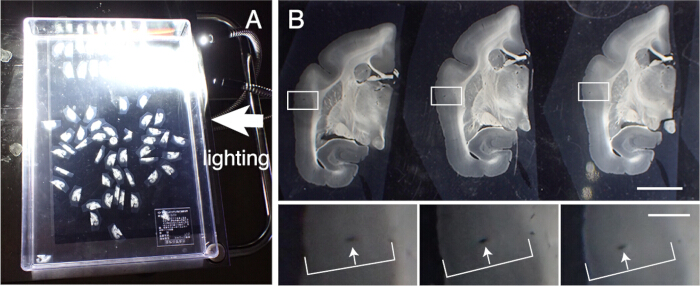
איור 3: יישור מקטעי רקמה לפי הסדר. (A) ניתן ליישר נכון עד 50 חלקי קורונל מרמוסט לפי הסדר במיכל פלסטיק (31 ס"מ x 22.5 ס"מ). כדי לדמיין את המבנים המפורטים, המיכל ממוקם על נייר שחור ומואר מהצד. מקטעים אלה מיושרים תחילה באופן גס בסדר ולאחר מכן כפופים ליישור מדויק. (B) היישור המדויק משתמש בכלי הדם כסמן. קליפת המוח מכילה כלי דם רבים הפועלים אנכית על פני שכבות קליפת המוח. הם מזוהים כחורים מוארכים המשנים באופן שיטתי את מיקומם בתוך שכבות קליפת המוח (חיצים לבנים). באמצעות שיטה זו, ניתן ליישר במדויק אפילו מקטעים עם מרווחים של 50 מיקרומטר. ניתן לזהות חורים בכלי דם אלה בתמונות סעיף SPTP לאישור. סרגל קנה מידה: 5 מ"מ (פנל עליון), 1 מ"מ (פנל תחתון). אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
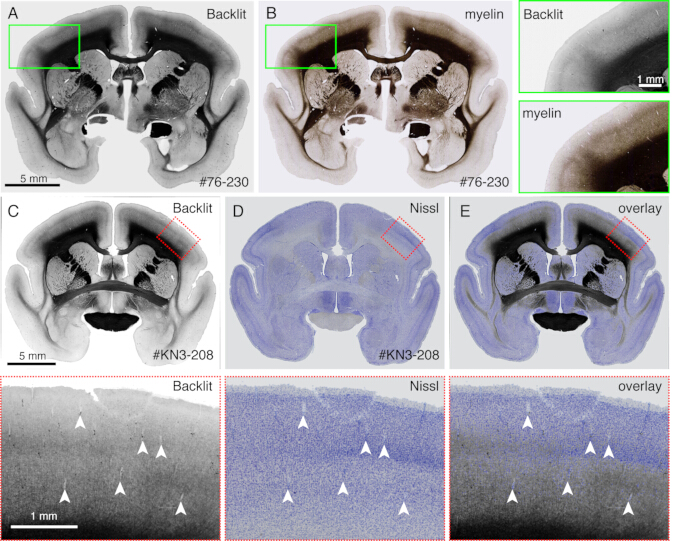
איור 4: תמונה עם תאורה אחורית כתחליף לצביעת המיאלין. (A,B) החלק הזהה שימש להדמיית תאורה אחורית ולצביעת מיאלין. ראשית, החלק הורכב על זכוכית המגלשה, יובש, התייבש עם PBS, כוסה וצולם באמצעות מיקרוסקופ אור (Table of Materials). לאחר הסרת הכיסוי, אותו חלק שימש לצביעת מיאלין21 וצולם באמצעות מיקרוסקופ פלואורסצנטי. התמונה עם התאורה האחורית נרשמה לתמונת המיאלין באמצעות תוסף bUnwarpJ של ImageJ. התיבות הירוקות מציגות את התצוגות המוגדלות של כל תמונה. שימו לב שתמונות אלה מראות דפוסים כמעט זהים, אלא שהכתמת המיאלין מדמיינת מבנים סיביים טוב יותר. (ג-ה) החלק הזהה שימש להדמיה עם תאורה אחורית וצביעת ניסל. מסיכת הסף הנמוך עבור התמונה עם התאורה האחורית נרשמה לראשונה עם מסיכת הסף הנמוך עבור תמונת Nissl באמצעות תוסף bUnwarpJ, והתמונה המקורית השתנתה באמצעות אותו פרמטר. שימו לב שכלי הדם (ראשי חץ לבנים) מתאימים היטב בין שתי התמונות. מכיוון ששתי התמונות הללו מיועדות לאותו חתך, ההתאמה כמעט מושלמת, וניתן להשוות ישירות בין תבניות המיאלין והניסל לזיהוי שכבות קליפת המוח. פסי קנה מידה: 5 מ"מ (לוחות A-E). אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
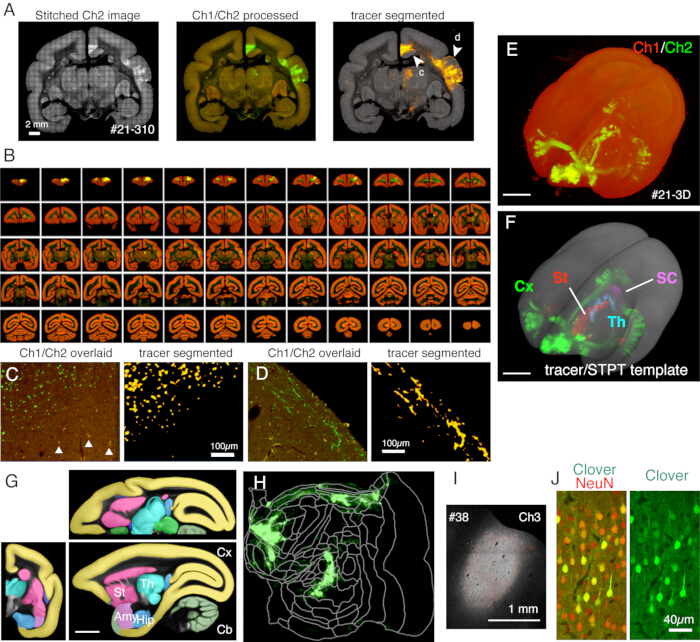
איור 5: תוצאה אופיינית של הדמיית STPT. (A) ריצוף פשוט של תמונות Ch2 (ירוק) של קטע לדוגמה (סעיף 310 של מדגם #21). ללא תיקון רקע, הגבולות עבור כל אריח גלויים. בטור האמצעי, האריחים נתפרו עם תיקון רקע עבור Ch1 (אדום) ו- Ch2 (ירוק), בהתאמה. כדי להפחית את האותות של ליפופוסצין (ראו לוח C), אותות Ch1 הופחתו מ-Ch2 והוצגו בירוק. כדי להפחית את אותות הליפופוסצין של Ch1, נעשה שימוש בפקודה "Remove Outilers.." לפני התפירה על-ידי ImageJ. בעמודה הימנית, אותות הנותב חולקו לפי צינור עיבוד תמונה11. ראשי החצים (c, d) מראים את המיקומים שבהם מוצגות התצוגות המוגדלות בחלוניות C ו- D. סרגל קנה מידה: 2 מ"מ. (B) סקירה כללית של מקטעים טוריים עבור מדגם #21. STPT יצרה 635 תמונות קורונליות ברזולוציה גבוהה עבור מדגם זה. (C) תצוגת הגדלה גבוהה המוצגת על-ידי ראש החץ c בלוח A. זוהי שכבת על פשוטה של Ch1 (אדום) ו- Ch2 (ירוק) ללא עיבוד נוסף. המשולשים מראים אותות פלואורסצנטיים של ליפופוסצין, המראים ספקטרום נרחב. אלגוריתם פילוח העוקבים מבדיל במדויק בין אותות הנותב לבין רקע ליפופוסצין למרות צורה דומה מאוד (פאנל ימני). סרגל קנה מידה: 100 מיקרומטר. (D) דוגמה נוספת לתצוגת הגדלה גבוהה. שימו לב שסיבי אקסון עדינים בשכבה 1 יכולים להיות גלויים היטב. סרגל קנה מידה: 100 מיקרומטר. (E) שחזור תלת-ממדי של תמונות STPT מקוריות. 635 תמונות העטרה ברזולוציה נמוכה, כפי שמוצג בלוח B, שימשו כערימת tiff להדמיה תלת-ממדית באמצעות fluorender22. סרגל קנה מידה: 5 מ"מ. (F) שחזור תלת-ממדי של אותות הנותב המקוטעים הרשומים בתבנית STPT (אפור). אותות הנותב באזורים שונים במוח הוצגו על-ידי צבעים שונים. אזורים אלה נחתכו באמצעות הביאור המוצג בלוח G. סרגל קנה מידה: 5 מ"מ. (G) תבנית STPT עם ביאור של אזורי מוח שונים. סרגל קנה מידה: 5 מ"מ. (H) אות המעקב קליפת המוח המוצג בלוח F הוצג בצורה של מפה שטוחה. (I) זיהוי אתר ההזרקה על ידי פלואורסצנטיות Ch3, שהיא פחות רגישה לפלואורסצנטיות הנותבת ונשארת בלתי רוויה. סרגל קנה מידה: 1 מ"מ. (J) צביעת החלק סביב מרכז ההזרקה בנוגדן NeuN הראתה שכ-30% מהנוירונים מראים ביטוי חזק של פלואורסצנטיות ירוקה תלתן. סרגל קנה מידה: 40 מיקרומטר. קיצורים: Cx; קורטקס, רחוב; סטריאטום, ה; תלמוס, SC; קוליקולוס מעולה. איימי; אמיגדלה, ירך; היפוקמפוס, Cb; המוח הקטן. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
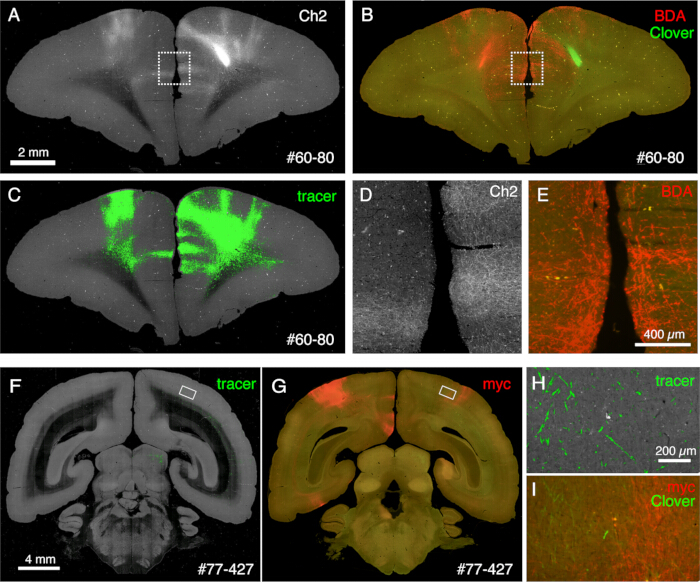
איור 6: היסטולוגיה פוסט-STPT המראה עוקבים מרובים שאינם פלואורסצנטיים. (א-ג) השוואה בין תמונת STPT לתמונה מוכתמת BDA. בדגימה זו מוזרק BDA לצד הנגדי של הזרקת תלתן. לוחות A ו- C מציגים את תמונת Ch2 ואת פילוח המעקב של נתוני STPT. לוח B מציג את הצביעה שלאחר STPT עבור BDA. פלואורסצנטיות תלתן פוחתת עקב הטיפול במתנול של הקטע. סרגל קנה מידה: 2 מ"מ. (D,E) התיבות המנוקדות בלוחות A ו- B מוגדלות. סרגל קנה מידה: 100 מיקרומטר. (F,G) השוואה של תמונת STPT עם צביעת נוגדנים נגד תג myc. בדגימה זו, הזרקת תלתן היא ל- PFC, ואילו AAV-smFP-myc מוזרק לקליפת המוח הקודקודית הנגדית. המלבנים הלבנים מוגדלים בלוחות H ו-I. סרגל קנה מידה: 4 מ"מ. (H) סגמנטציה של Tracer מוצגת בירוק. סרגל קנה מידה: 200 מיקרומטר. (I) צביעת myc מוצגת באדום. פלואורסצנטיות התלתן מוצגת בירוק. סרגל קנה מידה: 200 מיקרומטר. האותות הירוקים בלוחות H ו- I נמצאים במיקום דומה אך לא זהים מכיוון ש- STPT מאחזר רק ~ 10 מיקרומטר קטע אופטי. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
| פרוטוקול צביעה פלואורסצנטית BDA | |
| להסיר agarose | |
| שטיפת כפות | 10 דקות (2x) |
| 1% H2O2 בתמיסה של דנט | 10 דק' |
| שטיפת כפות | תמציתי |
| 0.5% חסימת TNB | 1 שעות |
| StAvHRP (1:4000) ב- TNB | 2 לילות |
| שטיפת TNT | 10 דקות (3x) |
| ביוטין TSA (1:4000) אינץ' 0.1 מ' בוראט (pH8.5) + 0.003% גובה2O2 | 2 שעות |
| שטיפת TNT | 10 דקות (3x) |
| Cy3-streptavidin (1:1000) ב-TNT | 3 שעות |
| שטיפת TNT | 10 דקות (2x) |
| שטיפת כפות | שמור את המקטע עד להרכבה |
| הרכבה של מקטע על זכוכית שקופיות באמצעות אמצעי הרכבה נגד דעיכה | |
| פרוטוקול צביעה פלואורסצנטית נגד MYC | |
| להסיר agarose | |
| שטיפת כפות | 10 דקות (2x) |
| חסימה ב- IB | 1 שעות |
| Anti-Myc (1:4000) ב- IB | 2 בלילה |
| שטיפת TNT | 10 דקות (3x) |
| Anti-mouse Cy3 (1:1000) ב-TNT | 3 שעות |
| שטיפת TNT | 10 דקות (2x) |
| שטיפת כפות | שמור את המקטע עד להרכבה |
| הרכבה של מקטע על זכוכית שקופיות באמצעות אמצעי הרכבה נגד דעיכה | |
| חוצצים/פתרונות | הרכב |
| 0.5% TNB | מגיב חסימת TSA 0.5% ב-TS7.5 |
| הפתרון של דנט | 20% DMSO, 80% מתנול |
| מאגר טבילה (IB) | 10% FBS, 2% BSA 0.5% TritonX100 ב-TBS |
| TBS (מלח חוצץ טריס) | 25 mM Tris, 137 mM NaCl, 2.7 mM KCl (pH 7.4) |
| TNT | 0.05% Tween20 אינץ' TS7.5 |
| TS7.5 | 0.1 מטר TRIS-HCl, pH 7.5, 0.15 מטר NaCl |
טבלה 1: צביעה פלואורסצנטית BDA ופרוטוקול צביעה פלואורסצנטית אנטי-מיק
| פלסמיד עבור נותב AAV | מס' אדג'ין. | נוגדן מומלץ | דילול מוצע | תוצאה צפויה |
| pAAV-EF1_Cre | 201198 | שיבוט Millipore 2D8 | 1:1000 | טוב לתאים |
| pAAVCam1.3_smFP_Myc | 201205 | MBL M192 My3 (עכבר) | 1:4000 | מצוין |
| pAAVCam1.3_smFP_HA | 201206 | CST C29F4 (ארנב) | 1:1000 | טוב לתאים |
| pAAVCam1.3_smFP_FLAG | 201207 | MBL PM020B (ארנב) | 1:1000 | אוקיי |
| AAVTRE3_smFP_Myc | 201208 | |||
| AAVTRE3_smFP_HA | 201209 | |||
| AAVTRE3_smFP_FLAG | 201210 |
טבלה 2: רשימת פלסמידים של Addgene הזמינים לייצור עוקבים שאינם פלואורסצנטיים. מבנה ה-cre מכוון לגרעין ומתאים לעקיבה לאחור עטופה ברטרו AAV2. מבנה smFP_HA טוב לזיהוי (ונסיגה של גוף התא).
סרטון משלים: מבט במיקרוסקופ על הסרת קרומי המוח. אנא לחץ כאן כדי להוריד סרטון זה.
Discussion
מאמר זה הסביר את הפתרונות המעשיים לטיפול במוחות מרמוסטים לעיבוד המוח כולו, כמו גם טכניקות היסטולוגיות עזר המשפרות את התועלת של טכניקת STPT. הכוח של "נוירואנטומיה של המוח כולו" באמצעות STPT הוא שאתה יכול להשיג את הקואורדינטות התלת-ממדיות של כל אזור עניין, בין אם הוא מבואר אנטומית או לא. על ידי רישום תלת-ממד לתלת-ממד בדיוק גבוה, ניתן להפוך קואורדינטות אלה לתבנית סטנדרטית עבור שכבת-על של ערכות נתונים מרובות. בדרך זו, התבנית הסטנדרטית משמשת כמדיום של שילוב נתונים. זה היה היבט חיוני של פרויקט מיפוי קליפת המוח הקדם-מצחית שלנו (PFC)10, שבו נותחו נתונים שהתקבלו מאנשים רבים. כמו כן, ניתן להשוות את המידע הממופה לתבנית הסטנדרטית עם נתונים שונים שכבר מופו, בין אם מדובר בניסל, דפוסי מיאלין, נתוני נותב, נתוני MRI (כולל MRI דיפוזיה) או ביאורים אנטומיים11. חשוב לציין, ניתן להשוות אותו גם לנתונים עתידיים שנצברו על ידי טכנולוגיה שטרם הופיעה. קיימות כיום תבניות מרובות למוח המרמוסט, המבוססות על צביעת ניסל23, MRI 23,24,25,26,27,28 ו-STPT11. אבל הם יכולים להפוך זה לקואורדינטות של זה בהתבסס על ניגודי תמונה ופרמטרים מחושבים מראש11. שילוב נתונים בכל סולם המוח בין מחקרים תורם להבנה טובה יותר של המוח כמערכת. התנאי המוקדם להצלחת אסטרטגיה זו הוא איסוף נתונים אמין ברחבי המוח. להלן נדונים שלבים קריטיים ובעיות פוטנציאליות הקשורות לפרוטוקול הנוכחי.
אחד התהליכים הפגיעים ביותר של דימות STPT הוא חיתוך רקמות. כאמור, לעתים קרובות קרומי המוח נשארים לא חתוכים ויכולים להפריע לחיתוך. בפרט, גרעין pulvinar ואת colliculus העליון הם שני אזורי המוח מושפעים ביותר: בהתאם ליסודיות של הסרת קרום המוח והטבעה באגרוז, הם יכולים להיות מופשטים מן בלוק הרקמה במהלך חיתוך. אזורים עמוקים אלה קשים לגישה מבחוץ ויכולים להישבר בקלות במהלך הסרת קרום המוח. הסרת קרום המוח זהירה אך יסודית היא קריטית להדמיה מוצלחת. חשש נוסף הוא היפוך גב של חלקים חתוכים על גוש הרקמה, מה שקורה לפעמים כאשר החלקים נשארים מחוברים גם לאחר החיתוך. ניתן למזער אותו על ידי עיצוב הבלוק כך שהלהב חותך בצורה אלכסונית ממש בקצהו.
על ידי הדמיה עמוק לתוך בלוק הרקמה, STPT מונע את הגבשושיות של פני השטח שלה. בעוד שהאותות הפלואורסצנטיים יכולים לעבור דרך אזור קליפת המוח די בקלות, הם פוחתים מאוד באזורים המיאליניים. לכן, עומק ההדמיה צריך להיקבע בקפידה כדי לאזן בין ההדמיה העקבית על פני כל משטח הבלוק לבין בהירות האותות באזור העשיר במיאלין, כגון החומר הלבן. במערך המשמש כאן, אנו בדרך כלל מכוונים למרחק של 25-35 מיקרומטר מפני השטח. כמו כן, יש להזהיר כי המשטח החתוך עלול להתכווץ באופן לא אחיד לאחר שעות ארוכות של אחסון. כדי למזער את אזור ההדמיה, פיצלנו את סשן ההדמיה ל-20-30 ריצות עם הגדרות במה שונות למשך 5-6 ימים. אנו מבצעים את המרווח בין הריצות פחות משעתיים או מאשרים את עומק פני השטח ומתאימים את גובה הבמה לפני כל ריצה.
בפרוטוקול זה, אות BDA הוגבר על ידי שיטת TSA. שיטה זו יעילה מאוד ויכולה לזהות אותות BDA המועברים באופן אנטרוגרדי אפילו ברזולוציה נמוכה יחסית (לדוגמה, איור 6B). ביוטין TSA זמין באופן מסחרי מבית Akoya Biosciences, אך הפתרון הביתי מראה שיפור טוב בהרבה. מצד שני, דילול הנוגדן והפתרון דורש התאמה זהירה כדי להשיג את התוצאה האופטימלית. טיפול מקדים של החלק בתמיסת מתנול הוא קריטי. ללא טיפול מקדים, אותות BDA בקושי מזוהים באקסונים myelinated.
כאשר משתמשים בעוקב אנטרוגרד, לעתים קרובות קשה לזהות את האתר המדויק של ההזרקה בגלל הרוויה של אותות הפלואורסצנטיים. בכל מערך מערכת דימות הרקמה ששימש במחקר הזה, אנו משתמשים בתעלה הכחולה כדי לזהות את התאים הנגועים (איור 5I). אפילו כאשר הערוצים האדומים והירוקים רוויים, כל נוירון נגוע בודד בדרך כלל ניתן לזיהוי בערוץ הכחול. זה נכון גם עם אלן עכבר קישוריות המוח אטלס1. בדיקת תאי המקור חשובה מכיוון שהזיהום מערב לעיתים רק שכבות מסוימות. נתקלנו בזיהומים חלקיים כאלה לעתים קרובות למדי באטלס קישוריות המוח של עכבר, אולי בגלל השימוש בשיטת היונטופורזיס29. ההתפשטות הרוחבית של העוקבים הנגיפיים יכולה להיות פחות או יותר משתנה בהתאם לזריקות. שונות זו עלולה להשפיע על תוצאת המעקב ודורשת נורמליזציה זהירה.
הרישום המוצלח של התמונה התלת-ממדית המתקבלת לתבנית הסטנדרטית הוא תהליך מפתח של כל המוח נוירואנטומיה. רישום תמונת STPT לתבנית STPT יכול להיות מדויק למדי, וראינו רק סטיות של כמה ווקסלים (50 מיקרומטר איזוקובי) עבור הגבולות עם ניגודיות תמונה גבוהה10. ובכל זאת, יש גבול למה שרישום יכול לעשות. בגלל תהליך הסרת קרומי המוח, לדגימות STPT יש בדרך כלל רווחים בין ההמיספרות ובין קליפת המוח למוח האמצעי/אחורי, בעוד שרקמות המוח דחוסות היטב בתמונות MRI in vivo . הבדלים כאלה קשה להתאים על ידי רישום. קליפת המוח המרמוסטית לרוב נטולת סולצי, אך החריץ התוך-קודקודי עמוק מאוד אצל אנשים מסוימים. סולצי כזה יאבד (מתרחש היתוך מלמעלה למעלה) עם ההרשמה. למרות הרישום הוא טכניקה רבת עוצמה, יש צורך לחזור לנתונים גולמיים לאישור התוצאה שהתקבלה.
יצירת נתוני תמונה מסיביים היא גם חוזק וגם מגבלה של טכניקה זו. בעוד שהיא משפרת את שלמות מערך הנתונים, היא מחייבת ניהול זהיר של הנתונים הנרכשים ופיתוח צינור עיבוד תמונה אוטומטי לפרשנות נתונים יעילה. בעתיד, היישום של בינה מלאכותית גנרטיבית (AI) בבניית צינורות עיבוד תמונה עשוי לפשט באופן משמעותי תהליך זה. הדמיה שיטתית של המוח כולו בוצעה גם בשיטות מבוססות סורק שקופיות21,30. בהשוואה לשיטות כאלה, STPT אינו דורש חישוב נוסף לשחזור תלת ממדי. בשילוב עם חתכים אופטיים, הוכחנו של-STPT יש פוטנציאל לשחזר אפילו מקטעי אקסונים על פני מקטעים31. עם שילוב נוסף של טכניקות פינוי רקמות, Economo et al. פיתחו שיטה לדמות את כל תאי העצב המסומנים בדלילות32,33. הגרסאות האחרונות של TissueCyte מציעות כעת אפשרויות לייזר נוסף כדי לשפר את העירור של חלבונים פלואורסצנטיים אדומים או יחידת לכידת קטע להתאוששות אוטומטית של סעיפים. עם התקדמות זו, גישת המוח כולו תהפוך ליעילה יותר, ותספק בסיס להבנה מקיפה של מוח הפרימטים, כולל זה של בני האדם.
Disclosures
למחברים אין מה לחשוף.
Acknowledgements
אנו מודים מקרב לב לצוות הטכני במעבדת ימאמורי ובמתקני בעלי החיים (RRD) על עזרתם. אנו מודים למרכז שיתוף הפעולה RIKEN CBS-Olympus על הסיוע הטכני ברכישת תמונות קונפוקליות. עבודה זו נתמכה על ידי התוכנית למחקר מדעי בתחומים חדשניים (מענק מספר 22123009) מ- MEXT, יפן, על ידי Brain/MINDS ו- Brain/MINDS2.0 מאמד, יפן (JP15dm0207001, JP23wm0625001 ו- JP24wm0625218), ועל ידי JSPS KAKENHI מענק מספר 24K09678 ל- A.W.
Materials
| Name | Company | Catalog Number | Comments |
| Agarose type I | Sigma | A6013 | |
| All-in-one fluorescence microscope | Keyence | BZ-X series | This study used BZ-X710 |
| anti-mouse Cy3 | Jackson Immuno Research Laboratories, Inc. | 115-165-003 | |
| anti-myc antibody | MBL | M192 | mouse monoclonal |
| Butorphanol | Meiji Animal Health | Vetorphale | |
| Ceramic blade | TissueVision | N/A | |
| Collagenase type I | Wako Chemical | #031-17601 | Aliquot into 100 µL x 10 of 100 mg/mL in PBS |
| Cotton swab (HUBY-340) | HUBY | BB-013SP | micro cotton swabs |
| Custom-made chamber | N/A | N/A | The chamber consist of four side plates and one bottom plates, all made of 1 cm thick acrylic plates, which can be securely fastened together using screw bolts. An additional acrylic plate is placed inside the chamber, with three metal poles inserted through it to hold the marmoset brain in an inverted position. |
| Cy3-Streptavidin | Jackson Immuno Research Laboratories, Inc. | 016-160-084 | |
| Dumont #5 forceps, Inox | N/A | N/A | |
| Epoxy instant mix | Locktite | N/A | |
| FIJI | NIH | https://imagej.net/software/fiji/downloads | |
| kn_pipeline_check_mosaic.py | N/A | N/A | github.com/watkarbey/STPT_depo; This is a checking script for TissueCyte data. |
| Medetomidine | Zenoaq | Domitor | |
| Midazolam | Sandoz | N/A | |
| NaBH4 | Sigma | #452882 | |
| NaIO4 | Sigma | S1878 | |
| Perfusion needle | Natsume Seisakusho Co., Ltd | KN-348, 20G-50 | |
| Slideglass (76 mm x 52 mm) | Matsunami | S9111 | |
| StAvHRP | Jackson Immuno Research Laboratories, Inc. | 016-030-084 | HRP-streptavidin (titration needs to be carefully determined) |
| TissueCyte1000 | TissueVision | https://www.tissuevision.com/tissuecyte | |
| TSA blocking reagent | Kiko Tech | FP1012 | Refer to TSA-biotin kit (Akoya Biosciences) |
| TSA-biotin | House-made | N/A | See Okamoto et al (ref. 16) |
| VECTASHIELD HardSet Mounting Medium | Vector laboratories Inc | N/A | Antifade mounting medium |
References
- Oh, S. W., Harris, J. A., Ng, L., Winslow, B., Cain, N., et al. A mesoscale connectome of the mouse brain. Nature. 508 (7495), 207-214 (2014).
- Ragan, T., et al. Serial two-photon tomography for automated ex vivo mouse brain imaging. Nat Methods. 9 (3), 255-258 (2012).
- Liang, Z., Arefin, T. M., Lee, C. H., Zhang, J. Using mesoscopic tract-tracing data to guide the estimation of fiber orientation distributions in the mouse brain from diffusion MRI. Neuroimage. 270, 119999(2023).
- Watakabe, A., Hirokawa, J. Cortical networks of the mouse brain elaborate within the gray matter. Brain Struct Funct. 223 (8), 3633-3652 (2018).
- Ypma, R. J. F., Bullmore, E. T. Statistical analysis of tract-tracing experiments demonstrates a dense, complex cortical network in the mouse. PLoS Comput Biol. 12 (9), e1005104(2016).
- Wang, Q., et al. The Allen mouse brain common coordinate framework: A 3D reference atlas. Cell. 181 (4), 936-953.e20 (2020).
- Köbbert, C., Apps, R., Bechmann, I., Lanciego, J. L., Mey, J., Thanos, S. Current concepts in neuroanatomical tracing. Prog Neurobiol. 62 (4), 327-351 (2000).
- Lanciego, J. L., Wouterlood, F. G. Neuroanatomical tract-tracing techniques that did go viral. Brain Struct Funct. 225 (4), 1193-1224 (2020).
- Bakker, R., Wachtler, T., Diesmann, M. CoCoMac 2.0 and the future of tract-tracing databases. Front Neuroinform. 6, (2012).
- Watakabe, A., et al. Local and long-distance organization of prefrontal cortex circuits in the marmoset brain. Neuron. 111 (14), 2258-2273.e10 (2023).
- Skibbe, H., et al. The Brain/MINDS marmoset connectivity resource: An open-access platform for cellular-level tracing and tractography in the primate brain. PLoS Biol. 21 (6), e3002158(2023).
- Mitchell, J. F., Leopold, D. A. The marmoset monkey as a model for visual neuroscience. Neurosci Res. 93, 20-46 (2015).
- Okano, H. Current status of and perspectives on the application of marmosets in neurobiology. Annu Rev Neurosci. 44, 27-48 (2021).
- Watakabe, A., et al. Comparative analyses of adeno-associated viral vector serotypes 1, 2, 5, 8 and 9 in marmoset, mouse and macaque cerebral cortex. Neurosci Res. 93, 144-157 (2015).
- Hata, J., et al. Multi-modal brain magnetic resonance imaging database covering marmosets with a wide age range. Sci Data. 10, 221(2023).
- Liwang, J. K., Bennett, H. C., Pi, H. -J., Kim, Y. Protocol for using serial two-photon tomography to map cell types and cerebrovasculature at single-cell resolution in the whole adult mouse brain. STAR Protoc. 4 (1), 102048(2023).
- Okamoto, S., et al. Exclusive labeling of direct and indirect pathway neurons in the mouse neostriatum by an adeno-associated virus vector with Cre/lox system. STAR Protoc. 2 (1), 100230(2021).
- Viswanathan, S., et al. High-performance probes for light and electron microscopy. Nat Methods. 12 (6), 568-576 (2015).
- Kuan, L., et al. Neuroinformatics of the Allen mouse brain connectivity atlas. Methods. 73, 4-17 (2015).
- Paxinos, G., Watson, C., Petrides, M., Rosa, M., Tokuno, H. The Marmoset Brain in Stereotaxic Coordinates. , Academic Press. London, Waltham, MA. (2012).
- Abe, H., et al. 3D reconstruction of brain section images for creating axonal projection maps in marmosets. J Neurosci Methods. 286, 102-113 (2017).
- Wan, Y., et al. FluoRender: Joint freehand segmentation and visualization for many-channel fluorescence data analysis. BMC Bioinformatics. 18 (1), 280(2017).
- Majka, P., et al. Towards a comprehensive atlas of cortical connections in a primate brain: Mapping tracer injection studies of the common marmoset into a reference digital template. J Comp Neurol. 524 (11), 2161-2181 (2016).
- Liu, C., Yen, C. C. -C., Szczupak, D., Tian, X., Glen, D., Silva, A. C. Marmoset brain mapping V3: Population multi-modal standard volumetric and surface-based templates. Neuroimage. 226, 117620(2021).
- Liu, C., et al. A digital 3D atlas of the marmoset brain based on multi-modal MRI. Neuroimage. 169, 106-116 (2018).
- Liu, C., et al. A resource for the detailed 3D mapping of white matter pathways in the marmoset brain. Nat Neurosci. 23 (2), 271-280 (2020).
- Woodward, A., et al. The Brain/MINDS 3D digital marmoset brain atlas. Sci Data. 5, 180009(2018).
- Saleem, K. S., Avram, A. V., Glen, D., Schram, V., Basser, P. J. The subcortical atlas of the marmoset ("SAM") monkey based on high-resolution MRI and histology. Cereb Cortex. 34 (4), bhae120(2024).
- Watakabe, A., Hirokawa, J. Cortical networks of the mouse brain elaborate within the gray matter. Brain Struct Funct. 223 (8), 3633-3652 (2018).
- Lin, M. K., et al. A high-throughput neurohistological pipeline for brain-wide mesoscale connectivity mapping of the common marmoset. eLife. 8, e40042(2019).
- Skibbe, H., et al. PAT-probabilistic axon tracking for densely labeled neurons in large 3-D micrographs. IEEE Trans Med Imaging. 38 (1), 69-78 (2019).
- Economo, M. N., et al. A platform for brain-wide imaging and reconstruction of individual neurons. eLife. 5, e10566(2016).
- Winnubst, J., et al. Reconstruction of 1,000 projection neurons reveals new cell types and organization of long-range connectivity in the mouse brain. Cell. 179 (1), 268-281.e13 (2019).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved