Method Article
Nöroanatomik Analizler için Tüm Marmoset Beyninin Seri İki Fotonlu Tomografisi
Bu Makalede
Özet
Seri iki fotonlu tomografi (STPT) görüntüleme, iki fotonlu görüntülemeyi otomatik evre kontrolü ve mikrotom dilimleme ile birleştirerek bir doku kütlesini üç boyutlu şeklinde görüntülemek için kullanılan bir tekniktir. Burada, marmoset beyinlerinin yapısal özelliklerini daha iyi anlamaları için bunu uygulamak için bir protokol açıklıyoruz.
Özet
Seri İki fotonlu tomografi (STPT), iki fotonlu görüntülemeyi otomatik evre kontrolü ve mikrotom dilimleme ile birleştirerek bir doku kütlesini üç boyutlu şeklinde görüntüleme tekniğidir. Marmoset beynindeki aksonal projeksiyonları izlemek için bu tekniği başarıyla uyguladık. Burada, tüm marmoset beyninin güvenilir hacimsel görüntülenmesi ile sonuçlanan ayrıntılı deneysel prosedürler açıklanmaktadır. Başarılı görüntüleme için önemli bir süreç, beyni çevreleyen ve dilimlemeye müdahale eden meninkslerin çıkarılmasıydı. Bu metodolojinin büyük bir avantajı, dilimlenmiş bölümlerin ek boyama için kullanılabilmesidir. Orijinal kurulumda, dilimlenmiş bölümler su banyosunda karıştırılır. Bu bölümler, korteksteki kan damarı modellerine göre orijinal sıralarına göre doğru bir şekilde hizalanabilir. Etkili histolojiye bir örnek, anatomik sınırları tanımlamak için Nissl boyama ile birleştirilebilen basit ışık yansıması ile miyelin yapısının görselleştirilmesidir. Bu bölümler ayrıca, birden fazla verinin katmanlanması için STPT verilerine kaydedilebilen floresan olmayan anterograd ve retrograd izleyicilerin immünolojik tespiti için de kullanılabilir.
Giriş
Nöroanatomik çalışmalarda, araştırmacılar tüm beyin bağlamında mikrometre dereceli yapıları (örneğin, aksonlar ve butonlar) gözlemleme ihtiyacı ile karşı karşıyadır. Bu zor göreve tipik olarak, seri bölümlerin görsel olarak incelenmesi ve ayrıntılı görüntüleme, analizler ve fotoğraf kaydı için ilgilenilen bölgenin aranmasıyla yaklaşılmıştır. Bununla birlikte, teknolojik ilerlemeyle birlikte, tüm beyin analizi için tüm beyni yüksek çözünürlükte görüntülemek mümkün hale geliyor. Oh ve ark.1 tarafından yapılan çığır açan bir çalışmada, yüzlerce fare beyni, seri iki foton tomografi (STPT) görüntüleme tekniği2 ile işlenen konektomik analiz için izleyici enjeksiyonları aldı. Bu çalışmanın özelliği, "bağlanabilirliği" ölçmek için anterograd izleyiciler seçmeleriydi. Anterograd izleyiciler, aksonal dağılım hakkında çok ayrıntılı uzamsal bilgi sağlarken, nöroanatomistler, analizi için zahmetli manuel segmentasyona güvenmişlerdir. Bu segmentasyon adımı da dahil olmak üzere çeşitli analitik prosedürleri otomatikleştirerek, çok amaçlı kullanımlar için kullanıma hazır yüksek çözünürlüklü izleyici verilerinin "seri üretiminde" başarılı oldular. İzleyici verilerini 3,4,5 ve standart beyinlerini6 kullanan çeşitli çalışmalar göz önüne alındığında, yaklaşımlarının etkinliği açıktır.
Tarihsel olarak, insan olmayan primat beyinlerinin sinirsel bağlantısı, 1950'lerde dejenerasyon yönteminin geliştirilmesinden bu yana, 1970'lerde anterograd/retrograd madde taşıma yöntemlerine ve mevcut viral stratejiyekadar birçok nöroanatomistin dikkatini çekmiştir 7,8. Bu nedenle, primat nöral bağlantılarını araştıran çok sayıda literatür bulunmaktadır. Özellikle, birçok araştırmacı makak beyninin karmaşık kortikortik bağlantısını araştırdı ve sonuçları tablolama için seçildi (örneğin, CoCoMac9). Yararlı olmasına rağmen, bu klasik çalışmaların çeşitli sınırlamaları vardı. Birincisi, her çalışma yalnızca sınırlı beyin bölgelerine odaklandığından, elde edilen bilgiler kaçınılmaz olarak parçalı hale gelir. İkincisi, her çalışma farklı yöntemler ve koşullar kullanır. Bu nedenle, çalışmalar arasında nicel değerlendirme karmaşık hale gelir. Üçüncüsü, bağlantı genellikle ya temsili bölümlerden oluşan bir kamera lucida olarak ya da yazar tanımlı beyin bölgeleri için yarı nicel bir tablo/grafik olarak gösterilir. Başka bir deyişle, karmaşık bir beyin yapısından yalnızca çok sınırlı bilgi, yayınlanmış literatürde sunulmak üzere çıkarılır. Manyetik rezonans görüntüleme (MRG) tekniklerinin gelişmesiyle birlikte düşük çözünürlükte tüm beyin çalışmaları ön plana çıkmıştır. Bununla birlikte, farelerdeki sinirsel bağlantılar hakkında bildiklerimiz ile primatlardaki bağlantılar arasındaki ayrıntı seviyeleri arasında büyük bir boşluk vardır.
Böyle bir arka planı göz önünde bulundurarak, ortak marmoset beyinlerinin10,11 kapsamlı anterograd izlemesini yapmak için yola çıktık. Makak beyninden çok daha küçük ve pürüzsüz olmasına rağmen, marmoset muadili, MT alanının varlığı ve granüler prefrontal alanlar gibi primatların açık belirtilerini sergiler ve bunların hiçbiri kemirgenlerde açıkça tanımlanmamıştır12,13. Burada, küçük boyut büyük bir avantajdı çünkü marmoset beyni bile fare beyninden on kat daha ağırdı. Neyse ki, STPT görüntüleme2 için ticari olarak temin edilebilen mikroskop olan TissueCyte1000 (bundan böyle tüm doku görüntüleme sistemi olarak anılacaktır) işletim yazılımının orijinal versiyonunun minimum güncellemeleriyle tüm marmoset beynini görüntüleyebildik. Bu güncelleme, dilimlemeden önce sahnenin ekstra hareketine izin vermek içindi. Mevcut sürüm artık marmoset beynini işlemek için yeterlidir. Bu makale, STPT görüntüleme için marmoset beynini işlemek için bir protokolü paylaşmaktadır. Bu yöntemin faydasını daha da artıran görüntüleme sonrası protokol de sağlanmaktadır.
Protokol
Tüm deneysel prosedürler, 1996 yılında revize edilen Laboratuvar Hayvanlarının Bakımı ve Kullanımı için Ulusal Sağlık Enstitüsü Rehberi (NIH Yayınları No. 80-23) ve Japon Fizyoloji Derneği'nin "Fizyolojik Bilim Alanında Hayvanların Bakımı ve Kullanımı için Yol Gösterici İlkeler" izlenerek gerçekleştirilmiş ve RIKEN Deney Hayvanları Komitesi tarafından onaylanmıştır (W2020-2-009(2)).
1. İzleyici enjeksiyonu
- Daha önce bildirilen prosedürlere göre marmoset beynine floresan ve floresan olmayan izleyicilerin enjeksiyonlarını gerçekleştirin14.
- STPT yöntemi ile kombinasyonla ilgili olarak, izleyicilerin floresansının iyileştirme yapılmadan tespit edilebilecek kadar güçlü olduğundan emin olun. Gelişmiş ifade için çift vektörlü bir TET-Off sistemi10 benimseyin.
NOT: Floresan olmayan izleyiciler de enjekte edilebilir ve üretilen dilimler kullanılarak STPT yapıldıktan sonra tespit edilebilir. Floresan olmayan izleyicilerin örnekleri arasında Biyotinile Dekstran Amin (BDA), giriş hücresi çekirdeği10'un retrograd tespiti için AAV2 retrosunda cre-eksprese eden AAV ve ayrıca GFP bazlı smFP-tag AAV'ler bulunur (aşağıya bakınız).
- STPT yöntemi ile kombinasyonla ilgili olarak, izleyicilerin floresansının iyileştirme yapılmadan tespit edilebilecek kadar güçlü olduğundan emin olun. Gelişmiş ifade için çift vektörlü bir TET-Off sistemi10 benimseyin.
- Perfüzyon 4 hafta sonra marmoset beynini düzeltin ve elde edin.
- Marmoseti uyuşturmak için, Medetomidin (0.04 mg / kg), midazolam (0.4 mg / kg) ve MMB adı verilen butorphanol (0.4 mg / kg) intramüsküler olarak uygulayın, ardından intraperitoneal Tiyopental Sodyum enjeksiyonu (100 mg / kg).
- Ağrı refleksinin kaybolduğunu onayladıktan sonra, kalbi açığa çıkarmak için göğüs boşluğunu kesin ve kanın ve fiksatifin çıkmasına izin vermek için sağ atriyumu kesin.
- Daha sonra perfüzyon iğnesini yerleştirmek için sol ventrikülü kesin, önce kanı ön ek solüsyonla (250 mM sükroz, 5 mM MgCl2 0.02 M fosfat tamponunda [PB, pH 7.4]) birkaç dakika (~ 50-100 mL), ardından %4 paraformaldehit / 0.1 M fosfat tamponu (PB; ~ 20 dakika boyunca hayvanın ağırlığının 2-3 katı) ile sabitleyin.
- İyi bir perfüzyon iyi bir sonuç için kritik öneme sahiptir. Perfüzyon iğnesini yerleştirirken, fiksatifin iyi bir akışını sağlamak için septum boyunca aorta doğru ilerletin. İğnenin ucu aort damarına ulaştığında görünür hale gelir. Uç zar zor görünene kadar geri çekin, böylece karotis arteri atlamaz.
- Beyni 4 ° C'de 48 saat boyunca% 4 paraformaldehit / 0.1 M PB'de tutun ve 50 mM PB'ye aktarın. Hemen kullanılmazsa, aşırı fiksasyona bağlı otofloresanı önlemek için beyni% 0.75 Glisin / 0.1 M PB'de saklayın.
2. Numune hazırlama (Şekil 1)
- Sabit beyni kollajenaz (3 mM'de 1 mg/mL, CaCl'de2 , 10 mL tris tamponlu salin [TBS]) ile 37 ° C'de 1 saat inkübe edin.
NOT: İnkübasyondan önce beyni 37 °C'de 5 dakika önceden ısıtın. - Pia maddesini ve diğer meninksleri soymak için beyin yüzeyini pamuklu çubukla dikkatlice ovalayın (Şekil 1A, Ek video). Ayrılmış meninksleri soymak için ince forseps kullanın.
NOT: Superior colliculus veya talamusun üst kısmındakiler de dahil olmak üzere orta beyni çevreleyen meninkslerin çıkarılması önemlidir. Derinlerde saklı olan bu yapıları ortaya çıkarmak zordur. Bununla birlikte, meninksleri mümkün olduğunca çıkarın. Aksi takdirde, genellikle kesilmeden kalırlar, yüzerler ve görüntüleme ve dilimlemeye müdahale ederler (Şekil 2A). - Beyin gömme işleminden önce ex vivo MRG'ye tabi tutulduğunda ekstra dikkatli olun, bu sırada beyin flor çözeltisinedaldırılır 15. Kalan flor, birlikte gömülürse, görüntüleme sırasında objektifin altında küçük hava kabarcıkları oluşturabilir. Bunu önlemek için, gömmeden önce beyni 1 hafta boyunca PB'de tutun.
NOT: Bu bekleme adımı genellikle gerekli değildir, ancak ex vivo MRG ile birleştirildiğinde kritiktir. - NaBH4 tamponunu, 0.2 g NaBH4'ü 40 ° C'ye ısıtılmış 100 mL 50 mM borat tamponu (pH 9.2) içinde çözerek hazırlayın. CO2 gazının dışarı çıkması için kapağı gevşek bırakın. Solüsyonu gece boyunca kapağı gevşetilmiş halde tutun. Şişeyi kullanana kadar ışıktan korumak için alüminyum folyoya sarın.
- 100 mL PB'de 2.25 g agaroz ve 0.21 g NaIO4'ü 2-3 saat karıştırarak oksitlenmiş agaroz yapın. Çözeltiyi vakumlu emiş ile filtreleyin ve PB'nin üç değişikliği ile yıkayın. Agarozu 50 mL PB'de tekrar süspanse edin.
- Agarozu bir mikrodalga fırında tamamen eritin ve 60-65 ° C'ye soğutun.
- Beyni özel yapım bir odaya yerleştirin ve beyni agarozun içine gömün. Agarozu korpus kallozumun altındaki boşluğa sokmaya özen gösterin (Şekil 1B).
NOT: Beyni önce oda sıcaklığında, ardından 65 °C'de 5 dakika önceden ısıtın, böylece agarozun katılaşmadan beyin yüzeyine yerleşmesini sağlayın. - Hazneyi sökün ve agaroz bloğunu gece boyunca 4 °C'de NaBH4 tamponuna daldırın.
- Tamponu 4 °C'de 1-2 hafta boyunca birkaç kez PB olarak değiştirin.
NOT: Tampon değişimi tamamlanmamışsa doku otofloresansı çok zayıflar. - Epoksi anında karıştırma ile dört Neodimyum mıknatıs takarak bir slayt cam sahne yapın.
- Agaroz bloğunu güçlü bir yapıştırıcı (örn. süper yapıştırıcı) ile sahneye monte edin (Şekil 1C).
3. Doku işleme
- Tüm doku görüntüleme sistemini üreticinin talimatlarına göre çalıştırın. Ayrıntılı bir protokol de yayınlanmaktadır16. Mevcut prosedür esas olarak TissueCyte1000 için kullanılır, ancak TissueCyte 1600FC gibi diğer modellere de uygulanabilir.
- İşlem, modeller arasında biraz farklıdır, ancak genellikle önemli olan aşağıdaki noktaları izleyin.
- Tüm marmoset beyni, donanımda herhangi bir değişiklik yapmadan ön uçtan arka uca koronal olarak işlenebilir. Beyni yerleştirirken sahne hareket sınırlarının aşılmadığından emin olun.
- Bıçağın her iki ucundaki yüzey derinliklerinin 10 μm içinde olduğundan emin olmak için bıçakların açısına ince ayar yapın. Yoğun miyelinasyon nedeniyle, derinlikteki 10 μm'lik bir fark bile yetişkin marmoset beyaz cevheri yoluyla farklı lazer penetrasyonlarına yol açabilir. Aynı nedenle, görüntüleme düzlemini yüzeyden yaklaşık 25-35 μm yüksekliğe ayarlayın.
- Tüm beyni 50 μm aralıklarla (~ 650 dilimden fazla) kesmek için seramik bir bıçak (önerilir) kullanın.
- Meninksler kesilmeden kalır ve uygun şekilde çıkarılmazsa dilimlemeyi engeller (Şekil 2). Bazı meninkslerin (örneğin, hipokampus veya pulvinarı çevreleyenler) çıkarılması zordur. Fark edildiğinde bu meninksleri ince forseps ile manuel olarak çıkarın.
4. Yardımcı histolojik teknikler
- Bölüm alma
- Çeşitli histolojik boyama yapmak için doku dilimlerini kurtarın. Bu bölümleri dilimleme sırasına göre doğru şekilde hizalayın. Hizalama için kan damarlarını kortikal katmanlar boyunca izleyin (Şekil 3).
- Daha iyi kullanım için her bölümden fazla agarozu kesin.
NOT: Bu işlemin aşırıya kaçmamasına gerek yoktur. Agaroz, histolojik işleme müdahale etmeden doku segmentlerini yerinde tutmaya hizmet eder. - Arkadan aydınlatmalı görüntüleme
- Bölümleri bir sürgülü cama monte edin ve kurulayın.
- Bölümü PBS ile yeniden sulandırın ve lamel görüntüleme için yerleştirin.
- Kesit, parlak alan modunda bir floresan mikroskobu (Şekil 4) ile görüntülendiğinde, lekelenme olmayan bir miyelinasyon modeli gözlemleyin. Pozlama süresini, ışık yansıması görünür olacak şekilde ayarlayın.
NOT: Karanlık alan aydınlatmasını kullanabilen herhangi bir mikroskop kullanılabilir. - Lameli çıkarın ve Nissl boyamaya veya başka bir boyamaya devam edin. Herhangi bir standart boyama prosedürü yeterlidir.
- Farklı boyama desenlerini miyelinasyon desenleriyle doğrudan karşılaştırmak için bu yöntemi kullanın (Şekil 4).
- BDA görüntüleme
- Ayrıntılı bir prosedür için Tablo 1'e bakın.
- İlk olarak, bölümleri Dent's Solution (% 20 DMSO,% 80 Metanol) ile tedavi edin. Dent'in çözeltisine dahil edilen metanol, aksonlardaki BDA sinyallerini önemli ölçüde arttırır.
- Floresan olarak algılanacak BDA sinyalini geliştirmek için tiramid sinyal amplifikasyonu (TSA) yöntemini kullanın17.
NOT: TSA-biotin çözeltisi satıcıdan satın alınabilir, ancak In-House reaktif çok daha ucuz ve daha etkilidir. - STPT görüntüsüne kaydolmak için, bölümü montaj ortamıyla birlikte bir kayar cama monte ettikten sonra arkadan aydınlatmalı bir görüntü çekin.
- Spagetti canavarı floresan proteini (smFP) boyama
NOT: 'Spagetti canavarı' floresan proteinleri (smFP'ler), birden fazla epitop etiketine18 sahip floresan olmayan GFP varyantlarının bir ailesidir. İmmün tespit üzerine mükemmel floresan sinyalleri sağlarlar ve floresan izleyicilere eşlik eden izleyiciler olarak uygundurlar. Addgene'de bulunan AAV yapıları için Tablo 2'ye bakın.- Tablo 1'de verilen ayrıntılı prosedürü izleyin.
5. Görüntüleme sonrası veri işleme
- Veri bütünlüğü testi
NOT: STPT çok sayıda görüntü dosyası oluşturur. Yetişkin bir marmosetin beyni 50 μm aralıklarla koronal olarak kesildiğinde, tüm beyni kaplamak için tipik olarak 650'den fazla bölüm gerekir. Her bölümün verileri, üç kanalda yakalanan bir dizi döşeme görüntüsünden oluşur. Bu görüntü dosyaları, her döşemenin konumunu kaydeden bir meta veri dosyasıyla birlikte tek bir klasörde saklanır. Toplam veri miktarını ve işlem süresini en aza indirmek için, görüntüleme, döşeme için X ve Y adımlarının sayısının kademeli olarak değiştiği çalışma blokları halinde gerçekleştirilir. Tipik olarak, her biri 30-50 bölümün görüntülenmesini içeren 20-30 blok çalışma, tek bir beyin için eksiksiz bir veri setini oluşturur. Bu verileri kullanmak için, diğerlerinin yanı sıra, döşenmiş görüntülerin dikilmesi, floresan sinyallerin segmentasyonu ve hacimsel verilerin standart bir şablona kaydedilmesi dahil olmak üzere çeşitli görüntü işleme adımları gereklidir.- Görüntü işleme adımlarını, çeşitli yazılım araçlarını kullanarak veya araştırmacıların özel ihtiyaçlarına göre uyarlanmış özel boru hatları aracılığıyla ayrı ayrı gerçekleştirin. Görüntü işlemenin ayrıntıları bu yazının kapsamı dışındadır ve diğer yayınlardabulunabilir 11,19.
- Kullanılan prosedürden bağımsız olarak, verilerin tutarlı bir şekilde düzenlendiğinden emin olun.
NOT: Tüm görüntüleme süreci birçok çalıştırma bloğu içerdiğinden ve birkaç güne yayıldığından, bir koşunun yarıda iptal edilmesi ve yeniden başlatılması alışılmadık bir durum değildir. Bu gibi durumlarda, veri yapısı bozulabilir ve görüntü işleme hattının düzgün bir şekilde yürütülmesini engelleyebilir. - Veri yapısının bozulma riskini en aza indirmek için, GitHub'da (github.com/watkarbey/STPT_depo) bulunan veri yapısının (kn_pipeline_check_mosaic.py) bütünlüğünü denetlemek için bir Python betiği çalıştırın.
- Lekeli görüntünün STPT görüntüsüne kaydedilmesi
NOT: Lekeli görüntünün STPT görüntüsüne doğrusal olmayan dönüşümü, ImageJ'nin bUnwarpJ eklentisi kullanılarak gerçekleştirilebilir.- Hedef (STPT) ve kaynak (lekeli) görüntülerin boyutlarını yaklaşık olarak eşit olacak şekilde ayarlayın.
- Bölümlerin şekillerini görselleştirmek için her görüntüyü ikili hale getirin.
- bUnwarpJ'yi çalıştırın. Dönüşümleri Kaydet seçeneğini işaretlemeyi unutmayın.
- bUnwarpJ'yi yeniden başlatın. Kaynak görüntü olarak ikili oluşturmadan önce orijinal görüntüyü seçin. Ardından Elastik Dönüşümü Yükle'ye tıklayın ve kaydedilen dönüşümü seçin.
Sonuçlar
Burada kullanılan tipik kurulumda, yetişkin bir marmosetin tüm beyni, yaklaşık 1 hafta içinde 50 μm'lik bir kesit aralığı ile ~ 1.3 x 1.3 μm / piksel çözünürlükte görüntülenebilir (Şekil 5). Bu, görüntü birleştirmeden sonra üç kanalda ~ 650 koronal görüntü anlamına gelir. 16x objektif lens ile (Nikon 16xW CFI75 LWD; NA = 0.80), tek bir çekimin görüş alanı yaklaşık 1 x 1 mm'dir. Bu çekimlerin dikilmesiyle tüm koronal yüzey için görüntü elde edilir (Şekil 5A). Z yönündeki hizalama mükemmeldir ve koronal görüntü verilerinin basitçe istiflenmesiyle iyi bir 3D görüntü elde edilir (Şekil 5B,E). Standardizasyon için, marmoset beyni11 için STPT şablonu 3D-3D kayıt için kullanılabilir (Şekil 5F). Bu veri dönüşümü, bir ilgi bölgesine anatomik açıklamadan bağımsız olarak mutlak bir uzay koordinatının atandığı tüm beyin nöroanatomisinin kilit yönlerinden biridir. Örnek beyin standart alana kaydedildikten sonra, daha fazla analiz için ilgilenilen alt bölgeler kolayca çıkarılabilir (Şekil 5F,G). Özellikle, kortikal bölgeler önceden belirlenmiş bir parametre kullanılarak düz bir haritaya dönüştürülebilir (Şekil 5H).
Görüntüleme sırasında oluşturulan kesitler çeşitli histolojik amaçlar için kullanılabilir. Şekil 4A,B'de gösterildiği gibi, lekelenme olmadan arkadan aydınlatmalı görüntüleme, otantik miyelin boyamaya çok benzer bir model sağlar. Bu, miyelin boyamaya mükemmel bir alternatif olabilir. Ayrıca, arkadan aydınlatmalı görüntü Nissl boyamadan önce elde edilirse, aynı bölüm hem miyelin hem de Nissl boyamanın desenlerini elde etmek için kullanılabilir, böylece alanları ve katmanları tanımlamak için yararlı bilgiler sağlar (Şekil 5C-E). Bu bölümler ayrıca immünolojik boyama için de kullanılabilir. Şekil 5J'de, AAV virüsünün transdüksiyon etkinliğini tahmin etmek için enjeksiyon merkezinin etrafındaki kesit NeuN antikoru ile karşı boyandı. Floresan izleyicilere ek olarak floresan olmayan izleyiciler enjekte etmek ve kesit alımından sonra bunları histolojik olarak tespit etmek de iyi bir stratejidir. Önceki çalışmamızda, anterograd yeşil izleyicileri, daha sonra anti-cre antikoru10 tarafından tespit edilen retrograd "cre" vektörü ile birleştirdik. Şekil 6A-E'nin bir örneğinde, yeşil izleyicinin (yonca) karşı tarafına BDA enjekte edildi ve floresan olarak tespit edildi. Kırmızı BDA sinyallerinin tüm beyin koordinatında lokalize edilmek üzere TissueCyte görüntüsüne kaydedilebileceğini unutmayın. Şekil 6F-I'in başka bir örneğinde, parietal alana smFP-myc enjekte edildi (Şekil 6G), yeşil izleyici ise ön bölgeye enjekte edildi. Bu şekilde, görüntülemeye müdahale etmeden aynı hayvana birden fazla izleyici enjekte edilebilir. Ek boyama için STPT bölümlerini kullanmanın büyük bir avantajı, floresan ve floresan olmayan izleyiciler arasındaki ilişkinin aynı beyin için belirlenebilmesidir. Bu nedenle, kortikokortik projeksiyonların karşılıklılığını yüksek hassasiyetli10'da belirleyebildik. Diğer bir avantaj, lekeli bölümlerin 3B koordinatlarının STPT verilerine ve ardından standart şablona geri eşlenebilmesidir. Bu nedenle, boyama için alınan tüm bölümleri kullanmak gerekli olmayabilir. Daha iyi yorumlama için, STPT verilerine daha fazla bağlam eklemek için boyama için bölümler seçilebilir.
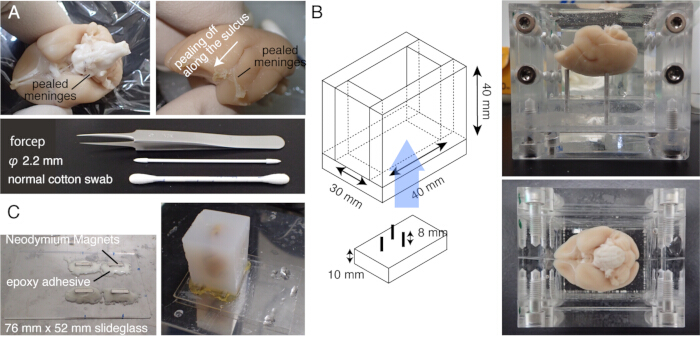
Şekil 1: STPT için numune hazırlama. (A) Pamuklu çubuklar kullanılarak meninks çıkarma. Beyin sapını çevreleyen beyin zarları ince uçlu forsepslerle çıkarılabilir. Marmoset beynini çevreleyen meninksler, pamuklu çubuklarla ovularak manuel olarak çıkarılır. Fotoğraf, lateral sulkus içinden soyulan meninksleri göstermektedir. (B) Agaroz gömme için kullanılan akrilik kutu. Pimler hareketlidir ve beynin açısını stereotaksik olarak sabitlenmiş konuma20 yakın olacak şekilde ayarlamak için kullanılır. (C) 76 mm x 52 mm sürgülü camdan yapılmış manyetik bir slayt ve epoksi yapıştırıcı ile tutturulmuş dört Neodimyum mıknatıs. Agaroz bloğu manyetik aşamaya süper yapıştırıcı ile tutturulur. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
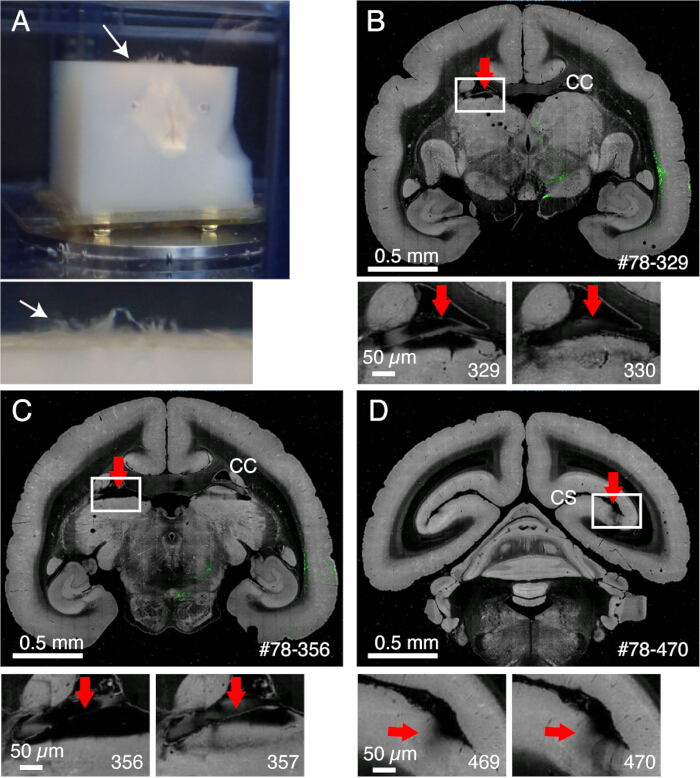
Şekil 2: Meninkslerin görüntüleme üzerindeki etkisi. (A) Kesilmeden kalan meninksler, beyaz okla gösterildiği gibi yukarı doğru yüzer. Bu örnekte, meninkslerin geniş bir çıkıntısı görülmektedir, çünkü agaroz gömülmeden önce çıkarılmamışlardır. Genellikle, meninksler sadece birkaç zor bölge için kesilmeden kalır. (B) Korpus kallozum ile talamusun üst kısmı arasında meninkslerin varlığına bağlı kötü dilimleme örneği. Bu durumda, kötü dilimleme, derin bir dilimin (329) ve nispeten normal bir dilimin (330) değişmesine yol açmıştır. #78-329, Brain/MINDS veri portalında (C) örnek no. 78, bölüm no. 329 anlamına gelir. Kötü görüntülemenin başka bir örneği. Daha kötü bir durumda, kırmızı okla gösterilen pulvinar çekirdek tamamen çıkabilir. Ölçek çubukları: 0,5 mm (üst panel), 0,5 μm (alt panel). (D) Kötü görüntülemenin başka bir örneği. Kalkarin sulkusun derinliklerindeki meninkslerin çıkarılması zordur. 469 ve 470 numaralı bölümlerde görülen gölgeler, hedefin altına giren yüzen meninkslerden kaynaklanmaktadır. Ölçek çubukları: 0,5 mm (üst panel), 0,5 μm (alt panel). Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
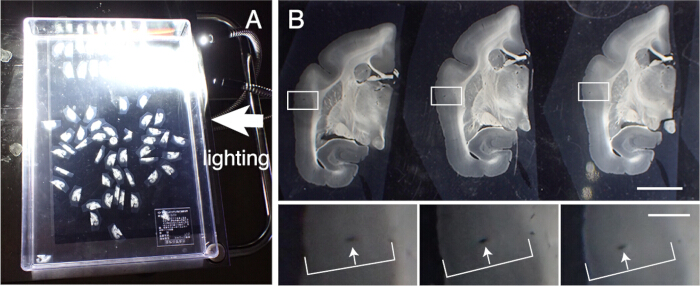
Şekil 3: Doku kesitlerinin sırayla hizalanması. (A) 50'ye kadar marmoset koronal bölümü, plastik bir kapta (31 cm x 22,5 cm) sırayla doğru şekilde hizalanabilir. Ayrıntılı yapıları görselleştirmek için, kap siyah kağıda yerleştirilir ve yandan aydınlatılır. Bu bölümler önce sırayla kabaca hizalanır ve ardından hassas hizalamaya tabi tutulur. (B) Hassas hizalama, işaretleyici olarak kan damarını kullanır. Serebral korteks, kortikal katmanlar boyunca dikey olarak uzanan birçok kan damarı içerir. Kortikal katmanlar (beyaz oklar) içindeki konumlarını sistematik olarak değiştiren uzun delikler olarak tanımlanırlar. Bu yöntemi kullanarak, 50 μm aralıklı bölümler bile doğru bir şekilde hizalanabilir. Bu kan damarı delikleri, onay için SPTP kesit görüntülerinde tanımlanabilir. Ölçek çubuğu: 5 mm (üst panel), 1 mm (alt panel). Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
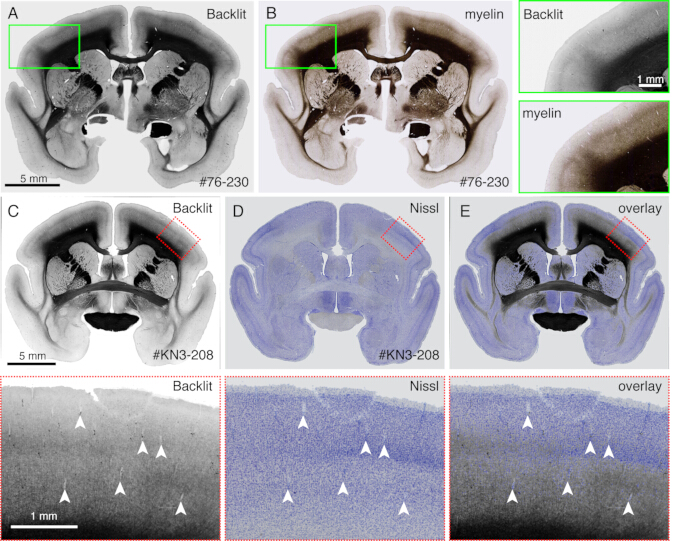
Şekil 4: Miyelin boyamanın yerine arkadan aydınlatmalı görüntü. (A,B) Aynı bölüm arkadan aydınlatmalı görüntüleme ve miyelin boyama için kullanıldı. İlk olarak, kesit sürgülü cam üzerine monte edildi, kurutuldu, PBS ile yeniden sulandırıldı, lamel yapıldı ve bir ışık mikroskobu kullanılarak görüntülendi (Malzeme Tablosu). Lameli çıkardıktan sonra, aynı bölüm miyelin boyama21 için kullanıldı ve bir floresan mikroskobu kullanılarak görüntülendi. Arkadan aydınlatmalı görüntü, ImageJ'nin bUnwarpJ eklentisi kullanılarak miyelin görüntüsüne kaydedildi. Yeşil kutular, her görüntünün büyütülmüş görünümlerini gösterir. Bu görüntülerin, miyelin boyamanın lifli yapıları daha iyi görselleştirmesi dışında, neredeyse aynı desenleri gösterdiğine dikkat edin. (C-E) Aynı bölüm arkadan aydınlatmalı görüntüleme ve Nissl boyama için kullanıldı. Arkadan aydınlatmalı görüntü için düşük eşikli maske ilk olarak bUnwarpJ eklentisi kullanılarak Nissl görüntüsü için düşük eşikli maske ile kaydedildi ve orijinal görüntü aynı parametre kullanılarak dönüştürüldü. Kan damarlarının (beyaz ok uçları) iki görüntü arasında iyi bir şekilde eşleştiğine dikkat edin. Bu iki görüntü aynı bölüm için olduğundan, eşleştirme neredeyse mükemmeldir ve kortikal tabakaların tanımlanması için miyelin ve Nissl desenleri doğrudan karşılaştırılabilir. Ölçek çubukları: 5 mm (paneller A-E). Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
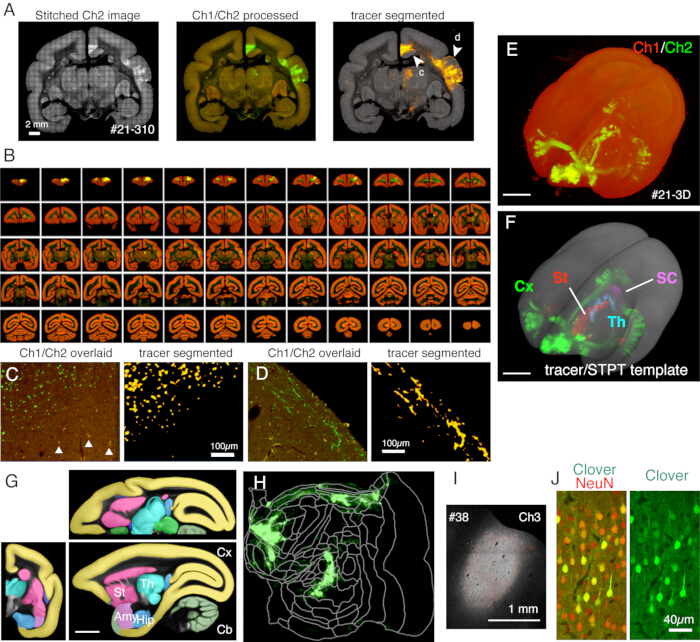
Şekil 5: STPT görüntülemenin tipik sonucu. (A) Örnek bir bölümün Ch2 (yeşil) görüntülerinin basit bir döşemesi (örnek #21 bölüm 310). Arka plan düzeltmesi olmadan, her kutucuğun kenarlıkları görünür. Orta sütunda, karolar sırasıyla Ch1 (kırmızı) ve Ch2 (yeşil) için arka plan düzeltmesi ile dikildi. Lipofuscin sinyallerini azaltmak için (panel C'ye bakınız), Ch1 sinyalleri Ch2'den çıkarıldı ve yeşil olarak gösterildi. Ch1'in lipofuscin sinyallerini azaltmak için, ImageJ tarafından dikişten önce "Remove Outilers.." komutu kullanıldı. Sağ sütunda, izleyici sinyalleri görüntü işleme boru hattı11 tarafından bölümlere ayrıldı. Ok uçları (c, d), C ve D panellerinde büyütülmüş görünümlerin gösterildiği konumları gösterir. Ölçek çubuğu: 2 mm. (B) Örnek #21 için seri bölümlere genel bakış. STPT, bu örnek için 635 yüksek çözünürlüklü koronal görüntü üretti. (C) Panel A'da ok ucu c ile gösterilen yüksek büyütmeli görünüm. Bu, başka bir işlem gerektirmeyen basit bir Ch1 (kırmızı) ve Ch2 (yeşil) kaplamasıdır. Üçgenler, yaygın bir spektrum gösteren lipofuscin floresan sinyallerini gösterir. İzleyici segmentasyon algoritması, çok benzer bir şekle (sağ panel) rağmen izleyici sinyallerini lipofusin arka planından doğru bir şekilde ayırt eder. Ölçek çubuğu: 100 μm. (D) Yüksek büyütmeli görünüme başka bir örnek. Katman 1'deki ince akson liflerinin iyi görülebileceğini unutmayın. Ölçek çubuğu: 100 μm. (E) Orijinal STPT görüntülerinin 3D rekonstrüksiyonu. Panel B'de gösterildiği gibi 635 düşük çözünürlüklü koronal görüntü, floranta22 kullanılarak 3D görselleştirme için tiff yığını olarak kullanıldı. Ölçek çubuğu: 5 mm. (F) STPT şablonuna (gri) kayıtlı segmentli izleyici sinyallerinin 3D rekonstrüksiyonu. Beynin farklı bölgelerindeki izleyici sinyaller farklı renklerle gösterildi. Bu bölgeler, panel G'de gösterilen ek açıklama kullanılarak kesildi. Ölçek çubuğu: 5 mm. (G) Farklı beyin bölgelerinin açıklamaları ile kaplanmış STPT şablonu. Ölçek çubuğu: 5 mm. (H) F panelinde gösterilen kortikal izleyici sinyali, düz bir harita şeklinde gösterilmiştir. (I) Enjeksiyon bölgesinin, izleyici floresansına daha az duyarlı olan ve doymamış kalan Ch3 floresansı ile tanımlanması. Ölçek çubuğu: 1 mm. (J) Enjeksiyon merkezinin etrafındaki bölümün NeuN antikoru ile boyanması, nöronların yaklaşık% 30'unun Yonca yeşili floresansının güçlü ifadesini gösterdiğini gösterdi. Ölçek çubuğu: 40 μm. Kısaltmalar: Cx; korteks, St; striatum, Th; talamus, SC; üstün kollikulus. Ayşe; amigdala, kalça; hipokampus, Cb; beyincik. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
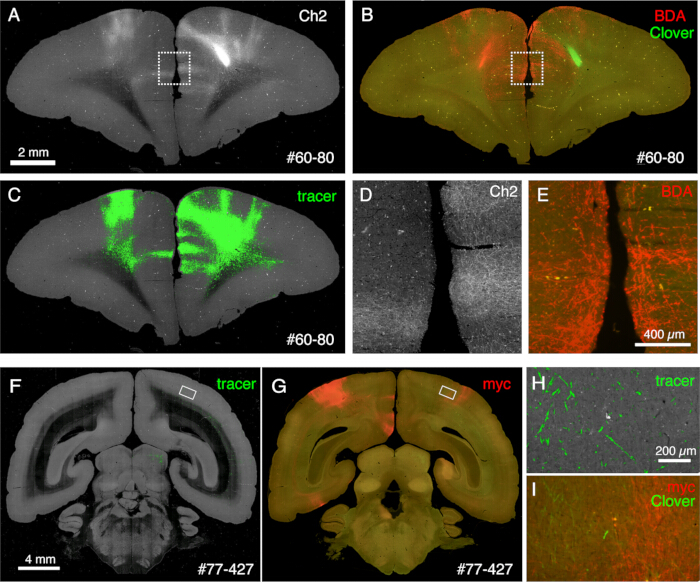
Şekil 6: Çoklu floresan olmayan izleyicileri gösteren STPT sonrası histoloji. (A-C) STPT görüntüsünün BDA lekeli görüntü ile karşılaştırılması. Bu örnekte, Yonca enjeksiyonunun karşı tarafına BDA enjekte edilir. Paneller A ve C, STPT verilerinin Ch2 görüntüsünü ve izleyici segmentasyonunu gösterir. Panel B, BDA için STPT sonrası boyamayı göstermektedir. Bölümün metanol muamelesi nedeniyle yonca floresansı azalır. Ölçek çubuğu: 2 mm. (D,E) A ve B panellerindeki noktalı kutular büyütülür. Ölçek çubuğu: 100 μm. (F,G) SPTT görüntüsünün anti-myc etiket antikor boyaması ile karşılaştırılması. Bu örnekte, Yonca enjeksiyonu PFC'ye yapılırken, AAV-smFP-myc kontralateral parietal kortekse enjekte edilir. Beyaz dikdörtgenler H ve I panellerinde büyütülür. Ölçek çubuğu: 4 mm. (H) İzleyici segmentasyonu yeşil renkle gösterilir. Ölçek çubuğu: 200 μm. (I) Myc boyaması kırmızı ile gösterilmiştir. Yonca floresansı yeşil renkle gösterilmiştir. Ölçek çubuğu: 200 μm. H ve I panellerindeki yeşil sinyaller benzer bir konumda bulunur, ancak STPT yalnızca ~ 10 μm optik bölüm aldığı için aynı değildir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
| BDA floresan boyama protokolü | |
| Agarozu çıkarın | |
| TBS yıkama | 10 dk (2x) |
| Dent çözeltisinde% 1 H2O2 | 10 dk |
| TBS yıkama | Kısa |
| % 0.5 TNB engelleme | 1 saat, |
| TNB'de StAvHRP (1:4000) | 2 gece |
| TNT yıkama | 10 dk (3x) |
| 0.1 M borat (pH8.5) + %0.003H2O2içinde TSA Biotin (1:4000) | 2 saat |
| TNT yıkama | 10 dk (3x) |
| TNT'de Cy3-streptavidin (1:1000) | 3 saat |
| TNT yıkama | 10 dk (2x) |
| TBS yıkama | Montaja kadar bölümü saklayın |
| Bölümü, bir antifade montaj ortamı kullanarak kayar cama monte edin | |
| Anti-MYC floresan boyama protokolü | |
| Agarozu çıkarın | |
| TBS yıkama | 10 dk (2x) |
| IB'de engelleme | 1 saat, |
| IB'de Anti-Myc (1:4000) | 2 gece boyunca |
| TNT yıkama | 10 dk (3x) |
| TNT'de anti-fare Cy3 (1:1000) | 3 saat |
| TNT yıkama | 10 dk (2x) |
| TBS yıkama | Montaja kadar bölümü saklayın |
| Bölümü, bir antifade montaj ortamı kullanarak kayar cama monte edin | |
| Tamponlar/çözeltiler | Kompozisyon |
| % 0,5 TNB | TS7.5'te% 0.5 TSA Bloke Edici Reaktif |
| Dent'in Çözümü | %20 DMSO, %80 Metanol |
| Daldırma tamponu (IB) | TBS'de %10 FBS, %2 BSA %0.5 TritonX100 |
| TBS (Tris tamponlu tuzlu su) | 25 mM Tris, 137 mM NaCl, 2.7 mM KCl (pH 7.4) |
| TNT | TS7.5 içinde %0.05 Tween20 |
| TS7.5 Serisi | 0,1 m TRIS-HCl, pH 7,5, 0,15 m NaCl |
Tablo 1: BDA floresan boyama ve anti-mik floresan boyama protokolü
| AAV izleyici için plazmid | Addgene Hayır. | Önerilen antikor | Önerilen seyreltme | Beklenen sonuç |
| pAAV-EF1_Cre | 201198 | Millipore klonu 2D8 | 1:1000 | hücreler için iyi |
| pAAVCam1.3_smFP_Myc | 201205 | MBL M192 My3 (fare) | 1:4000 | Mükemmel |
| pAAVCam1.3_smFP_HA | 201206 | CST C29F4 (tavşan) | 1:1000 | hücreler için iyi |
| pAAVCam1.3_smFP_FLAG | 201207 | MBL PM020B (tavşan) | 1:1000 | TAMAM |
| AAVTRE3_smFP_Myc | 201208 | |||
| AAVTRE3_smFP_HA | 201209 | |||
| AAVTRE3_smFP_FLAG | 201210 |
Tablo 2: Floresan olmayan izleyicilerin üretimi için mevcut Addgene plazmitlerinin listesi. Cre yapısı çekirdeği hedefler ve AAV2 retro ile sarılmış retrograd izleme için uygundur. smFP_HA yapı, hücre gövdesi tespiti (ve retrograd) için iyidir.
Ek Video: Meninkslerin çıkarılmasının mikroskop görünümü. Bu videoyu indirmek için lütfen buraya tıklayın.
Tartışmalar
Bu makale, tüm beyin işleme için marmoset beyinlerini işlemek için pratik çözümlerin yanı sıra STPT tekniğinin faydasını artıran yardımcı histolojik teknikleri açıklamıştır. STPT kullanarak "tüm beyin nöroanatomisi" nin gücü, anatomik olarak açıklamalı olsun ya da olmasın, herhangi bir ilgi alanının 3D koordinatlarını elde edebilmenizdir. Yüksek hassasiyetli 3D'den 3D'ye kayıt ile, bu koordinatları birden çok veri kümesinin üst üste bindirilmesi için standart bir şablona dönüştürmek mümkündür. Bu şekilde, standart şablon, veri tümleştirme aracı olarak hizmet eder. Bu, birçok kişiden elde edilen verilerin analiz edildiği prefrontal korteks (PFC) haritalama projemiz10'un önemli bir yönüydü. Ayrıca, standart şablona eşlenen bilgiler, Nissl, miyelin desenleri, izleyici verileri, MRI (difüzyon MRI dahil) verileri veya anatomik açıklamalar11 olsun, önceden eşlenmiş çeşitli verilerle karşılaştırılabilir. Daha da önemlisi, henüz ortaya çıkmamış teknoloji tarafından elde edilecek gelecekteki verilerle de karşılaştırılabilir. Şu anda marmoset beyni için Nissl boyama23, MRI 23,24,25,26,27,28 ve STPT11'e dayanan birden fazla şablon bulunmaktadır. Ancak görüntü kontrastlarına ve önceden hesaplanmış parametrelere11 dayalı olarak birbirlerinin koordinatlarına dönüştürülebilirler. Çalışmalar arasında tüm beyin ölçeğinde veri entegrasyonu, beynin bir sistem olarak daha iyi anlaşılmasına katkıda bulunur. Bu stratejinin işe yaraması için ön koşul, beyinde güvenilir veri toplanmasıdır. Aşağıda, mevcut protokolle ilgili kritik adımlar ve olası sorunlar tartışılmaktadır.
STPT görüntülemenin en hassas işlemlerinden biri doku dilimlemedir. Yukarıda bahsedildiği gibi, meninksler genellikle kesilmeden kalır ve dilimlemeye müdahale edebilir. Özellikle, pulvinar çekirdek ve superior colliculus en çok etkilenen iki beyin bölgesidir: meninksin çıkarılması ve agaroza gömülmesinin titizliğine bağlı olarak, dilimleme sırasında doku bloğundan sıyrılabilirler. Bu derin bölgelere dışarıdan yaklaşmak zordur ve meninks çıkarılması sırasında kolayca kırılabilir. Başarılı bir görüntüleme için dikkatli ama kapsamlı bir meninks çıkarılması kritik öneme sahiptir. Diğer bir endişe, dilimlenmiş bölümlerin doku bloğuna geri çevrilmesidir, bu da bazen bölümler dilimlemeden sonra bile bağlı kaldığında ortaya çıkar. Bloğu, bıçak en sonunda eğik olarak kesecek şekilde şekillendirerek en aza indirilebilir.
STPT, doku bloğunun derinliklerini görüntüleyerek yüzeyinin pürüzlülüğünü önler. Floresan sinyaller kortikal bölgeden oldukça kolay geçebilirken, miyelinli bölgelerde oldukça azalır. Bu nedenle, tüm blok yüzeyi boyunca tutarlı görüntüleme ile beyaz madde gibi miyelin açısından zengin bölgedeki sinyallerin parlaklığı arasında denge kurmak için görüntüleme derinliğinin dikkatli bir şekilde belirlenmesi gerekir. Burada kullanılan kurulumda genellikle yüzeyden 25-35 μm yükseklikte hedefleriz. Ayrıca, uzun saatler boyunca saklandıktan sonra kesilen yüzeyin eşit olmayan şekilde küçülebileceğine dikkat edilmelidir. Görüntüleme alanını en aza indirmek için görüntüleme seansını 5-6 gün boyunca farklı aşama ayarlarıyla 20-30 koşuya bölüyoruz. Ya koşular arasındaki aralığı 2 saatten daha az yaparız ya da yüzey derinliğini onaylar ve her çalıştırmadan önce sahne yüksekliğini ayarlarız.
Bu protokolde, BDA sinyali TSA yöntemi ile güçlendirildi. Bu yöntem oldukça etkilidir ve nispeten düşük çözünürlükte bile anterograd olarak taşınan BDA sinyallerini tespit edebilir (örneğin, Şekil 6B). TSA biotin, Akoya Biosciences'tan ticari olarak temin edilebilir, ancak ev yapımı çözelti çok daha iyi bir gelişme gösterir. Öte yandan, antikorun ve çözeltinin seyreltilmesi, en iyi sonucu elde etmek için dikkatli bir ayarlama gerektirir. Bölümün bir metanol çözeltisi ile ön muamelesi kritiktir. Ön işlem olmadan, BDA sinyalleri miyelinli aksonlarda zar zor tespit edilir.
Bir anterograd izleyici kullanıldığında, floresan sinyallerinin doygunluğu nedeniyle enjeksiyonun tam yerini belirlemek genellikle zordur. Bu çalışmada kullanılan tüm doku görüntüleme sistemi kurulumunda, enfekte olmuş hücreleri tanımlamak için mavi kanalı kullanıyoruz (Şekil 5I). Kırmızı ve yeşil kanallar doymuş olsa bile, enfekte olmuş her bir nöron genellikle mavi kanalda tespit edilebilir. Bu aynı zamanda Allen Mouse Brain Connectivity Atlas1 için de geçerlidir. Orijin hücrelerin incelenmesi önemlidir, çünkü enfeksiyon bazen sadece belirli katmanları içerir. Belki de iyontoforez yönteminin29 kullanılması nedeniyle, Fare Beyin Bağlantı Atlası için bu tür kısmi enfeksiyonlarla oldukça sık karşılaştık. Viral izleyicilerin yanal yayılımı, enjeksiyonlara bağlı olarak az ya da çok değişken olabilir. Bu değişkenlik, izlemenin sonucunu potansiyel olarak etkileyebilir ve dikkatli bir normalleştirme gerektirir.
Elde edilen 3D görüntünün standart şablona başarılı bir şekilde kaydedilmesi, tüm beyin nöroanatomisinin önemli bir sürecidir. STPT görüntüsünün STPT şablonuna kaydedilmesi oldukça doğru olabilir ve yüksek görüntü kontrastı10 olan kenarlıklar için yalnızca birkaç voksel (50 μm izokübik) sapmalar gözlemledik. Yine de, kaydın yapabileceklerinin bir sınırı vardır. Meninks çıkarma işlemi nedeniyle, STPT örnekleri genellikle hemisferler arasında ve korteks ile orta beyin / arka beyin arasında boşluklara sahipken, beyin dokuları in vivo MRI görüntülerinde sıkıca paketlenir. Bu tür farklılıkların kayıt ile ayarlanması zordur. Marmoset korteksi çoğunlukla sulkustan yoksundur, ancak intraparietal sulkus bazı kişilerde çok derindir. Böyle bir sulkus, kayıt sırasında kaybolacaktır (yukarıdan yukarıya füzyon meydana gelir). Kayıt güçlü bir teknik olmasına rağmen, elde edilen sonucun doğrulanması için ham verilere geri dönmek gerekir.
Büyük görüntü verilerinin üretilmesi, bu tekniğin hem bir gücü hem de bir sınırlamasıdır. Veri kümesinin eksiksizliğini artırırken, elde edilen verilerin dikkatli bir şekilde yönetilmesini ve verimli veri yorumlaması için otomatik bir görüntü işleme hattının geliştirilmesini gerektirir. Gelecekte, görüntü işleme boru hatlarının oluşturulmasında üretken yapay zekanın (AI) uygulanması bu süreci önemli ölçüde basitleştirebilir. Sistematik tüm beyin görüntülemesi de slayt tarayıcı tabanlı yöntemler kullanılarak gerçekleştirilmiştir21,30. Bu tür yöntemlerle karşılaştırıldığında, STPT, 3D rekonstrüksiyon için ek hesaplama gerektirmez. Optik kesitleme ile birlikte, STPT'nin31. bölümler boyunca akson segmentlerini bile yeniden yapılandırma potansiyeline sahip olduğunu gösterdik. Doku temizleme tekniklerinin daha fazla kombinasyonu ile Economo ve ark. seyrek olarak işaretlenmiş nöronların tamamını görüntülemek için bir yöntem geliştirdi32,33. TissueCyte'ın en son sürümleri artık kırmızı floresan proteinlerin uyarılmasını artırmak için ek bir lazer veya bölümlerin otomatik olarak geri kazanılması için bir kesit yakalama ünitesi için seçenekler sunuyor. Bu gelişmelerle birlikte, tüm beyin yaklaşımı daha verimli hale gelecek ve insanlarınki de dahil olmak üzere primat beyninin kapsamlı bir şekilde anlaşılması için bir temel sağlayacaktır.
Açıklamalar
Yazarların ifşa edecek hiçbir şeyi yok.
Teşekkürler
Yamamori laboratuvarı ve hayvan tesislerindeki (RRD) teknik personele yardımları için derinden teşekkür ederiz. Konfokal görüntü yakalama konusundaki teknik yardımı için RIKEN CBS-Olympus İşbirliği Merkezi'ne teşekkür ederiz. Bu çalışma, MEXT, Japonya'dan Yenilikçi Alanlarda Bilimsel Araştırma programı (hibe numarası 22123009), AMED, Japonya'dan Brain/MINDS ve Brain/MINDS2.0 (JP15dm0207001, JP23wm0625001 ve JP24wm0625218) ve JSPS KAKENHI Hibe Numarası 24K09678 tarafından AW tarafından desteklenmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Agarose type I | Sigma | A6013 | |
| All-in-one fluorescence microscope | Keyence | BZ-X series | This study used BZ-X710 |
| anti-mouse Cy3 | Jackson Immuno Research Laboratories, Inc. | 115-165-003 | |
| anti-myc antibody | MBL | M192 | mouse monoclonal |
| Butorphanol | Meiji Animal Health | Vetorphale | |
| Ceramic blade | TissueVision | N/A | |
| Collagenase type I | Wako Chemical | #031-17601 | Aliquot into 100 µL x 10 of 100 mg/mL in PBS |
| Cotton swab (HUBY-340) | HUBY | BB-013SP | micro cotton swabs |
| Custom-made chamber | N/A | N/A | The chamber consist of four side plates and one bottom plates, all made of 1 cm thick acrylic plates, which can be securely fastened together using screw bolts. An additional acrylic plate is placed inside the chamber, with three metal poles inserted through it to hold the marmoset brain in an inverted position. |
| Cy3-Streptavidin | Jackson Immuno Research Laboratories, Inc. | 016-160-084 | |
| Dumont #5 forceps, Inox | N/A | N/A | |
| Epoxy instant mix | Locktite | N/A | |
| FIJI | NIH | https://imagej.net/software/fiji/downloads | |
| kn_pipeline_check_mosaic.py | N/A | N/A | github.com/watkarbey/STPT_depo; This is a checking script for TissueCyte data. |
| Medetomidine | Zenoaq | Domitor | |
| Midazolam | Sandoz | N/A | |
| NaBH4 | Sigma | #452882 | |
| NaIO4 | Sigma | S1878 | |
| Perfusion needle | Natsume Seisakusho Co., Ltd | KN-348, 20G-50 | |
| Slideglass (76 mm x 52 mm) | Matsunami | S9111 | |
| StAvHRP | Jackson Immuno Research Laboratories, Inc. | 016-030-084 | HRP-streptavidin (titration needs to be carefully determined) |
| TissueCyte1000 | TissueVision | https://www.tissuevision.com/tissuecyte | |
| TSA blocking reagent | Kiko Tech | FP1012 | Refer to TSA-biotin kit (Akoya Biosciences) |
| TSA-biotin | House-made | N/A | See Okamoto et al (ref. 16) |
| VECTASHIELD HardSet Mounting Medium | Vector laboratories Inc | N/A | Antifade mounting medium |
Referanslar
- Oh, S. W., Harris, J. A., Ng, L., Winslow, B., Cain, N., et al. A mesoscale connectome of the mouse brain. Nature. 508 (7495), 207-214 (2014).
- Ragan, T., et al. Serial two-photon tomography for automated ex vivo mouse brain imaging. Nat Methods. 9 (3), 255-258 (2012).
- Liang, Z., Arefin, T. M., Lee, C. H., Zhang, J. Using mesoscopic tract-tracing data to guide the estimation of fiber orientation distributions in the mouse brain from diffusion MRI. Neuroimage. 270, 119999(2023).
- Watakabe, A., Hirokawa, J. Cortical networks of the mouse brain elaborate within the gray matter. Brain Struct Funct. 223 (8), 3633-3652 (2018).
- Ypma, R. J. F., Bullmore, E. T. Statistical analysis of tract-tracing experiments demonstrates a dense, complex cortical network in the mouse. PLoS Comput Biol. 12 (9), e1005104(2016).
- Wang, Q., et al. The Allen mouse brain common coordinate framework: A 3D reference atlas. Cell. 181 (4), 936-953.e20 (2020).
- Köbbert, C., Apps, R., Bechmann, I., Lanciego, J. L., Mey, J., Thanos, S. Current concepts in neuroanatomical tracing. Prog Neurobiol. 62 (4), 327-351 (2000).
- Lanciego, J. L., Wouterlood, F. G. Neuroanatomical tract-tracing techniques that did go viral. Brain Struct Funct. 225 (4), 1193-1224 (2020).
- Bakker, R., Wachtler, T., Diesmann, M. CoCoMac 2.0 and the future of tract-tracing databases. Front Neuroinform. 6, (2012).
- Watakabe, A., et al. Local and long-distance organization of prefrontal cortex circuits in the marmoset brain. Neuron. 111 (14), 2258-2273.e10 (2023).
- Skibbe, H., et al. The Brain/MINDS marmoset connectivity resource: An open-access platform for cellular-level tracing and tractography in the primate brain. PLoS Biol. 21 (6), e3002158(2023).
- Mitchell, J. F., Leopold, D. A. The marmoset monkey as a model for visual neuroscience. Neurosci Res. 93, 20-46 (2015).
- Okano, H. Current status of and perspectives on the application of marmosets in neurobiology. Annu Rev Neurosci. 44, 27-48 (2021).
- Watakabe, A., et al. Comparative analyses of adeno-associated viral vector serotypes 1, 2, 5, 8 and 9 in marmoset, mouse and macaque cerebral cortex. Neurosci Res. 93, 144-157 (2015).
- Hata, J., et al. Multi-modal brain magnetic resonance imaging database covering marmosets with a wide age range. Sci Data. 10, 221(2023).
- Liwang, J. K., Bennett, H. C., Pi, H. -J., Kim, Y. Protocol for using serial two-photon tomography to map cell types and cerebrovasculature at single-cell resolution in the whole adult mouse brain. STAR Protoc. 4 (1), 102048(2023).
- Okamoto, S., et al. Exclusive labeling of direct and indirect pathway neurons in the mouse neostriatum by an adeno-associated virus vector with Cre/lox system. STAR Protoc. 2 (1), 100230(2021).
- Viswanathan, S., et al. High-performance probes for light and electron microscopy. Nat Methods. 12 (6), 568-576 (2015).
- Kuan, L., et al. Neuroinformatics of the Allen mouse brain connectivity atlas. Methods. 73, 4-17 (2015).
- Paxinos, G., Watson, C., Petrides, M., Rosa, M., Tokuno, H. The Marmoset Brain in Stereotaxic Coordinates. , Academic Press. London, Waltham, MA. (2012).
- Abe, H., et al. 3D reconstruction of brain section images for creating axonal projection maps in marmosets. J Neurosci Methods. 286, 102-113 (2017).
- Wan, Y., et al. FluoRender: Joint freehand segmentation and visualization for many-channel fluorescence data analysis. BMC Bioinformatics. 18 (1), 280(2017).
- Majka, P., et al. Towards a comprehensive atlas of cortical connections in a primate brain: Mapping tracer injection studies of the common marmoset into a reference digital template. J Comp Neurol. 524 (11), 2161-2181 (2016).
- Liu, C., Yen, C. C. -C., Szczupak, D., Tian, X., Glen, D., Silva, A. C. Marmoset brain mapping V3: Population multi-modal standard volumetric and surface-based templates. Neuroimage. 226, 117620(2021).
- Liu, C., et al. A digital 3D atlas of the marmoset brain based on multi-modal MRI. Neuroimage. 169, 106-116 (2018).
- Liu, C., et al. A resource for the detailed 3D mapping of white matter pathways in the marmoset brain. Nat Neurosci. 23 (2), 271-280 (2020).
- Woodward, A., et al. The Brain/MINDS 3D digital marmoset brain atlas. Sci Data. 5, 180009(2018).
- Saleem, K. S., Avram, A. V., Glen, D., Schram, V., Basser, P. J. The subcortical atlas of the marmoset ("SAM") monkey based on high-resolution MRI and histology. Cereb Cortex. 34 (4), bhae120(2024).
- Watakabe, A., Hirokawa, J. Cortical networks of the mouse brain elaborate within the gray matter. Brain Struct Funct. 223 (8), 3633-3652 (2018).
- Lin, M. K., et al. A high-throughput neurohistological pipeline for brain-wide mesoscale connectivity mapping of the common marmoset. eLife. 8, e40042(2019).
- Skibbe, H., et al. PAT-probabilistic axon tracking for densely labeled neurons in large 3-D micrographs. IEEE Trans Med Imaging. 38 (1), 69-78 (2019).
- Economo, M. N., et al. A platform for brain-wide imaging and reconstruction of individual neurons. eLife. 5, e10566(2016).
- Winnubst, J., et al. Reconstruction of 1,000 projection neurons reveals new cell types and organization of long-range connectivity in the mouse brain. Cell. 179 (1), 268-281.e13 (2019).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır