Method Article
Серийная двухфотонная томография всего мозга мартышки для нейроанатомического анализа
В этой статье
Резюме
Серийная двухфотонная томография (STPT) — это метод визуализации массы ткани в ее трехмерной форме путем сочетания двухфотонной визуализации с автоматическим контролем сцены и микротомным срезом. Здесь мы опишем протокол его реализации для мозга мартышек, чтобы лучше понять их структурные особенности.
Аннотация
Серийная двухфотонная томография (STPT) — это метод визуализации массы ткани в ее трехмерной форме путем сочетания двухфотонной визуализации с автоматическим контролем этапа и микротомным срезом. Мы успешно реализовали эту методику для отслеживания аксональных проекций в мозге мартышки. Здесь подробно описаны экспериментальные процедуры, которые привели к надежной объемной визуализации всего мозга мартышки. Ключевым процессом для успешной визуализации было удаление мозговых оболочек, окружающих мозг, которые мешают срезу. Большим преимуществом данной методики является то, что срезанные срезы можно использовать для дополнительного окрашивания. В оригинальной конфигурации нарезанные участки взбиваются на водяной бане. Эти участки могут быть правильно выровнены в их первоначальном порядке в соответствии с расположением кровеносных сосудов в коре головного мозга. Примером эффективной гистологии является визуализация структуры миелина с помощью простого отражения света, которое можно сочетать с окрашиванием по Нисслю для определения анатомических границ. Эти разделы также могут быть использованы для иммунологического обнаружения нефлуоресцентных антероградных и ретроградных индикаторов, которые могут быть зарегистрированы в данных STPT для наслоения нескольких данных.
Введение
В нейроанатомических исследованиях исследователи сталкиваются с необходимостью наблюдения за структурами микрометрового порядка (например, аксонами и бутонами) в контексте всего мозга. К решению этой сложной задачи обычно прибегают путем визуального осмотра серийных срезов и поиска области интереса для детальной визуализации, анализа и фотосъемки. Однако с развитием технологий становится возможным получать изображения всего мозга в высоком разрешении для анализа всего мозга. В новаторском исследовании, проведенном Oh et al.1, сотни мозгов мышей получили инъекции индикаторов для коннектомного анализа, которые были обработаны спомощью метода серийной двухфотонной томографии (STPT). Особенностью этого исследования было то, что они выбрали антероградные индикаторы для количественной оценки «связности». В то время как антероградные индикаторы предоставляют очень подробную пространственную информацию о распределении аксонов, нейроанатомы полагаются на трудоемкую ручную сегментацию для ее анализа. Автоматизировав различные аналитические процедуры, в том числе и этот этап сегментации, они добились успеха в «массовом производстве» готовых к использованию данных трассеров с высоким разрешением для многоцелевого использования. Эффективность их подхода очевидна, учитывая множество исследований, в которых использовались данные индикаторов 3,4,5 и их стандартный мозг6.
Исторически сложилось так, что нейронные связи мозга приматов привлекали внимание многих нейроанатомов с момента разработки метода дегенерации в 1950-х годах, до методов транспортировки антероградных/ретроградных веществ в 1970-х годах и до современной вирусной стратегии 7,8. Таким образом, существует огромное количество литературы, в которой исследуются нейронные связи приматов. В частности, многие исследователи исследовали сложные кортикокортикальные связи мозга макак, и их результаты были отобраны для составления таблиц (например, CoCoMac9). Несмотря на свою полезность, эти классические исследования имели ряд ограничений. Во-первых, поскольку каждое исследование фокусируется только на ограниченных областях мозга, полученная информация неизбежно становится фрагментарной. Во-вторых, в каждом исследовании используются разные методы и условия. Таким образом, количественная оценка исследований становится сложной. В-третьих, связность обычно отображается либо в виде объектива камеры репрезентативных сечений, либо в виде полуколичественной таблицы/графика для областей мозга, определенных автором. Другими словами, только очень ограниченная информация из сложной структуры мозга извлекается для представления в опубликованной литературе. С развитием методов магнитно-резонансной томографии (МРТ) исследования всего мозга с низким разрешением стали заметными. Тем не менее, существует большой разрыв между уровнями детализации между тем, что мы знаем о нейронных связях у мышей и у приматов.
Имея в виду эти предпосылки, мы решили провести всестороннее антероградное отслеживание мозга обыкновенных игрунок10,11. Несмотря на то, что мозг мартышки намного меньше и гладче, чем мозг мартышки, он демонстрирует явные признаки приматов, такие как наличие области MT и зернистых префронтальных областей, ни один из которых четко не выражен у грызунов12,13. Здесь большим преимуществом был небольшой размер, потому что даже мозг мартышки весит в десять раз больше, чем мозг мыши. К счастью, мы смогли получить изображение всего мозга мартышки с минимальными обновлениями оригинальной версии операционного программного обеспечения TissueCyte1000 (далее именуемой системой визуализации целых тканей) — коммерчески доступного микроскопа для STPT imaging2. Это обновление должно было обеспечить дополнительное перемещение сцены перед нарезкой. Текущая версия теперь достаточна для обработки мозга мартышки. В этой статье описывается протокол обработки мозга мартышек для визуализации STPT. Также предусмотрен протокол поствизуализации, который еще больше повышает полезность этого метода.
протокол
Все экспериментальные процедуры проводились в соответствии с Руководством Национального института здравоохранения по уходу за лабораторными животными и их использованию (публикации NIH No 80-23), пересмотренными в 1996 году, и «Руководящими принципами ухода за животными и их использования в области физиологической науки» Японского физиологического общества, а также были одобрены Комитетом по экспериментальным животным RIKEN (W2020-2-009(2)).
1. Впрыск трассера
- Выполнение инъекций флуоресцентных и нефлуоресцентных индикаторов в мозг мартышки в соответствии с ранее описанными процедурами14.
- Что касается комбинации с методом STPT, убедитесь, что флуоресценция индикаторов достаточно сильна, чтобы ее можно было обнаружить без усиления. Используйте двухвекторную систему TET-Off10 для улучшения экспрессии.
ПРИМЕЧАНИЕ: Нефлуоресцентные индикаторы также могут быть введены и обнаружены после проведения STPT с использованием полученных срезов. Примерами нефлуоресцентных индикаторов являются биотинилированный декстранамин (BDA), кре-экспрессирующие AAV в AAV2 retro для ретроградного детектирования ядер входных клеток10, а также AAV на основе smFP-tag на основе GFP (см. ниже).
- Что касается комбинации с методом STPT, убедитесь, что флуоресценция индикаторов достаточно сильна, чтобы ее можно было обнаружить без усиления. Используйте двухвекторную систему TET-Off10 для улучшения экспрессии.
- Перфузионное исправление и получение мартышки мозга через 4 недели.
- Чтобы обезболить мартышку, введите внутримышечно медетомидин (0,04 мг/кг), мидазолам (0,4 мг/кг) и буторфанол (0,4 мг/кг), называемые MMB, с последующим внутрибрюшинным введением тиопентала натрия (100 мг/кг).
- После подтверждения того, что болевой рефлекс утерян, разрежьте грудную полость, чтобы обнажить сердце, и перережьте правое предсердие, чтобы позволить крови и фиксатору выйти наружу.
- Затем разрезать левый желудочек для введения перфузионной иглы для предварительного промывания крови префиксным раствором (250 мМ сахарозы, 5 мМ MgCl2 в 0,02 М фосфатном буфере [PB, pH 7,4]) в течение нескольких минут (~50-100 мл) с последующей фиксацией 4% параформальдегидом/0,1 М фосфатным буфером (PB; в 2-3 раза больше веса животного в течение ~20 мин).
- Хорошая перфузия имеет решающее значение для хорошего результата. При введении перфузионной иглы продвигайте ее вдоль перегородки по направлению к аорте, чтобы обеспечить хороший отток фиксатора. Кончик иглы становится видимым, когда она достигает аорты. Втягивайте до тех пор, пока кончик не станет едва заметным, чтобы он не обходил сонную артерию.
- Держите мозг в концентрации параформальдегида 4% / 0,1 М ПБ в течение 48 ч при 4 °C и перенесите на 50 мМ ПБ. Если не использовать сразу, храните мозг в 0,75% глицине/0,1 М PB, чтобы предотвратить аутофлуоресценцию из-за чрезмерной фиксации.
2. Подготовка образца (Рисунок 1)
- Инкубируйте фиксированный мозг коллагеназой (1 мг/мл в 3 мМ CaCl,2 в 10 мл трис-буферизованного физиологического раствора [TBS]) при 37 °C в течение 1 ч.
ПРИМЕЧАНИЕ: Разогрейте мозг при 37 °C в течение 5 минут перед инкубацией. - Осторожно протрите поверхность мозга ватным тампоном, чтобы отклеить вещество пиа и другие мозговые оболочки (Рисунок 1А, Дополнительное видео). С помощью тонких щипцов отшелушите отслоившиеся мозговые оболочки.
ПРИМЕЧАНИЕ: Важно удалить мозговые оболочки, окружающие средний мозг, в том числе верхний холмик или те, которые находятся в верхней части таламуса. Сложно обнажить эти структуры, которые скрыты глубоко внутри. Тем не менее, удалите мозговые оболочки как можно больше. В противном случае они часто остаются неразрезанными, всплывают вверх и мешают визуализации и нарезке (рисунок 2A). - Будьте особенно осторожны, когда мозг подвергается МРТ ex vivo перед внедрением, во время которого мозг погружается в раствор фтора15. Оставшийся фтор, если его соединить, может образовывать крошечные пузырьки воздуха под объективом во время визуализации. Чтобы этого избежать, держите мозг в PB в течение 1 недели перед внедрением.
ПРИМЕЧАНИЕ: Этот шаг ожидания обычно не является необходимым, но имеет решающее значение в сочетании с МРТ ex vivo . - Приготовьте буфер NaBH4, растворив 0,2 г NaBH4 в 100 мл 50 мМ боратного буфера (pH 9,2), нагретого до 40°C. Не закрывайте крышку, чтобы выпустить газ CO2 . Оставьте раствор на ночь, ослабив крышку. Заверните бутылку в алюминиевую фольгу, чтобы защитить ее от света до использования.
- Окисленную агарозу приготовить, размешивая 2,25 г агарозы и 0,21 г NaIO4 в 100 мл ПБ в течение 2-3 ч. Отфильтруйте раствор с помощью вакуумного отсоса и промойте его с тремя сменами ПБ. Повторно суспендируйте агарозу в 50 мл PB.
- Полностью растопите агарозу в микроволновой печи и остудите до 60-65 °С.
- Поместите мозг в специально изготовленную камеру и вставьте мозг в агарозу. Позаботьтесь о том, чтобы ввести агарозу в полость ниже мозолистого тела (рисунок 1Б).
ПРИМЕЧАНИЕ: Предварительно разогрейте мозг сначала при комнатной температуре, а затем при 65 °C в течение 5 минут, чтобы агароза осела на поверхности мозга без затвердевания. - Разберите камеру и погрузите агарозный блок в буфер NaBH4 на ночь при температуре 4 °C.
- Меняйте буфер на PB несколько раз в течение 1-2 недель при 4 °C.
ПРИМЕЧАНИЕ: Тканевая автофлуоресценция становится очень слабой, если буферный обмен неполный. - Сделайте стеклянную сцену, присоединив четыре неодимовых магнита с эпоксидной мгновенной смесью.
- Закрепите агарозный блок на сцене с помощью прочного клея (например, суперклея) (Рисунок 1C).
3. Обработка тканей
- Работайте со всей системой визуализации тканей в соответствии с инструкциями производителя. Также опубликован подробный протокол16. Данная процедура в основном используется для TissueCyte1000, но может быть применена и к другим моделям, таким как TissueCyte 1600FC.
- Операция в разных моделях немного отличается, но следуйте приведенным ниже пунктам, которые обычно важны.
- Весь мозг мартышки может быть обработан коронально от переднего до заднего конца без каких-либо изменений в аппаратном обеспечении. Следите за тем, чтобы при размещении мозга не превышались пределы движения рабочей области.
- Точно отрегулируйте угол наклона лопастей, чтобы глубина поверхности на обоих концах лопасти была в пределах 10 мкм. Из-за плотной миелинизации даже разница в глубине в 10 мкм может привести к различным лазерным проникновениям через белое вещество взрослой игрушки. По этой же причине установите плоскость изображения на расстоянии около 25-35 мкм от поверхности.
- Используйте керамическое лезвие (рекомендуется) для разрезания всего мозга с интервалом 50 μм (~более 650 срезов).
- Мозговые оболочки остаются неразрезанными и мешают нарезке, если их правильно не удалить (Рисунок 2). Некоторые мозговые оболочки (например, те, которые окружают гиппокамп или пульвинар) трудно удаляются. Вручную извлеките эти мозговые оболочки с помощью тонких щипцов, когда это заметите.
4. Вспомогательные гистологические методики
- Извлечение разделов
- Восстановите срезы тканей для выполнения различных гистологических окрашиваний. Точно выровняйте эти срезы в порядке нарезки. Проведите по кровеносным сосудам через корковые слои для выравнивания (Рисунок 3).
- Срежьте излишки агарозы с каждой секции для лучшего обращения.
ПРИМЕЧАНИЕ: Этот процесс не должен быть чрезмерным. Агароза служит для удержания сегментов ткани на месте, не мешая гистологической обработке. - Изображение с контровым светом
- Установите секции на предметное стекло и высушите.
- Увлажните секцию с помощью PBS и установите покровное стекло для визуализации.
- Наблюдайте за картиной миелинизации без окрашивания при визуализации среза с помощью флуоресцентного микроскопа (рис. 4) в светлопольном режиме. Отрегулируйте время экспозиции так, чтобы было видно отражение света.
ПРИМЕЧАНИЕ: Можно использовать любой микроскоп, если он может использовать освещение в темном поле. - Снимите покровное стекло и приступайте к окрашиванию по Nissl или любому другому окрашиванию. Достаточно любой стандартной процедуры окрашивания.
- Используйте этот метод для прямого сравнения различных моделей окрашивания с моделями миелинизации (рис. 4).
- Визуализация BDA
- Подробная процедура приведена в Таблице 1 .
- Сначала обработайте срезы раствором Дента (20% ДМСО, 80% метанол). Метанол, входящий в состав раствора Dent, значительно усиливает сигналы BDA в аксонах.
- Используйте метод усиления тирамидного сигнала (TSA) для усиления сигнала BDA, который должен быть обнаружен флуоресцентно17.
ПРИМЕЧАНИЕ: Раствор ТСА-биотина можно приобрести у поставщика, но реагент In-House намного дешевле и эффективнее. - Чтобы зарегистрироваться в образе STPT, сделайте изображение с подсветкой после установки секции на предметное стекло с монтажным носителем.
- Окрашивание флуоресцентным белком (smFP) Spaghetti Monster
ПРИМЕЧАНИЕ: Флуоресцентные белки (smFP) «спагетти-монстра» представляют собой семейство нефлуоресцентных вариантов GFP с несколькими эпитопными метками18. Они обеспечивают превосходные флуоресцентные сигналы при иммунологическом обнаружении и подходят в качестве сопутствующих индикаторов к флуоресцентным индикаторам. В таблице 2 приведены конструкции AAV, доступные в Addgene.- Следуйте подробной процедуре, приведенной в таблице 1.
5. Обработка данных после визуализации
- Тест на целостность данных
ПРИМЕЧАНИЕ: STPT генерирует огромное количество файлов изображений. Когда мозг взрослой игрунки коронально разрезается с интервалом 50 мкм, обычно требуется более 650 срезов, чтобы покрыть весь мозг. Данные каждого раздела состоят из серии изображений мозаики, захваченных в трех каналах. Эти файлы изображений хранятся в одной папке вместе с файлом метаданных, в котором записывается положение каждого листа. Чтобы свести к минимуму общий объем данных и время обработки, визуализация ведется блоками прогонов, в течение которых количество X и Y шагов для разбиения на листы постепенно меняется. Как правило, 20-30 блоков прогонов, каждый из которых содержит визуализацию 30-50 участков, составляют полный набор данных для одного мозга. Чтобы использовать эти данные, требуется несколько этапов обработки изображений, включая, среди прочего, сшивку мозаичных изображений, сегментацию флуоресцентных сигналов и регистрацию объемных данных в стандартном шаблоне.- Выполняйте этапы обработки изображений по отдельности с помощью различных программных инструментов или с помощью специальных конвейеров, адаптированных к конкретным потребностям исследователей. Детали обработки изображений выходят за рамки данной статьи и могут быть найдены в других публикациях11,19.
- Независимо от используемой процедуры, убедитесь, что данные организованы последовательно.
ПРИМЕЧАНИЕ: Поскольку весь процесс создания образов включает в себя множество блоков прогонов и длится несколько дней, нередки случаи, когда прогон отменяется на полпути и начинается заново. В таких случаях структура данных может быть нарушена, что препятствует правильному выполнению конвейера обработки изображений. - Чтобы свести к минимуму риск нарушения структуры данных, запустите скрипт Python для проверки целостности структуры данных (kn_pipeline_check_mosaic.py), доступной на GitHub (github.com/watkarbey/STPT_depo).
- Регистрация окрашенного изображения к образу STPT
ПРИМЕЧАНИЕ: Нелинейное преобразование окрашенного изображения в изображение STPT может быть выполнено с помощью плагина bUnwarpJ программы ImageJ.- Отрегулируйте размер изображений целевого (STPT) и исходного (окрашенного) изображений так, чтобы они были примерно равны.
- Бинаризуйте каждое изображение, чтобы визуализировать формы секций.
- Запустите bUnwarpJ. Не забудьте отметить опцию «Сохранить преобразования».
- Запустите bUnwarpJ снова. Выберите исходное изображение перед бинаризацией в качестве исходного изображения. Затем нажмите «Загрузить упругое преобразование» и выберите сохраненное преобразование.
Результаты
В типичной схеме, используемой здесь, весь мозг взрослой игрунки может быть визуализирован (рис. 5) с разрешением ~1,3 x 1,3 мкм/пиксель с интервалом сечения 50 мкм примерно за 1 неделю. Это составляет ~650 корональных изображений в трех каналах после сшивки изображений. С объективом 16x (Nikon 16xW CFI75 LWD; NA = 0,80), поле зрения одного снимка составляет около 1 х 1 мм. Изображение для всей корональной поверхности получается путем сшивания этих снимков (рис. 5А). Выравнивание в направлении Z отличное, и хорошее 3D-изображение получается путем простого наложения данных коронального изображения (рис. 5B, E). Для стандартизации можно использовать шаблон STPT для мозга11 мартышки для 3D-3D регистрации (рис. 5F). Это преобразование данных является одним из ключевых аспектов всей нейроанатомии мозга, в которой интересующей области присваивается абсолютная пространственная координата, не зависящая от анатомической аннотации. После того, как образец мозга зарегистрирован в стандартном пространстве, можно легко выделить интересующие его области для дальнейшего анализа (рис. 5F, G). В частности, области коры головного мозга могут быть преобразованы в плоскую карту с помощью заданного параметра (рисунок 5H).
Срезы, полученные во время визуализации, могут быть использованы для различных гистологических целей. Как показано на рисунках 4A, B, изображение с подсветкой без окрашивания дает рисунок, очень похожий на подлинное окрашивание миелином. Это может стать отличной альтернативой окрашиванию миелином. Кроме того, если изображение с подсветкой получено до окрашивания по Нисслю, то один и тот же участок может быть использован для получения узоров как миелинового, так и ниссльского окрашивания, что дает полезную информацию для идентификации областей и слоев (рис. 5C-E). Эти срезы также могут быть использованы для иммунологического окрашивания. На рисунке 5J срез вокруг центра инъекции был компенсирован антителом NeuN для оценки эффективности трансдукции вируса AAV. Также хорошей стратегией является введение нефлуоресцентных индикаторов в дополнение к флуоресцентным индикаторам и их гистологическое обнаружение после забора среза. В нашем предыдущем исследовании мы объединили антероградные зеленые индикаторы с ретроградным вектором «cre», который позже был обнаружен анти-cre антителом10. В примере на рисунке 6A-E BDA вводили в контралатеральную сторону зеленого индикатора (клевера) и флуоресцентно его обнаруживали. Обратите внимание, что красные сигналы BDA могут быть зарегистрированы на изображении TissueCyte и локализованы во всей координате мозга. В другом примере на рисунке 6F-I smFP-myc вводили в теменную область (рисунок 6G), в то время как зеленый индикатор вводили в лобную область. Таким образом, несколько индикаторов могут быть введены одному и тому же животному без вмешательства в визуализацию. Большим преимуществом использования участков STPT для дополнительного окрашивания является то, что взаимосвязь между флуоресцентными и нефлуоресцентными индикаторами может быть определена для одного и того же мозга. Таким образом, мы смогли определить взаимность кортикокортикальных проекций с высокой точностью10. Еще одним преимуществом является то, что 3D-координаты окрашенных участков могут быть сопоставлены с данными STPT, а затем со стандартным шаблоном. Таким образом, может не потребоваться использовать все извлеченные участки для окрашивания. Для лучшей интерпретации можно выбрать разделы для окрашивания, чтобы добавить дополнительный контекст к данным STPT.
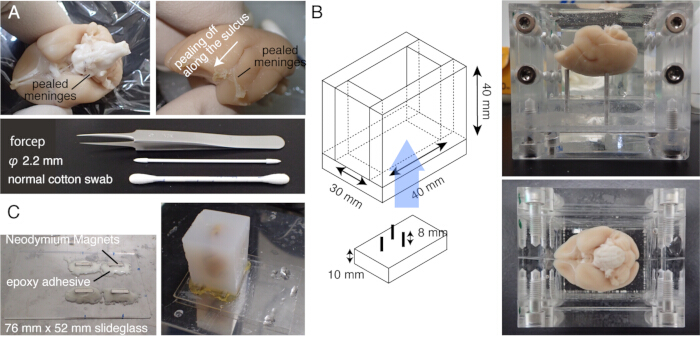
Рисунок 1: Подготовка образца для STPT. (A) Удаление мозговой оболочки с помощью ватных палочек. Мозговые оболочки, окружающие ствол мозга, могут быть удалены с помощью щипцов с тонким наконечником. Мозговые оболочки, окружающие мозг мартышки, удаляются вручную путем растирания ватными палочками. На фото показаны мозговые оболочки, отслаивающиеся изнутри боковой борозды. (В) Акриловая коробка, используемая для заделки агарозы. Штифты подвижны и используются для регулировки угла наклона мозга, чтобы он был близок к стереотаксически фиксированному положению20. (C) Магнитное стекло из стекла размером 76 мм x 52 мм и четырех неодимовых магнитов, прикрепленных эпоксидным клеем. Агарозный блок крепится к магнитному столику с помощью суперклея. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
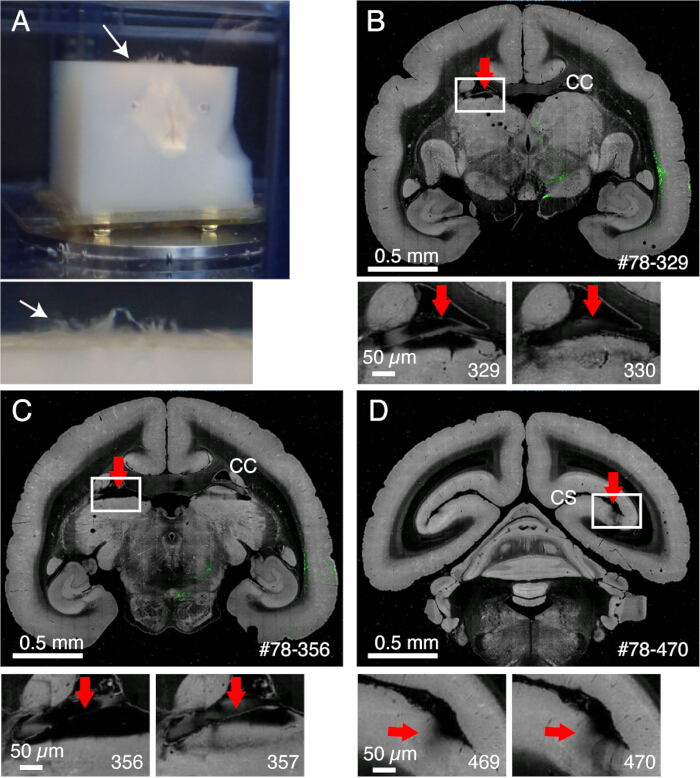
Рисунок 2: Влияние мозговых оболочек на визуализацию. (А) Мозговые оболочки, которые остаются неразрезаными, всплывают вверх, как показано белой стрелкой. В этом примере видна обширная выпячиваемость мозговых оболочек, поскольку они не были удалены перед внедрением агарозы. Обычно мозговые оболочки остаются неразрезанными только для нескольких сложных участков. (Б) Пример плохого среза из-за наличия мозговых оболочек между мозолистым телом и верхней частью таламуса. В этом случае плохая нарезка приводила к чередованию глубокого среза (329) и относительно нормального среза (330). #78-329 обозначает образец No 78 раздел No 329 на портале данных Brain/MINDS (C) Еще один пример плохой визуализации. В худшем случае пульвинарное ядро, показанное красной стрелкой, может полностью оторваться. Масштабные линейки: 0,5 мм (верхняя панель), 0,5 μм (нижняя панель). (D) Еще один пример плохого имиджа. Мозговые оболочки глубоко внутри пяточной борозды трудно удаляются. Тени, видимые на участках 469 и 470, вызваны плавающими оболочками, которые попали под цель. Масштабные линейки: 0,5 мм (верхняя панель), 0,5 μм (нижняя панель). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
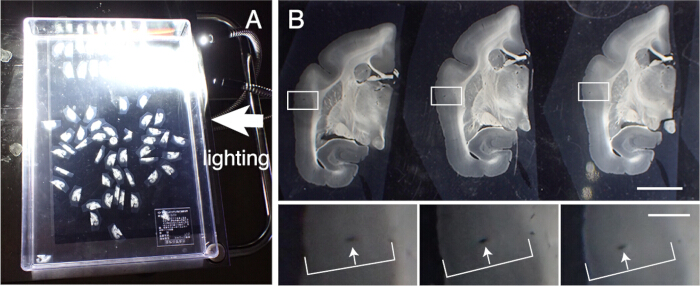
Рисунок 3: Выравнивание участков ткани по порядку. (A) До 50 корональных срезов мартышек могут быть правильно выровнены по порядку в пластиковом контейнере (31 см x 22,5 см). Чтобы визуализировать детализированные конструкции, контейнер помещают на черную бумагу и подсвечивают сбоку. Эти участки сначала грубо выравниваются по порядку, а затем подвергаются точному выравниванию. (B) Точное выравнивание использует кровеносный сосуд в качестве маркера. Кора головного мозга содержит множество кровеносных сосудов, которые проходят вертикально через корковые слои. Они идентифицируются как вытянутые отверстия, которые систематически меняют свое положение в пределах корковых слоев (белые стрелки). С помощью этого метода можно точно выровнять даже участки с интервалом 50 мкм. Эти отверстия в кровеносных сосудах могут быть идентифицированы на изображениях секции SPTP для подтверждения. Масштабная линейка: 5 мм (верхняя панель), 1 мм (нижняя панель). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
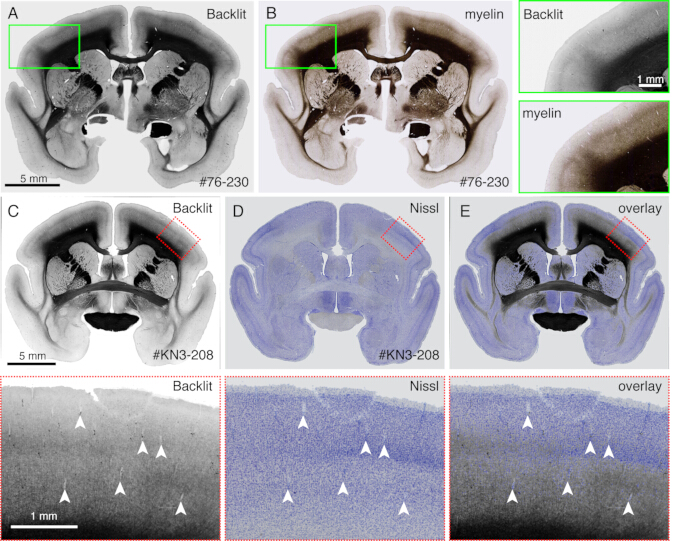
Рисунок 4: Изображение с подсветкой в качестве заменителя окрашивания миелином. (A,B) Идентичный участок использовался для изображения с подсветкой и окрашивания миелином. Сначала срез устанавливали на предметное стекло, сушили, регидратировали с помощью PBS, закрывали и визуализировали с помощью светового микроскопа (Table of Materials). После снятия покровного стекла тот же срез использовали для окрашивания миелином21 и визуализировали с помощью флуоресцентного микроскопа. Изображение с подсветкой регистрировалось на изображение миелина с помощью плагина bUnwarpJ компании ImageJ. В зеленых прямоугольниках показано увеличенное изображение каждого изображения. Обратите внимание, что на этих изображениях видны почти идентичные узоры, за исключением того, что окрашивание миелином лучше визуализирует фиброзные структуры. (К-Е) Идентичная секция использовалась для съемки с подсветкой и окрашивания по Нисслю. Низкопороговая маска для изображения с подсветкой сначала была зарегистрирована с низкопороговой маской для изображения Nissl с помощью плагина bUnwarpJ, а исходное изображение было преобразовано с помощью того же параметра. Обратите внимание, что кровеносные сосуды (белые стрелки) хорошо совпадают между двумя изображениями. Поскольку эти два изображения относятся к одному и тому же разделу, совпадение почти идеально, и можно напрямую сравнить паттерны миелина и Ниссля для идентификации корковых слоев. Масштабные линейки: 5 мм (панели А-Е). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
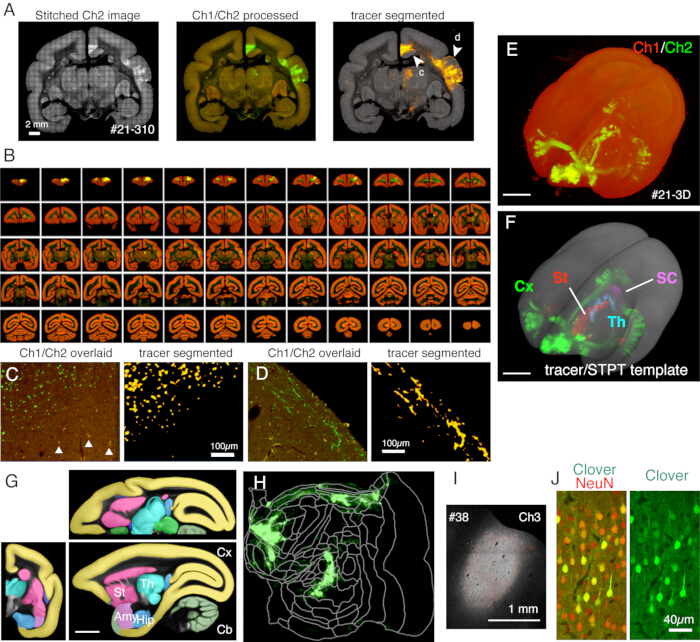
Рисунок 5: Типичный результат визуализации STPT. (A) Простое мозаичное изображение Ch2 (зеленого) на примере разреза (раздел 310 образца #21). Без коррекции фона видны границы для каждой плитки. В средней колонке плитки были сшиты с коррекцией фона для Ch1 (красный) и Ch2 (зеленый) соответственно. Чтобы уменьшить сигналы липофусцина (см. панель C), сигналы Ch1 вычитали из Ch2 и показывали зеленым цветом. Чтобы уменьшить липофусциновые сигналы Ch1, перед сшиванием с помощью ImageJ использовалась команда «Удалить аутилеры...». В правой колонке сигналы трассеров были сегментированы по конвейеру обработки изображений11. Стрелки (c, d) показывают места, где показаны увеличенные виды на панелях C и D. Масштабная линейка: 2 мм. (B) Обзор серийных разрезов для образца #21. STPT сгенерировал 635 изображений короны с высоким разрешением для этого образца. (C) Изображение с большим увеличением, показанное стрелкой c на панели A. Это простое наложение Ch1 (красный) и Ch2 (зеленый) без дальнейшей обработки. Треугольники показывают сигналы флуоресценции липофусцина, которые показывают широкий спектр. Алгоритм сегментации трассеров точно отличает сигналы трассеров от фона липофусцина, несмотря на очень похожую форму (правая панель). Масштабная линейка: 100 μм. (D) Еще один пример изображения с большим увеличением. Обратите внимание, что тонкие волокна аксонов в слое 1 могут быть хорошо заметны. Масштабная линейка: 100 мкм. (E) 3D-реконструкция исходных изображений STPT. 635 корональных изображений с низким разрешением, показанных на панели B, были использованы в качестве tiff-stack для 3D-визуализации с использованием флуорендера22. Масштабная линейка: 5 мм. (F) 3D-реконструкция сегментированных сигналов трассера, зарегистрированных в шаблоне STPT (серый). Сигналы индикаторов в разных областях мозга были показаны разными цветами. Эти области были вырезаны с помощью аннотации, показанной на панели G. Масштабная линейка: 5 мм. (G) Шаблон STPT, наложенный на аннотацию различных областей мозга. Масштабная линейка: 5 мм. (H) Сигнал кортикального трассера, показанный на панели F, был показан в виде плоской карты. (I) Идентификация места инъекции с помощью флуоресценции Ch3, которая менее чувствительна к флуоресценции индикатора и остается ненасыщенной. Масштабная линейка: 1 мм. (J) Окрашивание участка вокруг центра инъекции антителом NeuN показало, что примерно 30 % нейронов демонстрируют сильную экспрессию зеленой флуоресценции клевера. Масштабная линейка: 40 мкм. Сокращения: Cx; кора головного мозга, св. стриатум, Th; таламус, SC; Верхний холмистый. Эми; миндалевидное тело, бедро; гиппокамп, Cb; мозжечок. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
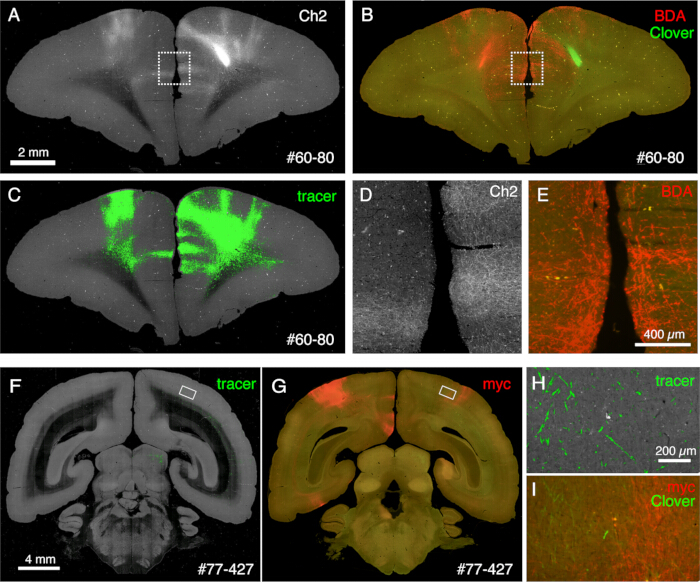
Рисунок 6: Гистология после STPT, показывающая множественные нефлуоресцентные индикаторы. (А-С) Сравнение STPT-изображения с BDA-окрашенным изображением. В этом образце BDA вводится в контралатеральную сторону впрыска клевера. На панелях A и C показано изображение Ch2 и сегментация трассеров данных STPT. На панели B показано окрашивание BDA после STPT. Флуоресценция клевера уменьшается из-за обработки разреза метанолом. Масштабная линейка: 2 мм. (D,E) Пунктирные прямоугольники на панелях A и B увеличены. Масштабная линейка: 100 мкм. (F,G) Сравнение STPT-изображения с окрашиванием антител anti-myc tag. В этом образце клевер вводится в ПФК, в то время как AAV-smFP-myc вводится в контралатеральную теменную кору. Белые прямоугольники увеличены на панелях H и I. Масштабная линейка: 4 мм. (H) Сегментация трассеров показана зеленым цветом. Масштабная линейка: 200 мкм. (I) Окрашивание myc показано красным цветом. Флуоресценция клевера показана зеленым цветом. Масштабная линейка: 200 μм. Зеленые сигналы на панелях H и I присутствуют в аналогичном положении, но не идентичны, потому что STPT извлекает только оптическое сечение ~10 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
| Протокол флуоресцентного окрашивания BDA | |
| Удаляем агарозу | |
| Промывка TBS | 10 мин (2 раза) |
| 1%Н2О2 в растворе Дента | 10 мин |
| Промывка TBS | Короткий |
| Блокировка TNB на 0,5% | 1 ч |
| StAvHRP (1:4000) в TNB | 2 ночевки |
| Промывка тротилом | 10 мин (3 раза) |
| TSA Биотин (1:4000) в 0,1 М борат (pH8,5) + 0,003% H2O2 | 2 ч |
| Промывка тротилом | 10 мин (3 раза) |
| Cy3-стрептавидин (1:1000) в тротиловом эквиваленте | 3 ч |
| Промывка тротилом | 10 мин (2 раза) |
| Промывка TBS | Сохраняйте секцию до монтажа |
| Установите секцию на скользящее стекло с помощью монтажного носителя, препятствующего выцветанию. | |
| Протокол флуоресцентного окрашивания против MYC | |
| Удаляем агарозу | |
| Промывка TBS | 10 мин (2 раза) |
| блокировка в IB | 1 ч |
| Anti-Myc (1:4000) в IB | 2 ночлег |
| Промывка тротилом | 10 мин (3 раза) |
| Антимышь Cy3 (1:1000) в тротиловом эквиваленте | 3 ч |
| Промывка тротилом | 10 мин (2 раза) |
| Промывка TBS | Сохраняйте секцию до монтажа |
| Установите секцию на скользящее стекло с помощью монтажного носителя, препятствующего выцветанию. | |
| Буферы/решения | Состав |
| 0,5% ТНБ | 0,5% блокирующий реагент TSA в TS7.5 |
| Решение Дента | 20% ДМСО, 80% Метанол |
| Погружной буфер (IB) | 10% FBS, 2% BSA 0,5% TritonX100 в TBS |
| TBS (Трис-буферизованный физиологический раствор) | 25 мМ Tris, 137 мМ NaCl, 2,7 мМ KCl (pH 7,4) |
| ТРОТИЛ | 0,05 % Tween20 в TS7.5 |
| ТС7.5 | 0,1 М TRIS-HCl, pH 7,5, 0,15 М NaCl |
Таблица 1: Протокол флуоресцентного окрашивания BDA и анти-myc флуоресцентного окрашивания
| Плазмида для трассера AAV | Addgene No. | Рекомендуемые антитела | Рекомендуемое разведение | Ожидаемый результат |
| pAAV-EF1_Cre | 201198 | Клон Millipore 2D8 | 1:1000 | Хорошо для клеток |
| pAAVCam1.3_smFP_Myc | 201205 | MBL M192 My3 (мышь) | 1:4000 | Отлично |
| pAAVCam1.3_smFP_HA | 201206 | CST C29F4 (кролик) | 1:1000 | Хорошо для клеток |
| pAAVCam1.3_smFP_FLAG | 201207 | MBL PM020B (кролик) | 1:1000 | ХОРОШО |
| AAVTRE3_smFP_Myc | 201208 | |||
| AAVTRE3_smFP_HA | 201209 | |||
| AAVTRE3_smFP_FLAG | 201210 |
Таблица 2: Список плазмид Addgene, доступных для производства нефлуоресцентных индикаторов. Конструкция cre нацелена на ядро и подходит для ретроградной трассировки с оболочкой AAV2 retro. smFP_HA конструкция хороша для обнаружения тела клетки (и ретрограда).
Дополнительное видео: Микроскоп для удаления мозговых оболочек. Пожалуйста, нажмите здесь, чтобы скачать это видео.
Обсуждение
В этой статье объясняются практические решения для работы с мозгом мартышек для обработки всего мозга, а также вспомогательные гистологические методы, которые повышают полезность метода STPT. Сила «нейроанатомии всего мозга» с использованием STPT заключается в том, что вы можете получить 3D-координаты любой интересующей области, независимо от того, анатомически она аннотирована или нет. С помощью высокоточной регистрации 3D-to-3D можно преобразовать эти координаты в стандартный шаблон для наложения нескольких наборов данных. Таким образом, стандартный шаблон служит средством интеграции данных. Это был важный аспект нашего проекта картирования префронтальной коры (ПФК)10, в котором анализировались данные, полученные от многих людей. Кроме того, информация, сопоставленная со стандартным шаблоном, может быть сопоставлена с различными данными, которые уже были отображены, будь то данные по шкале Ниссля, миелиновые паттерны, данные индикаторов, данные МРТ (включая диффузионную МРТ) или анатомические аннотации11. Важно отметить, что его также можно сравнить с будущими данными, которые будут получены с помощью еще не появившихся технологий. В настоящее время существует несколько шаблонов для мозга мартышки, которые основаны на окрашивании по Нисслю23, МРТ23, 24, 25, 26, 27, 28 и STPT11. Но они могут быть преобразованы в координаты друг друга на основе контрастов изображения и заранее рассчитанных параметров11. Интеграция данных в масштабах всего мозга в разных исследованиях способствует лучшему пониманию мозга как системы. Предпосылкой для работы этой стратегии является надежный сбор данных по всему мозгу. Ниже обсуждаются важнейшие шаги и потенциальные проблемы, связанные с текущим протоколом.
Одним из наиболее уязвимых процессов визуализации STPT является срез тканей. Как уже упоминалось выше, мозговые оболочки часто остаются неразрезанными и могут мешать нарезке. В частности, пульвинарное ядро и верхний холмик являются двумя наиболее подверженными воздействию областями мозга: в зависимости от тщательности удаления мозговой оболочки и встраивания в агарозу, они могут быть отделены от тканевого блока во время разреза. К этим глубоким областям трудно подойти извне, и они могут легко сломаться во время удаления мозговой оболочки. Тщательное, но тщательное удаление мозговой оболочки имеет решающее значение для успешной визуализации. Еще одной проблемой является переворачивание срезанных участков на тканевый блок, что иногда происходит, когда срезы остаются прикрепленными даже после разрезания. Его можно свести к минимуму, придав блоку такую форму, чтобы лезвие резал наискось в самом конце.
Благодаря визуализации глубоко в тканевом блоке, STPT позволяет избежать неровностей его поверхности. В то время как флуоресцентные сигналы могут довольно легко проходить через корковую область, они сильно ослаблены в миелинизированных областях. Таким образом, глубина изображения должна быть тщательно определена, чтобы сбалансировать равномерное изображение по всей поверхности блока и яркость сигналов в богатой миелином области, такой как белое вещество. В используемой здесь установке мы обычно нацелены на 25-35 мкм от поверхности. Также необходимо предупредить, что поверхность среза может неравномерно уменьшиться после долгих часов хранения. Чтобы свести к минимуму область визуализации, мы разбили сеанс визуализации на 20-30 прогонов с разными настройками сцены в течение 5-6 дней. Мы либо делаем интервал между прогонами менее 2 часов, либо подтверждаем глубину поверхности и корректируем высоту сцены перед каждым прогоном.
В этом протоколе сигнал BDA усиливался методом TSA. Этот метод очень эффективен и может обнаруживать антероградно транспортируемые сигналы BDA даже при относительно низком разрешении (например, рис. 6B). Биотин TSA коммерчески доступен от Akoya Biosciences, но домашнее решение демонстрирует гораздо лучшее улучшение. С другой стороны, разведение антитела и раствора требует тщательной корректировки для получения оптимального результата. Критична предварительная обработка разреза раствором метанола. Без предварительной обработки сигналы BDA едва обнаруживаются в миелинизированных аксонах.
При использовании антероградного индикатора часто бывает трудно определить точное место инъекции из-за насыщения сигналов флуоресценции. В системе визуализации тканей, используемой в этом исследовании, мы используем синий канал для идентификации инфицированных клеток (рисунок 5I). Даже когда красный и зеленый каналы насыщены, каждый отдельный инфицированный нейрон обычно обнаруживается в синем канале. То же самое можно сказать и о Allen Mouse Brain Connectivity Atlas1. Исследование клеток происхождения имеет важное значение, потому что инфекция иногда поражает только определенные слои. Мы довольно часто сталкивались с такими частичными инфекциями в Атласе связи мозга мышей, возможно, из-за использования метода ионофореза29. Боковое распространение вирусных индикаторов может быть более или менее вариабельным в зависимости от инъекций. Эта вариабельность потенциально может повлиять на результат трассировки и требует тщательной нормализации.
Успешная регистрация полученного 3D-изображения по стандартному шаблону является ключевым процессом всей нейроанатомии мозга. Регистрация STPT-изображения к STPT-шаблону может быть достаточно точной, и мы наблюдали только отклонения в несколько вокселей (50 мкм изокубических) для границ с высоким контрастомизображения10. Тем не менее, есть предел того, что может сделать регистрация. Из-за процесса удаления мозговой оболочки образцы STPT обычно имеют промежутки между полушариями и между корой и средним мозгом/задним мозгом, в то время как ткани мозга плотно упакованы на изображениях МРТ in vivo . Такие различия сложно скорректировать с помощью регистрации. Кора мартышек в основном лишена борозд, но внутритеменная борозда у некоторых людей очень глубокая. Такая борозда будет утеряна (происходит слияние сверху на верх) при регистрации. Несмотря на то, что регистрация является мощным методом, для подтверждения полученного результата необходимо возвращаться к исходным данным.
Генерация массивных данных изображений является как преимуществом, так и ограничением этого метода. Несмотря на то, что это повышает полноту набора данных, это требует тщательного управления полученными данными и разработки автоматизированного конвейера обработки изображений для эффективной интерпретации данных. В будущем применение генеративного искусственного интеллекта (ИИ) при построении конвейеров обработки изображений может значительно упростить этот процесс. Систематическая визуализация всего мозга также была выполнена с использованием методов, основанных на сканировании слайдов21,30. По сравнению с такими методами, STPT не требует дополнительных вычислений для 3D-реконструкции. В сочетании с оптическим срезом мы продемонстрировали, что STPT обладает потенциалом для реконструкции четных сегментов аксонов на участках31. С дальнейшим сочетанием методов очищения тканей Economo et al. разработали метод визуализации всего разреженно помеченных нейронов32,33. Последние версии TissueCyte теперь предлагают варианты для дополнительного лазера для усиления возбуждения красных флуоресцентных белков или блока захвата срезов для автоматического восстановления срезов. Благодаря этим достижениям целостный подход к мозгу станет более эффективным, обеспечивая основу для всестороннего понимания мозга приматов, в том числе человека.
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Мы глубоко благодарны техническому персоналу лаборатории Ямамори и животноводческих помещений (RRD) за их помощь. Мы благодарим Центр сотрудничества RIKEN CBS и Olympus за техническую помощь в получении конфокальных изображений. Эта работа была поддержана программой научных исследований в инновационных областях (грант No 22123009) от MEXT, Япония, Brain/MINDS и Brain/MINDS2.0 от AMED, Япония (JP15dm0207001, JP23wm0625001 и JP24wm0625218), а также грантом JSPS KAKENHI No 24K09678 для A.W.
Материалы
| Name | Company | Catalog Number | Comments |
| Agarose type I | Sigma | A6013 | |
| All-in-one fluorescence microscope | Keyence | BZ-X series | This study used BZ-X710 |
| anti-mouse Cy3 | Jackson Immuno Research Laboratories, Inc. | 115-165-003 | |
| anti-myc antibody | MBL | M192 | mouse monoclonal |
| Butorphanol | Meiji Animal Health | Vetorphale | |
| Ceramic blade | TissueVision | N/A | |
| Collagenase type I | Wako Chemical | #031-17601 | Aliquot into 100 µL x 10 of 100 mg/mL in PBS |
| Cotton swab (HUBY-340) | HUBY | BB-013SP | micro cotton swabs |
| Custom-made chamber | N/A | N/A | The chamber consist of four side plates and one bottom plates, all made of 1 cm thick acrylic plates, which can be securely fastened together using screw bolts. An additional acrylic plate is placed inside the chamber, with three metal poles inserted through it to hold the marmoset brain in an inverted position. |
| Cy3-Streptavidin | Jackson Immuno Research Laboratories, Inc. | 016-160-084 | |
| Dumont #5 forceps, Inox | N/A | N/A | |
| Epoxy instant mix | Locktite | N/A | |
| FIJI | NIH | https://imagej.net/software/fiji/downloads | |
| kn_pipeline_check_mosaic.py | N/A | N/A | github.com/watkarbey/STPT_depo; This is a checking script for TissueCyte data. |
| Medetomidine | Zenoaq | Domitor | |
| Midazolam | Sandoz | N/A | |
| NaBH4 | Sigma | #452882 | |
| NaIO4 | Sigma | S1878 | |
| Perfusion needle | Natsume Seisakusho Co., Ltd | KN-348, 20G-50 | |
| Slideglass (76 mm x 52 mm) | Matsunami | S9111 | |
| StAvHRP | Jackson Immuno Research Laboratories, Inc. | 016-030-084 | HRP-streptavidin (titration needs to be carefully determined) |
| TissueCyte1000 | TissueVision | https://www.tissuevision.com/tissuecyte | |
| TSA blocking reagent | Kiko Tech | FP1012 | Refer to TSA-biotin kit (Akoya Biosciences) |
| TSA-biotin | House-made | N/A | See Okamoto et al (ref. 16) |
| VECTASHIELD HardSet Mounting Medium | Vector laboratories Inc | N/A | Antifade mounting medium |
Ссылки
- Oh, S. W., Harris, J. A., Ng, L., Winslow, B., Cain, N., et al. A mesoscale connectome of the mouse brain. Nature. 508 (7495), 207-214 (2014).
- Ragan, T., et al. Serial two-photon tomography for automated ex vivo mouse brain imaging. Nat Methods. 9 (3), 255-258 (2012).
- Liang, Z., Arefin, T. M., Lee, C. H., Zhang, J. Using mesoscopic tract-tracing data to guide the estimation of fiber orientation distributions in the mouse brain from diffusion MRI. Neuroimage. 270, 119999 (2023).
- Watakabe, A., Hirokawa, J. Cortical networks of the mouse brain elaborate within the gray matter. Brain Struct Funct. 223 (8), 3633-3652 (2018).
- Ypma, R. J. F., Bullmore, E. T. Statistical analysis of tract-tracing experiments demonstrates a dense, complex cortical network in the mouse. PLoS Comput Biol. 12 (9), e1005104 (2016).
- Wang, Q., et al. The Allen mouse brain common coordinate framework: A 3D reference atlas. Cell. 181 (4), 936-953.e20 (2020).
- Köbbert, C., Apps, R., Bechmann, I., Lanciego, J. L., Mey, J., Thanos, S. Current concepts in neuroanatomical tracing. Prog Neurobiol. 62 (4), 327-351 (2000).
- Lanciego, J. L., Wouterlood, F. G. Neuroanatomical tract-tracing techniques that did go viral. Brain Struct Funct. 225 (4), 1193-1224 (2020).
- Bakker, R., Wachtler, T., Diesmann, M. CoCoMac 2.0 and the future of tract-tracing databases. Front Neuroinform. 6, (2012).
- Watakabe, A., et al. Local and long-distance organization of prefrontal cortex circuits in the marmoset brain. Neuron. 111 (14), 2258-2273.e10 (2023).
- Skibbe, H., et al. The Brain/MINDS marmoset connectivity resource: An open-access platform for cellular-level tracing and tractography in the primate brain. PLoS Biol. 21 (6), e3002158 (2023).
- Mitchell, J. F., Leopold, D. A. The marmoset monkey as a model for visual neuroscience. Neurosci Res. 93, 20-46 (2015).
- Okano, H. Current status of and perspectives on the application of marmosets in neurobiology. Annu Rev Neurosci. 44, 27-48 (2021).
- Watakabe, A., et al. Comparative analyses of adeno-associated viral vector serotypes 1, 2, 5, 8 and 9 in marmoset, mouse and macaque cerebral cortex. Neurosci Res. 93, 144-157 (2015).
- Hata, J., et al. Multi-modal brain magnetic resonance imaging database covering marmosets with a wide age range. Sci Data. 10, 221 (2023).
- Liwang, J. K., Bennett, H. C., Pi, H. -. J., Kim, Y. Protocol for using serial two-photon tomography to map cell types and cerebrovasculature at single-cell resolution in the whole adult mouse brain. STAR Protoc. 4 (1), 102048 (2023).
- Okamoto, S., et al. Exclusive labeling of direct and indirect pathway neurons in the mouse neostriatum by an adeno-associated virus vector with Cre/lox system. STAR Protoc. 2 (1), 100230 (2021).
- Viswanathan, S., et al. High-performance probes for light and electron microscopy. Nat Methods. 12 (6), 568-576 (2015).
- Kuan, L., et al. Neuroinformatics of the Allen mouse brain connectivity atlas. Methods. 73, 4-17 (2015).
- Paxinos, G., Watson, C., Petrides, M., Rosa, M., Tokuno, H. . The Marmoset Brain in Stereotaxic Coordinates. , (2012).
- Abe, H., et al. 3D reconstruction of brain section images for creating axonal projection maps in marmosets. J Neurosci Methods. 286, 102-113 (2017).
- Wan, Y., et al. FluoRender: Joint freehand segmentation and visualization for many-channel fluorescence data analysis. BMC Bioinformatics. 18 (1), 280 (2017).
- Majka, P., et al. Towards a comprehensive atlas of cortical connections in a primate brain: Mapping tracer injection studies of the common marmoset into a reference digital template. J Comp Neurol. 524 (11), 2161-2181 (2016).
- Liu, C., Yen, C. C. -. C., Szczupak, D., Tian, X., Glen, D., Silva, A. C. Marmoset brain mapping V3: Population multi-modal standard volumetric and surface-based templates. Neuroimage. 226, 117620 (2021).
- Liu, C., et al. A digital 3D atlas of the marmoset brain based on multi-modal MRI. Neuroimage. 169, 106-116 (2018).
- Liu, C., et al. A resource for the detailed 3D mapping of white matter pathways in the marmoset brain. Nat Neurosci. 23 (2), 271-280 (2020).
- Woodward, A., et al. The Brain/MINDS 3D digital marmoset brain atlas. Sci Data. 5, 180009 (2018).
- Saleem, K. S., Avram, A. V., Glen, D., Schram, V., Basser, P. J. The subcortical atlas of the marmoset ("SAM") monkey based on high-resolution MRI and histology. Cereb Cortex. 34 (4), bhae120 (2024).
- Watakabe, A., Hirokawa, J. Cortical networks of the mouse brain elaborate within the gray matter. Brain Struct Funct. 223 (8), 3633-3652 (2018).
- Lin, M. K., et al. A high-throughput neurohistological pipeline for brain-wide mesoscale connectivity mapping of the common marmoset. eLife. 8, e40042 (2019).
- Skibbe, H., et al. PAT-probabilistic axon tracking for densely labeled neurons in large 3-D micrographs. IEEE Trans Med Imaging. 38 (1), 69-78 (2019).
- Economo, M. N., et al. A platform for brain-wide imaging and reconstruction of individual neurons. eLife. 5, e10566 (2016).
- Winnubst, J., et al. Reconstruction of 1,000 projection neurons reveals new cell types and organization of long-range connectivity in the mouse brain. Cell. 179 (1), 268-281.e13 (2019).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены