Method Article
الخلايا اللحمية غير المتجانسة متعددة الخلايا في الثقافات ثلاثية الأبعاد الخالية من السقالات للخلايا السرطانية الظهارية لدفع الغزو
* These authors contributed equally
In This Article
Summary
هناك حاجة ماسة لنماذج السرطان ثلاثية الأبعاد التي تلتقط الحديث المتبادل غير المتجانس لدراسة ورم خبيث للسرطان. تقدم دراستنا توليد الظهارة اللحمية غير المتجانسة متعددة الخلايا في بيئة خالية من السقالات والسقالات والتي يمكن استخدامها لدراسة الغزو والتوزيعات المكانية الخلوية.
Abstract
سرطان الثدي هو السبب الرئيسي الثاني للوفاة المرتبطة بالسرطان بين النساء في الولايات المتحدة ، وقد ثبت أن النماذج العضوية للأورام الصلبة تلخص بأمانة جوانب تطور السرطان مثل الانتشار والغزو. على الرغم من أن العضيات المشتقة من المريض والعضيات الغريبة المشتقة من المريض ذات صلة من الناحية الفيزيولوجية المرضية ، إلا أنها مكلفة للتكاثر ، ويصعب التلاعب بها ، وتتألف بشكل أساسي من أكثر أنواع الخلايا تكاثرا داخل البيئة المكروية للورم (TME). تمنع هذه القيود استخدامها لتوضيح الآليات الخلوية لتطور المرض التي تعتمد على الخلايا اللحمية المرتبطة بالورم والتي توجد داخل TME والمعروفة بأنها تساهم في ورم خبيث ومقاومة العلاج.
هنا ، نبلغ عن طرق زراعة ثقافات ثلاثية الأبعاد متعددة الخلايا الظهارية اللحمية اللحمية. تشمل مزايا هذه الأساليب نظاما فعالا من حيث التكلفة لتوليد ثقافات ثلاثية الأبعاد شبيهة بالعضوية بسرعة داخل بيئات خالية من السقالات يمكن استخدامها لتتبع الغزو بدقة خلية واحدة داخل سقالات الهيدروجيل. على وجه التحديد ، نوضح كيفية توليد هذه الثقافات ثلاثية الأبعاد متعددة الخلايا غير المتجانسة باستخدام خلايا سرطان الثدي BT-474 بالاشتراك مع الخلايا الليفية (BJ-5ta) ، والخلايا الشبيهة بالخلايا الوحيدة (THP-1) ، و / أو الخلايا البطانية (EA.hy926). بالإضافة إلى ذلك ، يتيح وضع العلامات الفلورية التفاضلية لمجموعات الخلايا الفحص المجهري بفاصل زمني لتحديد تجميع الثقافة ثلاثية الأبعاد وديناميكيات الغزو.
والجدير بالذكر أن إضافة أي مجموعتين من الخلايا اللحمية إلى الثقافات ثلاثية الأبعاد لخلايا BT-474 يقلل بشكل كبير من دائرية الثقافات ثلاثية الأبعاد ، بما يتفق مع وجود هياكل كروية شبيهة بالعضوية أو الثانوية. في تجارب صبغة التعقب ، تشارك الخلايا الليفية والخلايا البطانية في النتوءات الشبيهة بالأعضاء المحيطية ويتم فصلها مكانيا عن الكروية BT-474 الأولية. أخيرا ، زادت الثقافات ثلاثية الأبعاد غير المتجانسة متعددة الخلايا لخلايا BT-474 من قدرة غزو الهيدروجيل. نظرا لأننا لاحظنا هذه الهياكل البارزة في الثقافات ثلاثية الأبعاد متعددة الخلايا غير المتجانسة لكل من الخلايا الظهارية للثدي غير السرطانية والورمية ، فإن هذا العمل يوفر طريقة فعالة وقابلة للتكرار لتوليد ثقافات ثلاثية الأبعاد شبيهة بالعضوية في بيئة خالية من السقالات للتحليلات اللاحقة للأنماط الظاهرية المرتبطة بتطور الورم الصلب.
Introduction
من المسلم به الآن أن تطور السرطان يعتمد على عاملين رئيسيين: التغيرات الجينية / اللاجينية في الخلايا السرطانية وعدد لا يحصى من التفاعل مع الخلايا غير السرطانية في البيئة المكروية للورم (TME)1. بينما من المسلم به أن التغيرات الجينية في الخلايا ضرورية لبدء الورم ، فإن هذه التعديلات وحدها ليست كافية لتطور الورم وورم خبيث2. من المعروف الآن الآن أن مكونات TME ، التي كان يعتقد في الأصل أنها متفرجة صامتة ، تعزز بنشاط تطور السرطان من خلال الحديث المتبادل والديناميكي مع الخلاياالسرطانية 3. تختلف تركيبة TME اعتمادا على الأنسجة التي ينشأ منها الورم ، ومرحلة الورم ، وخصائص المريض ، ولكن السمات المميزة تشمل الخلايا الليفية المرتبطة بالسرطان اللحمي (CAFs) ، والمصفوفة خارج الخلية (ECM) ، والخلايا البطانية الوعائية ، وكذلك الخلايا المناعية التكيفية والنخاعية1،4.
تتكون CAFs اللحمية في TME من أنواع فرعية من الخلايا الليفية ذات الأصول والوظائف المتنوعة5. هذه CAFs هي مكونات رئيسية ل TME لأنها تتفاعل مع الخلايا السرطانية في عدة واجهات. تفرز CAFs بروتينات ECM التي تغير صلابة المصفوفة ، والتي قد تحد إما من توصيل الدواء عن طريق الترسب المفرط للكولاجين والبروتيوغليكان والفيبرونيكتين أو تسمح للخلايا السرطانية بالغزو من موقع الورم الأساسي عن طريق إفراز البروتينات المعدنية المصفوفة المهينة ل ECM (MMPs) 6،7. بالإضافة إلى ذلك ، تعزز CAFs نمو الورم وهجرته والأوعية الدموية عن طريق إفراز مجموعة متنوعة من عوامل النمو والسيتوكينات والعوامل الوعائية مثل عامل نمو البشرة (EGF) ، وتحويل β عامل النمو (TGF-β) ، وعامل النمو البطاني الوعائي (VEGF) ، على التوالي1،6. في موازاة ذلك ، تعمل الخلايا البطانية ، التي يدفعها TME الناجم عن نقص الأكسجين ، أيضا على تعزيز الأوعية الدموية للورم وتثبيط وظائف الخلايا المناعية عن طريق زيادة إفراز العوامل الوعائية وتقليل إفراز جزيئات التصاق الكريات البيض1،8.
مع التعقيد المعقد الواضح لتطور السرطان ، أصبح من الضروري دمج مكونات لحمة TME في أبحاث السرطان الأساسية. ومع ذلك ، فإن إنشاء النماذج التي تلخص بأمانة الفيزيولوجيا المرضية للورم المعروفة لا يزال حاجة كبيرة لم تتم تلبيتها9،10. في حين أن نماذج زراعة الخلايا التقليدية ثنائية الأبعاد (2D) سهلة التعامل معها ، ويتم زراعتها بسرعة ، وقابلة للتكرار بدرجة كبيرة ، إلا أنها تتكون فقط من استنساخ الخلايا السرطانية سريعة الانتشار ولا تعكس عدم التجانس الخلوي الموجود في الأورام10،11،12. بطريقة مماثلة ، لا تلتقط نماذج الفئران المعدلة وراثيا أيضا بيولوجيا الورم البشري بسبب انخفاض عدم التجانس الجيني من زواج الأقارب ، والاختلافات الكبيرة في الجهاز المناعي ، والتعقيد النسيجي13،14. بسبب هذه القيود ، غالبا ما تفشل العلاجات المطورة من نماذج السرطان الكلاسيكية في الترجمة إلى الإعدادات السريرية.
يمكن لنماذج السرطان المشتقة من المريض مثل الطعوم الغريبة المشتقة من المريض والعضيات المشتقة من المريض معالجة عيوب نماذج السرطان التقليدية من خلال التقاط السمات الجزيئية للورم في الموقع والخلفية الجينية والتنظيم الخلوي10،11،15. ومع ذلك ، فإن مثل هذه الطعوم الغريبة والعضيات المشتقة من المريض تتطلب إجراءات نقش معقدة ووقت زراعة طويل16،17. إلى جانب التباين في مواقع اكتساب الورم وأخذ العينات وضعف الكفاءة في الحفظ بالتبريد ، هناك حاجة لتطوير نماذج تعمل كجسر بين مزارع الخلايا ثنائية الأبعاد الكلاسيكية ونماذج السرطان المشتقة من المريض11،18. في هذا الصدد ، يمكن أن تكون النماذج ثلاثية الأبعاد لزراعة الخلايا بمثابة نماذج يمكن زراعتها بسرعة والتقاط ميزات مهمة للورم في الجسم الحي مثل تفاعل الخلية الخلية ، وتفاعل الخلية ECM ، ونقص الأكسجة ، وتكوين الأوعية الدموية ، وإنتاج ECM19،20.
يتم تصنيف نماذج زراعة الخلايا ثلاثية الأبعاد إلى أنظمة نموذجية خالية من السقالات وقائمة على السقالات. في الأنظمة الخالية من السقالات ، يتم حث الخلايا على التجمع الذاتي في شكل كروي باستخدام ألواح زراعة خلايا محددة منخفضة الارتباط أو عن طريق التلاعب بالمعلمات الفيزيائية لطرق الاستزراع. تتراوح الطرق المعمول بها للحصول على سكرويات ثلاثية الأبعاد خالية من السقالات من مزارع الحبيبات الخلوية البسيطة عن طريق الطرد المركزي إلى قطرات الصفيحة الدقيقة المعلقة ، والرفع المغناطيسي ، والمفاعل الحيوي الديناميكي وأنظمة الموائعالدقيقة 20،21. يتم إنشاء ثقافات الخلايا ثلاثية الأبعاد القائمة على السقالات عن طريق إضافة سقالات قائمة على البوليمر أو الهيدروجيل لتقليد المصفوفة الفسيولوجية خارج الخلية19،22. تحمل هذه النماذج إمكانات هائلة لنمذجة التنظيم الخلوي في الجسم الحي ، والطوبولوجيا ، ومرفق المصفوفة ، والهجرة ، والاستجابة للأدوية.
بالإضافة إلى معالجة السقالة لنماذج تكوين ECM في حالات المرض ، يمكن أيضا استخدام مزارع الخلايا ثلاثية الأبعاد لنمذجة مجموعات الخلايا غير المتجانسة في TME. تم استخدام مزارع الخلايا ثلاثية الأبعاد المكونة من الخلايا السرطانية والخلايا الليفية اللحمية أو الخلايا البطانية لدراسة تفاعل السرطان وخطوط الخلايا الفردية غير السرطانية23،24،25. ستساعد الطرق القابلة للتكرار والفعالة من حيث التكلفة لتوسيع ثقافات الخلايا ثلاثية الأبعاد المكونة من خطوط خلايا متعددة غير متجانسة الباحثين على توضيح تطور الورم. هنا ، نبلغ عن طرق زراعة الثقافات ثلاثية الأبعاد متعددة الخلايا الظهارية اللحمية لدراسة الانتشار والغزو ولدونة حالة الخلية. يصف البروتوكول الثقافات ثلاثية الأبعاد القائمة على السقالات الخالية من السقالات والمستخلصات القاعدية لخلايا سرطان الثدي المزروعة بشكل مشترك مع مزيج من الخلايا اللحمية التي تتراوح من الخلايا الليفية (BJ-5ta) والخلايا البطانية (Ea.hy926) والخلايا الشبيهة بالخلايا الوحيدة (THP-1). يعد سرطان الثدي حاليا ثاني أكثر أنواع السرطان شيوعا في جميع أنحاء العالم وأكثر أنواع السرطان تشخيصا لدى النساء في الولايات المتحدةالأمريكية 26. ترجع الوفاة من سرطان الثدي إلى حد كبير إلى الطبيعة النقيلية والمقاومة للعلاج للمرض حيث يتم تقليل البقاء على قيد الحياة بشكل عام وخالي من النقائل بشكل كبير في المرضى الذين تم تشخيص إصابتهم بأنواع فرعية من سرطان الثدي العدوانية المخصب ب HER2 والشبيه بالقاعدة. قد تساعد بروتوكولات زراعة الخلايا ثلاثية الأبعاد الموصوفة في تطوير طرق زراعة فعالة من حيث التكلفة وسريعة وقابلة للتكرار يمكن إقرانها بطرق الحفاظ على الأنسجة المضمنة في البارافين الثابت بالفورمالين وتطبيقات البيولوجيا المكانية اللاحقة.
Protocol
1. وسط زراعة الخلية
ملاحظة: قم بإعداد جميع الوسائط داخل خزانة السلامة البيولوجية.
- لتحضير وسط زراعة الخلايا ل BJ-5ta و BT474 و EA.hy926 و MDA-MB-468 ، استكمل 500 مل من Dulbecco's Modified Eagle Medium (DMEM) عالي الجلوكوز مع 10٪ مصل الأبقار الجنينية المعطل للحرارة (FBS) و 1٪ بنسلين ستربتومايسين مع ماصة. ادمج 0.1٪ جنتاميسين مع ماصة دقيقة.
- لتحضير وسط زراعة الخلايا ل MCF10A ، استكمل 500 مل من DMEM / F12 مع مصل حصان 5٪ و 1٪ بنسلين ستربتومايسين بماصة. ادمج 0.1٪ جنتاميسين، و1 مل من 1 ميكروغرام/مل من الهيدروكورتيزون، و500 ميكرولتر من 10 ميكروغرام/مل من الأنسولين، و50 ميكرولتر من 100 نانوغرام/مل من توكسين الكوليرا، و10 ميكرولتر من 20 نانوغرام/مل من عامل نمو البشرة مع ماصة دقيقة.
- لتحضير وسط زراعة الخلايا ل MCF10Ca1h ، استكمل 500 مل من DMEM / F12 مع مصل حصان 5٪ و 1٪ بنسلين ستربتومايسين بماصة. ادمج 0.1٪ جنتاميسين مع ماصة دقيقة.
- لتحضير وسط زراعة الخلايا ل THP-1 ، استكمل 500 مل من RPMI 1640 مع 10٪ FBS و 1٪ بنسلين ستربتومايسين مع ماصة. ادمج 0.1٪ جنتاميسين مع ماصة دقيقة.
- قم بتغيير وسط زراعة الخلية كل 2-3 أيام ل BJ-5ta و BT474 و EA.hy926 و MDA-MB-468 و MCF10A و MCF10Ca1h حتى تصل الخلايا إلى التقاء 70-80٪ من خلال تقييم نموها يوميا باستخدام مجهر ساطع. قم بتغيير وسط زراعة الخلايا مرة واحدة في الأسبوع لخلايا THP-1.
- قم بزراعة خلايا BJ-5ta و BT474 و EA.hy926 و MDA-MB-468 و MCF10A و MCF10Ca1h في أطباق مقاس 100 مم مع أسطح معالجة بزراعة الخلايا في حاضنات زراعة الخلايا القياسية مع 5٪ ثاني أكسيد الكربون2.
- قم بزراعة خلايا THP-1 في قوارير T75 المعالجة بزراعة الخلايا في حاضنات زراعة الخلايا القياسية بنسبة 5٪ ثاني أكسيد الكربون2.
2. جمع الخلايا
- قم بتشغيل ضوء الأشعة فوق البنفسجية لتعقيم الجزء الداخلي من خزانة السلامة الحيوية لمدة 15 دقيقة.
- افتح وشاح نافذة خزانة السلامة الحيوية لتثبيت تدفق الهواء وتشغيل نظام الشفط بالفراغ.
- قم بتنظيف السطح الداخلي لغطاء المحرك وأنبوب نظام الشفط بالتفريغ بنسبة 70٪ من الإيثانول.
- قم بإعداد وسط زراعة خلايا طازج خال من المصل داخل خزانة السلامة الحيوية: مكمل 500 مل من متوسط النسر المعدل (DMEM) عالي الجلوكوز مع 1٪ بنسلين / ستربتومايسين باستخدام ماصة. ادمج 0.1٪ جنتاميسين مع ماصة دقيقة.
- قم بتسخين وسط زراعة الخلية ، والمحلول الملحي المخزن بالفوسفات (PBS) ، والتربسين-EDTA (0.25٪) إلى 37 درجة مئوية عن طريق وضع العناصر في حمام حبة قبل بدء التجربة.
- تأكد من أن الخلايا ملتقية بنسبة 70-80٪ من خلال الفحص البصري من خلال المجهر.
- قم بشفط والتخلص من وسط الثقافة من الخلايا المطلية باستخدام شفاط الفراغ. اغسل الوسط المتبقي مرة واحدة باستخدام 2 مل من PBS باستخدام ماصة ، ثم استنشق وتخلص من PBS باستخدام شفاط التفريغ.
ملاحظة: تزرع خلايا THP-1 في معلقة. يمكن حذف الخطوات 2.7-2.9. - أضف 1 مل من التربسين إلى طبق زراعة الخلايا باستخدام ماصة دقيقة ، وضع اللوحة داخل حاضنة ثاني أكسيد الكربونبنسبة 5٪ عند 37 درجة مئوية لمدة 5 دقائق.
- قم بتعطيل التربسين عن طريق إضافة 1 مل من مثبط التربسين لفول الصويا (في 1x PBS) إلى اللوحة باستخدام ماصة دقيقة. قم بتفريق مجموعات الخلايا عن طريق سحب الخليط السائل باستخدام ماصة دقيقة P1000 وجمع تعليق الخلية من قاع اللوحة. انقل معلق الخلية باستخدام ماصة دقيقة إلى أنبوب مخروطي سعة 15 مل وجهاز طرد مركزي عند 100 × جم لمدة 5 دقائق في درجة حرارة الغرفة. تخلص من المادة الطافية باستخدام شفاط الفراغ.
- استمر في عد الخلايا.
3. تحضير محلول صبغة العمل وتلوين الخلايا في التعليق
- قبل فتح قارورة مجسات الفلورسنت الجزيئية لتتبع الخلايا (انظر جدول المواد) ، اترك المنتج يسخن إلى درجة حرارة الغرفة لمدة 15 دقيقة في حمام حبة على درجة حرارة 37 درجة مئوية.
- قم بإذابة الصبغة الزرقاء لتعقب الخلايا المجففة بالتجميد (الكتلة = 5 ملجم، الوزن الجزيئي = 209.6 جم/مول) إلى تركيز نهائي قدره 10 مللي مولار مع 2.385 مل من DMSO باستخدام ماصة دقيقة.
- قم بإذابة الصبغة البرتقالية لتعقب الخلايا المجففة بالتجميد (الكتلة = 50 ميكروغرام ، الوزن الجزيئي = 550.4 جم / مول) إلى تركيز نهائي قدره 10 ملي مولار مع 9.084 ميكرولتر من DMSO باستخدام ماصة دقيقة.
- قم بإذابة صبغة حمراء عميقة لمتتبع الخلايا المجففة بالتجميد (الكتلة = 15 ميكروغرام ، الوزن الجزيئي = 698.3 جم / مول) إلى تركيز نهائي قدره 1 ملي مولار مع 20 ميكرولتر من DMSO باستخدام ماصة دقيقة.
- قم بإعداد محلول وسائط الصبغة الزرقاء لجهاز تعقب الخلايا العاملة (5 ميكرومتر) عن طريق تخفيف 1 ميكرولتر من الصبغة في 2 مل من وسط DMEM الخالي من المصل باستخدام ماصة دقيقة.
- قم بإعداد محلول وسائط صبغة البرتقال لتتبع الخلايا العاملة (5 ميكرومتر) عن طريق تخفيف 1 ميكرولتر من الصبغة في 2 مل من وسط DMEM الخالي من المصل باستخدام ماصة دقيقة.
- قم بإعداد محلول وسائط الصبغة الحمراء العميقة لجهاز تعقب الخلايا العاملة (1 ميكرومتر) عن طريق تخفيف 2 ميكرولتر من الصبغة في 2 مل من وسط DMEM الخالي من المصل باستخدام ماصة دقيقة.
- أعد تعليق الخلايا الظهارية ، الخلايا الليفية BJ-5ta ، والخلايا البطانية Ea.hy926 في محاليل وسائط الصبغة المعدة لتتبع الخلايا العاملة باللون الأزرق والبرتقالي والأحمر الغامق (2 مل) ، على التوالي باستخدام ماصة دقيقة.
- احتضان الأنابيب عند 37 درجة مئوية في حاضنة ثاني أكسيد الكربونبنسبة 5٪ لمدة 30 دقيقة.
- بعد 30 دقيقة من الحضانة ، قم بالطرد المركزي للأنابيب عند 100 × جم لمدة 5 دقائق في درجة حرارة الغرفة.
- قم بشفط المادة الطافية والتخلص منها باستخدام الشفاط الفراغي وإعادة تعليق الحبيبات جيدا في 1 مل من وسط DMEM المحتوي على مصل FBS بنسبة 10٪ باستخدام ماصة دقيقة.
- استمر في عد الخلايا.
4. عد الخلايا
- اجمع 10 ميكرولتر من تعليق الخلية وانقله إلى أنبوب دقيق باستخدام ماصة دقيقة.
- تخلط مع 10 ميكرولتر من التريبان الأزرق والماصة جيدا.
- انقل 20 ميكرولتر من محلول خلية التريبان باستخدام ماصة دقيقة إلى شريحة غرفة عد الخلايا. أدخل الخلايا وعدها باستخدام عداد الخلايا الآلي.
- احسب متوسط إجمالي عدد الخلية الحية من قراءتين.
5. الحسابات
- قم بإعداد مخزون الخلايا العاملة لكل نوع من الخلايا بتركيز 6.67 × 103 خلايا / مل أي ما يعادل 2,000 خلية / 300 ميكرولتر.
ملاحظة: يعتمد الحجم الإجمالي للمخزون على حجم العينة التجريبية. - بالنسبة للنباتات الكروية أحادية المزرعة ، تأكد من أن كل عينة مستقلة تتكون من 300 ميكرولتر من مخزون عمل الخلايا الظهارية بما يعادل 2,000 خلية ظهارية.
- بالنسبة للكبويات الكروية ذات الزراعة المشتركة (نوعان من الخلايا) ، تأكد من أن كل عينة مستقلة تتكون من 150 ميكرولتر من مخزون عمل الخلايا الظهارية و 150 ميكرولتر من مخزون عمل الخلايا اللحمية. ستحتوي العينة على 1,000 خلية ظهارية و 1,000 خلية لحمة.
- بالنسبة للزراعة الكروية المشتركة (ثلاثة أنواع من الخلايا) ، تأكد من أن كل عينة مستقلة تتكون من 150 ميكرولتر من مخزون عمل الخلايا الظهارية ، و 75 ميكرولتر من مخزون عمل الخلايا اللحمية # 1 ، و 75 ميكرولتر من مخزون عمل الخلايا اللحمية # 2. ستحتوي العينة على 1,000 خلية ظهارية ، و 500 خلية لحمية من مخزون العمل # 1 ، و 500 خلية لحمية من مخزون العمل # 2.
6. الطلاء
- انقل الحجم المطلوب باستخدام ماصة دقيقة لثلاث مكررات تقنية، بالإضافة إلى مكرر إضافي، إلى أنبوب دقيق. تخلط جيدا باستخدام ماصة، ثم تنقل 300 ميكرولتر من العينة إلى بئر من صفيحة دقيقة ذات قاع على شكل حرف U ومنخفضة للغاية سعة 96 بئرا.
- كرر العملية لكل نسخة فنية إضافية.
- ضع الصفيحة المكونة من 96 بئرا في حاضنة عند 37 درجة مئوية.
7. التصوير الساطع
- راقب نمو الكرة الكروية ومورفولوجيا كل 24 ساعة حتى 96 ساعة باستخدام المجهر.
- صورة كروية باستخدام مجهر تباين الطور.
8. إعداد بروتوكول التصوير واسع المجال للكرات الملطخة بأصباغ تعقب وكرويات متراكبة بمستخلص الغشاء القاعدي
- قم بتشغيل أجهزة التصوير والحاضنة الآلية المدرجة في جدول المواد، وقم بإنشاء بروتوكول تصوير جديد في مدير المهام الخاص ببرنامج التصوير. ضمن علامة التبويب الإجراء ، اضبط نقطة ضبط درجة حرارة الحاضنة الآلية على 37 درجة مئوية ، واسمح للحاضنة بموازنةثاني أكسيد الكربون بنسبة 2٪ ودرجة الحرارة قبل متابعة الخطوة التالية.
ملاحظة: يمكن استخدام جهاز تصوير الفلورسنت البديل إذا كان يحتوي على المرشحات المناسبة لكل من الأصباغ (الأزرق والأحمر الغامق والبرتقالي) المستخدمة. - اضبط إعدادات الصورة على المواصفات التالية: التكبير: 4X PL FL المرحلة ، مجال الرؤية: 3185 × 3185 ميكرومتر ، WFOV كامل.
- استخدم المواصفات التالية للقنوات: DAPI: 377/447 نانومتر ، الإضاءة = 10 ، وقت التكامل = 107 مللي ثانية ، الكسب = 10 ، RFP: 531/593 نانومتر ، الإضاءة = 10 ، وقت التكامل = 137 مللي ثانية ، الكسب = 10 ، CY5: 628/685 نانومتر ، الإضاءة = 10 ، وقت التكامل = 137 مللي ثانية ، الكسب = 10.
- لتصوير الكرويات في تراكب محلول استخراج الغشاء القاعدي ، استخدم مواصفات المجال الساطع التالية: الإضاءة = 10 ، ووقت التكامل = 5 مللي ثانية ، والكسب = 17.1.
- حدد الآبار المطلوبة للتصوير ووافق على تغييرات المواصفات بالنقر فوق أيقونة تحديد الآبار .
- انتقل إلى علامة التبويب تقليل البيانات لضبط إعدادات التحليل الخلوي.
- قم بتعيين قيمة الحد إلى 19,500 بخلفية فاتحة، وحدد ملء الثقوب في الأقنعة.
- لتحديد الكائن، قم بتعيين الحد الأدنى لحجم الكائن إلى 100 ميكرومتر والحد الأقصى لحجم الكائن إلى 1,000 ميكرومتر، وحدد تحليل الصورة بأكملها.
ملاحظة: هناك حاجة فقط إلى قناع أساسي وعدد الكائنات لهذا التحليل. - احفظ جميع التغييرات وافتح تطبيق التصوير.
- ضع الصفيحة الدقيقة التجريبية ذات القاع على شكل حرف U في الحاضنة عن طريق فتح الدرج ، ثم أغلقها باستخدام برنامج التصوير.
- لتشغيل البروتوكول ، انقر فوق علامة التبويب معلومات الإجراء ، وأضف مستخدما ، واختر البروتوكول.
- تأكد من تحديد نوع اللوحة الصحيح واضبط وقت التصوير على 30 دقيقة لكل لوحة.
- حدد الفاصل الزمني المطلوب للتصوير ، وحدد ما إذا كانت اللوحة بها غطاء ، واضبط وقت بدء التصوير ومدته.
- انقر فوق لوحة الجدولة / الوعاء لبدء عملية التصوير.
9. تراكب محلول استخراج الغشاء القاعدي (اختياري)
ملاحظة: يمكن تطبيق محلول استخراج الغشاء القاعدي على الكرات الكروية بعد 24 ساعة من الطلاء.
- املأ دلو الثلج بالثلج للحفاظ على محلول استخراج الغشاء القاعدي باردا وقم بتخزينه عند 4 درجات مئوية عندما لا يكون قيد الاستخدام.
- استنشق ما يقرب من 170 ميكرولتر من الوسط باستخدام ماصة متعددة القنوات.
- استخدم عدسة مكبرة وصندوق ضوئي صغير لمراقبة الكرات الصغيرة عن كثب. ضع اللوحة الكروية المكونة من 96 بئرا فوق صندوق الضوء وضع العدسة المكبرة في الأعلى.
- اضبط ماصة P200 على 30 ميكرولتر واجمع مستخلص الغشاء القاعدي لإنشاء ثلاث قطرات دقيقة.
- أضف قطرة صغيرة واحدة فوق كل كروي من التكرارات التقنية الثلاثة باستخدام ماصة دقيقة.
- تأكد من أن الصفيحة التي تحتوي على 96 بئرا مسطحة وضع الماصة عموديا فوق الكروية. حرر القطرة دون لمس قاع البئر.
- ضع الطبق في حاضنة على حرارة 37 درجة مئوية لمدة 20 دقيقة.
- قم بتراكب الكرات ب 50 ميكرولتر إضافي من محلول استخراج الغشاء القاعدي لكل بئر باستخدام ماصة دقيقة.
- أعد وضع الأكروية في وسط البئر باستخدام طرف ماصة.
- احتضان عند 37 درجة مئوية لمدة 30 دقيقة.
- أضف 100 ميكرولتر من وسط زراعة الخلايا إلى كل بئر.
10. القياس الكمي
- قم بتنزيل برنامج ImageJ وافتحه. قم بتحميل الصور الكروية.
- تعيين القياسات بالنقر فوق تحليل | تعيين القياسات وتحديد المنطقة | المركز. قم بقياس الكرات باستخدام أداة lasso لتتبع الغلاف الكروي وقياس الجسم.
- سجل قيم ثلاث تكرارات بيولوجية واحسب متوسط المساحة والدائرية.
- قم بتحويل المساحة من البكسل إلى المتر المربع باستخدام الصيغة التالية:
المساحة (م2) = ((550/504) × √ (المساحة بالبكسل)) 2 - تحليل البيانات.
- حدد إدخال قيم النسخ المتماثل، مكدسة في أعمدة.
- أدخل البيانات في الأعمدة وحدد التحكم الكروي أحادي الزراعة وعينات كروية للمعالجة في الزراعة المشتركة.
- قم بإجراء تحليل عمود ANOVA أحادي الاتجاه.
- استخدم معلمات ANOVA التالية:
- تجنب المطابقة أو الاقتران.
- افترض التوزيع الغوسي للمخلفات.
- افترض انحرافات معيارية متساوية.
- استخدم اختبار المقارنة المتعددة ل Tukey لمقارنة متوسط كل عمود بمتوسط كل عمود آخر.
11. معالجة الصور المناعية الفلورية واسعة النطاق
- احفظ الصور مباشرة من برنامج التصوير بتنسيق ملف PNG أو Tiff.
- حدد كل قناة فردية أو قنوات متداخلة واحفظها كملف PNG.
- اضبط السطوع والتباين في برنامج التصوير أو في ImageJ إذا تم تصدير الصور كملفات Tiff.
النتائج
في هذه الدراسة ، قمنا بتطوير نظام زراعة الخلايا لتوليد كرويات ثلاثية الأبعاد متعددة الخلايا غير متجانسة تتكون من خلايا ظهارية ولحمية ذات مورفولوجيا شبيهة بالعضوية. تم إنشاء الكرات عن طريق طلاء 2,000 خلية ظهارية في ظروف الزراعة الأحادية. في ظروف الزراعة المشتركة لنوعين من الخلايا ، تم إنشاء الكرات عن طريق طلاء 1,000 خلية ظهارية و 1,000 خلية لحمة. في ظروف الزراعة المشتركة لثلاثة أنواع من الخلايا ، تم إنشاء الكرويات عن طريق طلاء 1,000 خلية ظهارية ونوعين مختلفين من الخلايا اللحمية من 500 خلية من كل نوع من الخلايا. في المنبع من التأسيس الكروي ، يمكن تلطيخ الخلايا بأصباغ تعقب الخلايا الفلورية التي تسمح بمراقبة التنظيم المكاني الخلوي. بعد 24 ساعة من تكوين كروي أولي ، تشمل التطبيقات النهائية الاضطرابات الدوائية والتصوير وجمع العينات. يعد التصوير بفاصل زمني مفيدا لتقييم التغيرات في السلوك الكروي والتشكل ، بما في ذلك المساحة والدائرية (الشكل 1 أ). في 24 ساعة بعد الطلاء ، يمكن تضمين الكرات الكروية في بيئة سقالة ، ويمكن استخدام التصوير بفاصل زمني لتقييم بداية الهياكل الغازية من الكروي (الشكل 1 ب). يحتوي جمع عينات كروية متعددة الخلايا غير متجانسة على العديد من التطبيقات ، بما في ذلك التنميط الجيني والبروتيني على المستوى العالمي والخلية المفردة من خلال التقنيات التجريبية مثل تسلسل الحمض النووي الريبي ، وتسلسل الحمض النووي الريبي أحادي الخلية ، والتسلسل البروتيني ، والتألق المناعي الدوري.
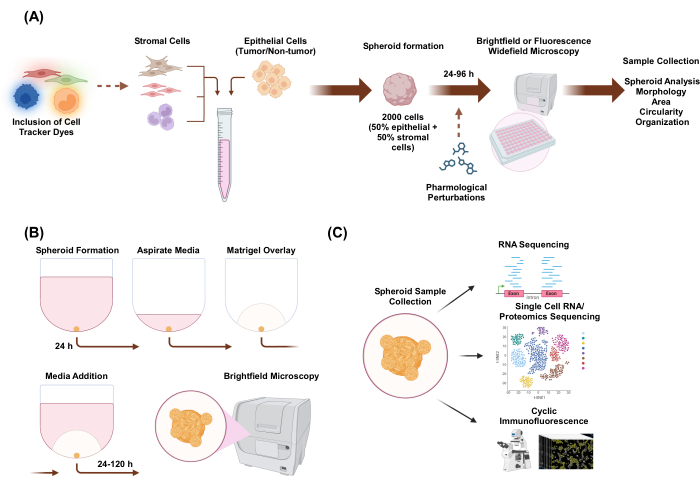
الشكل 1: التمثيل التخطيطي لعملية زراعة الخلايا ثلاثية الأبعاد والتطبيقات المحتملة. (أ) يتم سحب تعليق الخلايا الخلوية للخلايا الظهارية ذات الخلايا اللحمية غير الظهارية في ألواح تعلق ثلاثية الأبعاد منخفضة للغاية لتشكيل كرويات. يتم تصوير الكرات بواسطة الفحص المجهري للحقل الساطع كل 24 ساعة على مدار 96 ساعة. يمكن تلطيخ خطوط الخلايا بأصباغ تعقب الخلايا الفلورية للفحص المجهري واسع المجال في اتجاه مجرى النهر قبل إحداث تكوين كروي أو يمكن أن تنزعج دوائيا بعد تكوين كروي. يمكن تحليل المعلمات الكروية مثل التشكل والمساحة والدائرية والتنظيم. (ب) تتشكل الخلايا الكروية للخلايا الظهارية والظهارية ذات الخلايا اللحمية باستخدام البروتوكول من أ. تم إنشاء الكرات عن طريق طلاء 2,000 خلية ظهارية في ظروف الزراعة الأحادية. في ظروف الزراعة المشتركة لنوعين من الخلايا ، تم إنشاء الكرات عن طريق طلاء 1,000 خلية ظهارية و 1,000 خلية لحمة. في ظروف الزراعة المشتركة لثلاثة أنواع من الخلايا ، تم إنشاء الكرويات عن طريق طلاء 1,000 خلية ظهارية ونوعين مختلفين من الخلايا اللحمية من 500 خلية من كل نوع من الخلايا. بعد 24 ساعة ، يتم تراكب محلول استخراج الغشاء القاعدي الشبيه بالسقالة ، ويتم التقاط الصور في الفحص المجهري للمجال الساطع كل 24 ساعة لمدة 120 ساعة. (ج) يمكن استخدام الثقافات ثلاثية الأبعاد متعددة الخلايا غير المتجانسة الخالية من السقالات والقائمة على السقالات لمجموعة متنوعة من التطبيقات النهائية مثل التألق المناعي الدوري ، وتسلسل الحمض النووي الريبي أحادي الخلية ، والبروتينات أحادية الخلية. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
تحافظ الأشكال الكروية أحادية الزراعة MCF10A و MCF10Ca1h و BT-474 على نمط ظاهري كروي مضغوط لمدة تصل إلى 96 ساعة بعد الطلاء. عند الاستزراع المشترك مع الخلايا البطانية للأوعية الدموية الدقيقة EA.hy926 ، والخلايا الليفية BJ-5ta ، و / أو الخلايا الشبيهة بالخلايا الأحادية THP-1 ، طورت الكرات النتوءات الخلوية في المحيط ، والتي أصبحت أكثر وضوحا في 96 ساعة (الشكل 2A-C). الأهم من ذلك ، أن هذه النتوءات والظواهر الناشئة والضغط للكفوريات تمثل اختلافات في التنظيم الخلوي للكروية السرطانية والخلايا اللحمية المزروعة المشتركة التي ترتبط بالغزو ثلاثي الأبعاد بعد إضافة هيدروجيل قائم على الغشاء القاعدي مثل Matrigel. تراوحت التشكل الناشئ من مجاميع الخلايا الصلبة إلى الرخوة ، تشبه التشكل العضوي. في المقابل ، ظهرت الكرويات أحادية الزراعة MDA-MB-468 على شكل مجاميع خلايا كبيرة وفضفاضة. ومع ذلك ، عندما تم زراعة خلايا MDA-MB-468 بشكل مشترك مع EA.hy926 و / أو BJ-5ta و / أو THP-1 ، شكلت كرات كروية مضغوطة (الشكل 2 د).
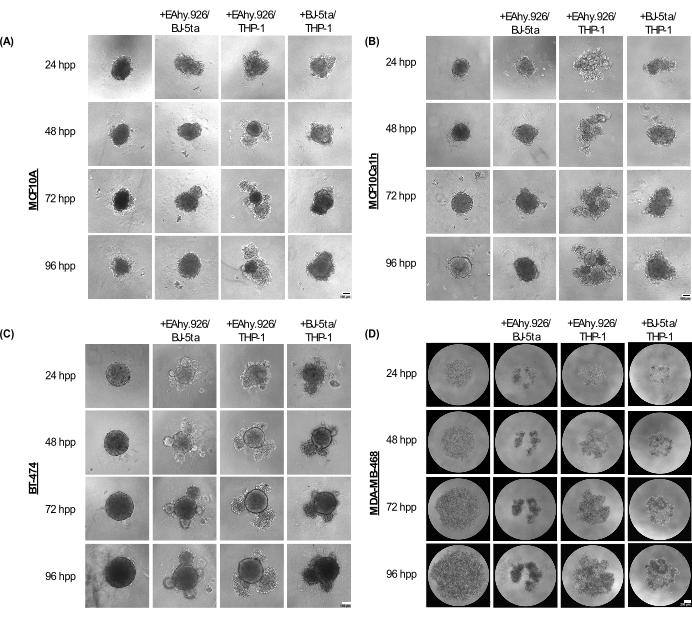
الشكل 2: مجموعة البنى والأشكال المعتمدة من خلال مجموعات من الخلايا اللحمية غير الظهارية في تركيبة عند دمجها مع الخلايا السرطانية الظهارية / غير السرطانية في ثقافات ثلاثية الأبعاد خالية من السقالات. صور الحقل الساطع التمثيلية ل (أ) MCF10A ، (ب) MCF10Ca1h ، (ج) BT-474 ، (د) MDA-MB-468 الكروية في الزراعة الأحادية أو في ظروف الزراعة المشتركة مع الخلايا البطانية الليفية اللحمية BJ-5ta / Ea.hy926 الخلايا البطانية للأوعية الدموية الدقيقة أو الخلايا الأحادية الشبيهة بالخلايا Ea.hy926 / THP-1 أو خلايا BJ-5ta / THP-1 عبر 96 ساعة. تم تشكيل كل كروي عن طريق طلاء 2,000 خلية. تشكلت الكرات في ظروف الزراعة الأحادية باستخدام 2,000 خلية ظهارية. تشكلت الكرات الكروية في ظروف الزراعة المشتركة باستخدام 1000 خلية ظهارية ونوعين مختلفين من الخلايا اللحمية من 500 خلية. بدأ تكوين هياكل شبيهة بالعضوية الناشئة أو المجمعة في ظروف الزراعة المشتركة الكروية بعد 24 ساعة من الطلاء في الخلايا الظهارية MCF10A و MCF10Ca1h و BT-474. لوحظ ضغط خلايا MDA-MB-468 في ظروف الزراعة الكروية المشتركة بعد 25 ساعة من الطلاء. أشرطة المقياس = 100 ميكرومتر. اختصار: hpp = ساعات ما بعد الطلاء. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
في 72 ساعة بعد الطلاء ، أظهرت خلايا MCF10A و MCF10Ca1h و BT-474 المستزرعة بشكل مشترك مع EA.hy926 و THP-1 ، أو مع BJ-5ta و THP-1 ، زيادة كبيرة في المساحة الكروية مقارنة بالسكويدات الظهارية أحادية الزرعة. أظهر MCF10Ca1h أيضا زيادة كبيرة في المنطقة الكروية عند استزراعها بشكل مشترك مع EA.hy926 و BJ-5ta. أدى ظهور الهياكل الناشئة في الكرات المستزرعة المشتركة إلى انخفاض كبير في الدائرية الكروية ل MCF10A و MCF10Ca1h و BT-474 المستزرعة بشكل مشترك مع EA.hy926 و THP-1 ، أو مع BJ-5ta و THP-1. لوحظت تأثيرات مماثلة ل BT-474 المزروعة المشتركة مع كل من EA.hy926 و BJ-5ta (الشكل 3 أ ، ب). في المقابل ، أظهرت خلايا MDA-MB-468 المستزرعة بشكل مشترك مع EA.hy926 و BJ-5ta و EA.hy926 و THP-1 أو BJ-5ta و THP-1 انخفاضا كبيرا في المساحة الكروية مقارنة بالزراعة الأحادية MDA-MB-468 الكروية. ومع ذلك ، لم يكن هناك أي تأثير على الدائرية (الشكل 3 أ ، ب).

الشكل 3: الرسوم البيانية لتحليل المساحة والدائرية للثقافات اللحمية ثلاثية الأبعاد أحادية المستزرعة وغير المتجانسة متعددة الخلايا الخالية من السقالات في 72 ساعة بعد الطلاء. (أ) متوسط المساحة (سم2) و (ب) متوسط دائرية MCF10A و MCF10Ca1h و BT-474 و MDA-MB-468 في الثقافات الكروية أحادية المزروعة وغير المتجانسة متعددة الخلايا بعد 72 ساعة من الطلاء. وتمثل البيانات المبلغ عنها ثلاثة نسخ بيولوجية مستقلة على الأقل ويتم الإبلاغ عنها كمتوسطات تكماثل تقني ± SEM، ما لم يذكر خلاف ذلك. تمثل *، **، *** أو **** القيم P < 0.05 أو 0.01 أو 0.001 أو 0.0001 على التوالي، ما لم يذكر خلاف ذلك. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
أظهر تطبيق صبغة تعقب الخلايا على الخلايا الظهارية السرطانية BT-474 والخلايا اللحمية قبل إنشاء اللحمة أن الخلايا اللحمية ، بما في ذلك EA.hy926 و BJ-5ta ، شكلت الهياكل الناشئة في محيط الكرات المركزية BT474 (الشكل 4 ، الفيديو التكميلي S1 ، الفيديو التكميلي S2 ، الفيديو التكميلي S3 ، والفيديو التكميلي S4). في 48 ساعة بعد الطلاء ، تكشف الصور الفلورية الفردية واسعة المجال للكفيريات المزروعة مع الخلايا الليفية أن الخلايا الكروية الليفية موضعية مع الخلايا البطانية ولكنها لم تشارك في توطينها مع BT-474 الكروية. كما تم العثور على أقلية من الخلايا البطانية تتشارك مع BT-474 الكروية في ظروف الزراعة المشتركة. يشير هذا إلى أن ترتيب الخلايا اللحمية داخل الكرة يرتبط بمورفولوجيا شبيهة بالعضوية.
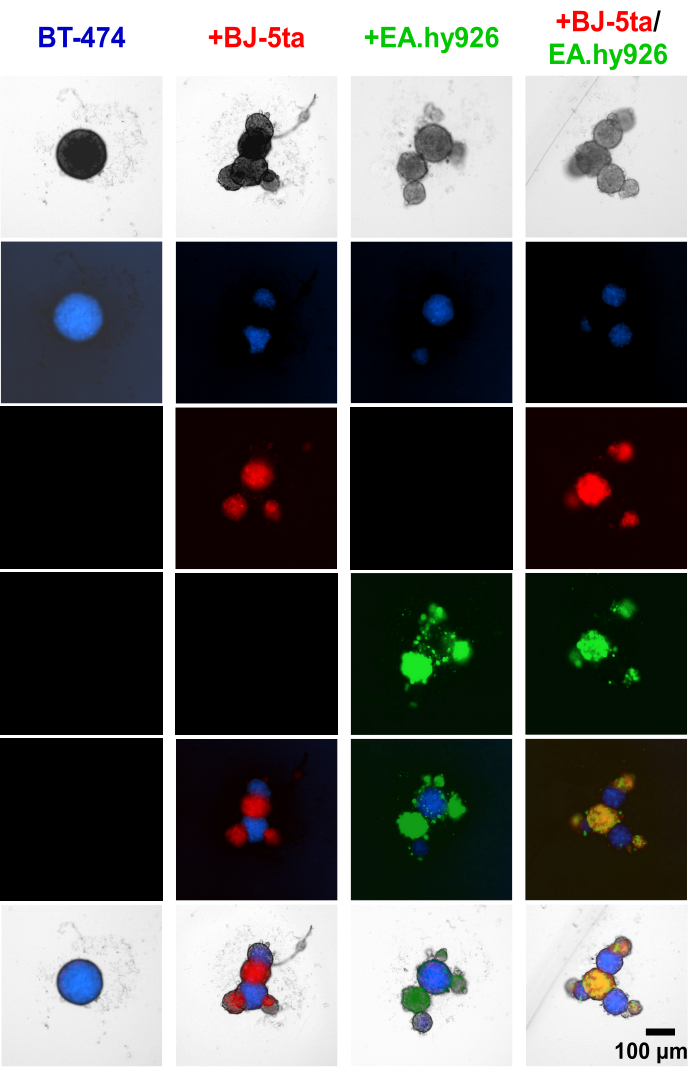
الشكل 4: صور ثابتة مضان واسعة المجال لخلايا اللحمة المصبوغة تفاضليا وخلايا BT-474 في الثقافات ثلاثية الأبعاد متعددة الخلايا غير المتجانسة بعد 48 ساعة. الكرويات BT-474 ملطخة بصبغة فلورية لتتبع الخلايا الزرقاء. الخلايا الليفية BJ-5ta ملطخة بصبغة تعقب الخلايا البرتقالية ، ممثلة باللون الأحمر. الخلايا البطانية Ea.hy926 ملطخة بصبغة تعقب الخلايا الحمراء العميقة ، ممثلة باللون الأخضر. تم تشكيل كل كروي عن طريق طلاء 2,000 خلية. تشكلت الكرات في ظروف الزراعة الأحادية باستخدام 2,000 خلية ظهارية. تشكلت الكرات في ظروف الزراعة المشتركة (BT-474 / BJ-5ta ، BT-474 / Ea.hy926) باستخدام 1,000 خلية ظهارية و 1,000 خلية لحمة. تم تشكيل الكرات الكروية في ظروف الزراعة المشتركة المزدوجة (BT-474 / BJ-5ta / Ea.hy926) باستخدام 1,000 خلية ظهارية و 500 خلية من كل نوع من الخلايا اللحمة. تمثل الأرقام ثلاثة مكررات بيولوجية على الأقل. شريط المقياس = 100 ميكرومتر. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
لتقييم الأهمية البيولوجية لنموذجنا الكروي العضوي ، تم تراكب الكرويات بمحلول مستخلص الغشاء القاعدي بعد 24 ساعة من الطلاء. لم تظهر الكرويات أحادية الزراعة BT-474 أي خصائص غازية بعد 120 ساعة من الطلاء. ومع ذلك ، فإن الكرات الكروية BT-474 التي تم زراعتها بشكل مشترك مع BJ-5ta أو EA.hy926 طورت هياكل على محيط الكروية ، والتي غزت بيئة محلول استخراج الغشاء القاعدي للسقالة. تم تحسين عدد وطول هذه النتوءات بشكل كبير في BT-474 الكروية المستزرعة بشكل مشترك مع كل من BJ-5ta و EA.hy926 بمقدار 48 ساعة حتى 120 ساعة بعد الطلاء (الشكل 5 ، الفيديو التكميلي S5 ، الفيديو التكميلي S6 ، الفيديو التكميلي S7 ، والفيديو التكميلي S8).
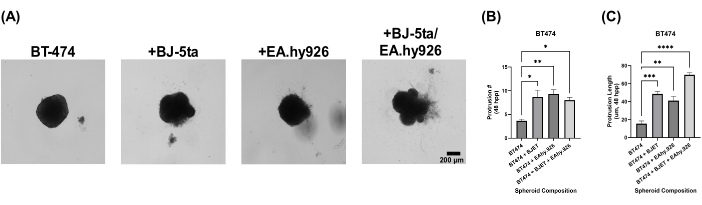
الشكل 5: صور ساكنة Brightfield لخلايا BT-474 في ثقافات ثلاثية الأبعاد غير متجانسة متعددة الخلايا مع تراكب محلول استخراج الغشاء القاعدي بعد 5 أيام من التراكب. تم تشكيل كل كروي عن طريق طلاء 2,000 خلية. تم تراكب محلول استخراج الغشاء القاعدي فوق الكرويات بعد 24 ساعة من الطلاء. تشكلت الكرات في ظروف الزراعة الأحادية باستخدام 2,000 خلية ظهارية. تشكلت الكرات في ظروف الزراعة المشتركة (BT-474 / BJ-5ta و BT-474 / Ea.hy926) باستخدام 1,000 خلية ظهارية و 1,000 خلية لحمة. تم تشكيل الكرات الكروية في ظروف الزراعة المشتركة المزدوجة (BT-474 / BJ-5ta / Ea.hy926) باستخدام 1,000 خلية ظهارية و 500 خلية من كل نوع من الخلايا اللحمة. (أ) يمكن ملاحظة الهياكل الغازية البارزة من كروي السرطان المضمن في محلول استخراج الغشاء القاعدي في ظروف الزراعة المشتركة. (ب) تأهيل عدد النتوءات الغازية في الوقت 48 حصان. (ج) تأهيل طول النتوء الغازي في الوقت 48 حصان. تمثل الأرقام ثلاثة مكررات بيولوجية على الأقل. شريط المقياس = 200 ميكرومتر. اختصار: hpp = ساعات ما بعد الطلاء. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
فيديو تكميلي S1: BT-474 كروي أحادي الزراعة مع صبغة زرقاء لتتبع الخلية. تم تعليق خلايا BT-474 (2,000) في صفيحة دقيقة ذات قاع على شكل حرف U ، ومرفقة منخفضة للغاية 96 بئرا لتشكيل كرويات. تم التقاط تداخل صور التألق الساطع وواسع المجال على مدار 48 ساعة. اختصار: ULA = مرفق منخفض للغاية. الرجاء النقر هنا لتنزيل هذا الفيديو.
الفيديو التكميلي S2: BT-474 الكروية المستزرعة مع الخلايا الليفية BJ-5ta. تم تعليق BT-474 (1,000) و 1,000 BJ-5ta من الخلايا الليفية في ألواح ULA لتشكيل كرويات. تم احتضان خلايا BT-474 بصبغة زرقاء متتبع الخلايا والخلايا الليفية BJ-5ta مع صبغة برتقالية لتتبع الخلايا. تم التقاط تداخل بين الصور الفلورية الساطعة وواسعة النطاق (الأزرق = BT-474 ، الأحمر = BJ-5ta) على مدار 48 ساعة. اختصار: ULA = مرفق منخفض للغاية. الرجاء النقر هنا لتنزيل هذا الفيديو.
الفيديو التكميلي S3: BT-474 الكروية المستزرعة بشكل مشترك مع الخلايا البطانية Ea.hy926. تم تعليق الخلايا البطانية BT-474 (1,000) و 1,000 Ea.hy926 في ألواح ULA لتشكيل كرويات. تم تحضين خلايا BT-474 بصبغة زرقاء متتبع الخلايا والخلايا البطانية Ea.hy926 مع صبغة حمراء عميقة لتتبع الخلية. تم التقاط تداخل صور الفلورسنت الساطع وواسع المجال (الأزرق = BT-474 ، الأخضر = Ea.hy926) على مدار 48 ساعة. اختصار: ULA = مرفق منخفض للغاية. الرجاء النقر هنا لتنزيل هذا الفيديو.
الفيديو التكميلي S4: تم زراعة الفيريات BT-474 بشكل مشترك مع الخلايا الليفية BJ-5ta والخلايا البطانية Ea.hy926. تم تعليق BT-474 (1,000) و 500 الخلايا الليفية BJ-5ta و 500 خلية بطانية Ea.hy926 في ألواح ULA لتشكيل كرويات. تم تحضين خلايا BT-474 بصبغة زرقاء لتتبع الخلايا. تم تحضين الخلايا الليفية BJ-5ta والخلايا البطانية Ea.hy926 بصبغة برتقالية متعقب الخلايا وصبغة حمراء عميقة ، على التوالي. تم التقاط تداخل الصور الفلورية الساطعة وواسعة المجال (الأزرق = BT-474 ، الأحمر = BJ-5ta ، الأخضر = Ea.hy926) على مدار 48 ساعة. اختصار: ULA = مرفق منخفض للغاية. الرجاء النقر هنا لتنزيل هذا الفيديو.
فيديو تكميلي S5: BT-474 كروي أحادي الزراعة في محلول استخراج الغشاء القاعدي. تم إعادة تعليق خلايا BT-474 (2,000) في ألواح ULA لتشكيل كرويات ، وتم تضمين الكرات الكروية في محلول غشاء القاعدي بعد 24 ساعة من الطلاء. تم التقاط صور Brightfield على مدار 60 ساعة. اختصار: ULA = مرفق منخفض للغاية. الرجاء النقر هنا لتنزيل هذا الفيديو.
الفيديو التكميلي S6: تم استزراع الفيريات BT-474 بشكل مشترك مع الخلايا الليفية BJ-5ta في محلول استخراج الغشاء القاعدي. تم إعادة تعليق BT-474 (1,000) و 1,000 BJ-5ta من الخلايا الليفية في ألواح ULA لتشكيل كرويات ، وتم تضمين الكرات في محلول استخراج الغشاء القاعدي بعد 24 ساعة من الطلاء. تم التقاط صور Brightfield على مدار 60 ساعة. اختصار: ULA = مرفق منخفض للغاية. الرجاء النقر هنا لتنزيل هذا الفيديو.
الفيديو التكميلي S7: تم زراعة الكرويات BT-474 بشكل مشترك مع الخلايا البطانية Ea.hy926 في محلول استخراج الغشاء القاعدي. تم إعادة تعليق الخلايا البطانية BT-474 (1,000) و 1,000 Ea.hy926 في ألواح ULA لتشكيل كرويات ، وتم تضمين الكرات في محلول استخراج الغشاء القاعدي بعد 24 ساعة من الطلاء. تم التقاط صور Brightfield على مدار 60 ساعة. اختصار: ULA = مرفق منخفض للغاية. الرجاء النقر هنا لتنزيل هذا الفيديو.
فيديو تكميلي S8: تم زراعة الكرويات BT-474 بشكل مشترك مع الخلايا الليفية BJ-5ta والخلايا البطانية Ea.hy926 في محلول استخراج الغشاء القاعدي. تم تعليق BT-474 (1,000) و 500 الخلايا الليفية BJ-5ta و 500 الخلايا البطانية Ea.hy926 في ألواح ULA لتشكيل كرويات ، وتم تضمين الكرات الكروية في محلول استخراج الغشاء القاعدي بعد 24 ساعة من الطلاء. تم التقاط صور Brightfield على مدار 60 ساعة. الرجاء النقر هنا لتنزيل هذا الفيديو.
Discussion
يوضح نموذجنا الكروي غير المتجانس متعدد الخلايا أن تفاعلات الخلايا الظهارية اللحمية تدفع تبرعم الخلايا اللحمية في ظروف الثقافة ثلاثية الأبعاد الخالية من السقالات وتشكيل الهياكل الغازية في ظروف الثقافة ثلاثية الأبعاد القائمة على السقالات. لاحظنا تكوين بنية مهدئة متسقة في كل من خطوط الخلايا السرطانية (MCF10Ca1h و BT-474) وخط الخلايا الظهارية غير الورمي MCF10A (الشكل 2A-C). ومن المثير للاهتمام ، أنه في حين أن الكرويات من خطوط الخلايا MCF10A و MCF10Ca1h و BT-474 ، سواء في الزراعة الأحادية أو الزراعة المشتركة مع الخلايا الليفية والخلايا البطانية ، شكلت هياكل مهدئة دائرية ومضغوطة في بيئات خالية من السقالات ، أظهرت الكرويات من خط الخلية MDA-MB-468 ضغطا أقل (الشكل 2 د). كان هذا غير متوقع ، حيث كان من المتوقع أن تشكل خلايا MDA-MB-468 كرويات دائرية ، مثل خطوط الخلايا الظهارية الأخرى التي تم اختبارها. تم العثور على خط الخلية SUM-149 ، وهو خط خلوي أولي هجين لسرطان الثدي الظهاري الوسيط ، لتشكيل كرويات مضغوطة مثل MCF10A و MCF10Ca1h و BT-474 (البيانات غير معروضة) 28. يجب أن تبحث الأبحاث المستقبلية في مسارات الإشارات التي تتوسط في تكوين كرويات أقل إحكاما في خط خلايا MDA-MB-468 لأن مثل هذه الحالات الشاذة قد تشير إلى نقاط ضعف خلوية يمكن الاستفادة منها لتطوير استراتيجيات علاجية جديدة.
فيما يتعلق بمزيج من خطوط الخلايا المختلفة ، تحفز الخلايا الشبيهة بالخلايا الأحادية THP-1 على تكوين هياكل مجمعة فضفاضة في جميع ظروف الزراعة المشتركة للكرويات. لوحظ ضغط أقل في الهياكل الناشئة في ظروف الزراعة المشتركة مع خلايا THP-1 / Ea.hy926 مقارنة بتلك الموجودة في ظروف الزراعة المشتركة مع خلايا THP-1 / BJ-5ta (الشكل 2A-D). لذلك ، يتأثر ضغط الكرويات بتكوين الخلايا اللحمية في النموذج29،30.
يمكن أن يؤدي الطلاء غير المتسق لمجموعات الخلايا غير المتجانسة إلى تطور كروي غير مكتمل أو تباين في الحجم الكروي ، مقارنة بتكراراتها التقنية. يعد ضمان الاتساق في طلاء الخلايا أمرا بالغ الأهمية ، حيث أن الترتيب المكاني للخلايا الذي يحدد النمط الظاهري الكروي وتطوره يحدث بشكل أساسي خلال أول 48 ساعةو 31. خلال هذه الفترة الحرجة ، تلعب نسب الخلايا دورا مهما ، حيث تؤثر نسبة الخلايا اللحمية على كل من المنطقة الكروية والدائرية.
يمكن تفكيك الركام الكروي السائب ، الذي يعتمد على نوع الخلية ، بسهولة أثناء المناولة اليدوية. ومع ذلك ، فإن التلاعب اليدوي ضروري عند تراكب الكرويات بمحلول استخراج غشاء القاعدي يشبه السقالة أو عند جمع عينات كروية كاملة. للتخفيف من هذه المشكلة، ينصح بالعمل بوتيرة أبطأ عند جمع الكرويات عن طريق شفط الماصة وتقليل المناولة اليدوية كلما أمكن ذلك. أثناء تراكب محلول استخراج الغشاء القاعدي ، تكون الكرات الكروية عرضة للتحول داخل البئر ، وغالبا ما تستقر عند حافة البئر. تعتبر نسبة محلول استخراج الغشاء القاعدي إلى الوسائط مهمة للحفاظ على خصائص المصفوفة لنظام 3D. ومع ذلك ، لا يمكن تغليف الكرات بالكامل بسبب لزوجة محلول استخراج الغشاء القاعدي ، لذلك يلزم التدخل اليدوي32. يشكل تحديد المواقع الكروية غير المركزية تحديا للتصوير ، حيث يمكن أن يتداخل انكسار الضوء بالقرب من الحافة البلاستيكية للبئر مع وضوح الصورة.
تتكون الكرويات المستخدمة في هذه الدراسة من خطوط الخلايا السرطانية البشرية. لم يتم تطبيق الطرق الموضحة هنا بعد على خطوط الخلايا الأولية. تشير نتائجنا إلى أن تفاعلات خلية خلوية معينة يمكن أن تدفع إلى تكوين هياكل شبيهة بالعضوية ، مما يشير إلى قابلية التطبيق المحتمل لهذه الطريقة على مجموعة واسعة من خطوط الخلايا السرطانية. ومع ذلك ، بينما يحاول نموذجنا تقليد تعقيد البيئة المكروية للورم ، فإن المعدلات المختلفة للتكاثر الخلوي تمثل تحديا للدراسات طويلة المدى33. تميل الخلايا سريعة التكاثر إلى تجاوز الخلايا الأكثر تكاثرا ، مما يجعل هذا النموذج أقل ملاءمة للتجارب الممتدة. بالإضافة إلى ذلك ، يمكن أن تؤدي متطلبات نوع وسائط النمو المختلفة لخطوط الخلايا إلى عوامل إضافية قد تؤدي إلى أنماط ظاهرية كروية. نمت معظم خطوط الخلايا في هذه الدراسة في وسائط DMEM. قد تتطلب الدراسات التي أجريت على خطوط الخلايا المزروعة في وسائط مختلفة ظروفا ثقافية مختلفة لاختبار مجموعة متنوعة من نسب الوسائط. ومع ذلك ، لوحظ هذا التأثير في التجارب طويلة المدى30.
يقدم نموذجنا العديد من المزايا مقارنة بنماذج السرطان ثلاثية الأبعاد الأخرى. تتميز الكرات التي ننتجها بمورفولوجيا وحجم أولي موحد وقابل للتكرار ، مما يسهل مقارنة نتائج العلاج بالضوابط. في المقابل ، يمكن أن تؤدي بعض النماذج التي تستخدم خلايا مفردة معلقة في الوسائط أو السقالات إلى توزيعات مكانية خلوية متغيرة ، مما يؤدي إلى عدم الاتساق. يوضح هذا النموذج أنه يمكن دراسة التفاعلات بين مجموعات الخلايا المتميزة بشكل فعال.
تقليديا ، تتكون النماذج العضوية والكروية من خلايا سرطانية أحادية الزراعة أو مزارع الخلايا السرطانية المشتركة للتحقيق في تدرجات العناصر الغذائية أو نقص الأكسجة أو الترتيب الخلوي34. بالإضافة إلى ذلك ، يمكن دراسة هذا النموذج في بيئة سقالات في غضون 24 ساعة بعد الطلاء ، مما يوفر فرصة لاستكشاف أحداث الغزو المبكرة مدفوعة بتفاعلات خلية خلوية متنوعة. في حين أن مناهج السرطان ثلاثية الأبعاد البديلة تستخدم مكونات مصفوفة سقالة مختلفة لدراسة التغيرات في مورفولوجيا الكروية والغزو ، فإن هذا النموذج يكمل ذلك من خلال السماح بالتحقيق في هذه التغييرات في سياق كل من ديناميكيات سكان الخلايا وتكوين السقالة35.
تحتفظ معظم الكرات التي يتم إنتاجها باستخدام أساليبنا بسلامتها الهيكلية بعد المناولة اليدوية ، مما يسمح بجمع العينات في التطبيقات النهائية. يمكن إدخال التعديلات الجينية التقليدية مثل CRISPR-Cas9 ، ونقل shRNA الفيروسي ، وتداخل siRNA في المنبع من تكوين كروي. تشير السلوكيات المعقدة التي لوحظت في هذه الكرويات إلى تغييرات ديناميكية في التعبير الجيني ، والتي يمكن التحقيق فيها بشكل أكبر باستخدام تسلسل الحمض النووي الريبي. يمكن أيضا استخدام التقنيات المتقدمة مثل Cycif و scRNA-seq و CosMx و Visium لدراسة علم الجينوم والبروتينات على المستوى المكاني أو الخلية الواحدة. هذا النموذج الكروي لديه القدرة على تقليد الدراسات في الجسم الحي لعلاجات الورم المستهدفة من خلال التقاط التفاعلات بين براعم الخلايا اللحمية والعوامل العلاجية قبل وصولها إلى الخلايا السرطانية. هذا مهم لأنه يمكن أن يساعد في تحديد ما إذا كانت الخلايا اللحمية تؤثر على فاعلية الدواء ، مما قد يحمي الخلايا السرطانية من التأثيرات العلاجية.
Disclosures
ليس لدى المؤلفين أي تضارب في المصالح للإعلان عنه.
Acknowledgements
نشكر أعضاء مختبر الأورام التنموي بجامعة بايلور على ملاحظاتهم المفيدة وملاحظاتهم أثناء إعداد هذه المخطوطة. تم تقديم الدعم التمويلي من قبل قسم الأحياء بجامعة بايلور وكلية الآداب والعلوم ، NIH-NIGMS 2SC1GM121182 (إلى JAK).
Materials
| Name | Company | Catalog Number | Comments |
| 15 mL Polypropylene Centrifuge Tubes | Falcon | 14-959-53A | |
| 96-Well, Treated, U-Shaped-Bottom Microplate | Thermo Scientific | 12566432 | |
| 100 mm Dish Cell Culture Treated Surface | Thermo Scientific | 130182 | |
| 170 L CO2 Incubators | VWR | VWR51014991(10810902) | |
| 200 Self-Sealing Barrier Pipet Tips | Fisher Scientific | 02-682-255 | |
| 500 mL DMEM/Hams F-12, [+] L-glutamine | Corning | 10-090-CV | |
| 1000 Self-Sealing Barrier Pipet Tips | Molecular Biology Products Inc. | 2179HR | |
| Animal-Free Recombinant Human EGF | PeproTech | AF-100-15 | |
| Automated Pipette Repeater E3x | Eppendorf | 4987000410 | |
| Basement membrane solution | Huntsman Cancer Institute | https://healthcare.utah.edu/huntsmancancerinstitute/ | |
| Bead Bath | Lab Armor | 74300706 | |
| Biorender | Biorender | Biorender.com | |
| Biosafety Laminar Flow Cabinets | Thermo Scientific | 300590389 | |
| BioSpa 8 Automated Incubator | Agilent | 23082120 | |
| Cell Counter | Invitrogen | AMQAF2000 | |
| Cell Counting Chamber Slides | Thermo Scientific | C10283 | |
| CellTracker Deep Red | Thermo Fisher Scientific | C34565 | |
| Centrifuge | Thermo Scientific | 13100675 | |
| Cholera Toxin B subunit | Sigma-Aldrich | C9903-1MG | |
| Combitips advanced, Sterile, 5.0 mL | Fisher Scientific | 13-683-714 | |
| Cytation 10 Reader Imager | Agilent | 2105245 | |
| Defined Trypsin Inhibitor | Gibco | R007100 | soybean trypsin inhibitor in 1x PBS |
| Donor Horse Serum, 500 mL, United States Origin | Corning | 35-030-CV | |
| Dulbecco's Modified Eagle's Medium | Corning | 10-013-CV | |
| Excel Sofware | Microsoft office 365 | https://www.microsoft.com/en-us/microsoft-365/excel | |
| Fetal Bovine Serum | Thermo Scientific | 26140079 | |
| Fetal Bovine Serum, qualified, US origin | Thermo Scientific | 26140079 | |
| Gentamicin Sulfate, Liquid | Corning | 30-005-CR | |
| GraphPad Prism | |||
| Hydrocortisone solution,50 µM, sterile-filtered, BioXtra | Sigma-Aldrich | H6909-10ML | |
| Image J Software | Fiji | https://imagej.net/ij/ | |
| Insulin solution human | Sigma-Aldrich | I9278-5ML | |
| Magnifying Glass | Fisher Scientific | 01-182-392 | |
| Microcentrifuge Tube | Costar | 3621 | |
| Microscope | Olympus | CKX53SF | |
| Mini Lightbox | Fisher Scientific | 361044708 | |
| Molecular Probes CellTracker Blue CMAC Dye | Fisher Scientific | C2110 | |
| Molecular Probes CellTracker Orange CMRA Dye | Fisher Scientific | C34551 | |
| Penicillin-Streptomycin Solution | Cytiva | SV30010 | |
| Penicillin-Streptomycin Solution | Cytiva | SV30010 | |
| Phase-Contrast Microscope | Echo | RVSF1000 | |
| Phosphate Buffered Saline | Fisher Scientific | SH3025601 | |
| Pipet Controller | Corning | 4099 | |
| Pipette 100 – 1,000 µL | Eppendorf | 3123000063 | |
| Pipette 20 – 200 µL | Eppendorf | 3123000055 | |
| Prism | GraphPad Software | https://www.graphpad.com/features | |
| RPMI 1640 with L-glutamine and 25 mM HEPES | Corning | 10-041-CV | |
| Serological Pipette, 10 mL | Thermo Scientific | 170356N | |
| Serological Pipette, 25 mL | Thermo Scientific | 170357N | |
| Serological Pipette, 5 mL | Thermo Scientific | 170355N | |
| Trypan Blue Solution, 0.4% | Corning | 25900CI | |
| Trypsin-EDTA, 0.25% | Corning | 25053CI |
References
- de Visser, K. E., Joyce, J. A. The evolving tumor microenvironment: From cancer initiation to metastatic outgrowth. Cancer Cell. 41 (3), 374-403 (2023).
- Hanahan, D., Weinberg, R. A. Hallmarks of cancer: The next generation. Cell. 144 (5), 646-674 (2011).
- Anderson, N. M., Simon, M. C. The tumor microenvironment. Curr Biol. 30 (16), R921-R925 (2020).
- Baghban, R., et al. Tumor microenvironment complexity and therapeutic implications at a glance. Cell Commun Signal. 18 (1), 59 (2020).
- Sahai, E., et al. A framework for advancing our understanding of cancer-associated fibroblasts. Nat Rev Cancer. 20 (3), 174-186 (2020).
- Erdogan, B., Webb, D. J. Cancer-associated fibroblasts modulate growth factor signaling and extracellular matrix remodeling to regulate tumor metastasis. Biochem Soc Trans. 45 (1), 229-236 (2017).
- Iozzo, R. V., Sanderson, R. D. Proteoglycans in cancer biology, tumour microenvironment and angiogenesis. J Cell Mol Med. 15 (5), 1013-1031 (2011).
- Amersfoort, J., Eelen, G. Immunomodulation by endothelial cells - partnering up with the immune system. Nat Rev Immunol. 22 (9), 576-588 (2022).
- Balani, S., Nguyen, L. V., Eaves, C. J. Modeling the process of human tumorigenesis. Nat Commun. 8 (1), 15422 (2017).
- Drost, J., Clevers, H. Organoids in cancer research. Nat Rev Cancer. 18 (7), 407-418 (2018).
- Wang, E., Xiang, K., Zhang, Y., Wang, X. -. F. Patient-derived organoids (PDOs) and PDO-derived xenografts (PDOXs): New opportunities in establishing faithful pre-clinical cancer models. J Natl Cancer Cent. 2 (4), 263-276 (2022).
- Kamb, A. What's wrong with our cancer models. Nat Rev Drug Discov. 4 (2), 161-165 (2005).
- Tuveson, D., Clevers, H. Cancer modeling meets human organoid technology. Science. 364 (6444), 952-955 (2019).
- Zitvogel, L., Pitt, J. M., Daillère, R., Smyth, M. J. Mouse models in oncoimmunology. Nat Rev Cancer. 16 (12), 759-773 (2016).
- Liu, Y., et al. Patient-derived xenograft models in cancer therapy: technologies and applications. Signal Transduct Target Ther. 8 (1), 160 (2023).
- Ben-David, U., et al. Patient-derived xenografts undergo mouse-specific tumor evolution. Nat Genet. 49 (11), 1567-1575 (2017).
- Byrne, A. T., et al. Interrogating open issues in cancer precision medicine with patient-derived xenografts. Nat Rev Cancer. 17 (4), 254-268 (2017).
- Ivanics, T., et al. Patient-derived xenograft cryopreservation and reanimation outcomes are dependent on cryoprotectant type. Lab Invest. 98 (7), 947-956 (2018).
- Biju, T. S., Priya, V. V., Francis, A. P. Role of three-dimensional cell culture in therapeutics and diagnostics: an updated review. Drug Deliv and Transl Res. 13 (9), 2239-2253 (2023).
- Urzì, O., et al. Three-dimensional cell cultures: The bridge between in vitro and in vivo models. Int J Mol Sci. 24 (15), 12046 (2023).
- Cacciamali, A., Villa, R., Dotti, S. 3D cell cultures: Evolution of an ancient tool for new applications. Front Physiol. 13, 836480 (2022).
- Abuwatfa, W. H., Pitt, W. G. Scaffold-based 3D cell culture models in cancer research. J Biomed Sci. 31 (1), 7 (2024).
- Yakavets, I., et al. Advanced co-culture 3D breast cancer model for investigation of fibrosis induced by external stimuli: optimization study. Sci Rep. 10 (1), 21273 (2020).
- Mohammadrezaei, D., et al. Predicting and elucidating the post-printing behavior of 3D printed cancer cells in hydrogel structures by integrating in-vitro and in-silico experiments. Sci Rep. 13 (1), 1211 (2023).
- Kuen, J., Darowski, D., Kluge, T., Majety, M. Pancreatic cancer cell/fibroblast co-culture induces M2 like macrophages that influence therapeutic response in a 3D model. PLOS ONE. 12 (7), e0182039 (2017).
- Bray, F., et al. Global cancer statistics 2022: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin. 74 (3), 229-263 (2024).
- Kennecke, H., et al. Metastatic behavior of breast cancer subtypes. J Clin Oncol. 28 (20), 3271-3277 (2010).
- Neve, R. M., et al. A collection of breast cancer cell lines for the study of functionally distinct cancer subtypes. Cancer Cell. 10 (6), 515-527 (2006).
- Pingitore, P., et al. Human multilineage 3D spheroids as a model of liver steatosis and fibrosis. Int J Mol Sci. 20 (7), 1629 (2019).
- Bar-Ephraim, Y. E., Kretzschmar, K. Organoids in immunological research. Nat Rev Immunol. 20 (5), 279-293 (2020).
- Beerkens, A. P. M., et al. Characterizing OXPHOS inhibitor-mediated alleviation of hypoxia using high-throughput live cell-imaging. Cancer Metab. 12 (1), 13 (2024).
- Feaster, T. K., et al. Matrigel mattress. Cir Res. 117 (12), 995-1000 (2015).
- Huang, Z., Yu, P., Tang, J. Characterization of triple-negative breast cancer MDA-MB-231 cell spheroid model. Onco Targets Ther. 13, 5395-5405 (2020).
- Nam, S., Khawar, I. A., Park, J. K., Chang, S., Kuh, H. -. J. Cellular context-dependent interaction between cancer and stellate cells in hetero-type multicellular spheroids of pancreatic tumor. Biochem Biophys Res Commun. 515 (1), 183-189 (2019).
- Monteiro, M. V., Gaspar, V. M., Ferreira, L. P. Hydrogel 3D in vitro tumor models for screening cell aggregation mediated drug response. Biomater Sci. 8 (7), 1855-1864 (2020).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved