Method Article
상피암 세포의 스캐폴드가 없는 3D 배양에서 이종다세포 기질 세포(Heteromulticellular Stromal Cells in Scaffold-free 3D Cultures of Epithelial Cancer Cells to Drive Invasion)
요약
암 전이를 연구하기 위해 이세포성 누화를 캡처하는 3D 암 모델이 매우 필요합니다. 우리의 연구는 침입 및 세포 공간 분포를 연구하는 데 사용할 수 있는 골격 및 골격이 없는 환경에서 이종 다세포 기질-상피의 생성을 제시합니다.
초록
유방암은 미국 여성의 암 관련 사망 원인 중 두 번째로 큰 원인이며, 고형 종양의 오가노이드 모델은 증식 및 침습과 같은 암 진행의 측면을 충실하게 요약하는 것으로 나타났습니다. 환자 유래 오가노이드 및 환자 유래 이종 이식 오가노이드는 병태생리학적으로 관련이 있지만 전파 비용이 많이 들고 조작하기 어려우며 주로 종양 미세환경(TME) 내에서 가장 증식하는 세포 유형으로 구성됩니다. 이러한 한계는 TME 내에서 발견되고 전이 및 치료 저항성에 기여하는 것으로 알려진 종양 관련 기질 세포에 의존하는 질병 진행의 세포 메커니즘을 밝히는 데 사용하는 것을 방해합니다.
여기에서는 상피-기질 다세포 3D 배양을 배양하는 방법에 대해 보고합니다. 이러한 방법의 장점에는 하이드로겔 스캐폴드 내의 단일 세포 해상도에서 침입을 추적하는 데 사용할 수 있는 스캐폴드가 없는 환경 내에서 오가노이드와 같은 3D 배양을 빠르게 생성하는 비용 효율적인 시스템이 포함됩니다. 구체적으로, BT-474 유방암 세포를 섬유아세포(BJ-5ta), 단핵구 유사 세포(THP-1) 및/또는 내피 세포(EA.hy926)와 결합하여 이러한 이종 다세포 3D 배양을 생성하는 방법을 보여줍니다. 또한 세포 집단의 차등 형광 표지를 통해 타임 랩스 현미경을 통해 3D 배양 조립 및 침입 역학을 정의할 수 있습니다.
특히, BT-474 세포의 3D 배양에 두 개의 기질 세포 조합을 추가하면 오가노이드 유사 또는 2차 스페로이드 구조의 존재와 일치하는 3D 배양의 순환성이 크게 감소합니다. 추적기 염료 실험에서 섬유아세포와 내피 세포는 말초 오가노이드와 같은 돌출부에 공동 국소화되며 일차 BT-474 스페로이드와 공간적으로 분리됩니다. 마지막으로, BT-474 세포의 이종 다세포 3D 배양은 하이드로겔 침입 용량을 증가시켰습니다. 비종양형성 유방 상피세포와 종양형성 유방 상피 세포 모두의 이종다세포 3D 배양에서 이러한 돌출 구조를 관찰했기 때문에 이 연구는 고형 종양 진행과 관련된 표현형의 후속 분석을 위해 골격이 없는 환경에서 오가노이드와 같은 3D 배양을 생성하기 위한 효율적이고 재현 가능한 방법을 제공합니다.
서문
암 진행은 이제 두 가지 주요 요인, 즉 종양 세포의 유전적/후성유전학적 변화와 종양 미세환경(TME)에서 비종양 세포와의 무수한 상호 작용에 의존하는 것으로 인식되고 있습니다1. 세포의 유전적 변화가 종양 시작에 필요한 것으로 인정되고 있지만, 이러한 변화만으로는 종양 진행과 전이에 충분하지 않습니다2. TME의 구성 요소는 원래 조용한 방관자로 여겨졌지만, 이제는 종양 세포와의 상호 및 동적 누화를 통해 암 진행을 적극적으로 촉진하는 것으로 알려져 있습니다3. TME 구성은 종양이 유래한 조직, 종양 병기 및 환자 특성에 따라 다르지만, 특징적인 특징으로는 기질암 관련 섬유아세포(CAF), 세포외 기질(ECM), 혈관 내피 세포, 적응 면역 및 골수성 면역 세포가 있습니다 1,4.
TME의 기질 CAF는 다양한 기원과 기능을 가진 섬유아세포 아형으로 구성되어 있습니다5. 이러한 CAF는 여러 계면에서 종양 세포와 상호 작용하기 때문에 TME의 핵심 구성 요소입니다. CAF는 기질의 강성을 변화시키는 ECM 단백질을 분비하는데, 이는 콜라겐, 프로테오글리칸 및 피브로넥틴의 과도한 증착을 통해 약물 전달을 제한하거나 ECM 분해 기질 금속단백분해효소(MMP)의 분비를 통해 종양 세포가 원발성 종양 부위에서 침입할 수 있도록 할 수 있습니다6,7. 또한, CAF는 다양한 성장인자, 사이토카인, 혈관신생인자(epidermal growth factor, EGF), 형질전환성장인자(Transforming growth factor β, TGF-β), 혈관내피성장인자(VEGF)의 분비를 통해 종양 성장, 이동 및 혈관형성을 촉진한다 1,6. 이와 동시에, 저산소성 TME에 의해 유발된 내피 세포는 혈관신생 인자의 분비 증가와 백혈구 접착 분자의 분비 감소를 통해 종양 혈관화를 촉진하고 면역 세포 기능을 억제합니다 1,8.
암 진행의 복잡성이 명백히 복잡함에 따라 기본 암 연구에 TME 기질 구성 요소를 통합하는 것이 필수적이 되었습니다. 그러나 알려진 종양 병태생리학을 충실히 요약하는 모델의 확립은 여전히 중요한 미충족 요구입니다 9,10. 기존의 2차원(2D) 세포 배양 모델은 다루기 쉽고, 빠르게 배양되며, 재현성이 높지만, 빠르게 증식하는 암세포 클론으로만 구성되며 종양에서 발견되는 세포 이질성을 반영하지 않습니다 10,11,12. 유사한 방식으로, 형질전환 마우스 모델도 근친 교배로 인한 낮은 유전적 이질성, 면역 체계의 현저한 차이 및 조직학적 복잡성으로 인해 인간 종양 생물학을 포착하지 못합니다13,14. 이러한 한계로 인해 고전적인 암 모델에서 개발된 치료법은 종종 임상 환경으로 전환되지 못합니다.
환자 유래 이종이식편(patient-derived xenografts) 및 환자 유래 오가노이드(patient-derived organoid)와 같은 환자 유래 암 모델은 제자리 종양 분자 특징, 유전적 배경 및 세포 조직을 포착하여 기존 암 모델의 단점을 해결할 수 있습니다 10,11,15. 그러나 이러한 환자 유래 이종이식편 및 오가노이드는 복잡한 생착 절차와 긴 배양 시간을 필요로 합니다16,17. 종양 획득 및 샘플링 부위의 다양성과 냉동 보존의 낮은 효율성과 함께 고전적인 2D 세포 배양과 환자 유래 암 모델 사이의 다리 역할을 하는 모델을 개발할 필요가 있습니다11,18. 이와 관련하여 세포 배양의 3D 모델은 신속하게 배양할 수 있고 세포-세포 상호 작용, 세포-ECM 상호 작용, 저산소증, 혈관 신생 및 ECM19,20 생산과 같은 중요한 생체 내 종양 기능을 캡처할 수 있는 모델 역할을 할 수 있습니다.
3D 세포 배양 모델은 scaffold-free 및 scaffold 기반 모델 시스템으로 분류됩니다. 스캐폴드가 없는 시스템에서는 세포가 특정 저부착 세포 배양 플레이트를 사용하거나 배양 방법의 물리적 매개변수를 조작하여 구형 모양으로 자체 응집되도록 유도됩니다. 스캐폴드가 없는 3D 스페로이드를 얻기 위해 확립된 방법은 원심분리에 의한 간단한 세포 펠릿 배양부터 매달린 마이크로플레이트 방울, 자기 부상, 동적 생물반응기 및 미세유체 시스템에 이르기까지 다양합니다20,21. 스캐폴드 기반 3D 세포 배양은 생리학적 세포외 기질을 모방하기 위해 폴리머 또는 하이드로겔 기반 스캐폴드를 추가하여 설정됩니다19,22. 이러한 모델은 생체 내 세포 조직, 토폴로지, 매트릭스 부착, 이동 및 약물 반응을 모델링할 수 있는 엄청난 잠재력을 가지고 있습니다.
질병 상태의 ECM 구성 모델을 위한 스캐폴드 조작 외에도 3D 세포 배양을 사용하여 TME에서 이질적인 세포 집단을 모델링할 수도 있습니다. 암세포와 기질 섬유아세포 또는 내피 세포로 구성된 3D 세포 배양은 암과 개별 비종양 세포주의 상호 작용을 연구하는 데 사용되었습니다 23,24,25. 여러 이종 세포주로 구성된 이러한 3D 세포 배양을 확장하기 위한 재현 가능하고 비용 효율적인 방법은 연구원들이 종양 진행을 밝히는 데 도움이 될 것입니다. 여기에서는 증식, 침입 및 세포 상태 가소성을 연구하기 위해 상피-기질 다세포 3D 배양을 배양하는 방법에 대해 보고합니다. 이 프로토콜은 섬유아세포(BJ-5ta), 내피세포(Ea.hy926) 세포 및 단핵구 유사 세포(THP-1)에 이르는 기질 세포의 조합과 공동 배양된 유방암 세포의 비계 및 기저막 추출물 스캐폴드 기반 3D 배양을 설명합니다. 유방암은 현재 전 세계적으로 두 번째로 흔한 암이며 미국에서 여성에게 가장 많이 진단되는 암이다26. 유방암으로 인한 사망은 공격적인 HER2 농축 및 기저성 유방암 아형으로 진단된 환자에서 전반적으로 전이가 없고 전이가 없는 생존율이 현저히 감소하기 때문에 유방암의 전이성 및 치료 저항성 특성에 주로 기인한다27. 당사가 설명한 3D 세포 배양 프로토콜은 포르말린 고정 파라핀 포매 조직 보존 방법 및 후속 공간 생물학 응용 분야와 쌍을 이룰 수 있는 비용 효율적이고 빠르며 재현 가능한 배양 방법을 개발하는 데 도움이 될 수 있습니다.
프로토콜
1. 세포 배양 배지
알림: 생물 안전 캐비닛 내부의 모든 매체를 준비하십시오.
- BJ-5ta, BT474, EA.hy926 및 MDA-MB-468에 대한 세포 배양 배지를 준비하려면 Dulbecco's Modified Eagle Medium(DMEM) 고포도당 500mL에 10% 열 불활성화 소 태아 혈청(FBS) 및 1% 페니실린-스트렙토마이신을 피펫으로 보충합니다. 마이크로피펫에 0.1% 겐타마이신을 함유합니다.
- MCF10A용 세포 배양 배지를 준비하려면 DMEM/F12 500mL에 5% 말 혈청과 1% 페니실린-스트렙토마이신을 피펫으로 보충합니다. 마이크로피펫을 사용하여 0.1% 겐타마이신, 1μg/mL 하이드로코르티손 1mL, 10μg/mL 인슐린 500μL, 100ng/mL 콜레라 독소 50μL 및 20ng/mL 표피 성장 인자 10μL를 통합합니다.
- MCF10Ca1h에 대한 세포 배양 배지를 준비하려면 피펫으로 DMEM/F12 500mL에 5% 말 혈청과 1% 페니실린-스트렙토마이신을 보충합니다. 마이크로피펫에 0.1% 겐타마이신을 함유합니다.
- THP-1에 대한 세포 배양 배지를 준비하려면 RPMI 1640 500mL에 10% FBS 및 1% 페니실린-스트렙토마이신을 피펫으로 보충합니다. 마이크로피펫에 0.1% 겐타마이신을 함유합니다.
- 명시야 현미경으로 매일 세포의 성장을 평가하여 세포가 70-80% 포화도에 도달할 때까지 BJ-5ta, BT474, EA.hy926, MDA-MB-468, MCF10A 및 MCF10Ca1h에 대해 2-3일마다 세포 배양 배지를 교체합니다. THP-1 세포에 대해 일주일에 한 번 세포 배양 배지를 변경합니다.
- 5% CO2가 함유된 표준 세포 배양 인큐베이터에서 세포 배양 처리된 표면이 있는 100mm 접시에서 BJ-5ta, BT474, EA.hy926, MDA-MB-468, MCF10A 및 MCF10Ca1h 세포를 성장시킵니다.
- 5% CO2가 함유된 표준 세포 배양 인큐베이터에서 T75 세포 배양 처리 플라스크에서 THP-1 세포를 성장시킵니다.
2. 세포 수집
- 자외선을 켜서 생물 안전 캐비닛 내부를 15분 동안 소독합니다.
- 생물 안전 캐비닛 창틀을 열어 공기 흐름을 안정화하고 진공 흡입 시스템을 켭니다.
- 내부 후드 표면과 진공 흡입 시스템의 튜브를 70% 에탄올로 청소합니다.
- 생물 안전성 캐비닛 내부에 새로운 무혈청 세포 배양 배지 준비: 피펫을 사용하여 Dulbecco의 DMEM(Modified Eagle's medium) 고포도당 500mL에 1% 페니실린/스트렙토마이신을 보충합니다. 마이크로피펫에 0.1% 겐타마이신을 함유합니다.
- 실험을 시작하기 전에 세포 배양 배지, 인산염 완충 식염수(PBS) 및 트립신-EDTA(0.25%)를 비드 수조에 넣어 37°C로 가열합니다.
- 현미경을 통한 육안 검사를 통해 세포가 70-80% 합류하는지 확인합니다.
- 진공 흡입기를 사용하여 도금된 세포에서 배양 배지를 흡입하고 폐기합니다. 피펫으로 PBS 2mL로 남은 배지를 한 번 세척한 다음 진공 흡입기로 PBS를 흡인하고 폐기합니다.
참고 : THP-1 세포는 현탁액으로 성장합니다. 2.7-2.9단계는 생략할 수 있습니다. - 마이크로피펫을 사용하여 세포 배양 접시에 트립신 1mL를 추가하고 플레이트를 37°C의 5% CO2 인큐베이터에 5분 동안 넣습니다.
- 마이크로피펫으로 플레이트에 대두 트립신 억제제 1mL(1x PBS)를 추가하여 트립신을 비활성화합니다. P1000 마이크로피펫으로 액체 혼합물을 피펫팅하여 세포 클러스터를 분산시키고 플레이트 바닥에서 세포 현탁액을 수집합니다. 마이크로피펫을 사용하여 세포 현탁액을 15mL 코니컬 튜브로 옮기고 실온에서 5분 동안 100 × g 으로 원심분리합니다. 진공 흡입기로 상층액을 폐기하십시오.
- 세포 계수를 계속합니다.
3. 현탁액에서 작업 염료 용액 및 염색 세포의 준비
- cell tracker molecular fluorescent probes( 재료 표 참조)의 바이알을 열기 전에 37°C로 설정된 비드 수조에서 제품을 15분 동안 실온으로 예열합니다.
- 마이크로피펫을 사용하여 동결건조된 세포 추적기 파란색 염료(질량 = 5mg, 분자량 = 209.6g/mol)를 2.385mL의 DMSO와 함께 최종 농도 10mM까지 용해합니다.
- 마이크로피펫을 사용하여 동결건조된 세포 추적기 주황색 염료(질량 = 50μg, 분자량 = 550.4g/mol)를 9.084μL의 DMSO로 최종 농도 10mM까지 용해합니다.
- 마이크로피펫을 사용하여 동결건조된 세포 추적기 진한 적색 염료(질량 = 15μg, 분자량 = 698.3g/mol)를 20μL의 DMSO와 함께 최종 농도 1mM로 용해합니다.
- 마이크로피펫으로 염료 1μL를 2mL의 무혈청 DMEM 배지에 희석하여 working cell tracker blue dye 배지 용액(5μM)을 준비합니다.
- 마이크로피펫으로 염료 1μL를 무혈청 DMEM 배지 2mL에 희석하여 working cell tracker 주황색 염료 배지 용액(5μM)을 준비합니다.
- 마이크로피펫으로 염료 2μL를 2mL의 무혈청 DMEM 배지에 희석하여 working cell tracker deep red dye 배지 용액(1μM)을 준비합니다.
- 준비된 작업 세포 추적기 파란색, 주황색 및 진한 빨간색 염료 배지 용액(2mL)에 각각 상피 세포, BJ-5ta 섬유아세포 및 Ea.hy926 내피 세포를 마이크로피펫으로 재현탁합니다.
- 37°C의 5% CO2 인큐베이터에서 30분 동안 튜브를 배양합니다.
- 30분 배양 후 실온에서 5분 동안 100 x g 의 튜브를 원심분리합니다.
- 진공 흡입기로 상층액을 흡입 및 폐기하고 마이크로피펫으로 1mL의 10% FBS 혈청 함유 DMEM 배지에 펠릿을 완전히 재현탁합니다.
- 세포 계수를 계속합니다.
4. 세포 계수
- 세포 현탁액 10μL를 모아 마이크로피펫을 사용하여 마이크로튜브로 옮깁니다.
- 10μL의 트리판 블루와 피펫을 완전히 혼합합니다.
- 20μL의 cell-trypan 용액을 마이크로피펫으로 세포 계수 챔버 슬라이드로 옮깁니다. 자동화된 셀 카운터를 사용하여 셀을 삽입하고 계산합니다.
- 두 번의 판독값에서 평균 총 살아있는 세포 수를 계산합니다.
5. 계산
- 2,000 cells/300 μL에 해당하는 6.67 ×10 3 cells/mL의 농도로 각 세포 유형에 대한 작업 세포 스톡을 준비합니다.
참고: 총 재고량은 실험 표본 크기에 따라 달라집니다. - 단일 배양 스페로이드의 경우, 각 독립 샘플이 2,000개의 상피 세포에 해당하는 300μL의 상피 세포 작업 재고로 구성되어 있는지 확인하십시오.
- 공동 배양 스페로이드(두 가지 세포 유형)의 경우, 각 독립 샘플이 150μL의 상피 세포 작업 재고와 150μL의 기질 세포 작업 표준으로 구성되어야 합니다. 샘플에는 1,000개의 상피 세포와 1,000개의 기질 세포가 포함됩니다.
- 공동 배양 스페로이드(3가지 세포 유형)의 경우, 각 독립 샘플이 150μL의 상피 세포 작업 재고, 75μL의 기질 세포 #1 작업 재고 및 75μL의 기질 세포 #2 작업 재고로 구성되어 있는지 확인하십시오. 샘플에는 1,000개의 상피 세포, 작업 재고 #1의 500개 기질 세포 및 작업 재고 #2의 500개 기질 세포가 포함됩니다.
6. 도금
- 마이크로피펫으로 3번의 기술적 복제와 1번의 추가 실험을 위해 필요한 부피를 마이크로튜브로 옮깁니다. 피펫으로 완전히 혼합한 다음 샘플 300μL를 U자형 바닥, 초저 부착 96웰 마이크로플레이트의 웰로 옮깁니다.
- 각 추가 기술 복제에 대해 프로세스를 반복합니다.
- 96웰 플레이트를 37°C의 인큐베이터에 넣습니다.
7. 명시야 이미징
- 현미경을 사용하여 24시간에서 최대 96시간마다 스페로이드 성장 및 형태를 관찰합니다.
- 위상차 현미경을 사용한 이미지 스페로이드.
8. 트래커 염료로 염색된 스페로이드 및 기저막 추출물로 오버레이된 스페로이드에 대한 광시야 이미징 프로토콜 설정
- 재료 표에 나열된 이미징 및 자동 인큐베이터 장치를 켜고 이미징 소프트웨어의 작업 관리자에서 새 이미징 프로토콜을 만듭니다. 절차 탭에서 자동 인큐베이터 온도 설정점을 37°C로 설정하고 다음 단계를 계속하기 전에 인큐베이터가 CO2%와 온도를 평형화하도록 합니다.
참고: 사용된 각 염료(파란색, 진한 빨간색 및 주황색)에 적합한 필터가 있는 경우 대체 형광 이미저를 사용할 수 있습니다. - 이미지 설정을 다음 사양으로 설정합니다: 배율: 4X PL FL 위상, 시야각: 3185 x 3185 μm, 전체 WFOV.
- 채널에 대해 다음 사양을 사용하십시오: DAPI: 377/447 nm, 조명 = 10, 통합 시간 = 107 ms, 게인 = 10, RFP: 531/593 nm, 조명 = 10, 통합 시간 = 137 ms, 게인 = 10, CY5: 628/685 nm, 조명 = 10, 통합 시간 = 137 ms, 게인 = 10.
- 기저 멤브레인 추출물 용액 오버레이에서 스페로이드를 이미징하려면 조명 = 10, 통합 시간 = 5ms, 이득 = 17.1의 명시야 사양을 사용합니다.
- 이미징을 위해 원하는 well을 선택하고 select wells 아이콘을 클릭하여 사양 변경을 승인합니다.
- Data Reduction(데이터 축소) 탭으로 이동하여 세포 분석 설정을 조정합니다.
- 밝은 배경에서 임계값을 19,500으로 설정하고 마스크에 구멍 채우기를 선택합니다.
- 개체 선택의 경우 최소 개체 크기를 100μm로, 최대 개체 크기를 1,000μm로 설정하고 전체 이미지 분석을 선택합니다.
참고: 이 분석에는 기본 마스크와 개체 수만 필요합니다. - 모든 변경 사항을 저장하고 이미저 응용 프로그램을 엽니다.
- 서랍을 열어 실험용 U자형 바닥 마이크로플레이트를 인큐베이터에 넣은 다음 이미저 소프트웨어를 사용하여 닫습니다.
- 프로토콜을 실행하려면 Procedure Info(절차 정보 ) 탭을 클릭하고 사용자를 추가한 다음 프로토콜을 선택합니다.
- 올바른 플레이트 유형이 선택되었는지 확인하고 이미징 시간을 플레이트당 30분으로 설정합니다.
- 원하는 이미징 간격을 선택하고, 플레이트에 뚜껑이 있는지 여부를 표시하고, 이미징 시작 시간과 지속 시간을 조정합니다.
- Schedule Plate/Vessel을 클릭하여 이미징 프로세스를 시작합니다.
9. 기저막 추출물 용액 오버레이 (선택 사항)
참고: 기저막 추출물 용액은 도금 후 24시간 이내에 스페로이드에 적용할 수 있습니다.
- 얼음 양동이에 얼음을 채워 기저막 추출물 용액을 차갑게 유지하고 사용하지 않을 때는 4°C에서 보관하십시오.
- 멀티채널 피펫으로 약 170μL의 배지를 흡입합니다.
- 돋보기와 미니 라이트박스를 사용하여 작은 스페로이드를 자세히 관찰합니다. 96웰 스페로이드 플레이트를 라이트박스 위에 놓고 돋보기를 머리 위에 놓습니다.
- P200 피펫을 30 μL로 설정하고 기저 멤브레인 추출물을 수집하여 3개의 마이크로액적을 생성합니다.
- 마이크로피펫으로 3가지 기술 복제물의 각 스페로이드에 하나의 마이크로드롭을 추가합니다.
- 96웰 플레이트가 평평한지 확인하고 피펫을 스페로이드 위에 수직으로 배치합니다. 우물 바닥에 닿지 않고 물방울을 방출하십시오.
- 플레이트를 37°C의 인큐베이터에 20분 동안 놓습니다.
- 마이크로피펫을 사용하여 웰당 추가로 50μL의 기저 멤브레인 추출물 용액을 스페로이드에 오버레이합니다.
- 피펫 팁을 사용하여 스페로이드를 웰 중앙으로 재배치합니다.
- 37 °C에서 30 분 동안 배양합니다.
- 각 웰에 100μL의 세포 배양 배지를 추가합니다.
10. 정량화
- ImageJ 소프트웨어를 다운로드하여 엽니다. 스페로이드 이미지를 업로드합니다.
- Analyze(분석) | Measurements를 설정하고 Area | 중심점. 올가미 도구를 사용하여 스페로이드를 추적하고 물체를 측정하여 스페로이드를 측정합니다.
- 3개의 생물학적 복제에 대한 값을 기록하고 평균 면적과 원형도를 계산합니다.
- 다음 공식을 사용하여 면적을 픽셀에서 평방 미터로 변환합니다.
면적(m2) = ((550/504) × √(픽셀 단위의 면적)) 2 - 데이터를 분석합니다.
- Enter replicate values, stacked into columns(열에 누적된 복제 값 입력)를 선택합니다.
- 열에 데이터를 입력하고 단일배양 스페로이드 대조군과 공동 배양 처리 스페로이드 샘플을 선택합니다.
- 일원 분산 분석 컬럼 분석을 수행합니다.
- 다음 ANOVA 매개변수를 사용합니다.
- 일치 또는 페어링을 피하십시오.
- 잔차의 가우스 분포를 가정합니다.
- 동일한 표준 편차를 가정합니다.
- Tukey의 다중 비교 검정을 사용하여 각 열의 평균을 다른 모든 열의 평균과 비교합니다.
11. 광시야 면역 형광 이미지 처리
- 이미저 소프트웨어에서 직접 이미지를 PNG 또는 Tiff 파일 형식으로 저장합니다.
- 각 개별 채널 또는 겹치는 채널을 선택하고 PNG 파일로 저장합니다.
- 이미저 소프트웨어 또는 ImageJ(이미지를 Tiff 파일로 내보내는 경우)에서 밝기와 대비를 조정합니다.
결과
본 연구에서는 오가노이드와 같은 형태를 가진 상피 세포와 기질 세포로 구성된 이종 다세포 3D 스페로이드를 생성하기 위한 세포 배양 시스템을 개발했습니다. 스페로이드는 단일배양 조건에서 2,000개의 상피 세포를 도금하여 확립되었습니다. 두 가지 세포 유형의 공동 배양 조건에서 1,000개의 상피 세포와 1,000개의 기질 세포를 도금하여 스페로이드를 확립했습니다. 3가지 세포 유형의 공동 배양 조건에서 1,000개의 상피 세포와 각 세포 유형별 500개 세포로 구성된 2가지 다른 기질 세포 유형을 도금하여 스페로이드를 확립했습니다. 스페로이드 형성의 상류에서는 세포 공간 조직을 모니터링할 수 있는 형광 세포 추적기 염료로 세포를 염색할 수 있습니다. 초기 스페로이드 형성 24시간 후, 다운스트림 응용 분야에는 약리학적 섭동, 이미징 및 샘플 수집이 포함됩니다. 타임 랩스 이미징은 면적 및 원형도를 포함한 스페로이드 거동 및 형태학의 변화를 평가하는 데 유용합니다(그림 1A). 도금 후 24시간 동안 스페로이드를 스캐폴드 환경에 내장할 수 있으며, 타임랩스 이미징을 사용하여 스페로이드에서 침습 구조의 시작을 평가할 수 있습니다(그림 1B). 이종 다세포 스페로이드 시료 수집은 RNA 염기서열분석, 단세포 RNA 염기서열분석, 단백질체 염기서열분석 및 고리형 면역형광과 같은 실험 기술을 통해 전역 및 단일 세포 수준에서 게놈 및 단백질체 프로파일링을 포함한 많은 응용 분야를 가지고 있습니다.
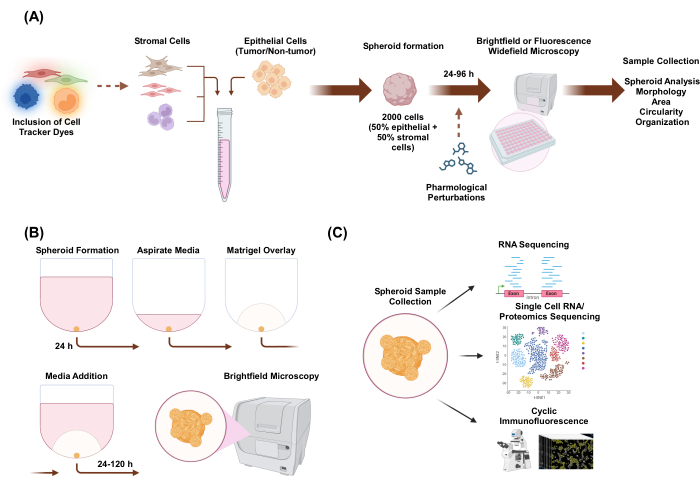
그림 1: 3D 세포 배양 과정의 개략도와 잠재적 응용 분야. (A) 비상피 기질 세포가 있는 상피 세포의 세포 현탁액을 3D 초저 부착 플레이트에 피펫으로 삽입하여 스페로이드를 형성합니다. 스페로이드는 96시간 동안 24시간마다 명시야 현미경으로 이미지화됩니다. 세포주는 스페로이드 형성을 유도하기 전에 다운스트림 광시야 현미경 검사를 위해 형광 세포 추적기 염료로 염색 하거나 스페로이드 형성 후 약리학적으로 교란할 수 있습니다. 형태학, 면적, 원형도 및 조직과 같은 스페로이드 매개변수를 분석할 수 있습니다. (B) 기질 세포를 가진 상피 및 상피 세포의 스페로이드는 A의 프로토콜을 사용하여 형성됩니다. 스페로이드는 단일배양 조건에서 2,000개의 상피 세포를 도금하여 확립되었습니다. 두 가지 세포 유형의 공동 배양 조건에서 1,000개의 상피 세포와 1,000개의 기질 세포를 도금하여 스페로이드를 확립했습니다. 3가지 세포 유형의 공동 배양 조건에서 1,000개의 상피 세포와 각 세포 유형별 500개 세포로 구성된 2가지 다른 기질 세포 유형을 도금하여 스페로이드를 확립했습니다. 24시간 후, 골격과 같은 기저막 추출물 용액을 오버레이하고 120시간 동안 24시간마다 명시야 현미경으로 이미지를 캡처합니다.(C) 확립된 골격이 없는 골격 기반 이종-다세포 3D 배양은 고리형 면역형광, 단일 세포 RNA 염기서열 분석 및 단일 세포 단백질체학과 같은 다양한 다운스트림 응용 분야에 사용할 수 있습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
MCF10A, MCF10Ca1h 및 BT-474 단일배양 스페노이드는 도금 후 최대 96시간 동안 컴팩트한 구형 표현형을 유지합니다. EA.hy926 미세혈관 내피 세포, BJ-5ta 섬유아세포 및/또는 THP-1 단핵구 유사 세포와 공동 배양했을 때 스페로이드는 주변부에 세포 돌출부를 발달시켰으며, 이는 96시간에서 더 뚜렷해졌습니다(그림 2A-C). 중요한 것은 스페로이드의 이러한 돌출부, 발아 및 압축 현상이 암 스페로이드와 공동 배양된 기질 세포의 세포 조직의 변화를 나타내며, 이는 Matrigel과 같은 기저막 기반 하이드로겔 첨가에 따른 3D 침습성과 상관관계가 있다는 것입니다. 싹트는 형태는 고체에서 느슨한 세포 응집체에 이르기까지 다양했으며, 이는 오가노이드 형태학과 유사합니다. 대조적으로, MDA-MB-468 단일배양 스페로이드는 크고 느슨한 세포 응집체로 나타났습니다. 그러나 MDA-MB-468 세포를 EA.hy926, BJ-5ta 및/또는 THP-1과 공동 배양했을 때 소형 스페로이드를 형성했습니다(그림 2D).
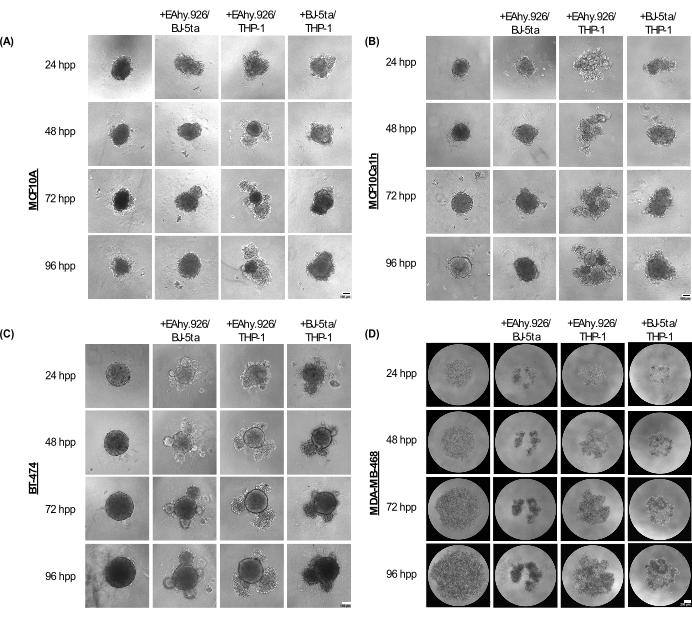
그림 2: 스캐폴드가 없는 3D 배양에서 상피 종양/비종양 세포와 결합할 때 비상피 기질 세포의 조합에 의해 채택되는 구조 및 형태학의 범위. 96시간에 걸쳐 기질 BJ-5ta 섬유아세포/Ea.hy926 미세혈관 내피 세포 또는 Ea.hy926/THP-1 단핵구 유사 세포 또는 BJ-5ta/THP-1 세포와 함께 단일 배양 또는 공동 배양 조건에서 (A) MCF10A, (B) MCF10Ca1h, (C) BT-474, (D) MDA-MB-468 스페로이드의 대표적인 명시야 이미지. 각 스페로이드는 2,000개의 세포를 도금하여 형성되었습니다. 단일배양 조건에서의 스페로이드는 2,000개의 상피 세포를 사용하여 형성되었습니다. 공동 배양 조건에서의 스페로이드는 1,000개의 상피 세포와 500개의 세포로 구성된 두 가지 다른 기질 세포 유형을 사용하여 형성되었습니다. 발아 또는 응집된 오가노이드 유사 구조의 형성은 MCF10A, MCF10Ca1h 및 BT-474 상피 세포에서 도금 후 24시간 후 스페로이드 공동 배양 조건에서 시작되었습니다. MDA-MB-468 세포의 압축은 도금 후 25시간 후 스페로이드 공동 배양 조건에서 관찰되었습니다. 스케일 바 = 100μm. 약어 : hpp = 도금 후 시간. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
EA.hy926 및 THP-1 또는 BJ-5ta 및 THP-1과 공동 배양한 MCF10A, MCF10Ca1h 및 BT-474 세포는 도금 후 72시간에서 단일 배양 상피 스페로이드에 비해 스페로이드 면적이 크게 증가했습니다. MCF10Ca1h는 또한 EA.hy926 및 BJ-5ta와 공동 배양했을 때 스페로이드 면적이 크게 증가한 것으로 나타났습니다. 공동 배양된 스페로이드에서 발아 구조의 시작으로 EA.hy926 및 THP-1 또는 BJ-5ta 및 THP-1과 공동 배양된 MCF10A, MCF10Ca1h 및 BT-474의 스페로이드 순환도가 크게 감소했습니다. EA.hy926 및 BJ-5ta와 함께 배양된 BT-474에서도 유사한 효과가 관찰되었습니다(그림 3A, B). 대조적으로, EA.hy926 및 BJ-5ta, EA.hy926 및 THP-1 또는 BJ-5ta 및 THP-1과 공동 배양된 MDA-MB-468 세포는 단일 배양 MDA-MB-468 스페로이드에 비해 스페로이드 면적이 현저히 감소했습니다. 그러나 순환성에는 영향이 없었습니다(그림 3A, B).

그림 3: 도금 후 72시간 동안 단일 배양 및 이종 다세포 기질 3D 스캐폴드가 없는 배양의 면적 및 원형도 분석 그래프. (A) 도금 후 72시간 동안 단일 배양 및 이종 다세포 기질 스페로이드 배양에서 MCF10A, MCF10Ca1h, BT-474 및 MDA-MB-468의 평균 면적(cm2) 및 (B) 평균 원형도. 보고된 데이터는 최소 3개의 독립적인 생물학적 복제물을 대표하며 달리 표시되지 않는 한 SEM± 기술적 복제 평균으로 보고됩니다. *, **, *** 또는 ****는 달리 명시되지 않는 한 각각 0.05, 0.01, 0.001 또는 0.0001< p 값을 나타냅니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
스페로이드 확립 전에 BT-474 종양형성 상피세포와 기질세포에 세포 추적기 염료를 적용한 결과, EA.hy926 및 BJ-5ta를 포함한 기질세포가 중앙 BT474 스페로이드 주변에서 발아 구조를 형성한다는 사실이 입증되었습니다(그림 4, 보충 동영상 S1, 보충 동영상 S2, 보충 동영상 S3 및 보충 동영상 S4). 도금 후 48시간에서 섬유아세포와 공동 배양된 스페로이드의 개별 광시야 형광 이미지는 섬유아세포 스페로이드가 내피 세포와 함께 공동 국소화되었지만 BT-474 스페로이드와 공동 국소화되지 않았음을 보여줍니다. 또한 소수의 내피 세포가 공동 배양 조건에서 BT-474 스페로이드와 공동 국소화하는 것으로 밝혀졌습니다. 이는 스페로이드 내 기질 세포의 배열이 오가노이드와 같은 형태와 상관관계가 있음을 시사합니다.
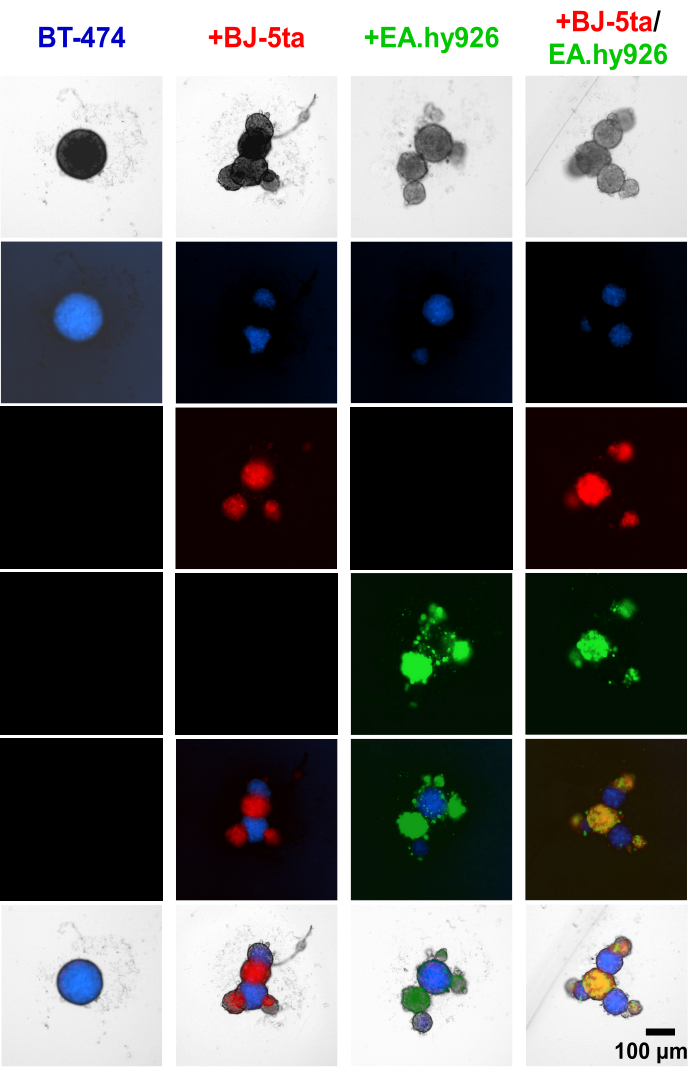
그림 4: 도금 후 48시간 동안 이종 다세포 3D 배양에서 차등적으로 염색된 기질 및 BT-474 세포의 광시야 형광 스틸 이미지. BT-474 스페로이드는 청색 세포 추적기 형광 염료로 염색됩니다. BJ-5ta 섬유아세포는 빨간색으로 표시되는 주황색 세포 추적기 염료로 염색됩니다. Ea.hy926 내피 세포는 녹색으로 표시되는 짙은 적색 세포 추적기 염료로 염색됩니다. 각 스페로이드는 2,000개의 세포를 도금하여 형성되었습니다. 단일배양 조건에서의 스페로이드는 2,000개의 상피 세포를 사용하여 형성되었습니다. 공동 배양 조건(BT-474/BJ-5ta, BT-474/Ea.hy926)에서 1,000개의 상피 세포와 1,000개의 기질 세포를 사용하여 스페로이드를 형성했습니다. 이중 공동 배양 조건(BT-474/BJ-5ta/Ea.hy926)에서 스페로이드는 1,000개의 상피 세포와 각 기질 세포 유형의 500개 세포를 사용하여 형성되었습니다. 수치는 적어도 3 개의 생물학적 복제를 대표합니다. 스케일 바 = 100μm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
오가노이드 스페로이드 모델의 생물학적 관련성을 평가하기 위해 도금 후 24시간 후에 스페로이드를 기저막 추출물 용액으로 오버레이했습니다. 단일배양 BT-474 스페로이드는 도금 후 120시간 동안 침습성을 나타내지 않았습니다. 그러나 BJ-5ta 또는 EA.hy926과 공동배양한 BT-474 스페로이드는 스페로이드 주변부에 구조를 발달시켜 스캐폴드 기저막 추출물 용액 환경을 침범했습니다. BJ-5ta 및 EA.hy926과 함께 배양된 BT-474 스페로이드에서 도금 후 48시간에서 120시간까지 이러한 돌출부의 수와 길이가 크게 향상되었습니다(그림 5, 보충 비디오 S5, 보충 비디오 S6, 보충 비디오 S7 및 보충 비디오 S8).
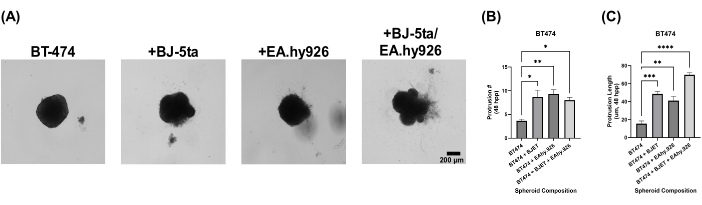
그림 5: 오버레이 후 5일 시점에 기저막 추출물 용액 오버레이를 사용한 이종 다세포 3D 배양에서 BT-474 세포의 명시야 스틸 이미지. 각 스페로이드는 2,000개의 세포를 도금하여 형성되었습니다. 기저 멤브레인 추출물 용액을 도금 후 24시간 동안 스페로이드 위에 오버레이했습니다. 단일배양 조건에서의 스페로이드는 2,000개의 상피 세포를 사용하여 형성되었습니다. 공동 배양 조건(BT-474/BJ-5ta 및 BT-474/Ea.hy926)에서 1,000개의 상피 세포와 1,000개의 기질 세포를 사용하여 스페로이드를 형성했습니다. 이중 공동 배양 조건(BT-474/BJ-5ta/Ea.hy926)에서 스페로이드는 1,000개의 상피 세포와 각 기질 세포 유형의 500개 세포를 사용하여 형성되었습니다. (A) 기저막 추출물 용액에 박힌 암 스페로이드에서 돌출된 침습 구조를 공동 배양 조건에서 관찰할 수 있습니다. (B) 시간 48 hpp에서 침습적 돌출 횟수의 자격. (C) 시간 48 hpp에서의 침습적 돌출 길이의 자격. 수치는 적어도 3 개의 생물학적 복제를 대표합니다. 눈금 막대 = 200μm. 약어 : hpp = 도금 후 시간. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
보충 동영상 S1: 세포 추적기 청색 염료를 사용한 BT-474 단일배양 스페로이드. BT-474(2,000) 세포를 U자형 바닥, 초저 부착 96웰 마이크로플레이트에 재현탁하여 스페로이드를 형성했습니다. 명시야와 광시야 형광 이미지의 겹침은 48시간 동안 캡처되었습니다. 약어 : ULA = ultralow attachment. 이 비디오를 다운로드하려면 여기를 클릭하십시오.
보충 비디오 S2: BJ-5ta 섬유아세포와 공동 배양된 BT-474 스페로이드. BT-474(1,000개) 및 1,000개의 BJ-5ta 섬유아세포를 ULA 플레이트에 재현탁시켜 스페로이드를 형성했습니다. BT-474 세포는 cell tracker blue dye로, BJ-5ta 섬유아세포는 cell tracker orange dye로 배양하였다. 명시야 형광과 광시야 형광(파란색 = BT-474, 빨간색 = BJ-5ta) 이미지의 중첩이 48시간 동안 캡처되었습니다. 약어 : ULA = ultralow attachment. 이 비디오를 다운로드하려면 여기를 클릭하십시오.
보충 동영상 S3: Ea.hy926 내피 세포와 공동 배양된 BT-474 스페로이드. BT-474 (1,000) 및 1,000 Ea.hy926 내피 세포를 ULA 플레이트에 재현탁하여 스페로이드를 형성했습니다. BT-474 세포는 세포 추적기 블루 염료와 Ea.hy926 내피 세포를 세포 추적기 딥 레드 염료로 배양했습니다. 명시야 및 광시야 형광등(파란색 = BT-474, 녹색 = Ea.hy926) 이미지의 중첩이 48시간 동안 캡처되었습니다. 약어 : ULA = ultralow attachment. 이 비디오를 다운로드하려면 여기를 클릭하십시오.
보충 동영상 S4: BJ-5ta 섬유아세포 및 Ea.hy926 내피 세포와 공동 배양된 BT-474 스페로이드. BT-474 (1,000), 500 BJ-5ta 섬유아세포 및 500 Ea.hy926 내피 세포를 ULA 플레이트에 재현탁하여 스페로이드를 형성했습니다. BT-474 세포는 cell tracker blue dye로 배양했습니다. BJ-5ta 섬유아세포와 Ea.hy926 내피 세포를 각각 세포 추적기 주황색 염료와 진한 빨간색 염료로 배양했습니다. 명시야 및 광시야 형광등(파란색 = BT-474, 빨간색 = BJ-5ta, 녹색 = Ea.hy926) 이미지의 중첩이 48시간 동안 캡처되었습니다. 약어 : ULA = ultralow attachment. 이 비디오를 다운로드하려면 여기를 클릭하십시오.
보충 비디오 S5: 기저막 추출물 용액의 BT-474 단일배양 스페로이드. BT-474 세포(2,000개)를 ULA 플레이트에 재현탁시켜 스페로이드를 형성하고, 스페로이드를 도금 후 24시간 이내에 기저막 용액에 매립하였다. 명시야 이미지는 60시간 이상 촬영되었습니다. 약어 : ULA = ultralow attachment. 이 비디오를 다운로드하려면 여기를 클릭하십시오.
보충 동영상 S6: 기저막 추출물 용액에서 BJ-5ta 섬유아세포와 공동 배양된 BT-474 스페로이드. BT-474(1,000개) 및 1,000개의 BJ-5ta 섬유아세포를 ULA 플레이트에 재현탁시켜 스페로이드를 형성하고, 스페로이드를 도금 후 24시간 이내에 기저막 추출물 용액에 매립하였다. 명시야 이미지는 60시간 이상 촬영되었습니다. 약어 : ULA = ultralow attachment. 이 비디오를 다운로드하려면 여기를 클릭하십시오.
보충 동영상 S7: 기저막 추출물 용액에서 Ea.hy926 내피 세포와 공동 배양된 BT-474 스페로이드. BT-474 (1,000) 및 1,000 Ea.hy926 내피 세포를 ULA 플레이트에 재현탁시켜 스페로이드를 형성하고, 스페로이드를 도금 후 24시간 후에 기저막 추출물 용액에 매립하였다. 명시야 이미지는 60시간 이상 촬영되었습니다. 약어 : ULA = ultralow attachment. 이 비디오를 다운로드하려면 여기를 클릭하십시오.
보충 동영상 S8: 기저막 추출물 용액에서 BJ-5ta 섬유아세포 및 Ea.hy926 내피 세포와 함께 배양된 BT-474 스페로이드. BT-474 (1,000), 500 BJ-5ta 섬유아세포, 500 Ea.hy926 내피세포를 ULA plate에 재현탁시켜 spheroid를 형성하고, spheroid를 도금 24h 후 기저막 추출물 용액에 매립하였다. 명시야 이미지는 60시간 이상 촬영되었습니다. 이 비디오를 다운로드하려면 여기를 클릭하십시오.
토론
당사의 이종-다세포 스페로이드 모델은 상피-기질 세포 상호 작용이 스캐폴드가 없는 3D 배양 조건에서 기질 세포 발아와 스캐폴드 기반 3D 배양 조건에서 침습성 구조의 형성을 주도한다는 것을 보여줍니다. 종양형성 세포주(MCF10Ca1h 및 BT-474)와 비종양형성 상피 세포주 MCF10A(그림 2A-C) 모두에서 일관된 발아 구조 형성을 관찰했습니다. 흥미롭게도, 세포주 MCF10A, MCF10Ca1h 및 BT-474의 스페로이드는 단일배양 또는 섬유아세포 및 내피 세포와의 공동 배양에서 비계가 없는 환경에서 원형의 조밀한 발아 구조를 형성한 반면, 세포주 MDA-MB-468의 스페로이드는 압축이 적은 것으로 나타났습니다(그림 2D). MDA-MB-468 세포는 테스트된 다른 상피 세포주와 마찬가지로 원형 스페로이드를 형성할 것으로 예상되었기 때문에 이는 예상치 못한 일이었습니다. 하이브리드 상피-중간엽 원발성 유방암 세포주인 세포주 SUM-149는 MCF10A, MCF10Ca1h 및 BT-474(데이터는 표시되지 않음)와 같은 소형 스페로이드를 형성하는 것으로 밝혀졌습니다28. 향후 연구에서는 MDA-MB-468 세포주에서 덜 조밀한 스페로이드의 형성을 매개하는 신호 전달 경로를 조사해야 하는데, 이러한 이상은 새로운 치료 전략 개발에 활용될 수 있는 세포 취약성을 나타낼 수 있기 때문입니다.
서로 다른 세포주의 조합과 관련하여, THP-1 단핵구 유사 세포는 스페로이드의 모든 공동 배양 조건에서 느슨한 응집 구조의 형성을 유도합니다. THP-1/BJ-5ta 세포와의 공동 배양 조건에서의 신진 구조에 비해 THP-1/Ea.hy926 세포와의 공동 배양 조건에서 신진 구조에서 압축이 덜 관찰됩니다(그림 2A-D). 그러므로, 스페로이드의 압축은 모델29,30의 기질 세포 조성에 의해 영향을 받는다.
이종 세포 조합의 일관되지 않은 도금은 기술적 복제에 비해 불완전한 스페로이드 발달 또는 스페로이드 크기의 변동성을 초래할 수 있습니다. 세포 도금의 일관성을 보장하는 것이 중요한데, 스페로이드 표현형과 발달을 결정하는 세포의 공간적 배열은 주로 처음 48시간 이내에 발생하기 때문입니다31. 이 중요한 시기에는 세포 비율이 중요한 역할을 하며, 기질 세포의 비율은 스페로이드 면적과 순환성 모두에 영향을 미칩니다.
세포 유형에 따라 달라지는 느슨한 스페로이드 응집체는 수동 취급 중에 쉽게 분해될 수 있습니다. 그러나 스페로이드를 골격과 같은 기저막 추출물 용액으로 오버레이하거나 전체 스페로이드 샘플을 수집할 때 수동 조작이 필요합니다. 이 문제를 완화하려면 피펫 흡입을 통해 스페로이드를 수집할 때 더 느린 속도로 작업하고 가능하면 수동 처리를 최소화하는 것이 좋습니다. 기저막 추출물 용액 오버레이 동안 스페로이드는 우물 내에서 이동하는 경향이 있으며 종종 우물의 가장자리에 침전됩니다. 기저막 추출물 용액 대 매체 비율은 3D 시스템의 매트릭스 특성을 유지하는 데 중요합니다. 그러나 기저막 추출물 용액의 점도로 인해 스페로이드를 완전히 둘러쌀 수 없으므로 수동 개입이 필요합니다32. 중심이 맞지 않는 스페로이드 포지셔닝은 웰의 플라스틱 가장자리 근처의 빛 굴절이 이미지 선명도를 방해할 수 있기 때문에 이미징에 어려움을 줍니다.
이 연구에 사용된 스페로이드는 인간 암 세포주로 구성되었습니다. 여기에 설명된 방법은 아직 1차 세포주에 적용되지 않았습니다. 본 연구 결과는 특정 세포-세포 상호작용이 오가노이드 유사 구조의 형성을 촉진할 수 있음을 시사하며, 이는 이 방법을 광범위한 종양 형성 세포주에 적용할 수 있음을 시사합니다. 그러나 본 연구의 모델은 종양 미세환경의 복잡성을 모방하려고 시도하지만, 세포 증식 속도의 차이는 장기 연구에 어려움을 안겨준다33. 빠르게 증식하는 세포는 느리게 증식하는 세포보다 성장하는 경향이 있으므로 이 모델은 확장된 실험에 적합하지 않습니다. 또한 세포주에 대한 다양한 성장 배지 유형 요구 사항은 스페로이드 표현형으로 이어질 수 있는 추가 요인을 유발할 수 있습니다. 이 연구에서 대부분의 세포주는 DMEM 배지에서 성장했습니다. 서로 다른 배지에서 성장한 세포주를 사용한 연구에는 다양한 배지 비율을 테스트하는 다양한 배양 조건이 필요할 수 있습니다. 그러나 이러한 효과는 장기 실험30에서 관찰된다.
우리 모델은 다른 3D 암 모델에 비해 몇 가지 이점을 제공합니다. 우리가 생성하는 스페로이드는 균일하고 재현 가능한 초기 형태와 크기를 가지고 있어 치료 결과를 대조군과 쉽게 비교할 수 있습니다. 대조적으로, 매체 또는 골격에 부유하는 단일 세포를 사용하는 일부 모델은 다양한 세포 공간 분포를 초래하여 불일치를 초래할 수 있습니다. 이 모델은 서로 다른 세포 집단 간의 상호 작용을 효과적으로 연구할 수 있음을 보여줍니다.
전통적으로 오가노이드 및 스페로이드 모델은 영양소, 저산소증 또는 세포 배열의 구배를 조사하기 위해 단일배양 암세포 또는 암세포 공동 배양으로 구성되었습니다34. 또한 이 모델은 도금 후 24시간 이내에 골격 환경에서 연구할 수 있어 다양한 세포-세포 상호 작용에 의해 주도되는 조기 침입 이벤트를 탐색할 수 있는 기회를 제공합니다. 대안적인 3D 암 접근법은 스페로이드 형태 및 침습성의 변화를 연구하기 위해 다양한 골격 매트릭스 구성 요소를 사용하지만, 이 모델은 세포 집단 역학과 골격 구성의 맥락에서 이러한 변화를 조사할 수 있도록 함으로써 이를 보완합니다35.
당사의 방법을 사용하여 생산된 대부분의 스페로이드는 수동 처리 후에도 구조적 무결성을 유지하여 다운스트림 응용 분야에서 샘플을 수집할 수 있습니다. CRISPR-Cas9, 렌티바이러스 shRNA 형질도입 및 siRNA 간섭과 같은 기존의 유전자 변형은 스페로이드 형성의 상류에 도입될 수 있습니다. 이러한 스페로이드에서 관찰된 복잡한 행동은 유전자 발현의 역동적인 변화를 시사하며, 이는 RNA-seq를 사용하여 추가로 조사할 수 있습니다. CycIF, scRNA-seq, CosMx 및 Visium과 같은 고급 기술을 사용하여 공간 또는 단일 세포 수준에서 유전체학 및 단백질체학을 연구할 수도 있습니다. 이 스페로이드 모델은 암세포에 도달하기 전에 기질 세포 싹과 치료제 간의 상호 작용을 포착하여 표적 종양 치료제의 생체 내 연구를 모방할 수 있는 잠재력을 가지고 있습니다. 이는 기질 세포가 약물의 효능에 영향을 미치는지 여부를 결정하는 데 도움이 될 수 있기 때문에 중요하며, 잠재적으로 치료 효과로부터 암세포를 보호할 수 있습니다.
공개
저자는 선언할 이해 상충이 없습니다.
감사의 말
이 원고를 준비하는 동안 도움이 되는 의견과 피드백을 주신 Baylor University Developmental Oncogene Laboratory 구성원에게 감사드립니다. 자금 지원은 Baylor University Department of Biology and College of Arts and Sciences, NIH-NIGMS 2SC1GM121182(J.A.K.에게)에서 제공했습니다.
자료
| Name | Company | Catalog Number | Comments |
| 15 mL Polypropylene Centrifuge Tubes | Falcon | 14-959-53A | |
| 96-Well, Treated, U-Shaped-Bottom Microplate | Thermo Scientific | 12566432 | |
| 100 mm Dish Cell Culture Treated Surface | Thermo Scientific | 130182 | |
| 170 L CO2 Incubators | VWR | VWR51014991(10810902) | |
| 200 Self-Sealing Barrier Pipet Tips | Fisher Scientific | 02-682-255 | |
| 500 mL DMEM/Hams F-12, [+] L-glutamine | Corning | 10-090-CV | |
| 1000 Self-Sealing Barrier Pipet Tips | Molecular Biology Products Inc. | 2179HR | |
| Animal-Free Recombinant Human EGF | PeproTech | AF-100-15 | |
| Automated Pipette Repeater E3x | Eppendorf | 4987000410 | |
| Basement membrane solution | Huntsman Cancer Institute | https://healthcare.utah.edu/huntsmancancerinstitute/ | |
| Bead Bath | Lab Armor | 74300706 | |
| Biorender | Biorender | Biorender.com | |
| Biosafety Laminar Flow Cabinets | Thermo Scientific | 300590389 | |
| BioSpa 8 Automated Incubator | Agilent | 23082120 | |
| Cell Counter | Invitrogen | AMQAF2000 | |
| Cell Counting Chamber Slides | Thermo Scientific | C10283 | |
| CellTracker Deep Red | Thermo Fisher Scientific | C34565 | |
| Centrifuge | Thermo Scientific | 13100675 | |
| Cholera Toxin B subunit | Sigma-Aldrich | C9903-1MG | |
| Combitips advanced, Sterile, 5.0 mL | Fisher Scientific | 13-683-714 | |
| Cytation 10 Reader Imager | Agilent | 2105245 | |
| Defined Trypsin Inhibitor | Gibco | R007100 | soybean trypsin inhibitor in 1x PBS |
| Donor Horse Serum, 500 mL, United States Origin | Corning | 35-030-CV | |
| Dulbecco's Modified Eagle's Medium | Corning | 10-013-CV | |
| Excel Sofware | Microsoft office 365 | https://www.microsoft.com/en-us/microsoft-365/excel | |
| Fetal Bovine Serum | Thermo Scientific | 26140079 | |
| Fetal Bovine Serum, qualified, US origin | Thermo Scientific | 26140079 | |
| Gentamicin Sulfate, Liquid | Corning | 30-005-CR | |
| GraphPad Prism | |||
| Hydrocortisone solution,50 µM, sterile-filtered, BioXtra | Sigma-Aldrich | H6909-10ML | |
| Image J Software | Fiji | https://imagej.net/ij/ | |
| Insulin solution human | Sigma-Aldrich | I9278-5ML | |
| Magnifying Glass | Fisher Scientific | 01-182-392 | |
| Microcentrifuge Tube | Costar | 3621 | |
| Microscope | Olympus | CKX53SF | |
| Mini Lightbox | Fisher Scientific | 361044708 | |
| Molecular Probes CellTracker Blue CMAC Dye | Fisher Scientific | C2110 | |
| Molecular Probes CellTracker Orange CMRA Dye | Fisher Scientific | C34551 | |
| Penicillin-Streptomycin Solution | Cytiva | SV30010 | |
| Penicillin-Streptomycin Solution | Cytiva | SV30010 | |
| Phase-Contrast Microscope | Echo | RVSF1000 | |
| Phosphate Buffered Saline | Fisher Scientific | SH3025601 | |
| Pipet Controller | Corning | 4099 | |
| Pipette 100 – 1,000 µL | Eppendorf | 3123000063 | |
| Pipette 20 – 200 µL | Eppendorf | 3123000055 | |
| Prism | GraphPad Software | https://www.graphpad.com/features | |
| RPMI 1640 with L-glutamine and 25 mM HEPES | Corning | 10-041-CV | |
| Serological Pipette, 10 mL | Thermo Scientific | 170356N | |
| Serological Pipette, 25 mL | Thermo Scientific | 170357N | |
| Serological Pipette, 5 mL | Thermo Scientific | 170355N | |
| Trypan Blue Solution, 0.4% | Corning | 25900CI | |
| Trypsin-EDTA, 0.25% | Corning | 25053CI |
참고문헌
- de Visser, K. E., Joyce, J. A. The evolving tumor microenvironment: From cancer initiation to metastatic outgrowth. Cancer Cell. 41 (3), 374-403 (2023).
- Hanahan, D., Weinberg, R. A. Hallmarks of cancer: The next generation. Cell. 144 (5), 646-674 (2011).
- Anderson, N. M., Simon, M. C. The tumor microenvironment. Curr Biol. 30 (16), R921-R925 (2020).
- Baghban, R., et al. Tumor microenvironment complexity and therapeutic implications at a glance. Cell Commun Signal. 18 (1), 59 (2020).
- Sahai, E., et al. A framework for advancing our understanding of cancer-associated fibroblasts. Nat Rev Cancer. 20 (3), 174-186 (2020).
- Erdogan, B., Webb, D. J. Cancer-associated fibroblasts modulate growth factor signaling and extracellular matrix remodeling to regulate tumor metastasis. Biochem Soc Trans. 45 (1), 229-236 (2017).
- Iozzo, R. V., Sanderson, R. D. Proteoglycans in cancer biology, tumour microenvironment and angiogenesis. J Cell Mol Med. 15 (5), 1013-1031 (2011).
- Amersfoort, J., Eelen, G. Immunomodulation by endothelial cells - partnering up with the immune system. Nat Rev Immunol. 22 (9), 576-588 (2022).
- Balani, S., Nguyen, L. V., Eaves, C. J. Modeling the process of human tumorigenesis. Nat Commun. 8 (1), 15422 (2017).
- Drost, J., Clevers, H. Organoids in cancer research. Nat Rev Cancer. 18 (7), 407-418 (2018).
- Wang, E., Xiang, K., Zhang, Y., Wang, X. -. F. Patient-derived organoids (PDOs) and PDO-derived xenografts (PDOXs): New opportunities in establishing faithful pre-clinical cancer models. J Natl Cancer Cent. 2 (4), 263-276 (2022).
- Kamb, A. What's wrong with our cancer models. Nat Rev Drug Discov. 4 (2), 161-165 (2005).
- Tuveson, D., Clevers, H. Cancer modeling meets human organoid technology. Science. 364 (6444), 952-955 (2019).
- Zitvogel, L., Pitt, J. M., Daillère, R., Smyth, M. J. Mouse models in oncoimmunology. Nat Rev Cancer. 16 (12), 759-773 (2016).
- Liu, Y., et al. Patient-derived xenograft models in cancer therapy: technologies and applications. Signal Transduct Target Ther. 8 (1), 160 (2023).
- Ben-David, U., et al. Patient-derived xenografts undergo mouse-specific tumor evolution. Nat Genet. 49 (11), 1567-1575 (2017).
- Byrne, A. T., et al. Interrogating open issues in cancer precision medicine with patient-derived xenografts. Nat Rev Cancer. 17 (4), 254-268 (2017).
- Ivanics, T., et al. Patient-derived xenograft cryopreservation and reanimation outcomes are dependent on cryoprotectant type. Lab Invest. 98 (7), 947-956 (2018).
- Biju, T. S., Priya, V. V., Francis, A. P. Role of three-dimensional cell culture in therapeutics and diagnostics: an updated review. Drug Deliv and Transl Res. 13 (9), 2239-2253 (2023).
- Urzì, O., et al. Three-dimensional cell cultures: The bridge between in vitro and in vivo models. Int J Mol Sci. 24 (15), 12046 (2023).
- Cacciamali, A., Villa, R., Dotti, S. 3D cell cultures: Evolution of an ancient tool for new applications. Front Physiol. 13, 836480 (2022).
- Abuwatfa, W. H., Pitt, W. G. Scaffold-based 3D cell culture models in cancer research. J Biomed Sci. 31 (1), 7 (2024).
- Yakavets, I., et al. Advanced co-culture 3D breast cancer model for investigation of fibrosis induced by external stimuli: optimization study. Sci Rep. 10 (1), 21273 (2020).
- Mohammadrezaei, D., et al. Predicting and elucidating the post-printing behavior of 3D printed cancer cells in hydrogel structures by integrating in-vitro and in-silico experiments. Sci Rep. 13 (1), 1211 (2023).
- Kuen, J., Darowski, D., Kluge, T., Majety, M. Pancreatic cancer cell/fibroblast co-culture induces M2 like macrophages that influence therapeutic response in a 3D model. PLOS ONE. 12 (7), e0182039 (2017).
- Bray, F., et al. Global cancer statistics 2022: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin. 74 (3), 229-263 (2024).
- Kennecke, H., et al. Metastatic behavior of breast cancer subtypes. J Clin Oncol. 28 (20), 3271-3277 (2010).
- Neve, R. M., et al. A collection of breast cancer cell lines for the study of functionally distinct cancer subtypes. Cancer Cell. 10 (6), 515-527 (2006).
- Pingitore, P., et al. Human multilineage 3D spheroids as a model of liver steatosis and fibrosis. Int J Mol Sci. 20 (7), 1629 (2019).
- Bar-Ephraim, Y. E., Kretzschmar, K. Organoids in immunological research. Nat Rev Immunol. 20 (5), 279-293 (2020).
- Beerkens, A. P. M., et al. Characterizing OXPHOS inhibitor-mediated alleviation of hypoxia using high-throughput live cell-imaging. Cancer Metab. 12 (1), 13 (2024).
- Feaster, T. K., et al. Matrigel mattress. Cir Res. 117 (12), 995-1000 (2015).
- Huang, Z., Yu, P., Tang, J. Characterization of triple-negative breast cancer MDA-MB-231 cell spheroid model. Onco Targets Ther. 13, 5395-5405 (2020).
- Nam, S., Khawar, I. A., Park, J. K., Chang, S., Kuh, H. -. J. Cellular context-dependent interaction between cancer and stellate cells in hetero-type multicellular spheroids of pancreatic tumor. Biochem Biophys Res Commun. 515 (1), 183-189 (2019).
- Monteiro, M. V., Gaspar, V. M., Ferreira, L. P. Hydrogel 3D in vitro tumor models for screening cell aggregation mediated drug response. Biomater Sci. 8 (7), 1855-1864 (2020).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유