Method Article
Células estromais heteromulticelulares em culturas 3D sem andaimes de células epiteliais cancerígenas para impulsionar a invasão
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
Há uma necessidade crítica de modelos 3D de câncer que capturem crosstalk heterocelular para estudar a metástase do câncer. Nosso estudo apresenta a geração de estroma-epitelial heteromulticelular em um ambiente scaffold e scaffold-free que pode ser usado para estudar a invasão e as distribuições espaciais celulares.
Resumo
O câncer de mama é a segunda principal causa de morte relacionada ao câncer entre mulheres nos EUA. Modelos organoides de tumores sólidos demonstraram recapitular fielmente aspectos da progressão do câncer, como proliferação e invasão. Embora os organoides derivados do paciente e os organoides do xenoenxerto derivados do paciente sejam fisiopatologicamente relevantes, eles são caros de propagar, difíceis de manipular e compostos principalmente pelos tipos de células mais proliferativas dentro do microambiente tumoral (TME). Essas limitações impedem seu uso para elucidar mecanismos celulares de progressão da doença que dependem de células estromais associadas ao tumor que são encontradas no TME e conhecidas por contribuir para a metástase e resistência à terapia.
Aqui, relatamos métodos para cultivar culturas 3D multicelulares epitelial-estromais. As vantagens desses métodos incluem um sistema econômico para gerar rapidamente culturas 3D semelhantes a organoides em ambientes livres de andaimes que podem ser usados para rastrear a invasão em resolução de célula única dentro de andaimes de hidrogel. Especificamente, demonstramos como gerar essas culturas 3D heteromulticelulares usando células de câncer de mama BT-474 em combinação com fibroblastos (BJ-5ta), células semelhantes a monócitos (THP-1) e/ou células endoteliais (EA.hy926). Além disso, a marcação fluorescente diferencial de populações de células permite que a microscopia de lapso de tempo defina a montagem da cultura 3D e a dinâmica de invasão.
Notavelmente, a adição de quaisquer duas combinações de células estromais a culturas 3D de células BT-474 reduz significativamente a circularidade das culturas 3D, consistente com a presença de estruturas esferóides secundárias ou semelhantes a organoides. Em experimentos de corante rastreador, fibroblastos e células endoteliais co-localizam-se nas saliências semelhantes a organoides periféricos e são espacialmente segregados do esferóide primário BT-474. Finalmente, culturas 3D heteromulticelulares de células BT-474 aumentaram a capacidade de invasão de hidrogel. Uma vez que observamos essas estruturas protrusivas em culturas 3D heteromulticelulares de células epiteliais mamárias não tumorigênicas e tumorigênicas, este trabalho fornece um método eficiente e reprodutível para gerar culturas 3D semelhantes a organoides em um ambiente livre de andaimes para análises subsequentes de fenótipos associados à progressão do tumor sólido.
Introdução
A progressão do câncer é agora reconhecida como dependente de dois fatores principais: as mudanças genéticas / epigenéticas nas células tumorais e uma miríade de interação com células não tumorais no microambiente tumoral (TME) 1. Embora as alterações genéticas nas células sejam reconhecidas como necessárias para a iniciação do tumor, tais alterações por si só não são suficientes para a progressão do tumor e metástase2. Sabe-se agora que os componentes do TME, originalmente pensados para serem espectadores silenciosos, promovem ativamente a progressão do câncer por meio de crosstalk mútuo e dinâmico com células tumorais3. A composição do TME difere dependendo do tecido de origem do tumor, do estágio do tumor e das características do paciente, mas as características marcantes incluem fibroblastos associados ao câncer estromal (CAFs), matriz extracelular (MEC), células endoteliais vasculares, bem como células imunes adaptativas e mieloides 1,4.
Os CAFs estromais no TME são compostos por subtipos de fibroblastos de diversas origens e funções5. Esses CAFs são componentes-chave do TME, pois interagem com as células tumorais em várias interfaces. Os CAFs secretam proteínas ECM que alteram a rigidez da matriz, o que pode limitar a entrega do medicamento por meio da deposição excessiva de colágeno, proteoglicanos e fibronectina ou permitir que as células tumorais invadam a partir do local do tumor primário por meio da secreção de metaloproteinases da matriz degradadoras de ECM (MMPs)6,7. Além disso, os CAFs promovem o crescimento, migração e vascularização do tumor por meio da secreção de uma variedade de fatores de crescimento, citocinas e fatores angiogênicos, como fator de crescimento epidérmico (EGF), fator de crescimento transformador β (TGF-β) e fator de crescimento endotelial vascular (VEGF), respectivamente 1,6. Paralelamente, as células endoteliais, estimuladas pelo TME hipóxico, também promovem a vascularização tumoral e suprimem as funções das células imunes por meio do aumento da secreção de fatores angiogênicos e da redução da secreção de moléculas de adesão leucocitária 1,8.
Com a aparente complexidade intrincada da progressão do câncer, tornou-se essencial incorporar componentes estromais da TME na pesquisa básica do câncer. No entanto, o estabelecimento de modelos que recapitulem fielmente a fisiopatologia tumoral conhecida ainda é uma necessidade significativa não atendida 9,10. Embora os modelos tradicionais de cultura de células bidimensionais (2D) sejam fáceis de manusear, cultivados rapidamente e altamente reprodutíveis, eles são compostos apenas por clones de células cancerígenas de proliferação rápida e não refletem a heterogeneidade celular encontrada em tumores 10,11,12. De maneira semelhante, os modelos de camundongos transgênicos também não capturam a biologia do tumor humano devido à baixa heterogeneidade genética da endogamia, diferenças significativas no sistema imunológico e complexidade histológica13,14. Devido a tais limitações, as terapias desenvolvidas a partir de modelos clássicos de câncer muitas vezes não se traduzem em ambientes clínicos.
Modelos de câncer derivados de pacientes, como xenoenxertos derivados de pacientes e organoides derivados de pacientes, podem abordar as desvantagens dos modelos convencionais de câncer, capturando características moleculares tumorais in situ, fundo genético e organização celular 10,11,15. No entanto, esses xenoenxertos e organoides derivados de pacientes requerem procedimentos complicados de enxerto e longo tempo de cultura16,17. Combinado com a variação nos locais de aquisição e amostragem do tumor e a baixa eficiência na criopreservação, há a necessidade de desenvolver modelos que atuem como uma ponte entre as culturas de células 2D clássicas e os modelos de câncer derivados de pacientes11,18. Nesse sentido, os modelos 3D de cultura celular podem servir como modelos que podem ser cultivados rapidamente e capturar características tumorais importantes in vivo, como interação célula-célula, interação célula-MEC, hipóxia, angiogênese e produção de ECM19,20.
Os modelos de cultura de células 3D são categorizados em sistemas de modelos sem andaimes e baseados em andaimes. Em sistemas sem andaimes, as células são induzidas a se autoagregar em uma forma esférica usando placas específicas de cultura de células de baixa fixação ou manipulando os parâmetros físicos dos métodos de cultura. Os métodos estabelecidos para obter esferoides 3D livres de andaimes variam de simples culturas de pellets de células por centrifugação a gotas de microplacas suspensas, levitação magnética e biorreatores dinâmicos e sistemas microfluídicos20,21. As culturas de células 3D baseadas em andaimes são estabelecidas pela adição de andaimes à base de polímero ou hidrogel para imitar a matriz extracelular fisiológica19,22. Tais modelos possuem imenso potencial para modelar a organização celular in vivo, topologia, fixação da matriz, migração e resposta a medicamentos.
Além da manipulação de andaimes para modelos de composição de ECM em estados de doença, as culturas de células 3D também podem ser usadas para modelar populações celulares heterogêneas em um TME. Culturas de células 3D compostas por células cancerígenas e fibroblastos estromais ou células endoteliais têm sido usadas para estudar a interação de câncer e linhagens celulares não tumorais individuais 23,24,25. Métodos reprodutíveis e econômicos para expandir essas culturas de células 3D compostas por várias linhagens celulares heterogêneas ajudariam os pesquisadores a elucidar a progressão do tumor. Aqui, relatamos métodos para cultivar culturas 3D multicelulares epitelial-estromais para estudar proliferação, invasão e plasticidade do estado celular. O protocolo descreve culturas 3D baseadas em andaimes e extratos de membrana basal de células de câncer de mama co-cultivadas com uma combinação de células estromais que variam de fibroblastos (BJ-5ta), células endoteliais (Ea.hy926) e células semelhantes a monócitos (THP-1). O câncer de mama é atualmente o segundo câncer mais comum em todo o mundo e o câncer mais diagnosticado em mulheres nos EUA26. A morte por câncer de mama se deve em grande parte à natureza metastática e resistente à terapia da doença, pois a sobrevida geral e livre de metástases é significativamente reduzida em pacientes diagnosticadas com subtipos agressivos de câncer de mama enriquecido com HER2 e basal27. Nossos protocolos de cultura de células 3D descritos podem ajudar no desenvolvimento de métodos de cultura econômicos, rápidos e reprodutíveis que podem ser combinados com métodos de preservação de tecidos embebidos em parafina fixados em formalina e subsequentes aplicações de biologia espacial.
Protocolo
1. Meio de cultura celular
NOTA: Prepare todos os meios dentro de um gabinete de biossegurança.
- Para preparar o meio de cultura celular para BJ-5ta, BT474, EA.hy926 e MDA-MB-468, suplemente 500 mL de meio de Eagle modificado (DMEM) de Dulbecco com 10% de soro fetal bovino inativado pelo calor (FBS) e 1% de penicilina-estreptomicina com uma pipeta. Incorpore gentamicina a 0,1% com uma micropipeta.
- Para preparar o meio de cultura de células para MCF10A, suplemente 500 mL de DMEM/F12 com 5% de soro de cavalo e 1% de penicilina-estreptomicina com uma pipeta. Incorpore gentamicina a 0,1%, 1 mL de hidrocortisona 1 μg/mL, 500 μL de insulina 10 μg/mL, 50 μL de toxina da cólera 100 ng/mL e 10 μL de fator de crescimento epidérmico 20 ng/mL com uma micropipeta.
- Para preparar o meio de cultura celular para MCF10Ca1h, suplemente 500 mL de DMEM/F12 com 5% de soro de cavalo e 1% de penicilina-estreptomicina com uma pipeta. Incorpore gentamicina a 0,1% com uma micropipeta.
- Para preparar o meio de cultura celular para THP-1, suplemente 500 mL de RPMI 1640 com 10% de FBS e 1% de penicilina-estreptomicina com uma pipeta. Incorpore gentamicina a 0,1% com uma micropipeta.
- Troque o meio de cultura celular a cada 2-3 dias para BJ-5ta, BT474, EA.hy926, MDA-MB-468, MCF10A e MCF10Ca1h até que as células atinjam 70-80% de confluência, avaliando seu crescimento diariamente com um microscópio de campo claro. Troque o meio de cultura celular uma vez por semana para células THP-1.
- Cultive células BJ-5ta, BT474, EA.hy926, MDA-MB-468, MCF10A e MCF10Ca1h em placas de 100 mm com superfícies tratadas com cultura de células em incubadoras de cultura de células padrão com 5% de CO2.
- Cultive células THP-1 em frascos tratados com cultura de células T75 em incubadoras de cultura de células padrão com 5% de CO2.
2. Coleta de células
- Ligue a luz UV para higienizar o interior do gabinete de biossegurança por 15 min.
- Abra o caixilho da janela do gabinete de biossegurança para estabilizar o fluxo de ar e ligue o sistema de aspiração a vácuo.
- Limpe a superfície interna do capô e a tubulação do sistema de aspiração a vácuo com etanol a 70%.
- Prepare o meio de cultura de células fresco sem soro dentro do gabinete de biossegurança: suplemente 500 mL de meio de Eagle modificado de Dulbecco (DMEM) com penicilina/estreptomicina a 1% usando uma pipeta. Incorpore 0,1% de gentamicina com uma micropipeta.
- Aqueça o meio de cultura de células, solução salina tamponada com fosfato (PBS) e tripsina-EDTA (0,25%) a 37 ° C, colocando os itens em um banho de esferas antes de iniciar o experimento.
- Certifique-se de que as células sejam 70-80% confluentes por meio de inspeção visual por meio de um microscópio.
- Aspirar e eliminar o meio de cultura das células plaqueadas com o aspirador de vácuo. Lave o meio restante uma vez com 2 mL de PBS com uma pipeta, aspire e descarte o PBS com o aspirador a vácuo.
NOTA: As células THP-1 são cultivadas em suspensão; As etapas 2.7 a 2.9 podem ser omitidas. - Adicione 1 mL de tripsina à placa de cultura de células usando uma micropipeta e coloque a placa dentro de uma incubadora de CO2 a 5% a 37 ° C por 5 min.
- Inative a tripsina adicionando 1 mL do inibidor de tripsina de soja (em 1x PBS) à placa com uma micropipeta. Disperse os aglomerados de células pipetando a mistura líquida com uma micropipeta P1000 e recolha a suspensão celular do fundo da placa. Transferir a suspensão celular com uma micropipeta para um tubo cónico de 15 ml e centrifugar a 100 × g durante 5 min à temperatura ambiente. Descarte o sobrenadante com o aspirador de vácuo.
- Continue para a contagem de células.
3. Preparação da solução de corante de trabalho e das células de coloração em suspensão
- Antes de abrir o frasco para injetáveis das sondas fluorescentes moleculares cell tracker (consulte a Tabela de Materiais), deixe o produto aquecer até a temperatura ambiente por 15 min em um banho de esferas regulado a 37 ° C.
- Dissolva o corante azul rastreador de células liofilizado (massa = 5 mg, peso molecular = 209,6 g/mol) até uma concentração final de 10 mM com 2,385 mL de DMSO usando uma micropipeta.
- Dissolva o corante laranja rastreador de células liofilizadas (massa = 50 μg, peso molecular = 550,4 g/mol) até uma concentração final de 10 mM com 9,084 μL de DMSO usando uma micropipeta.
- Dissolva o corante vermelho escuro do rastreador de células liofilizadas (massa = 15 μg, peso molecular = 698,3 g/mol) até uma concentração final de 1 mM com 20 μL de DMSO usando uma micropipeta.
- Prepare a solução de corante azul do rastreador de células de trabalho (5 μM) diluindo 1 μL do corante em 2 mL de meio DMEM sem soro com uma micropipeta.
- Prepare a solução de corante laranja do rastreador de células de trabalho (5 μM) diluindo 1 μL do corante em 2 mL de meio DMEM sem soro com uma micropipeta.
- Prepare a solução de corante vermelho escuro do rastreador de células de trabalho (1 μM) diluindo 2 μL do corante em 2 mL de meio DMEM sem soro com uma micropipeta.
- Ressuspenda as células epiteliais, fibroblastos BJ-5ta e células endoteliais Ea.hy926 nas soluções preparadas de corante azul, laranja e vermelho escuro (2 mL), respectivamente, com uma micropipeta.
- Incubar os tubos a 37 °C na incubadora de CO 5%2 durante 30 min.
- Após 30 min de incubação, centrifugue os tubos a 100 x g por 5 min em temperatura ambiente.
- Aspire e descarte o sobrenadante com o aspirador a vácuo e ressuspenda completamente o pellet em 1 mL de meio DMEM contendo soro FBS a 10% com uma micropipeta.
- Continue para a contagem de células.
4. Contagem de células
- Colete 10 μL da suspensão celular e transfira-os para um microtubo com uma micropipeta.
- Misture com 10 μL de azul de tripano e pipete bem.
- Transferir 20 μL da solução de tripano celular com uma micropipeta para uma lâmina de câmara de contagem de células. Insira e conte as células usando um contador de células automatizado.
- Calcule o número médio total de células vivas a partir de duas leituras.
5. Cálculos
- Prepare estoques de células de trabalho para cada tipo de célula em uma concentração de 6,67 × 103 células/mL equivalente a 2.000 células/300 μL.
NOTA: O volume total de estoque dependerá do tamanho da amostra experimental. - Para esferoides de monocultura, certifique-se de que cada amostra independente consiste em 300 μL do estoque de trabalho de células epiteliais equivalente a 2.000 células epiteliais.
- Para esferoides de cocultura (dois tipos de células), certifique-se de que cada amostra independente consiste em 150 μL de estoque de células epiteliais e 150 μL de estoque de células estromais. A amostra conterá 1.000 células epiteliais e 1.000 células estromais.
- Para esferoides de cocultura (três tipos de células), certifique-se de que cada amostra independente consista em 150 μL de estoque de células epiteliais, 75 μL de estoque de trabalho de célula estromal # 1 e 75 μL de estoque de trabalho de célula estromal # 2. A amostra conterá 1.000 células epiteliais, 500 células estromais do estoque de trabalho # 1 e 500 células estromais do estoque de trabalho # 2.
6. Chapeamento
- Transferir o volume necessário com uma micropipeta para três réplicas técnicas, mais uma extra, para um microtubo. Misture bem com uma pipeta e, em seguida, transfira 300 μL da amostra para um poço de uma microplaca de 96 poços de fixação ultrabaixa em forma de U.
- Repita o processo para cada replicação técnica adicional.
- Coloque a placa de 96 poços em uma incubadora a 37 °C.
7. Imagem de campo claro
- Observe o crescimento e a morfologia dos esferóides a cada 24 h até 96 h usando um microscópio.
- Esferoides de imagem usando um microscópio de contraste de fase.
8. Configuração do protocolo de imagem de campo amplo para esferóides corados com corantes rastreadores e esferoides sobrepostos com extrato de membrana basal
- Ligue os dispositivos de imagem e incubadora automatizada listados na Tabela de Materiais e crie um novo protocolo de imagem no gerenciador de tarefas do software de imagem. Na guia Procedimento , defina o ponto de ajuste de temperatura da incubadora automatizada para 37 °C e permita que a incubadora equilibre CO2% e temperatura antes de continuar com a próxima etapa.
NOTA: Um gerador de imagens fluorescente alternativo pode ser usado se tiver os filtros apropriados para cada um dos corantes (azul, vermelho escuro e laranja) usados. - Defina as definições de imagem para as seguintes especificações: Ampliação: 4X PL FL Phase, Campo de View: 3185 X 3185 μm, WFOV total.
- Use as seguintes especificações para os canais: DAPI: 377/447 nm, iluminação = 10, tempo de integração = 107 ms, ganho = 10, RFP: 531/593 nm, iluminação = 10, tempo de integração = 137 ms, ganho = 10, CY5: 628/685 nm, iluminação = 10, tempo de integração = 137 ms, ganho = 10.
- Para obter imagens de esferoides em uma sobreposição de solução de extrato de membrana basal, use as seguintes especificações de campo claro: iluminação = 10, tempo de integração = 5 ms e ganho = 17,1.
- Selecione os poços desejados para geração de imagens e aprove as alterações de especificação clicando no ícone de seleção de poços .
- Navegue até a guia Redução de dados para ajustar as configurações de análise celular.
- Defina o valor limite como 19.500 com um plano de fundo claro e selecione Preencher buracos em máscaras.
- Para seleção de objetos, defina o tamanho mínimo do objeto para 100 μm e o tamanho máximo do objeto para 1.000 μm e selecione Analisar imagem inteira.
NOTA: Somente uma máscara primária e uma contagem de objetos são necessárias para esta análise. - Salve todas as alterações e abra o aplicativo de imagem.
- Coloque a microplaca experimental de fundo em forma de U na incubadora abrindo a gaveta e feche-a usando o software de imagem.
- Para executar o protocolo, clique na guia Informações do procedimento , adicione um usuário e escolha o protocolo.
- Certifique-se de que o tipo de placa correto esteja selecionado e defina o tempo de imagem para 30 min por placa.
- Selecione o intervalo de imagem desejado, indique se a placa tem uma tampa e ajuste a hora de início e a duração da imagem.
- Clique em Programar placa/vaso para iniciar o processo de geração de imagens.
9. Sobreposição de solução de extrato de membrana basal (opcional)
NOTA: A solução de extrato de membrana basal pode ser aplicada a esferóides 24 h após o revestimento.
- Encha um balde de gelo com gelo para manter a solução de extrato da membrana basal fria e armazene-o a 4 ° C quando não estiver em uso.
- Aspirar aproximadamente 170 μL de meio com uma pipeta multicanal.
- Use uma lupa e uma mini caixa de luz para observar de perto os pequenos esferoides. Coloque a placa esferóide de 96 poços sobre a caixa de luz e posicione a lupa acima da cabeça.
- Defina a pipeta P200 para 30 μL e colete o extrato da membrana basal para criar três microgotículas.
- Adicionar uma micropipeta sobre cada esferóide dos três replicados técnicos.
- Certifique-se de que a placa de 96 poços esteja plana e posicione a pipeta verticalmente acima do esferoide. Solte a gota sem tocar no fundo do poço.
- Coloque a placa em uma incubadora a 37 °C por 20 min.
- Cubra os esferóides com 50 μL adicionais da solução de extrato de membrana basal por poço com uma micropipeta.
- Reposicione os esferóides no centro do poço usando uma ponta de pipeta.
- Incubar a 37 °C durante 30 min.
- Adicione 100 μL de meio de cultura celular a cada poço.
10. Quantificação
- Baixe e abra o software ImageJ. Carregue as imagens esferoides.
- Defina as medidas clicando em Analisar | Definir medidas e selecionar área | Centróide. Meça os esferoides usando a ferramenta laço para rastrear o esferóide e medir o objeto.
- Registar os valores de três réplicas biológicas e calcular a área média e a circularidade.
- Converta a área de pixels em metros quadrados usando a seguinte fórmula:
Área (m2) = ((550/504) × √ (área em pixels)) 2 - Analise os dados.
- Selecione Inserir valores de replicação, empilhados em colunas.
- Insira os dados nas colunas e selecione o controle de esferoides de monocultura e as amostras de esferoides de tratamento de cocultura.
- Execute uma análise de coluna ANOVA unidirecional.
- Use os seguintes parâmetros ANOVA:
- Evite combinar ou emparelhar.
- Suponha uma distribuição gaussiana de resíduos.
- Suponha desvios padrão iguais.
- Use o teste de comparação múltipla de Tukey para comparar a média de cada coluna com a média de todas as outras colunas.
11. Processamento de imagem imunofluorescente de campo amplo
- Salve as imagens diretamente do software de imagem como formato de arquivo PNG ou Tiff.
- Selecione cada canal individual ou canais sobrepostos e salve como arquivo PNG.
- Ajuste o brilho e o contraste no software do gerador de imagens ou no ImageJ se as imagens forem exportadas como arquivos Tiff.
Resultados
Neste estudo, desenvolvemos um sistema de cultura celular para gerar esferoides 3D heteromulticelulares constituídos por células epiteliais e estromais com morfologia semelhante a organoides. Os esferoides foram estabelecidos por plaqueamento de 2.000 células epiteliais em condições de monocultura. Em condições de co-cultura de dois tipos de células, os esferoides foram estabelecidos por plaqueamento de 1.000 células epiteliais e 1.000 células estromais. Em condições de co-cultura de três tipos de células, os esferoides foram estabelecidos por plaqueamento de 1.000 células epiteliais e dois tipos diferentes de células estromais de 500 células de cada tipo de célula. A montante do estabelecimento do esferóide, as células podem ser coradas com corantes rastreadores de células fluorescentes que permitem monitorar a organização espacial celular. Após 24 h de formação inicial de esferoides, as aplicações a jusante incluem perturbações farmacológicas, imagens e coleta de amostras. A imagem de lapso de tempo é útil para avaliar mudanças no comportamento e morfologia do esferóide, incluindo área e circularidade (Figura 1A). 24 h após o reforço, os esferoides podem ser incorporados em um ambiente de andaime, e a imagem de lapso de tempo pode ser usada para avaliar o início de estruturas invasivas do esferóide (Figura 1B). A coleta de amostras de esferoides heteromulticelulares tem muitas aplicações, incluindo perfis genômicos e proteômicos nos níveis global e de célula única por meio de técnicas experimentais, como sequenciamento de RNA, sequenciamento de RNA de célula única, sequenciamento proteômico e imunofluorescência cíclica.
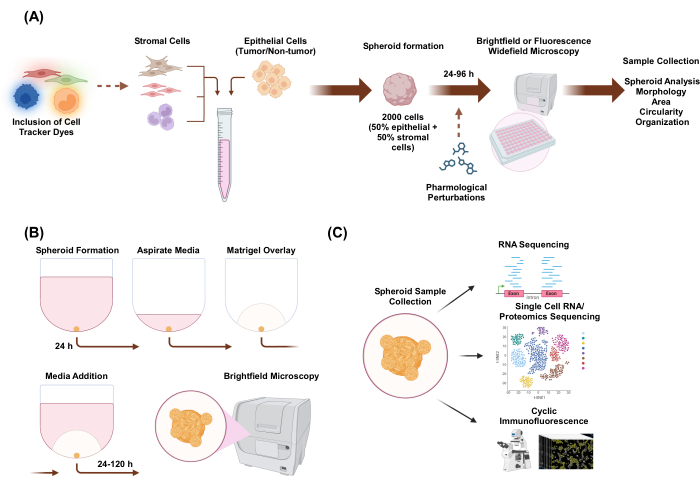
Figura 1: Representação esquemática do processo de cultura de células 3D e possíveis aplicações. (A) A suspensão celular de células epiteliais com células estromais não epiteliais é pipetada em placas de fixação ultrabaixa 3D para formar esferoides. Os esferoides são fotografados por microscopia de campo claro a cada 24 h durante 96 h. As linhagens celulares podem ser coradas com corantes rastreadores de células fluorescentes para microscopia de campo amplo a jusante antes de induzir a formação de esferóides ou podem ser perturbadas farmacologicamente após a formação de esferoides. Parâmetros esferóides como morfologia, área, circularidade e organização podem ser analisados. (B) Esferóides de células epiteliais e epiteliais com células estromais são formados usando o protocolo de A. Os esferoides foram estabelecidos por plaqueamento de 2.000 células epiteliais em condições de monocultura. Em condições de co-cultura de dois tipos de células, os esferoides foram estabelecidos por plaqueamento de 1.000 células epiteliais e 1.000 células estromais. Em condições de co-cultura de três tipos de células, os esferoides foram estabelecidos por plaqueamento de 1.000 células epiteliais e dois tipos diferentes de células estromais de 500 células de cada tipo de célula. Após 24 h, uma solução de extrato de membrana basal semelhante a um andaime é sobreposta e as imagens são capturadas em microscopia de campo claro a cada 24 h por 120 h. (C) Culturas 3D heteromulticelulares estabelecidas sem andaimes e baseadas em andaimes podem ser usadas para uma variedade de aplicações a jusante, como imunofluorescência cíclica, sequenciamento de RNA de célula única e proteômica de célula única. Clique aqui para ver uma versão maior desta figura.
Os esferoides de monocultura MCF10A, MCF10Ca1h e BT-474 mantêm um fenótipo esférico compacto por até 96 h após o plaqueamento. Quando co-cultivados com células endoteliais microvasculares EA.hy926, fibroblastos BJ-5ta e / ou células semelhantes a monócitos THP-1, os esferoides desenvolveram protrusões celulares na periferia, que se tornaram mais pronunciadas em 96 h ( Figura 2A-C ). É importante ressaltar que essas saliências, fenômenos de brotamento e compactação dos esferoides representam variações da organização celular do esferóide cancerígeno e das células estromais co-cultivadas que se correlacionaram com a invasividade 3D após a adição de um hidrogel baseado em membrana basal como o Matrigel. A morfologia de brotamento variou de agregados de células sólidas a soltas, assemelhando-se à morfologia organoide. Em contraste, os esferóides de monocultura MDA-MB-468 apareceram como grandes agregados de células soltas. No entanto, quando as células MDA-MB-468 foram co-cultivadas com EA.hy926, BJ-5ta e / ou THP-1, elas formaram esferóides compactos ( Figura 2D ).
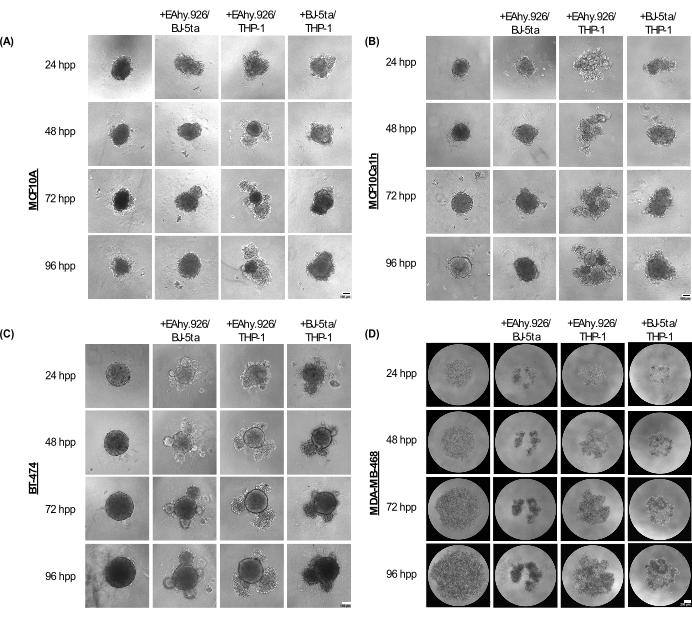
Figura 2: A gama de arquiteturas e morfologias adotadas por combinações de células estromais não epiteliais em combinação quando combinadas com células tumorais epiteliais / não tumorais em culturas 3D sem andaimes. Imagens representativas de campo claro de (A) MCF10A, (B) MCF10Ca1h, (C) BT-474, (D) esferóides MDA-MB-468 em monocultura ou em condições de co-cultura com fibroblastos estromais BJ-5ta / células endoteliais microvasculares Ea.hy926 ou células semelhantes a monócitos Ea.hy926 / THP-1 ou células BJ-5ta / THP-1 em 96 h. Cada esferóide foi formado pelo plaqueamento de 2.000 células. Esferoides em condições de monocultura foram formados usando 2.000 células epiteliais. Os esferoides em condições de co-cultura foram formados usando 1.000 células epiteliais e dois tipos diferentes de células estromais de 500 células. A formação de estruturas semelhantes a organoides agregadas ou brotamento foi iniciada em condições de co-cultura esferóide 24 h após o plaqueamento em células epiteliais MCF10A, MCF10Ca1h e BT-474. A compactação de células MDA-MB-468 foi observada em condições de co-cultura de esferóides 25 h após o plaqueamento. Barras de escala = 100 μm. Abreviatura: hpp = horas após o revestimento. Clique aqui para ver uma versão maior desta figura.
Às 72 h após o plaqueamento, as células MCF10A, MCF10Ca1h e BT-474 co-cultivadas com EA.hy926 e THP-1, ou com BJ-5ta e THP-1, exibiram um aumento significativo na área esferoide em comparação com os esferoides epiteliais em monocultura. MCF10Ca1h também mostrou um aumento significativo na área esferóide quando co-cultivado com EA.hy926 e BJ-5ta. O início de estruturas de brotamento em esferoides co-cultivados levou a uma diminuição significativa na circularidade dos esferóides para MCF10A, MCF10Ca1h e BT-474 co-cultivados com EA.hy926 e THP-1, ou com BJ-5ta e THP-1. Efeitos semelhantes foram observados para BT-474 co-cultivado com EA.hy926 e BJ-5ta ( Figura 3A, B ). Em contraste, as células MDA-MB-468 co-cultivadas com EA.hy926 e BJ-5ta, EA.hy926 e THP-1, ou BJ-5ta e THP-1, mostraram uma diminuição significativa na área esferóide em comparação com os esferoides MDA-MB-468 em monocultura; no entanto, não houve efeito na circularidade (Figura 3A, B).

Figura 3: Gráficos de análise de área e circularidade de culturas monocultivadas e heteromulticelulares estromais 3D livres de andaimes 72 h após o plaqueamento. (A) Área média (cm2) e (B) circularidade média de MCF10A, MCF10Ca1h, BT-474 e MDA-MB-468 em culturas esferoides estromais monocultivadas e heteromulticelulares 72 h após o plaqueamento. Os dados comunicados são representativos de, pelo menos, três réplicas biológicas independentes e são comunicados como médias técnicas de replicação ± SEM, salvo indicação em contrário. *, **, *** ou **** representam valores de p < 0,05, 0,01, 0,001 ou 0,0001, respectivamente, salvo indicação em contrário. Clique aqui para ver uma versão maior desta figura.
A aplicação de corante rastreador celular a células epiteliais tumorigênicas BT-474 e células estromais antes do estabelecimento do esferóide demonstrou que as células estromais, incluindo EA.hy926 e BJ-5ta, formaram as estruturas de brotamento no perímetro dos esferoides BT474 centrais (Figura 4, Vídeo Suplementar S1, Vídeo Suplementar S2, Vídeo Suplementar S3 e Vídeo Suplementar S4). Às 48 h após o plaqueamento, imagens individuais de fluorescência de campo amplo de esferoides co-cultivados com fibroblastos revelam que os esferoides de fibroblastos co-localizaram-se com células endoteliais, mas não co-localizaram com os esferoides BT-474. Uma minoria de células endoteliais também foi encontrada para co-localizar com esferoides BT-474 em condições de co-cultura. Isso sugere que o arranjo das células estromais dentro do esferóide está correlacionado com uma morfologia semelhante a um organoide.
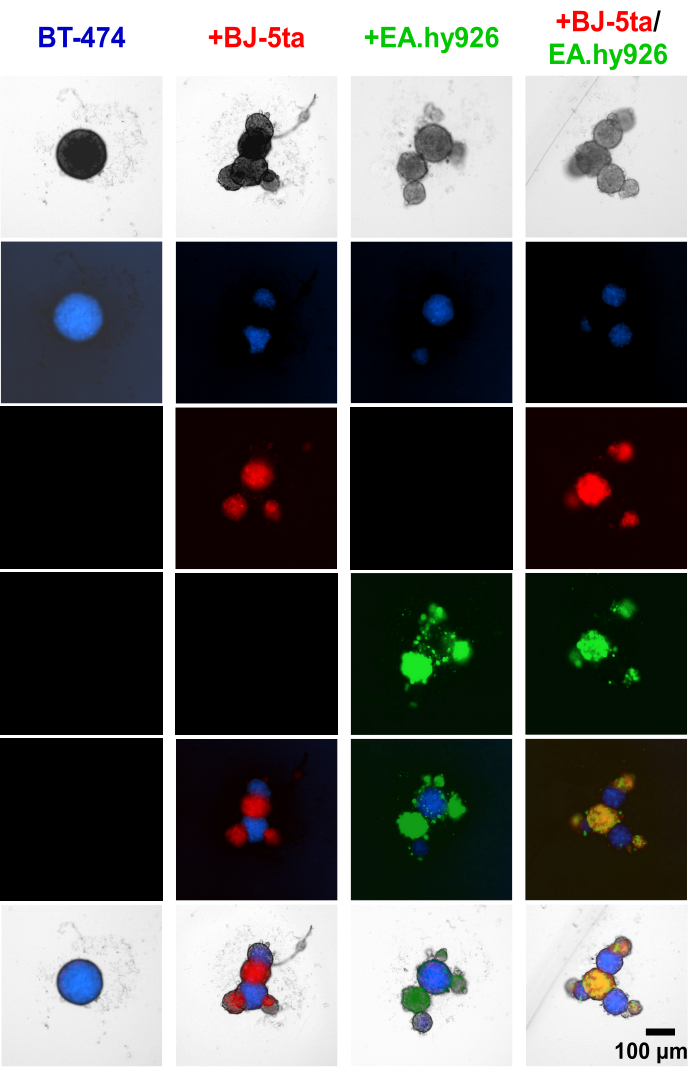
Figura 4: Imagens estáticas de fluorescência de campo amplo de células estromais e BT-474 tingidas diferencialmente em culturas 3D heteromulticelulares 48 h após o plaqueamento. Os esferóides BT-474 são corados com corante fluorescente rastreador de células azul. Os fibroblastos BJ-5ta são corados com corante rastreador de células laranja, representado na cor vermelha. As células endoteliais Ea.hy926 são coradas com corante rastreador de glóbulos vermelhos profundos, representado na cor verde. Cada esferóide foi formado pelo plaqueamento de 2.000 células. Esferoides em condições de monocultura foram formados usando 2.000 células epiteliais. Esferoides em condições de co-cultura (BT-474 / BJ-5ta, BT-474 / Ea.hy926) foram formados usando 1.000 células epiteliais e 1.000 células estromais. Esferoides em condições de co-cultura dupla (BT-474 / BJ-5ta / Ea.hy926) foram formados usando 1.000 células epiteliais e 500 células de cada tipo de célula estromal. As figuras são representativas de pelo menos três réplicas biológicas. Barra de escala = 100 μm. Clique aqui para ver uma versão ampliada desta figura.
Para avaliar a relevância biológica de nosso modelo de esferóide organoide, os esferoides foram revestidos com solução de extrato de membrana basal 24 h após o plaqueamento. Os esferoides BT-474 em monocultura não apresentaram propriedades invasivas 120 h após o plaqueamento. No entanto, os esferoides BT-474 co-cultivados com BJ-5ta ou EA.hy926 desenvolveram estruturas na periferia do esferóide, que invadiram o ambiente da solução de extrato de membrana basal do andaime. O número e o comprimento dessas saliências foram significativamente aumentados em esferoides BT-474 co-cultivados com BJ-5ta e EA.hy926 por 48 h a 120 h após o plaqueamento (Figura 5, Vídeo Suplementar S5, Vídeo Suplementar S6, Vídeo Suplementar S7 e Vídeo Suplementar S8).
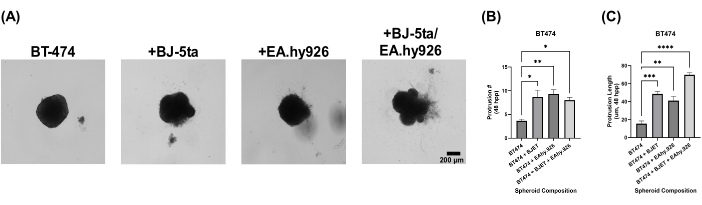
Figura 5: Imagens estáticas de campo claro de células BT-474 em culturas 3D heteromulticelulares com sobreposição de solução de extrato de membrana basal 5 dias após a sobreposição. Cada esferóide foi formado pelo plaqueamento de 2.000 células. A solução de extrato de membrana basal foi sobreposta sobre esferoides 24 h após o plaqueamento. Esferoides em condições de monocultura foram formados usando 2.000 células epiteliais. Esferoides em condições de co-cultura (BT-474/BJ-5ta e BT-474/Ea.hy926) foram formados usando 1.000 células epiteliais e 1.000 células estromais. Esferoides em condições de co-cultura dupla (BT-474 / BJ-5ta / Ea.hy926) foram formados usando 1.000 células epiteliais e 500 células de cada tipo de célula estromal. (A) Estruturas invasivas que se projetam do esferóide cancerígeno embutido na solução de extrato de membrana basal podem ser observadas em condições de co-cultura. (B) Qualificação da contagem de protrusão invasiva no tempo 48 hpp. (C) Qualificação do comprimento da protrusão invasiva no tempo 48 hpp. As figuras são representativas de pelo menos três réplicas biológicas. Barra de escala = 200 μm. Abreviatura: hpp = horas após o revestimento. Clique aqui para ver uma versão maior desta figura.
Vídeo Suplementar S1: Esferóide de monocultura BT-474 com corante azul rastreador de células. As células BT-474 (2.000) foram ressuspensas em uma microplaca de 96 poços de fixação ultrabaixa em forma de U para formar esferoides. Uma sobreposição de imagens de fluorescência de campo claro e campo amplo foi capturada ao longo de 48 h. Abreviatura: ULA = fixação ultrabaixa. Clique aqui para baixar este vídeo.
Vídeo Suplementar S2: Esferóides BT-474 co-cultivados com fibroblastos BJ-5ta. Os fibroblastos BT-474 (1.000) e 1.000 BJ-5ta foram ressuspensos em placas ULA para formar esferoides. As células BT-474 foram incubadas com corante azul rastreador celular e fibroblastos BJ-5ta com corante laranja rastreador celular. Uma sobreposição de imagens de fluorescência de campo claro e campo amplo (azul = BT-474, vermelho = BJ-5ta) foi capturada ao longo de 48 h. Abreviatura: ULA = fixação ultrabaixa. Clique aqui para baixar este vídeo.
Vídeo Suplementar S3: Esferoides BT-474 co-cultivados com células endoteliais Ea.hy926. As células endoteliais BT-474 (1.000) e 1.000 Ea.hy926 foram ressuspensas em placas ULA para formar esferoides. As células BT-474 foram incubadas com corante azul rastreador celular e células endoteliais Ea.hy926 com corante vermelho escuro rastreador celular. Uma sobreposição de imagens fluorescentes de campo claro e campo amplo (azul = BT-474, verde = Ea.hy926) foi capturada ao longo de 48 h. Abreviatura: ULA = fixação ultrabaixa. Clique aqui para baixar este vídeo.
Vídeo suplementar S4: Esferóides BT-474 co-cultivados com fibroblastos BJ-5ta e células endoteliais Ea.hy926. BT-474 (1.000), 500 fibroblastos BJ-5ta e 500 células endoteliais Ea.hy926 foram ressuspensas em placas ULA para formar esferoides. As células BT-474 foram incubadas com corante azul rastreador celular. Os fibroblastos BJ-5ta e as células endoteliais Ea.hy926 foram incubados com corante laranja rastreador celular e corante vermelho escuro, respectivamente. Uma sobreposição de imagens fluorescentes de campo claro e campo amplo (azul = BT-474, vermelho = BJ-5ta, verde = Ea.hy926) foi capturada ao longo de 48 h. Abreviatura: ULA = fixação ultrabaixa. Clique aqui para baixar este vídeo.
Vídeo Suplementar S5: Esferóide de monocultura BT-474 em solução de extrato de membrana basal. As células BT-474 (2.000) foram ressuspensas em placas ULA para formar esferoides, e os esferoides foram incorporados em uma solução de membrana basal 24 h após o plaqueamento. As imagens de campo claro foram tiradas ao longo de 60 h. Abreviatura: ULA = fixação ultrabaixa. Clique aqui para baixar este vídeo.
Vídeo suplementar S6: Esferóides BT-474 co-cultivados com fibroblastos BJ-5ta em solução de extrato de membrana basal. Os fibroblastos BT-474 (1.000) e 1.000 BJ-5ta foram ressuspensos em placas ULA para formar esferoides, e os esferoides foram incorporados em uma solução de extrato de membrana basal 24 h após o plaqueamento. As imagens de campo claro foram tiradas ao longo de 60 h. Abreviatura: ULA = fixação ultrabaixa. Clique aqui para baixar este vídeo.
Vídeo suplementar S7: Esferoides BT-474 co-cultivados com células endoteliais Ea.hy926 em solução de extrato de membrana basal. As células endoteliais BT-474 (1.000) e 1.000 Ea.hy926 foram ressuspensas em placas ULA para formar esferoides, e os esferoides foram incorporados em uma solução de extrato de membrana basal 24 h após o plaqueamento. As imagens de campo claro foram tiradas ao longo de 60 h. Abreviatura: ULA = fixação ultrabaixa. Clique aqui para baixar este vídeo.
Vídeo suplementar S8: Esferóides BT-474 co-cultivados com fibroblastos BJ-5ta e células endoteliais Ea.hy926 em solução de extrato de membrana basal. BT-474 (1.000), 500 fibroblastos BJ-5ta e 500 células endoteliais Ea.hy926 foram ressuspensas em placas ULA para formar esferoides, e os esferoides foram incorporados em uma solução de extrato de membrana basal 24 h após o plaqueamento. As imagens de campo claro foram tiradas ao longo de 60 h. Clique aqui para baixar este vídeo.
Discussão
Nosso modelo esferóide heteromulticelular demonstra que as interações entre células epiteliais e estromais impulsionam o brotamento de células estromais em condições de cultura 3D sem andaimes e a formação de estruturas invasivas em condições de cultura 3D baseadas em andaimes. Observamos formação consistente de estrutura de brotamento em ambas as linhagens celulares tumorigênicas (MCF10Ca1h e BT-474) e na linhagem de células epiteliais não tumorigênicas MCF10A (Figura 2A-C). Curiosamente, enquanto os esferoides das linhagens celulares MCF10A, MCF10Ca1h e BT-474, seja em monocultura ou co-cultura com fibroblastos e células endoteliais, formaram estruturas circulares e compactas em ambientes livres de andaimes, os esferoides da linhagem celular MDA-MB-468 mostraram menos compactação (Figura 2D). Isso foi inesperado, pois as células MDA-MB-468 foram antecipadas para formar esferóides circulares, como as outras linhas de células epiteliais testadas. Descobriu-se que a linhagem celular SUM-149, uma linhagem celular híbrida de câncer de mama primário epitelial-mesenquimal, forma esferoides compactos como MCF10A, MCF10Ca1h e BT-474 (dados não mostrados)28. Pesquisas futuras devem investigar as vias de sinalização que medeiam a formação de esferoides menos compactos na linhagem celular MDA-MB-468, uma vez que tais anomalias podem indicar vulnerabilidades celulares que podem ser aproveitadas para o desenvolvimento de novas estratégias terapêuticas.
Em relação à combinação de diferentes linhagens celulares, as células semelhantes a monócitos THP-1 induzem a formação de estruturas agregadas soltas em todas as condições de co-cultura de esferoides. Menos compactação é observada em estruturas de brotamento em condições de co-cultura com células THP-1 / Ea.hy926 em comparação com aquelas em condições de co-cultura com células THP-1 / BJ-5ta ( Figura 2A-D ). Portanto, a compactação dos esferoides é influenciada pela composição das células estromais no modelo29,30.
O plaqueamento inconsistente das combinações de heterocélulas pode resultar em desenvolvimento incompleto do esferóide ou variabilidade no tamanho do esferóide, em comparação com suas réplicas técnicas. Garantir a consistência no plaqueamento celular é crucial, pois o arranjo espacial das células que determina o fenótipo e o desenvolvimento do esferóide ocorre principalmente nas primeiras 48 h31. Durante este período crítico, as proporções celulares desempenham um papel crucial, com a proporção de células estromais afetando tanto a área esferóide quanto a circularidade.
Agregados esferoides soltos, que dependem do tipo de célula, podem ser facilmente desmontados durante o manuseio manual. No entanto, a manipulação manual é necessária ao sobrepor esferoides com uma solução de extrato de membrana basal semelhante a um andaime ou ao coletar amostras inteiras de esferoides. Para mitigar esse problema, é aconselhável trabalhar em um ritmo mais lento ao coletar esferoides por aspiração de pipeta e minimizar o manuseio manual sempre que possível. Durante a sobreposição da solução de extrato de membrana basal, os esferóides são propensos a se deslocar dentro do poço, muitas vezes se instalando na borda do poço. Uma proporção solução-meio de extrato de membrana basal é importante para manter as propriedades da matriz do sistema 3D; no entanto, os esferóides não podem ser totalmente envelopados devido à viscosidade da solução de extrato de membrana basal, portanto, é necessária intervenção manual32. O posicionamento não centralizado do esferóide representa um desafio para a geração de imagens, pois a refração da luz perto da borda plástica do poço pode interferir na clareza da imagem.
Os esferoides usados neste estudo eram compostos por linhagens de células cancerígenas humanas; Os métodos aqui descritos ainda não foram aplicados às linhagens celulares primárias. Nossos resultados sugerem que interações célula-célula específicas podem impulsionar a formação de estruturas semelhantes a organoides, indicando a potencial aplicabilidade desse método a uma ampla gama de linhagens celulares tumorigênicas. No entanto, embora nosso modelo tente mimetizar a complexidade do microambiente tumoral, as diferentes taxas de proliferação celular apresentam um desafio para estudos de longo prazo33. As células de proliferação rápida tendem a superar as de proliferação mais lenta, tornando esse modelo menos adequado para experimentos prolongados. Além disso, diferentes requisitos de tipo de meio de crescimento para linhagens celulares podem introduzir fatores adicionais que podem levar a fenótipos esferoides. A maioria das linhagens celulares neste estudo foi cultivada em meio DMEM. Estudos com linhagens celulares cultivadas em diferentes meios podem exigir diferentes condições de cultura testando uma variedade de proporções de meios; no entanto, esse efeito é observado em experimentação de longo prazo30.
Nosso modelo oferece várias vantagens sobre outros modelos de câncer 3D. Os esferoides que geramos têm uma morfologia e tamanho iniciais uniformes e reprodutíveis, facilitando a comparação dos resultados do tratamento com os controles. Em contraste, alguns modelos que usam células únicas suspensas em meios ou andaimes podem resultar em distribuições espaciais celulares variáveis, levando à inconsistência. Este modelo demonstra que as interações entre populações celulares distintas podem ser efetivamente estudadas.
Tradicionalmente, os modelos organoides e esferoides têm sido compostos de células cancerígenas em monocultura ou coculturas de células cancerígenas para investigar gradientes de nutrientes, hipóxia ou arranjo celular34. Além disso, este modelo pode ser estudado em um ambiente de andaime dentro de 24 horas após o revestimento, proporcionando uma oportunidade para explorar eventos de invasão precoce impulsionados por diversas interações célula-célula. Embora as abordagens alternativas de câncer 3D empreguem diferentes componentes da matriz de andaime para estudar as mudanças na morfologia e invasividade dos esferoides, este modelo as complementa, permitindo a investigação dessas mudanças no contexto da dinâmica da população celular e da composição do andaime35.
A maioria dos esferoides produzidos usando nossos métodos mantém sua integridade estrutural após o manuseio manual, permitindo a coleta de amostras em aplicações a jusante. Modificações genéticas convencionais, como CRISPR-Cas9, transdução de shRNA lentiviral e interferência de siRNA, podem ser introduzidas a montante da formação de esferoides. Os comportamentos complexos observados nesses esferoides sugerem alterações dinâmicas na expressão gênica, que podem ser investigadas usando RNA-seq. Técnicas avançadas como CycIF, scRNA-seq, CosMx e Visium também podem ser empregadas para estudar genômica e proteômica em níveis espaciais ou de célula única. Este modelo esferóide tem o potencial de imitar estudos in vivo de terapias tumorais direcionadas, capturando interações entre brotos de células estromais e agentes terapêuticos antes que atinjam as células cancerígenas. Isso é significativo porque pode ajudar a determinar se as células estromais influenciam a potência da droga, potencialmente protegendo as células cancerígenas dos efeitos terapêuticos.
Divulgações
Os autores não têm conflitos de interesse a declarar.
Agradecimentos
Agradecemos aos membros do Laboratório de Oncogenes do Desenvolvimento da Baylor University por suas observações e comentários úteis durante a preparação deste manuscrito. O apoio financeiro foi fornecido pelo Departamento de Biologia e Faculdade de Artes e Ciências da Baylor University, NIH-NIGMS 2SC1GM121182 (para J.A.K.).
Materiais
| Name | Company | Catalog Number | Comments |
| 15 mL Polypropylene Centrifuge Tubes | Falcon | 14-959-53A | |
| 96-Well, Treated, U-Shaped-Bottom Microplate | Thermo Scientific | 12566432 | |
| 100 mm Dish Cell Culture Treated Surface | Thermo Scientific | 130182 | |
| 170 L CO2 Incubators | VWR | VWR51014991(10810902) | |
| 200 Self-Sealing Barrier Pipet Tips | Fisher Scientific | 02-682-255 | |
| 500 mL DMEM/Hams F-12, [+] L-glutamine | Corning | 10-090-CV | |
| 1000 Self-Sealing Barrier Pipet Tips | Molecular Biology Products Inc. | 2179HR | |
| Animal-Free Recombinant Human EGF | PeproTech | AF-100-15 | |
| Automated Pipette Repeater E3x | Eppendorf | 4987000410 | |
| Basement membrane solution | Huntsman Cancer Institute | https://healthcare.utah.edu/huntsmancancerinstitute/ | |
| Bead Bath | Lab Armor | 74300706 | |
| Biorender | Biorender | Biorender.com | |
| Biosafety Laminar Flow Cabinets | Thermo Scientific | 300590389 | |
| BioSpa 8 Automated Incubator | Agilent | 23082120 | |
| Cell Counter | Invitrogen | AMQAF2000 | |
| Cell Counting Chamber Slides | Thermo Scientific | C10283 | |
| CellTracker Deep Red | Thermo Fisher Scientific | C34565 | |
| Centrifuge | Thermo Scientific | 13100675 | |
| Cholera Toxin B subunit | Sigma-Aldrich | C9903-1MG | |
| Combitips advanced, Sterile, 5.0 mL | Fisher Scientific | 13-683-714 | |
| Cytation 10 Reader Imager | Agilent | 2105245 | |
| Defined Trypsin Inhibitor | Gibco | R007100 | soybean trypsin inhibitor in 1x PBS |
| Donor Horse Serum, 500 mL, United States Origin | Corning | 35-030-CV | |
| Dulbecco's Modified Eagle's Medium | Corning | 10-013-CV | |
| Excel Sofware | Microsoft office 365 | https://www.microsoft.com/en-us/microsoft-365/excel | |
| Fetal Bovine Serum | Thermo Scientific | 26140079 | |
| Fetal Bovine Serum, qualified, US origin | Thermo Scientific | 26140079 | |
| Gentamicin Sulfate, Liquid | Corning | 30-005-CR | |
| GraphPad Prism | |||
| Hydrocortisone solution,50 µM, sterile-filtered, BioXtra | Sigma-Aldrich | H6909-10ML | |
| Image J Software | Fiji | https://imagej.net/ij/ | |
| Insulin solution human | Sigma-Aldrich | I9278-5ML | |
| Magnifying Glass | Fisher Scientific | 01-182-392 | |
| Microcentrifuge Tube | Costar | 3621 | |
| Microscope | Olympus | CKX53SF | |
| Mini Lightbox | Fisher Scientific | 361044708 | |
| Molecular Probes CellTracker Blue CMAC Dye | Fisher Scientific | C2110 | |
| Molecular Probes CellTracker Orange CMRA Dye | Fisher Scientific | C34551 | |
| Penicillin-Streptomycin Solution | Cytiva | SV30010 | |
| Penicillin-Streptomycin Solution | Cytiva | SV30010 | |
| Phase-Contrast Microscope | Echo | RVSF1000 | |
| Phosphate Buffered Saline | Fisher Scientific | SH3025601 | |
| Pipet Controller | Corning | 4099 | |
| Pipette 100 – 1,000 µL | Eppendorf | 3123000063 | |
| Pipette 20 – 200 µL | Eppendorf | 3123000055 | |
| Prism | GraphPad Software | https://www.graphpad.com/features | |
| RPMI 1640 with L-glutamine and 25 mM HEPES | Corning | 10-041-CV | |
| Serological Pipette, 10 mL | Thermo Scientific | 170356N | |
| Serological Pipette, 25 mL | Thermo Scientific | 170357N | |
| Serological Pipette, 5 mL | Thermo Scientific | 170355N | |
| Trypan Blue Solution, 0.4% | Corning | 25900CI | |
| Trypsin-EDTA, 0.25% | Corning | 25053CI |
Referências
- de Visser, K. E., Joyce, J. A. The evolving tumor microenvironment: From cancer initiation to metastatic outgrowth. Cancer Cell. 41 (3), 374-403 (2023).
- Hanahan, D., Weinberg, R. A. Hallmarks of cancer: The next generation. Cell. 144 (5), 646-674 (2011).
- Anderson, N. M., Simon, M. C. The tumor microenvironment. Curr Biol. 30 (16), R921-R925 (2020).
- Baghban, R., et al. Tumor microenvironment complexity and therapeutic implications at a glance. Cell Commun Signal. 18 (1), 59 (2020).
- Sahai, E., et al. A framework for advancing our understanding of cancer-associated fibroblasts. Nat Rev Cancer. 20 (3), 174-186 (2020).
- Erdogan, B., Webb, D. J. Cancer-associated fibroblasts modulate growth factor signaling and extracellular matrix remodeling to regulate tumor metastasis. Biochem Soc Trans. 45 (1), 229-236 (2017).
- Iozzo, R. V., Sanderson, R. D. Proteoglycans in cancer biology, tumour microenvironment and angiogenesis. J Cell Mol Med. 15 (5), 1013-1031 (2011).
- Amersfoort, J., Eelen, G. Immunomodulation by endothelial cells - partnering up with the immune system. Nat Rev Immunol. 22 (9), 576-588 (2022).
- Balani, S., Nguyen, L. V., Eaves, C. J. Modeling the process of human tumorigenesis. Nat Commun. 8 (1), 15422 (2017).
- Drost, J., Clevers, H. Organoids in cancer research. Nat Rev Cancer. 18 (7), 407-418 (2018).
- Wang, E., Xiang, K., Zhang, Y., Wang, X. -. F. Patient-derived organoids (PDOs) and PDO-derived xenografts (PDOXs): New opportunities in establishing faithful pre-clinical cancer models. J Natl Cancer Cent. 2 (4), 263-276 (2022).
- Kamb, A. What's wrong with our cancer models. Nat Rev Drug Discov. 4 (2), 161-165 (2005).
- Tuveson, D., Clevers, H. Cancer modeling meets human organoid technology. Science. 364 (6444), 952-955 (2019).
- Zitvogel, L., Pitt, J. M., Daillère, R., Smyth, M. J. Mouse models in oncoimmunology. Nat Rev Cancer. 16 (12), 759-773 (2016).
- Liu, Y., et al. Patient-derived xenograft models in cancer therapy: technologies and applications. Signal Transduct Target Ther. 8 (1), 160 (2023).
- Ben-David, U., et al. Patient-derived xenografts undergo mouse-specific tumor evolution. Nat Genet. 49 (11), 1567-1575 (2017).
- Byrne, A. T., et al. Interrogating open issues in cancer precision medicine with patient-derived xenografts. Nat Rev Cancer. 17 (4), 254-268 (2017).
- Ivanics, T., et al. Patient-derived xenograft cryopreservation and reanimation outcomes are dependent on cryoprotectant type. Lab Invest. 98 (7), 947-956 (2018).
- Biju, T. S., Priya, V. V., Francis, A. P. Role of three-dimensional cell culture in therapeutics and diagnostics: an updated review. Drug Deliv and Transl Res. 13 (9), 2239-2253 (2023).
- Urzì, O., et al. Three-dimensional cell cultures: The bridge between in vitro and in vivo models. Int J Mol Sci. 24 (15), 12046 (2023).
- Cacciamali, A., Villa, R., Dotti, S. 3D cell cultures: Evolution of an ancient tool for new applications. Front Physiol. 13, 836480 (2022).
- Abuwatfa, W. H., Pitt, W. G. Scaffold-based 3D cell culture models in cancer research. J Biomed Sci. 31 (1), 7 (2024).
- Yakavets, I., et al. Advanced co-culture 3D breast cancer model for investigation of fibrosis induced by external stimuli: optimization study. Sci Rep. 10 (1), 21273 (2020).
- Mohammadrezaei, D., et al. Predicting and elucidating the post-printing behavior of 3D printed cancer cells in hydrogel structures by integrating in-vitro and in-silico experiments. Sci Rep. 13 (1), 1211 (2023).
- Kuen, J., Darowski, D., Kluge, T., Majety, M. Pancreatic cancer cell/fibroblast co-culture induces M2 like macrophages that influence therapeutic response in a 3D model. PLOS ONE. 12 (7), e0182039 (2017).
- Bray, F., et al. Global cancer statistics 2022: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin. 74 (3), 229-263 (2024).
- Kennecke, H., et al. Metastatic behavior of breast cancer subtypes. J Clin Oncol. 28 (20), 3271-3277 (2010).
- Neve, R. M., et al. A collection of breast cancer cell lines for the study of functionally distinct cancer subtypes. Cancer Cell. 10 (6), 515-527 (2006).
- Pingitore, P., et al. Human multilineage 3D spheroids as a model of liver steatosis and fibrosis. Int J Mol Sci. 20 (7), 1629 (2019).
- Bar-Ephraim, Y. E., Kretzschmar, K. Organoids in immunological research. Nat Rev Immunol. 20 (5), 279-293 (2020).
- Beerkens, A. P. M., et al. Characterizing OXPHOS inhibitor-mediated alleviation of hypoxia using high-throughput live cell-imaging. Cancer Metab. 12 (1), 13 (2024).
- Feaster, T. K., et al. Matrigel mattress. Cir Res. 117 (12), 995-1000 (2015).
- Huang, Z., Yu, P., Tang, J. Characterization of triple-negative breast cancer MDA-MB-231 cell spheroid model. Onco Targets Ther. 13, 5395-5405 (2020).
- Nam, S., Khawar, I. A., Park, J. K., Chang, S., Kuh, H. -. J. Cellular context-dependent interaction between cancer and stellate cells in hetero-type multicellular spheroids of pancreatic tumor. Biochem Biophys Res Commun. 515 (1), 183-189 (2019).
- Monteiro, M. V., Gaspar, V. M., Ferreira, L. P. Hydrogel 3D in vitro tumor models for screening cell aggregation mediated drug response. Biomater Sci. 8 (7), 1855-1864 (2020).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados