Method Article
תאי סטרומה הטרו-תאיים בתרביות תלת מימד ללא פיגומים של תאי סרטן אפיתל כדי להניע פלישה
* These authors contributed equally
In This Article
Summary
יש צורך קריטי במודלים תלת מימדיים של סרטן הלוכדים הצלבה הטרו-תאית כדי לחקור גרורות סרטניות. המחקר שלנו מציג את הדור של הטרו-אפיתל סטרומלטי-תאי בסביבה נטולת פיגומים ופיגומים שניתן להשתמש בהם לחקר פלישה והתפלגות מרחבית תאית.
Abstract
סרטן השד הוא הגורם השני המוביל למוות הקשור לסרטן בקרב נשים בארה"ב. מודלים אורגנואידים של גידולים מוצקים הוכחו כמסכמים נאמנה היבטים של התקדמות הסרטן כגון התפשטות ופלישה. למרות שאורגנואידים שמקורם בחולה ואורגנואידים קסנוגרפט שמקורם בחולה רלוונטיים מבחינה פתופיזיולוגית, הם יקרים להפצה, קשים למניפולציה ומורכבים בעיקר מסוגי התאים המתרבים ביותר בתוך מיקרו-סביבת הגידול (TME). מגבלות אלו מונעות את השימוש בהם להבהרת מנגנונים תאיים של התקדמות המחלה התלויים בתאי סטרומה הקשורים לגידול הנמצאים בתוך TME וידועים כתורמים לגרורות ולעמידות לטיפול.
כאן, אנו מדווחים על שיטות לטיפוח תרביות תלת מימד רב-תאיות אפיתליות-סטרומליות. היתרונות של שיטות אלו כוללים מערכת חסכונית לייצור מהיר של תרביות תלת מימד דמויות אורגנואידים בסביבות נטולות פיגומים שניתן להשתמש בהן כדי לעקוב אחר פלישה ברזולוציה של תא בודד בתוך פיגומי הידרוג'ל. באופן ספציפי, אנו מדגימים כיצד ליצור תרביות תלת מימד הטרו-תאיות אלה באמצעות תאי סרטן שד BT-474 בשילוב עם פיברובלסטים (BJ-5ta), תאים דמויי מונוציטים (THP-1) ו/או תאי אנדותל (EA.hy926). בנוסף, תיוג פלואורסצנטי דיפרנציאלי של אוכלוסיות תאים מאפשר מיקרוסקופ זמן-lapse להגדיר הרכבת תרבית תלת מימדית ודינמיקת פלישה.
יש לציין כי הוספה של כל שני שילובי תאי סטרומה לתרביות תלת מימד של תאי BT-474 מפחיתה משמעותית את המעגליות של תרביות התלת מימד, בהתאם לנוכחותם של מבנים ספרואידים דמויי אורגנואידים או משניים. בניסויי צבע גשש, פיברובלסטים ותאי אנדותל מתמקמים בבליטות דמויות אורגנואיד היקפיות ומופרדים מרחבית מהספרואיד הראשוני BT-474. לבסוף, תרביות תלת מימד הטרו-תאיות של תאי BT-474 הגדילו את יכולת פלישת ההידרוג'ל. מכיוון שצפינו במבנים בולטים אלה בתרביות תלת מימד הטרו-תאיות של תאי אפיתל שד שאינם גידוליים וגידולים כאחד, עבודה זו מספקת שיטה יעילה וניתנת לשחזור ליצירת תרביות תלת מימד דמויות אורגנואידים בסביבה נטולת פיגומים לניתוחים עוקבים של פנוטיפים הקשורים להתקדמות גידול מוצק.
Introduction
התקדמות הסרטן מוכרת כיום כתלויה בשני גורמים עיקריים: השינויים הגנטיים/אפיגנטיים בתאי הגידול ומספר עצום של אינטראקציה עם תאים שאינם גידוליים במיקרו-סביבת הגידול (TME)1. בעוד ששינויים גנטיים בתאים מוכרים כהכרחיים להתחלת הגידול, שינויים כאלה לבדם אינם מספיקים להתקדמות הגידול ולגרורות2. מרכיבי ה-TME, שנחשבו במקור כצופים דוממים, ידועים כיום כמקדמים באופן פעיל את התקדמות הסרטן באמצעות דיבור הדדי ודינמי עם תאי גידול3. הרכב ה-TME משתנה בהתאם לרקמה ממנה נוצר הגידול, שלב הגידול ומאפייני המטופל, אך מאפייני ההיכר כוללים פיברובלסטים הקשורים לסרטן סטרומה (CAFs), מטריצה חוץ-תאית (ECM), תאי אנדותל כלי דם, כמו גם תאי חיסון אדפטיביים ומיאלואידים 1,4.
CAFs סטרומליים ב-TME מורכבים מתת-סוגים פיברובלסטים ממקורות ותפקודים מגוונים5. CAFs כאלה הם מרכיבי מפתח של TME מכיוון שהם מקיימים אינטראקציה עם תאי גידול במספר ממשקים. CAFs מפרישים חלבוני ECM המשנים את קשיחות המטריצה, מה שעלול להגביל את אספקת התרופה באמצעות שקיעה מוגזמת של קולגן, פרוטאוגליקנים ופיברונקטין או לאפשר לתאי גידול לפלוש מאתר הגידול הראשוני באמצעות הפרשת מטריצות מטאלופרוטאינאזות מפרקות ECM (MMPs)6,7. בנוסף, CAFs מקדמים צמיחה, נדידה וכלי דם של גידול באמצעות הפרשת מגוון גורמי גדילה, ציטוקינים וגורמים אנגיוגניים כגון גורם גדילה אפידרמיס (EGF), גורם גדילה טרנספורמטיבי β (TGF-β) וגורם גדילה אנדותל כלי דם (VEGF), בהתאמה 1,6. במקביל, תאי אנדותל, המופעלים על ידי TME היפוקסי מקדמים גם הם את כלי הדם של הגידול ומדכאים את תפקודי תאי החיסון באמצעות הפרשה מוגברת של גורמים אנגיוגניים והפרשה מופחתת של מולקולות הידבקות לויקוציטים 1,8.
עם המורכבות המורכבת לכאורה של התקדמות הסרטן, חיוני לשלב רכיבים סטרומליים של TME במחקר הסרטן הבסיסי. עם זאת, הקמת מודלים המסכמים נאמנה את הפתופיזיולוגיה הידועה של הגידול היא עדיין צורך משמעותי שלא נענה 9,10. בעוד שמודלים מסורתיים של תרביות תאים דו-ממדיות (2D) קלים לטיפול, מתורבתים במהירות וניתנים לשחזור מאוד, הם מורכבים רק משיבוטים של תאים סרטניים המתרבים במהירות ואינם משקפים את ההטרוגניות התאית המצויה בגידולים 10,11,12. באופן דומה, מודלים של עכברים טרנסגניים גם אינם לוכדים את הביולוגיה של הגידול האנושי בשל הטרוגניות גנטית נמוכה מהזדווגות, הבדלים משמעותיים במערכת החיסון ומורכבות היסטולוגית13,14. בשל מגבלות כאלה, טיפולים שפותחו ממודלים קלאסיים של סרטן לרוב אינם מתורגמים למסגרות קליניות.
מודלים של סרטן שמקורם בחולה כגון קסנוגרפטים שמקורם בחולה ואורגנואידים שמקורם בחולה יכולים לטפל בחסרונות של מודלים סרטניים קונבנציונליים על ידי לכידת מאפיינים מולקולריים של גידול באתר, רקע גנטי וארגון תאי 10,11,15. עם זאת, קסנוגרפים ואורגנואידים כאלה שמקורם בחולה דורשים הליכי השתלה מסובכים וזמן תרבית ארוך16,17. בשילוב עם שונות באתרי הרכישה והדגימה של הגידול ויעילות ירודה בשימור בהקפאה, יש צורך לפתח מודלים הפועלים כגשר בין תרביות תאים דו-ממדיות קלאסיות לבין מודלים סרטניים שמקורם בחולה11,18. בהקשר זה, מודלים תלת מימדיים של תרבית תאים יכולים לשמש כמודלים שניתן לתרבית במהירות וללכוד תכונות גידול חשובות in vivo כגון אינטראקציה בין תא לתא, אינטראקציה בין תא ל-ECM, היפוקסיה, אנגיוגנזה וייצור ECM 19,20.
מודלים של תרביות תאים תלת מימדיות מסווגים למערכות מודלים ללא פיגומים ומבוססות פיגומים. במערכות נטולות פיגומים, תאים מושרים לצבור את עצמם לצורה כדורית על ידי שימוש בלוחות תרבית תאים ספציפיים בעלי התקשרות נמוכה או על ידי מניפולציה של הפרמטרים הפיזיקליים של שיטות תרבית. שיטות מבוססות להשגת ספרואידים תלת מימדיים ללא פיגומים נעות בין תרביות כדורי תאים פשוטות על ידי צנטריפוגה לטיפות מיקרו-פלטות תלויות, ריחוף מגנטי ומערכות ביו-ריאקטור ומיקרופלואידיותדינמיות 20,21. תרביות תאים תלת מימדיות מבוססות פיגומים נוצרות על ידי תוספת של פיגומים מבוססי פולימר או הידרוג'ל כדי לחקות את המטריצה החוץ-תאית הפיזיולוגית19,22. מודלים כאלה טומנים בחובם פוטנציאל עצום למידול ארגון תאי in vivo, טופולוגיה, הצמדת מטריצות, הגירה ותגובה לתרופות.
בנוסף למניפולציה של פיגומים עבור מודלים של הרכב ECM במצבי מחלה, ניתן להשתמש בתרביות תאים תלת מימדיות גם למודל אוכלוסיות תאים הטרוגניות ב-TME. תרביות תאים תלת מימדיות המורכבות מתאי סרטן, ופיברובלסטים סטרומליים או תאי אנדותל, שימשו לחקר האינטראקציה בין סרטן וקווי תאים בודדים שאינם גידוליים 23,24,25. שיטות ניתנות לשחזור וחסכוניות להרחבת תרביות תאים תלת מימדיות כאלה המורכבות ממספר קווי תאים הטרוגניים יעזרו לחוקרים להבהיר את התקדמות הגידול. כאן, אנו מדווחים על שיטות לטיפוח תרביות תלת מימד רב-תאיות אפיתליות-סטרומליות כדי לחקור התפשטות, פלישה ופלסטיות מצב התא. הפרוטוקול מתאר תרביות תלת מימד נטולות פיגומים ותמצית קרום בסיס מבוססות פיגומים של תאי סרטן השד בתרבית משותפת עם שילוב של תאי סטרומה החל מפיברובלסטים (BJ-5ta), תאי אנדותל (Ea.hy926) ותאים דמויי מונוציטים (THP-1). סרטן השד הוא כיום הסרטן השני בשכיחותו בעולם והסרטן המאובחן ביותר בקרב נשים בארה"ב26. מוות מסרטן השד נובע בעיקר מהאופי הגרורתי והעמיד לטיפול של המחלה, שכן ההישרדות הכללית וללא גרורות מופחתת משמעותית בחולות שאובחנו עם תת-סוגים אגרסיביים של סרטן שד מועשר ב-HER2 ודמוי בסיס27. פרוטוקולי תרבית התאים התלת-ממדיים המתוארים שלנו עשויים לסייע בפיתוח שיטות תרבית חסכוניות, מהירות וניתנות לשחזור שעשויות להיות משולבות עם שיטות שימור רקמות משובצות פרפין קבועות בפורמלין ויישומי ביולוגיה מרחבית לאחר מכן.
Protocol
1. מדיום תרבית תאים
הערה: הכן את כל המדיה בתוך ארון בטיחות ביולוגית.
- להכנת מדיום תרבית תאים עבור BJ-5ta, BT474, EA.hy926 ו-MDA-MB-468, יש להוסיף 500 מ"ל של Dulbecco's Modified Eagle Medium (DMEM) עם 10% סרום בקר עוברי מומת בחום (FBS) ו-1% פניצילין-סטרפטומיצין עם פיפטה. שלבו 0.1% גנטמיצין עם מיקרופיפטה.
- להכנת מדיום תרבית תאים ל-MCF10A, יש להוסיף 500 מ"ל של DMEM/F12 עם 5% סרום סוס ו-1% פניצילין-סטרפטומיצין עם פיפטה. שלבו 0.1% גנטמיצין, 1 מ"ל של 1 מיקרוגרם/מ"ל הידרוקורטיזון, 500 מיקרוליטר של 10 מיקרוגרם/מ"ל אינסולין, 50 מיקרוליטר של 100 ננוגרם/מ"ל רעלן כולרה, ו-10 מיקרוליטר של 20 ננוגרם/מ"ל גורם גדילה אפידרמיס עם מיקרופיפטה.
- להכנת מדיום תרבית תאים ל-MCF10Ca1h, יש להוסיף 500 מ"ל של DMEM/F12 עם 5% סרום סוס ו-1% פניצילין-סטרפטומיצין עם פיפטה. שלבו 0.1% גנטמיצין עם מיקרופיפטה.
- להכנת מדיום תרבית תאים ל-THP-1, יש להוסיף 500 מ"ל של RPMI 1640 עם 10% FBS ו-1% פניצילין-סטרפטומיצין עם פיפטה. שלבו 0.1% גנטמיצין עם מיקרופיפטה.
- החלף את מדיום תרבית התאים כל 2-3 ימים עבור BJ-5ta, BT474, EA.hy926, MDA-MB-468, MCF10A ו-MCF10Ca1h עד שהתאים מגיעים למפגש של 70-80% על ידי הערכת צמיחתם מדי יום במיקרוסקופ שדה בהיר. שנה את מדיום תרבית התאים פעם בשבוע עבור תאי THP-1.
- גדל תאי BJ-5ta, BT474, EA.hy926, MDA-MB-468, MCF10A ו-MCF10Ca1h בצלחות של 100 מ"מ עם משטחים שטופלו בתרבית תאים בחממות תרבית תאים סטנדרטיות עם 5% CO2.
- לגדל תאי THP-1 בצלוחיות שטופלו בתרבית תאים T75 באינקובטורים סטנדרטיים של תרביות תאים עם 5% CO2.
2. איסוף תאים
- הפעל את אור ה-UV כדי לחטא את פנים ארון הבטיחות הביולוגית למשך 15 דקות.
- פתח את אבנט חלון ארון הבטיחות הביולוגית כדי לייצב את זרימת האוויר והפעל את מערכת שאיבת הוואקום.
- נקה את משטח מכסה המנוע הפנימי ואת הצינורות של מערכת שאיבת הוואקום עם 70% אתנול.
- הכן מדיום תרבית תאים טרי ללא סרום בתוך ארון הבטיחות הביולוגית: הוסף 500 מ"ל של מדיום הנשר המותאם (DMEM) של Dulbecco עם 1% פניצילין/סטרפטומיצין באמצעות פיפטה. שלבו 0.1% ג'נטמיצין עם מיקרופיפטה.
- יש לחמם את מדיום תרבית התאים, מי מלח עם חוצץ פוספט (PBS) וטריפסין-EDTA (0.25%) ל-37 מעלות צלזיוס על ידי הנחת הפריטים באמבט חרוזים לפני תחילת הניסוי.
- ודא שהתאים מתכנסים 70-80% באמצעות בדיקה ויזואלית באמצעות מיקרוסקופ.
- שאפו והשליכו את מדיום התרבות מהתאים המצופים בעזרת שואב הוואקום. שוטפים את המדיום הנותר פעם אחת עם 2 מ"ל PBS עם פיפטה, ואז שואבים וזורקים את ה-PBS עם שואב הוואקום.
הערה: תאי THP-1 גדלים בתרחיף; ניתן להשמיט את שלבים 2.7-2.9. - מוסיפים 1 מ"ל טריפסין לצלחת תרבית התאים בעזרת מיקרופיפטה, ומניחים את הצלחת בתוך אינקובטור 5% CO2 בטמפרטורה של 37 מעלות צלזיוס למשך 5 דקות.
- השבת את הטריפסין על ידי הוספת 1 מ"ל של מעכב טריפסין פולי סויה (ב-1x PBS) לצלחת בעזרת מיקרופיפטה. פיזרו אשכולות תאים על ידי פיפטינג של תערובת הנוזל עם מיקרופיפטה P1000 ואספו את תרחיף התאים מתחתית הצלחת. העבירו את תרחיף התאים עם מיקרופיפטה לצינור חרוטי של 15 מ"ל וצנטריפוגה בטמפרטורה של 100 × גרם למשך 5 דקות בטמפרטורת החדר. השלך את הסופרנטנט עם שואב הוואקום.
- המשך לספירת תאים.
3. הכנת תמיסת צבע עובדת וצביעה של תאים בהשעיה
- לפני פתיחת הבקבוקון של בדיקות פלואורסצנטיות מולקולריות של גשש תאים (ראה טבלת חומרים), אפשר למוצר להתחמם לטמפרטורת החדר למשך 15 דקות באמבט חרוזים המוגדר על 37 מעלות צלזיוס.
- ממיסים את הצבע הכחול של עוקב התאים הליופילי (מסה = 5 מ"ג, משקל מולקולרי = 209.6 גרם/מול) לריכוז סופי של 10 מ"מ עם 2.385 מ"ל של DMSO באמצעות מיקרופיפטה.
- ממיסים את הצבע הכתום של עוקב התאים הליופילי (מסה = 50 מיקרוגרם, משקל מולקולרי = 550.4 גרם/מול) לריכוז סופי של 10 מ"מ עם 9.084 מיקרוליטר של DMSO באמצעות מיקרופיפטה.
- ממיסים את הצבע האדום העמוק של עוקב התאים הליופילי (מסה = 15 מיקרוגרם, משקל מולקולרי = 698.3 גרם/מול) לריכוז סופי של 1 מ"מ עם 20 מיקרוליטר של DMSO באמצעות מיקרופיפטה.
- הכן את תמיסת מדיית הצבע הכחול של גשש תא העבודה (5 מיקרומטר) על ידי דילול 1 מיקרוליטר של הצבע ב-2 מ"ל של מדיום DMEM נטול סרום עם מיקרופיפטה.
- הכן את תמיסת מדיית הצבע הכתום של גשש תא העבודה (5 מיקרומטר) על ידי דילול 1 מיקרוליטר של הצבע ב-2 מ"ל של מדיום DMEM נטול סרום עם מיקרופיפטה.
- הכן את תמיסת מדיית הצבע האדום העמוק (1 מיקרומטר) על ידי דילול 2 מיקרוליטר של הצבע ב-2 מ"ל של מדיום DMEM נטול סרום עם מיקרופיפטה.
- השעו מחדש את תאי האפיתל, פיברובלסטים BJ-5ta ותאי אנדותל Ea.hy926 בתמיסות מדיה של צבע כחול, כתום ואדום עמוק (2 מ"ל), בהתאמה עם מיקרופיפטה.
- דגרו את הצינורות בטמפרטורה של 37 מעלות צלזיוס בחממת 5% CO2 למשך 30 דקות.
- לאחר 30 דקות של דגירה, צנטריפוגה את הצינורות ב-100 x גרם למשך 5 דקות בטמפרטורת החדר.
- שאפו והשליכו את הסופרנטנט עם שואב הוואקום והשעו מחדש את הגלולה ביסודיות ב-1 מ"ל של 10% מדיום DMEM המכיל סרום FBS עם מיקרופיפטה.
- המשך לספירת תאים.
4. ספירת תאים
- אוספים 10 מיקרוליטר מתרחיף התא ומעבירים אותו למיקרו-צינור עם מיקרופיפטה.
- מערבבים עם 10 מיקרוליטר טריפן כחול ופיפטה היטב.
- העבירו 20 מיקרוליטר מתמיסת התא-טריפן עם מיקרופיפטה לשקופית תא ספירת תאים. הכנס וספור את התאים באמצעות מונה תאים אוטומטי.
- חשב את מספר התאים החיים הממוצע הכולל משתי קריאות.
5. חישובים
- הכן מלאי תאים עובדים לכל סוג תא בריכוז של 6.67 × 103 תאים/מ"ל שווה ערך ל-2,000 תאים/300 מיקרוליטר.
הערה: נפח המלאי הכולל יהיה תלוי בגודל המדגם הניסיוני. - עבור ספרואידים חד-תרביתיים, ודא שכל דגימה עצמאית מורכבת מ-300 מיקרוליטר של מלאי העבודה של תאי האפיתל השווה ערך ל-2,000 תאי אפיתל.
- עבור ספרואידים בתרבית משותפת (שני סוגי תאים), ודא שכל דגימה עצמאית מורכבת מ-150 מיקרוליטר של מלאי עבודה של תאי אפיתל ו-150 מיקרוליטר של מלאי עבודה של תאי סטרומל. הדגימה תכיל 1,000 תאי אפיתל ו-1,000 תאי סטרומל.
- עבור ספרואידים בתרבית משותפת (שלושה סוגי תאים), ודא שכל דגימה עצמאית מורכבת מ-150 מיקרוליטר של מלאי עבודה של תאי אפיתל, 75 מיקרוליטר של מלאי עבודה של תא סטרומה #1 ו-75 מיקרוליטר של מלאי עבודה של תא סטרומה #2. הדגימה תכיל 1,000 תאי אפיתל, 500 תאי סטרומה של מלאי עבודה #1 ו-500 תאי סטרומה של מלאי עבודה #2.
6. ציפוי
- העבירו את הנפח הנדרש עם מיקרופיפטה לשלושה שכפולים טכניים, בתוספת תוספת אחת, למיקרו-צינור. מערבבים היטב עם פיפטה, ואז מעבירים 300 מיקרוליטר מהדגימה לבאר של מיקרופלטה בצורת U עם תחתית נמוכה במיוחד של 96 בארות.
- חזור על התהליך עבור כל שכפול טכני נוסף.
- מניחים את צלחת 96 הבארות בחממה בטמפרטורה של 37 מעלות צלזיוס.
7. הדמיית שדה בהירות
- התבונן בצמיחה ומורפולוגיה של כדורים כל 24 שעות עד 96 שעות באמצעות מיקרוסקופ.
- דמיין ספרואידים באמצעות מיקרוסקופ ניגודיות פאזה.
8. הגדרת פרוטוקול הדמיה בשדה רחב עבור ספרואידים מוכתמים בצבעי גשש וספרואידים המכוסים בתמצית קרום מרתף
- הפעל את התקני ההדמיה והחממה האוטומטית המפורטים בטבלת החומרים, וצור פרוטוקול הדמיה חדש במנהל המשימות של תוכנת ההדמיה. תחת הכרטיסייה נוהל, הגדר את נקודת הגדרת טמפרטורת החממה האוטומטית ל-37 מעלות צלזיוס, ואפשר לחממה לאזן CO2% וטמפרטורה לפני שתמשיך לשלב הבא.
הערה: ניתן להשתמש בהדמיית פלורסנט חלופית אם יש לה את המסננים המתאימים לכל אחד מהצבעים (כחול, אדום עמוק וכתום) המשמשים. - הגדר את הגדרות התמונה למפרטים הבאים: הגדלה: 4X PL FL PHASE, שדה ראייה: 3185 X 3185 מיקרומטר, WFOV מלא.
- השתמש במפרט הבא עבור הערוצים: DAPI: 377/447 ננומטר, תאורה = 10, זמן אינטגרציה = 107 אלפיות השנייה, רווח = 10, RFP: 531/593 ננומטר, תאורה = 10, זמן אינטגרציה = 137 אלפיות השנייה, רווח = 10, CY5: 628/685 ננומטר, תאורה = 10, זמן אינטגרציה = 137 אלפיות השנייה, רווח = 10.
- להדמיית ספרואידים בשכבת-על של תמיסת תמצית ממברנת מרתף, השתמש במפרטי השדה הבהיר הבאים: תאורה = 10, זמן אינטגרציה = 5 אלפיות השנייה ורווח = 17.1.
- בחר את הבארות הרצויות להדמיה ואשר את שינויי המפרט על ידי לחיצה על סמל בחר בארות .
- נווט אל הכרטיסייה הפחתת נתונים כדי להתאים את הגדרות הניתוח הסלולרי.
- קבעו את ערך הסף ל- 19,500 עם רקע בהיר, ובחרו 'מלא חורים במסיכות'.
- לבחירת אובייקט, קבעו את גודל העצם המינימלי ל- 100 מיקרומטר ואת גודל העצם המרבי ל- 1,000 מיקרומטר, ובחרו 'נתח את כל התמונה'.
הערה: רק מסיכה ראשית וספירת אובייקטים נחוצים לניתוח זה. - שמור את כל השינויים ופתח את יישום ההדמיה.
- הנח את המיקרו-פלטה התחתונה הניסיונית בצורת U בחממה על ידי פתיחת המגירה, ולאחר מכן סגור אותה באמצעות תוכנת ההדמיה.
- כדי להפעיל את הפרוטוקול, לחץ על הכרטיסייה פרטי פרוצדורה , הוסף משתמש ובחר את הפרוטוקול.
- ודא שנבחר סוג הצלחת הנכון והגדר את זמן ההדמיה ל-30 דקות לכל צלחת.
- בחר את מרווח ההדמיה הרצוי, ציין אם לצלחת יש מכסה והתאם את זמן ומשך התחלת ההדמיה.
- לחץ על תזמון לוחית/כלי כדי להתחיל בתהליך ההדמיה.
9. כיסוי תמיסת תמצית קרום מרתף (אופציונלי)
הערה: ניתן למרוח תמיסת תמצית קרום מרתף על ספרואידים 24 שעות לאחר הציפוי.
- מלאו דלי קרח בקרח כדי לשמור על תמיסת תמצית קרום המרתף קרה ואחסנו אותה בטמפרטורה של 4 מעלות צלזיוס כאשר אינה בשימוש.
- שאפו כ -170 מיקרוליטר של מדיום בעזרת פיפטה רב ערוצית.
- השתמש בזכוכית מגדלת ובקופסת אור קטנה כדי להתבונן מקרוב בכדורים הקטנים. הנח את צלחת הכדור בעלת 96 הבארות מעל קופסת האור ומקם את זכוכית המגדלת מעל.
- הגדר את הפיפטה P200 ל-30 מיקרוליטר ואסוף את תמצית קרום הבסיס ליצירת שלוש מיקרו-טיפות.
- הוסף מיקרו-טיפה אחת על כל כדור משלושת השכפולים הטכניים עם מיקרופיפטה.
- ודא שהצלחת בעלת 96 הבארות שטוחה ומקם את הפיפטה אנכית מעל הכדור. שחרר את הטיפה מבלי לגעת בקרקעית הבאר.
- מניחים את הצלחת בחממה בטמפרטורה של 37 מעלות צלזיוס למשך 20 דקות.
- שכבו את הספרואידים עם 50 מיקרוליטר נוספים של תמיסת תמצית קרום המרתף לכל באר עם מיקרופיפטה.
- מקם מחדש את הספרואידים למרכז הבאר באמצעות קצה פיפטה.
- יש לדגור בטמפרטורה של 37 מעלות צלזיוס למשך 30 דקות.
- הוסף 100 מיקרוליטר של מדיום תרבית תאים לכל באר.
10. כימות
- הורד ופתח את תוכנת ImageJ. העלה את התמונות הספרואידיות.
- הגדר מדידות על ידי לחיצה על ניתוח | הגדר מידות ובחר אזור | צנטרואיד. מדוד את הספרואידים באמצעות כלי הלאסו כדי לעקוב אחר הספרואיד ולמדוד את האובייקט.
- רשום את הערכים עבור שלושה שכפולים ביולוגיים וחשב את השטח והמעגליות הממוצעים.
- המר את השטח מפיקסלים למטרים רבועים באמצעות הנוסחה הבאה:
שטח (m2) = ((550/504) × √ (שטח בפיקסלים)) 2 - נתח נתונים.
- בחר הזן ערכים משוכפלים, מוערמים בעמודות.
- הזן את הנתונים לעמודות ובחר את בקרת הספרואידים המונוקולטורית ואת דגימות הספרואידים לטיפול בתרבית משותפת.
- בצע ניתוח עמודות ANOVA חד-כיווני.
- השתמש בפרמטרים הבאים של ANOVA:
- הימנע מהתאמה או התאמה.
- נניח התפלגות גאוס של שאריות.
- נניח סטיות תקן שוות.
- השתמש במבחן ההשוואה המרובה של Tukey כדי להשוות את הממוצע של כל עמודה עם הממוצע של כל עמודה אחרת.
11. עיבוד תמונה אימונופלואורסצנטי בשדה רחב
- שמור את התמונות ישירות מתוכנת ההדמיה כפורמט קובץ PNG או Tiff.
- בחר כל ערוץ בנפרד או ערוצים חופפים ושמור כקובץ PNG.
- התאימו את הבהירות והניגודיות בתוכנת הצילום או ב-ImageJ אם התמונות מיוצאות כקובצי Tiff.
תוצאות
במחקר זה, פיתחנו מערכת תרבית תאים ליצירת ספרואידים תלת מימדיים הטרו-תאיים המורכבים מתאי אפיתל וסטרומה עם מורפולוגיה דמוית אורגנואיד. ספרואידים הוקמו על ידי ציפוי של 2,000 תאי אפיתל בתנאי מונוקולטורה. בתנאי תרבית משותפת של שני סוגי תאים, ספרואידים הוקמו על ידי ציפוי של 1,000 תאי אפיתל ו-1,000 תאי סטרומל. בתנאי תרבית משותפת של שלושה סוגי תאים, ספרואידים הוקמו על ידי ציפוי של 1,000 תאי אפיתל ושני סוגי תאי סטרומה שונים של 500 תאים מכל סוג תא. במעלה הזרם של הקמת הספרואידים, ניתן לצבוע תאים בצבעי מעקב אחר תאים פלואורסצנטיים המאפשרים ניטור ארגון מרחבי תאי. לאחר 24 שעות של היווצרות ספרואידים ראשונית, יישומים במורד הזרם כוללים הפרעות פרמקולוגיות, הדמיה ואיסוף דגימות. הדמיית זמן-lapse שימושית להערכת שינויים בהתנהגות ובמורפולוגיה של ספרואידים, כולל שטח ומעגליות (איור 1A). ב-24 שעות לאחר הציפוי, ניתן להטמיע ספרואידים בסביבת פיגום, וניתן להשתמש בהדמיית זמן-lapse כדי להעריך את הופעתם של מבנים פולשניים מהספרואיד (איור 1B). לאיסוף דגימות ספרואידים הטרו-תאיות יש יישומים רבים, כולל פרופיל גנומי ופרוטאומי ברמה הגלובלית וברמה הבודדת באמצעות טכניקות ניסיוניות כגון ריצוף RNA, ריצוף RNA של תא בודד, ריצוף פרוטאומי ואימונופלואורסצנציה מחזורית.
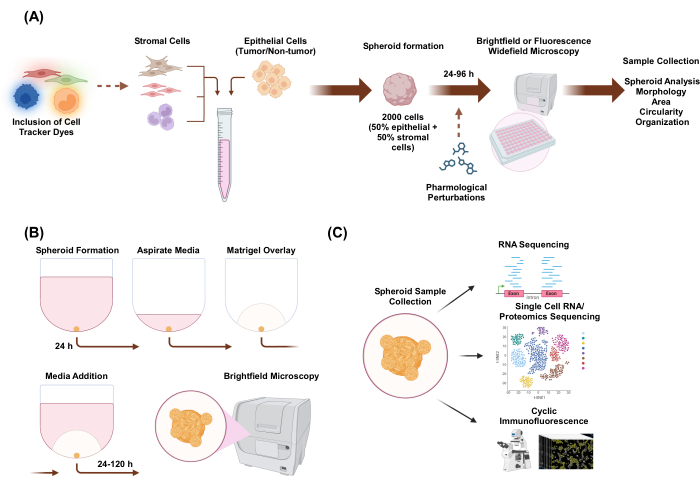
איור 1: ייצוג סכמטי של תהליך תרבית התאים התלת-ממדית ויישומים פוטנציאליים. (A) תרחיף תאים של תאי אפיתל עם תאי סטרומה שאינם אפיתל מוזרם לתוך לוחות חיבור תלת-ממדיים אולטרה-נמוכים ליצירת ספרואידים. ספרואידים מצולמים על ידי מיקרוסקופ שדה בהיר כל 24 שעות במשך 96 שעות. ניתן לצבוע קווי תאים בצבעי מעקב אחר תאים פלואורסצנטיים למיקרוסקופ שדה רחב במורד הזרם לפני גרימת היווצרות ספרואידים או להפריע להם פרמקולוגית לאחר היווצרות ספרואידים. ניתן לנתח פרמטרים ספרואידים כגון מורפולוגיה, שטח, מעגליות וארגון. (B) ספרואידים של תאי אפיתל ותאי אפיתל עם תאי סטרומה נוצרים באמצעות הפרוטוקול מ-A. ספרואידים הוקמו על ידי ציפוי של 2,000 תאי אפיתל בתנאי מונוקולטורה. בתנאי תרבית משותפת של שני סוגי תאים, ספרואידים הוקמו על ידי ציפוי של 1,000 תאי אפיתל ו-1,000 תאי סטרומל. בתנאי תרבית משותפת של שלושה סוגי תאים, ספרואידים הוקמו על ידי ציפוי של 1,000 תאי אפיתל ושני סוגי תאי סטרומה שונים של 500 תאים מכל סוג תא. לאחר 24 שעות, תמיסת תמצית קרום בסיס דמוית פיגום מונחת, והתמונות נלכדות במיקרוסקופ שדה בהיר כל 24 שעות למשך 120 שעות. (C) ניתן להשתמש בתרביות תלת מימד הטרו-רב-תאיות מבוססות ללא פיגומים ומבוססות פיגומים למגוון יישומים במורד הזרם כגון אימונופלואורסצנציה מחזורית, ריצוף RNA של תא יחיד ופרוטאומיקה של תא בודד. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
ספרואידים מונוקולטורים MCF10A, MCF10Ca1h ו-BT-474 שומרים על פנוטיפ כדורי קומפקטי עד 96 שעות לאחר הציפוי. בתרבית משותפת עם תאי אנדותל מיקרו-וסקולריים EA.hy926, פיברובלסטים BJ-5ta ו/או תאים דמויי מונוציטים THP-1, הספרואידים פיתחו בליטות תאיות בפריפריה, שהפכו בולטות יותר לאחר 96 שעות (איור 2A-C). חשוב לציין, תופעות הבליטות, הנביטות והדחיסה הללו של ספרואידים מייצגות וריאציות של הארגון התאי של הספרואיד הסרטני ותאי הסטרומה המתורבתים בקורלציה עם פולשניות תלת מימדית לאחר הוספת הידרוג'ל מבוסס קרום בסיסי כמו מטריג'ל. המורפולוגיה הניצנית נעה בין אגרגטים של תאים מוצקים לרופפים, בדומה למורפולוגיה אורגנואידית. לעומת זאת, ספרואידים מונוקולטורים MDA-MB-468 הופיעו כאגרגטים גדולים ורופפים של תאים. עם זאת, כאשר תאי MDA-MB-468 עברו תרבית משותפת עם EA.hy926, BJ-5ta ו/או THP-1, הם יצרו ספרואידים קומפקטיים (איור 2D).
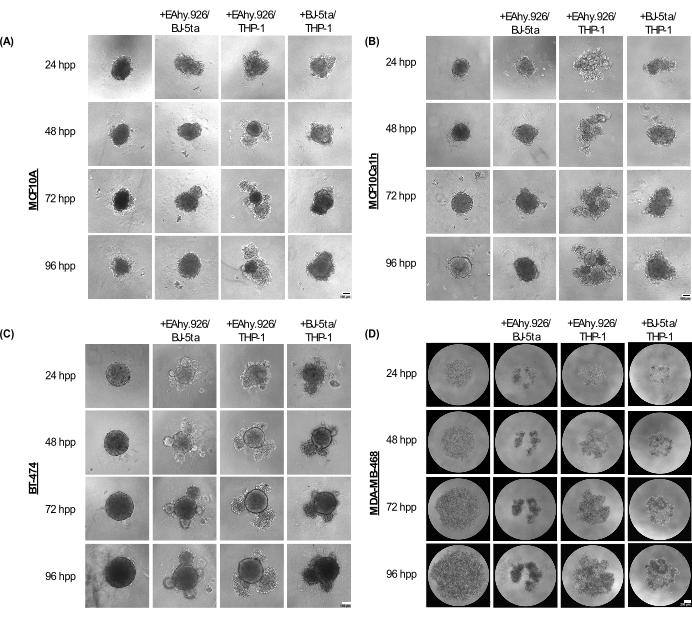
איור 2: מגוון הארכיטקטורות והמורפולוגיה שאומצו על ידי שילובים של תאי סטרומה שאינם אפיתל בשילוב עם תאי גידול אפיתל/לא גידול בתרביות תלת מימד ללא פיגומים. תמונות שדה בהירות מייצגות של (A) MCF10A, (B) MCF10Ca1h, (C) BT-474, (D) ספרואידים MDA-MB-468 במונוקולטורה או בתנאי תרבית משותפת עם פיברובלסטים סטרומליים BJ-5ta/Ea.hy926 תאי אנדותל מיקרו-וסקולריים או תאים דמויי מונוציטים Ea.hy926/THP-1 או תאי BJ-5ta/THP-1 לאורך 96 שעות. כל ספרואיד נוצר על ידי ציפוי של 2,000 תאים. ספרואידים בתנאי מונוקולטורה נוצרו באמצעות 2,000 תאי אפיתל. ספרואידים בתנאי תרבית משותפת נוצרו באמצעות 1,000 תאי אפיתל ושני סוגי תאי סטרומה שונים של 500 תאים. היווצרות מבנים דמויי אורגנואידים ניצנים או מצטברים החלה בתנאי תרבית משותפת ספרואידית 24 שעות לאחר הציפוי בתאי אפיתל MCF10A, MCF10Ca1h ו-BT-474. דחיסה של תאי MDA-MB-468 נצפתה בתנאי תרבית משותפת ספרואידית 25 שעות לאחר הציפוי. פסי קנה מידה = 100 מיקרומטר. קיצור: hpp = שעות לאחר הציפוי. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
ב-72 שעות לאחר הציפוי, תאי MCF10A, MCF10Ca1h ו-BT-474 שגודלו בתרבית משותפת עם EA.hy926 ו-THP-1, או עם BJ-5ta ו-THP-1, הראו עלייה משמעותית בשטח הספרואידים בהשוואה לספרואידים אפיתליאליים מונוקולטורים. MCF10Ca1h הראה גם עלייה משמעותית באזור הספרואיד בתרבית משותפת עם EA.hy926 ו-BJ-5ta. הופעתם של מבנים ניצנים בספרואידים בתרבית משותפת הובילה לירידה משמעותית במעגליות הספרואידים עבור MCF10A, MCF10Ca1h ו-BT-474 בתרבית משותפת עם EA.hy926 ו-THP-1, או עם BJ-5ta ו-THP-1. השפעות דומות נצפו עבור BT-474 בתרבית משותפת עם EA.hy926 ו-BJ-5ta (איור 3A,B). לעומת זאת, תאי MDA-MB-468 שגודלו בתרבית משותפת עם EA.hy926 ו-BJ-5ta, EA.hy926 ו-THP-1, או BJ-5ta ו-THP-1, הראו ירידה משמעותית בשטח הספרואידים בהשוואה לספרואידים מונוקולטורים MDA-MB-468; עם זאת, לא הייתה השפעה על המעגליות (איור 3A,B).

איור 3: גרפים של ניתוח שטח ומעגליות של תרביות סטרומליות תלת-ממדיות נטולות פיגומים חד-תרביות והטרומלט-תאיות ב-72 שעות לאחר הציפוי. (A) שטח ממוצע (ס"מ2) ו-(B) מעגליות ממוצעת של MCF10A, MCF10Ca1h, BT-474 ו-MDA-MB-468 בתרביות ספרואידים סטרומליות חד-תרביות והטרומולטי-תאיות 72 שעות לאחר הציפוי. הנתונים המדווחים מייצגים לפחות שלושה שכפולים ביולוגיים בלתי תלויים ומדווחים כממוצעי שכפול טכניים ± SEM, אלא אם צוין אחרת. *, **, *** או **** מייצגים ערכי p < 0.05, 0.01, 0.001 או 0.0001, בהתאמה, אלא אם צוין אחרת. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
היישום של צבע מעקב תאים על תאי אפיתל גידוליים BT-474 ותאי סטרומה לפני התבססות הספרואידים הראה שתאי סטרומל, כולל EA.hy926 ו-BJ-5ta, יצרו את המבנים הניצנים בהיקף הספרואידים המרכזיים של BT474 (איור 4, סרטון משלים S1, סרטון משלים S2, וידאו משלים S3 ווידאו משלים S4). לאחר 48 שעות לאחר הציפוי, תמונות פלואורסצנטיות בודדות בשדה רחב של ספרואידים בתרבית משותפת עם פיברובלסטים מגלות כי ספרואידים פיברובלסטים התמקמו יחד עם תאי אנדותל אך לא התמקמו יחד עם ספרואידים BT-474. מיעוט של תאי אנדותל נמצא גם כמתמקם יחד עם ספרואידים BT-474 בתנאי תרבית משותפת. זה מצביע על כך שסידור תאי הסטרומה בתוך הספרואיד נמצא בקורלציה עם מורפולוגיה דמוית אורגנואיד.
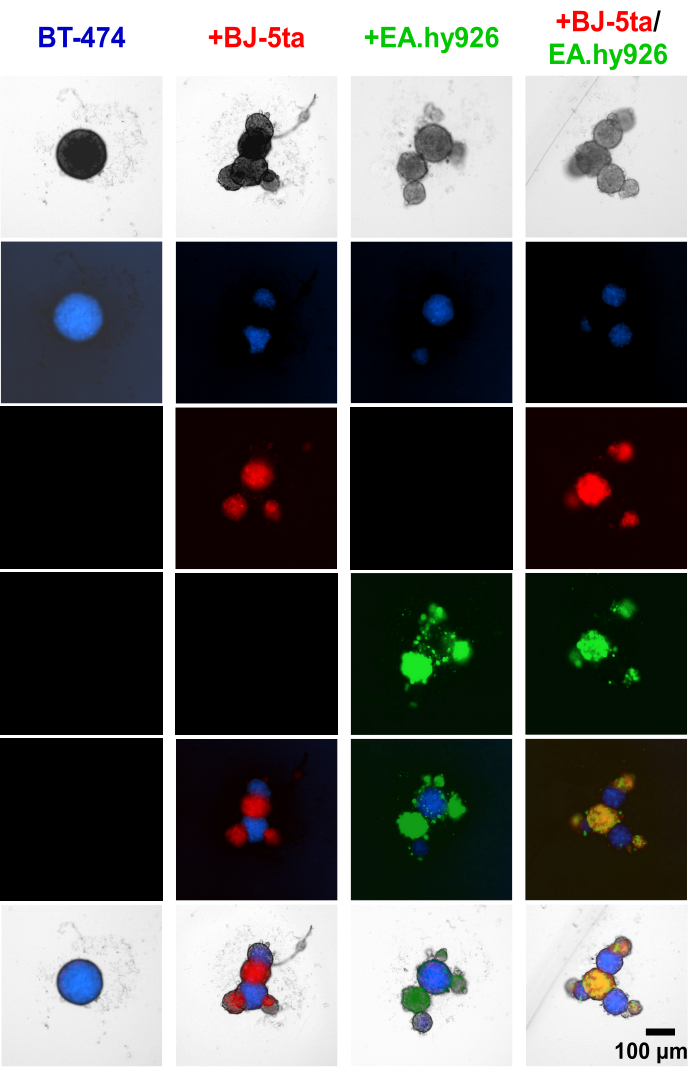
איור 4: תמונות סטילס פלואורסצנטיות בשדה רחב של תאי סטרומה ותאי BT-474 צבועים באופן דיפרנציאלי בתרביות תלת-ממדיות הטרו-תאיות ב-48 שעות לאחר הציפוי. ספרואידים BT-474 מוכתמים בצבע פלואורסצנטי של מעקב תאים כחולים. פיברובלסטים BJ-5ta מוכתמים בצבע עוקב תאים כתומים, המיוצג בצבע אדום. תאי אנדותל Ea.hy926 מוכתמים בצבע מעקב אחר תאים אדומים עמוקים, המיוצג בצבע ירוק. כל ספרואיד נוצר על ידי ציפוי של 2,000 תאים. ספרואידים בתנאי מונוקולטורה נוצרו באמצעות 2,000 תאי אפיתל. ספרואידים בתנאי תרבית משותפת (BT-474/BJ-5ta, BT-474/Ea.hy926) נוצרו באמצעות 1,000 תאי אפיתל ו-1,000 תאי סטרומל. ספרואידים בתנאי תרבית משותפת כפולה (BT-474/BJ-5ta/Ea.hy926) נוצרו באמצעות 1,000 תאי אפיתל ו-500 תאים מכל סוג של תאי סטרומל. הנתונים מייצגים לפחות שלושה שכפולים ביולוגיים. סרגל קנה מידה = 100 מיקרומטר. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
כדי להעריך את הרלוונטיות הביולוגית של מודל הספרואידים האורגנואידים שלנו, הספרואידים כוסו בתמיסת תמצית קרום הבסיס 24 שעות לאחר הציפוי. ספרואידים מונוקולטורים BT-474 לא הראו תכונות פולשניות 120 שעות לאחר הציפוי. עם זאת, ספרואידים BT-474 בתרבית משותפת עם BJ-5ta או EA.hy926 פיתחו מבנים בפריפריה של הספרואיד, שפלשו לסביבת תמיסת תמצית קרום הבסיס של הפיגום. מספר ואורך הבליטות הללו שופרו באופן משמעותי בספרואידים BT-474 שגודלו בתרבית משותפת עם BJ-5ta ו-EA.hy926 ב-48 שעות עד 120 שעות לאחר הציפוי (איור 5, סרטון משלים S5, סרטון משלים S6, סרטון משלים S7 וסרטון משלים S8).
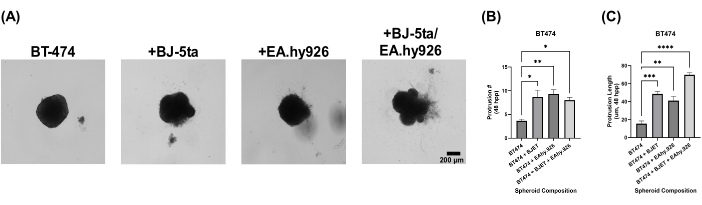
איור 5: תמונות סטילס Brightfield של תאי BT-474 בתרביות תלת-ממדיות הטרו-תאיות עם שכבת-על של תמיסת תמצית ממברנת הבסיס ב-5 ימים לאחר שכבת-העל. כל ספרואיד נוצר על ידי ציפוי של 2,000 תאים. תמיסת תמצית קרום הבסיס הייתה מונחת על ספרואידים 24 שעות לאחר הציפוי. ספרואידים בתנאי מונוקולטורה נוצרו באמצעות 2,000 תאי אפיתל. ספרואידים בתנאי תרבית משותפת (BT-474/BJ-5ta ו-BT-474/Ea.hy926) נוצרו באמצעות 1,000 תאי אפיתל ו-1,000 תאי סטרומל. ספרואידים בתנאי תרבית משותפת כפולה (BT-474/BJ-5ta/Ea.hy926) נוצרו באמצעות 1,000 תאי אפיתל ו-500 תאים מכל סוג של תאי סטרומל. (A) ניתן להבחין במבנים פולשניים הבולטים מהספרואיד הסרטני המוטבע בתמיסת תמצית קרום הבסיס בתנאי תרבית משותפת. (ב) הסמכה של ספירת בליטות פולשניות בזמן 48 כ"ס. (ג) הסמכה של אורך בליטה פולשנית בזמן 48 כ"ס. הנתונים מייצגים לפחות שלושה שכפולים ביולוגיים. סרגל קנה מידה = 200 מיקרומטר. קיצור: hpp = שעות לאחר הציפוי. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
סרטון משלים S1: כדור מונוקולטור BT-474 עם צבע כחול גשש תאים. תאי BT-474 (2,000) הושעו מחדש במיקרו-פלטה בצורת U עם תחתית נמוכה במיוחד עם 96 בארות ליצירת ספרואידים. חפיפה של תמונות פלואורסצנטיות של שדה בהיר ושדה רחב צולמה במשך 48 שעות. קיצור: ULA = חיבור נמוך במיוחד. אנא לחץ כאן להורדת סרטון זה.
סרטון משלים S2: ספרואידים BT-474 בתרבית משותפת עם פיברובלסטים BJ-5ta. BT-474 (1,000) ו-1,000 פיברובלסטים BJ-5ta הושעו מחדש בלוחות ULA ליצירת ספרואידים. תאי BT-474 הודגרו עם צבע כחול עוקב תאים ופיברובלסטים BJ-5ta עם צבע כתום עוקב תאים. חפיפה של תמונות שדה בהיר ושדה רחב (כחול = BT-474, אדום = BJ-5ta) צולמה במשך 48 שעות. קיצור: ULA = חיבור נמוך במיוחד. אנא לחץ כאן להורדת סרטון זה.
סרטון משלים S3: ספרואידים BT-474 בתרבית משותפת עם תאי אנדותל Ea.hy926. תאי אנדותל BT-474 (1,000) ו-1,000 Ea.hy926 הושעו מחדש בלוחות ULA ליצירת ספרואידים. תאי BT-474 הודגרו עם צבע כחול עוקב תאים ותאי אנדותל Ea.hy926 עם צבע אדום עמוק של עוקב תאים. חפיפה של תמונות פלואורסצנטיות בשדה בהיר ושדה רחב (כחול = BT-474, ירוק = Ea.hy926) צולמה במשך 48 שעות. קיצור: ULA = חיבור נמוך במיוחד. אנא לחץ כאן להורדת סרטון זה.
סרטון משלים S4: ספרואידים BT-474 בתרבית משותפת עם פיברובלסטים BJ-5ta ותאי אנדותל Ea.hy926. BT-474 (1,000), 500 פיברובלסטים BJ-5ta ו-500 תאי אנדותל Ea.hy926 הושעו מחדש בלוחות ULA ליצירת ספרואידים. תאי BT-474 הודגרו בצבע כחול של מעקב אחר תאים. פיברובלסטים BJ-5ta ותאי אנדותל Ea.hy926 הודגרו עם צבע כתום עוקב תאים וצבע אדום עמוק, בהתאמה. חפיפה של תמונות פלואורסצנטיות בשדה בהיר ושדה רחב (כחול = BT-474, אדום = BJ-5ta, ירוק = Ea.hy926) צולמה במשך 48 שעות. קיצור: ULA = חיבור נמוך במיוחד. אנא לחץ כאן להורדת סרטון זה.
סרטון משלים S5: ספרואיד מונוקולטור BT-474 בתמיסת תמצית ממברנת המרתף. תאי BT-474 (2,000) הושעו מחדש בלוחות ULA ליצירת ספרואידים, והספרואידים הוטמעו בתמיסת ממברנת הבסיס 24 שעות לאחר הציפוי. תמונות ברייטפילד צולמו במשך 60 שעות. קיצור: ULA = חיבור נמוך במיוחד. אנא לחץ כאן להורדת סרטון זה.
סרטון משלים S6: ספרואידים BT-474 בתרבית משותפת עם פיברובלסטים BJ-5ta בתמיסת תמצית קרום הבסיס. BT-474 (1,000) ו-1,000 פיברובלסטים BJ-5ta הושעו מחדש בלוחות ULA ליצירת ספרואידים, והספרואידים הוטמעו בתמיסת תמצית קרום הבסיס 24 שעות לאחר הציפוי. תמונות ברייטפילד צולמו במשך 60 שעות. קיצור: ULA = חיבור נמוך במיוחד. אנא לחץ כאן להורדת סרטון זה.
סרטון משלים S7: ספרואידים BT-474 בתרבית משותפת עם תאי אנדותל Ea.hy926 בתמיסת תמצית קרום הבסיס. תאי אנדותל BT-474 (1,000) ו-1,000 Ea.hy926 הושעו מחדש בלוחות ULA ליצירת ספרואידים, והספרואידים הוטמעו בתמיסת תמצית קרום מרתף 24 שעות לאחר הציפוי. תמונות ברייטפילד צולמו במשך 60 שעות. קיצור: ULA = חיבור נמוך במיוחד. אנא לחץ כאן להורדת סרטון זה.
סרטון משלים S8: ספרואידים BT-474 בתרבית משותפת עם פיברובלסטים BJ-5ta ותאי אנדותל Ea.hy926 בתמיסת תמצית קרום הבסיס. BT-474 (1,000), 500 פיברובלסטים BJ-5ta ו-500 תאי אנדותל Ea.hy926 הושעו מחדש בלוחות ULA ליצירת ספרואידים, והספרואידים הוטמעו בתמיסת תמצית קרום מרתף 24 שעות לאחר הציפוי. תמונות Brightfield צולמו במשך 60 שעות. אנא לחץ כאן להורדת סרטון זה.
Discussion
המודל הספרואיד ההטרו-רב-תאי שלנו מדגים כי אינטראקציות בין תאי אפיתל-סטרומה מניעות ניצנים של תאי סטרומה בתנאי תרבית תלת מימדית ללא פיגומים והיווצרות מבנים פולשניים בתנאי תרבית תלת מימדית מבוססי פיגומים. ראינו היווצרות מבנה עקבית בשני קווי התאים הגידוליים (MCF10Ca1h ו-BT-474) ובקו תאי האפיתל הלא גידולי MCF10A (איור 2A-C). מעניין שבעוד שספרואידים מקווי תאים MCF10A, MCF10Ca1h ו-BT-474, בין אם במונוקולטורה או בתרבית משותפת עם פיברובלסטים ותאי אנדותל, יצרו מבנים מעגליים וקומפקטיים בסביבות נטולות פיגומים, ספרואידים מקו התאים MDA-MB-468 הראו פחות דחיסה (איור 2D). זה היה בלתי צפוי, שכן תאי MDA-MB-468 היו צפויים ליצור ספרואידים מעגליים, כמו שאר קווי תאי האפיתל שנבדקו. קו התאים SUM-149, קו תאי סרטן שד ראשוני אפיתל-מזנכימלי היברידי, נמצא כיוצר ספרואידים קומפקטיים כמו MCF10A, MCF10Ca1h ו-BT-474 (הנתונים לא מוצגים)28. מחקר עתידי צריך לחקור את מסלולי האיתות המתווכים את היווצרותם של ספרואידים פחות קומפקטיים בקו התאים MDA-MB-468 מכיוון שאנומליות כאלה עשויות להצביע על פגיעויות תאיות שניתן למנף לפיתוח אסטרטגיות טיפוליות חדשות.
לגבי השילוב של קווי תאים שונים, תאים דמויי מונוציטים THP-1 גורמים להיווצרות מבני אגרגט רופפים בכל תנאי התרבות המשותפת של ספרואידים. פחות דחיסה נצפתה במבנים ניצנים בתנאי תרבית משותפת עם תאי THP-1/Ea.hy926 בהשוואה לאלו בתנאי תרבית משותפת עם תאי THP-1/BJ-5ta (איור 2A-D). לכן, הדחיסה של ספרואידים מושפעת מהרכב תאי הסטרומה במודל29,30.
ציפוי לא עקבי של שילובי התאים ההטרו-תאים יכול לגרום להתפתחות ספרואידית לא שלמה או לשונות בגודל הספרואיד, בהשוואה לשכפולים הטכניים שלהם. הבטחת עקביות בציפוי התאים היא קריטית, שכן הסידור המרחבי של התאים הקובע את הפנוטיפ וההתפתחות הספרואידית מתרחש בעיקר במהלך 48השעות הראשונות. במהלך תקופה קריטית זו, יחסי התאים ממלאים תפקיד מכריע, כאשר שיעור תאי הסטרומה משפיע הן על השטח הספרואיד והן על המעגליות.
אגרגטים ספרואידים רופפים, התלויים בסוג התא, יכולים להתפרק בקלות במהלך טיפול ידני. עם זאת, מניפולציה ידנית נחוצה בעת כיסוי ספרואידים בתמיסת תמצית קרום בסיס דמוית פיגום או בעת איסוף דגימות ספרואידים שלמות. כדי להקל על בעיה זו, רצוי לעבוד בקצב איטי יותר בעת איסוף ספרואידים באמצעות שאיבת פיפטה ולמזער את הטיפול הידני במידת האפשר. במהלך שכבת תמיסת תמצית קרום המרתף, ספרואידים נוטים לנוע בתוך הבאר, ולעתים קרובות מתיישבים בקצה הבאר. יחס תמיסה למדיה של תמצית ממברנת הבסיס חשוב לשמירה על תכונות המטריצה של מערכת התלת מימד; עם זאת, לא ניתן לעטוף את הספרואידים במלואם בשל הצמיגות של תמיסת תמצית קרום המרתף, ולכן נדרשת התערבות ידנית32. מיקום ספרואיד לא ממורכז מהווה אתגר להדמיה, שכן שבירת אור ליד קצה הפלסטיק של הבאר עלולה להפריע לבהירות התמונה.
הספרואידים ששימשו במחקר זה היו מורכבים משורות תאי סרטן אנושיים; השיטות המתוארות כאן עדיין לא יושמו על קווי תאים ראשוניים. התוצאות שלנו מצביעות על כך שאינטראקציות ספציפיות בין תאים יכולות להניע את היווצרותם של מבנים דמויי אורגנואידים, מה שמעיד על היישום הפוטנציאלי של שיטה זו על מגוון רחב של קווי תאים גידוליים. עם זאת, בעוד שהמודל שלנו מנסה לחקות את המורכבות של מיקרו-סביבת הגידול, השיעורים השונים של התפשטות התאים מהווים אתגר למחקרים ארוכי טווח33. תאים המתרבים במהירות נוטים לגדול יותר מתרבים לאט יותר, מה שהופך את המודל הזה לפחות מתאים לניסויים ממושכים. בנוסף, דרישות שונות לסוג מצע גידול עבור קווי תאים יכולות להכניס גורמים נוספים שעלולים להוביל לפנוטיפים ספרואידים. רוב קווי התאים במחקר זה גודלו במצע DEM. מחקרים עם קווי תאים הגדלים במדיות שונות עשויים לדרוש תנאי תרבית שונים הבודקים מגוון יחסי מדיה; עם זאת, השפעה זו נצפתה בניסויים ארוכי טווח30.
המודל שלנו מציע מספר יתרונות על פני מודלים אחרים של סרטן בתלת מימד. לספרואידים שאנו מייצרים יש מורפולוגיה וגודל ראשוניים אחידים וניתנים לשחזור, מה שמקל על השוואת תוצאות הטיפול עם בקרות. לעומת זאת, מודלים מסוימים המשתמשים בתאים בודדים תלויים במדיה או בפיגומים יכולים לגרום להתפלגות מרחבית תאית משתנה, מה שמוביל לחוסר עקביות. מודל זה מדגים כי ניתן לחקור ביעילות אינטראקציות בין אוכלוסיות תאים נפרדות.
באופן מסורתי, מודלים אורגנואידים וספרואידים הורכבו מתאי סרטן מונוקולטורים או תרביות משותפות של תאים סרטניים כדי לחקור שיפועים של חומרים מזינים, היפוקסיה או סידור תאים34. בנוסף, ניתן ללמוד מודל זה בסביבה פיגומים תוך 24 שעות לאחר הציפוי, מה שמספק הזדמנות לחקור אירועי פלישה מוקדמים המונעים על ידי אינטראקציות תא-תא מגוונות. בעוד שגישות סרטן תלת-ממדיות חלופיות משתמשות ברכיבי מטריצת פיגומים שונים כדי לחקור שינויים במורפולוגיה ופולשניות של הספרואידים, מודל זה משלים אותם בכך שהוא מאפשר לחקור את השינויים הללו בהקשר של הדינמיקה של אוכלוסיית התאים והרכב הפיגומים35.
רוב הספרואידים המיוצרים בשיטות שלנו שומרים על שלמותם המבנית לאחר טיפול ידני, מה שמאפשר איסוף דגימות ביישומים במורד הזרם. ניתן להכניס שינויים גנטיים קונבנציונליים כגון CRISPR-Cas9, התמרת shRNA לנטי-ויראלית והפרעות siRNA במעלה הזרם של היווצרות ספרואידים. ההתנהגויות המורכבות שנצפו בספרואידים אלה מצביעות על שינויים דינמיים בביטוי הגנים, אותם ניתן לחקור עוד יותר באמצעות RNA-seq. ניתן להשתמש בטכניקות מתקדמות כגון CycIF, scRNA-seq, CosMx ו-Visium לחקר גנומיקה ופרוטאומיקה ברמה מרחבית או חד-תאית. למודל ספרואיד זה יש פוטנציאל לחקות מחקרי in vivo של טיפולי גידול ממוקדים על ידי לכידת אינטראקציות בין ניצני תאי סטרומה לחומרים טיפוליים לפני שהוא מגיע לתאי הסרטן. זה משמעותי מכיוון שהוא יכול לעזור לקבוע אם תאי סטרומה משפיעים על עוצמת התרופה, מה שעשוי להגן על תאי הסרטן מפני ההשפעות הטיפוליות.
Disclosures
למחברים אין ניגודי אינטרסים להצהיר עליהם.
Acknowledgements
אנו מודים לחברי המעבדה לאונקוגנים התפתחותיים של אוניברסיטת ביילור על ההערות המועילות והמשוב שלהם במהלך הכנת כתב היד הזה. תמיכה במימון ניתנה על ידי המחלקה לביולוגיה של אוניברסיטת ביילור והמכללה לאמנויות ומדעים, NIH-NIGMS 2SC1GM121182 (ל-J.A.K).
Materials
| Name | Company | Catalog Number | Comments |
| 15 mL Polypropylene Centrifuge Tubes | Falcon | 14-959-53A | |
| 96-Well, Treated, U-Shaped-Bottom Microplate | Thermo Scientific | 12566432 | |
| 100 mm Dish Cell Culture Treated Surface | Thermo Scientific | 130182 | |
| 170 L CO2 Incubators | VWR | VWR51014991(10810902) | |
| 200 Self-Sealing Barrier Pipet Tips | Fisher Scientific | 02-682-255 | |
| 500 mL DMEM/Hams F-12, [+] L-glutamine | Corning | 10-090-CV | |
| 1000 Self-Sealing Barrier Pipet Tips | Molecular Biology Products Inc. | 2179HR | |
| Animal-Free Recombinant Human EGF | PeproTech | AF-100-15 | |
| Automated Pipette Repeater E3x | Eppendorf | 4987000410 | |
| Basement membrane solution | Huntsman Cancer Institute | https://healthcare.utah.edu/huntsmancancerinstitute/ | |
| Bead Bath | Lab Armor | 74300706 | |
| Biorender | Biorender | Biorender.com | |
| Biosafety Laminar Flow Cabinets | Thermo Scientific | 300590389 | |
| BioSpa 8 Automated Incubator | Agilent | 23082120 | |
| Cell Counter | Invitrogen | AMQAF2000 | |
| Cell Counting Chamber Slides | Thermo Scientific | C10283 | |
| CellTracker Deep Red | Thermo Fisher Scientific | C34565 | |
| Centrifuge | Thermo Scientific | 13100675 | |
| Cholera Toxin B subunit | Sigma-Aldrich | C9903-1MG | |
| Combitips advanced, Sterile, 5.0 mL | Fisher Scientific | 13-683-714 | |
| Cytation 10 Reader Imager | Agilent | 2105245 | |
| Defined Trypsin Inhibitor | Gibco | R007100 | soybean trypsin inhibitor in 1x PBS |
| Donor Horse Serum, 500 mL, United States Origin | Corning | 35-030-CV | |
| Dulbecco's Modified Eagle's Medium | Corning | 10-013-CV | |
| Excel Sofware | Microsoft office 365 | https://www.microsoft.com/en-us/microsoft-365/excel | |
| Fetal Bovine Serum | Thermo Scientific | 26140079 | |
| Fetal Bovine Serum, qualified, US origin | Thermo Scientific | 26140079 | |
| Gentamicin Sulfate, Liquid | Corning | 30-005-CR | |
| GraphPad Prism | |||
| Hydrocortisone solution,50 µM, sterile-filtered, BioXtra | Sigma-Aldrich | H6909-10ML | |
| Image J Software | Fiji | https://imagej.net/ij/ | |
| Insulin solution human | Sigma-Aldrich | I9278-5ML | |
| Magnifying Glass | Fisher Scientific | 01-182-392 | |
| Microcentrifuge Tube | Costar | 3621 | |
| Microscope | Olympus | CKX53SF | |
| Mini Lightbox | Fisher Scientific | 361044708 | |
| Molecular Probes CellTracker Blue CMAC Dye | Fisher Scientific | C2110 | |
| Molecular Probes CellTracker Orange CMRA Dye | Fisher Scientific | C34551 | |
| Penicillin-Streptomycin Solution | Cytiva | SV30010 | |
| Penicillin-Streptomycin Solution | Cytiva | SV30010 | |
| Phase-Contrast Microscope | Echo | RVSF1000 | |
| Phosphate Buffered Saline | Fisher Scientific | SH3025601 | |
| Pipet Controller | Corning | 4099 | |
| Pipette 100 – 1,000 µL | Eppendorf | 3123000063 | |
| Pipette 20 – 200 µL | Eppendorf | 3123000055 | |
| Prism | GraphPad Software | https://www.graphpad.com/features | |
| RPMI 1640 with L-glutamine and 25 mM HEPES | Corning | 10-041-CV | |
| Serological Pipette, 10 mL | Thermo Scientific | 170356N | |
| Serological Pipette, 25 mL | Thermo Scientific | 170357N | |
| Serological Pipette, 5 mL | Thermo Scientific | 170355N | |
| Trypan Blue Solution, 0.4% | Corning | 25900CI | |
| Trypsin-EDTA, 0.25% | Corning | 25053CI |
References
- de Visser, K. E., Joyce, J. A. The evolving tumor microenvironment: From cancer initiation to metastatic outgrowth. Cancer Cell. 41 (3), 374-403 (2023).
- Hanahan, D., Weinberg, R. A. Hallmarks of cancer: The next generation. Cell. 144 (5), 646-674 (2011).
- Anderson, N. M., Simon, M. C. The tumor microenvironment. Curr Biol. 30 (16), R921-R925 (2020).
- Baghban, R., et al. Tumor microenvironment complexity and therapeutic implications at a glance. Cell Commun Signal. 18 (1), 59 (2020).
- Sahai, E., et al. A framework for advancing our understanding of cancer-associated fibroblasts. Nat Rev Cancer. 20 (3), 174-186 (2020).
- Erdogan, B., Webb, D. J. Cancer-associated fibroblasts modulate growth factor signaling and extracellular matrix remodeling to regulate tumor metastasis. Biochem Soc Trans. 45 (1), 229-236 (2017).
- Iozzo, R. V., Sanderson, R. D. Proteoglycans in cancer biology, tumour microenvironment and angiogenesis. J Cell Mol Med. 15 (5), 1013-1031 (2011).
- Amersfoort, J., Eelen, G. Immunomodulation by endothelial cells - partnering up with the immune system. Nat Rev Immunol. 22 (9), 576-588 (2022).
- Balani, S., Nguyen, L. V., Eaves, C. J. Modeling the process of human tumorigenesis. Nat Commun. 8 (1), 15422 (2017).
- Drost, J., Clevers, H. Organoids in cancer research. Nat Rev Cancer. 18 (7), 407-418 (2018).
- Wang, E., Xiang, K., Zhang, Y., Wang, X. -. F. Patient-derived organoids (PDOs) and PDO-derived xenografts (PDOXs): New opportunities in establishing faithful pre-clinical cancer models. J Natl Cancer Cent. 2 (4), 263-276 (2022).
- Kamb, A. What's wrong with our cancer models. Nat Rev Drug Discov. 4 (2), 161-165 (2005).
- Tuveson, D., Clevers, H. Cancer modeling meets human organoid technology. Science. 364 (6444), 952-955 (2019).
- Zitvogel, L., Pitt, J. M., Daillère, R., Smyth, M. J. Mouse models in oncoimmunology. Nat Rev Cancer. 16 (12), 759-773 (2016).
- Liu, Y., et al. Patient-derived xenograft models in cancer therapy: technologies and applications. Signal Transduct Target Ther. 8 (1), 160 (2023).
- Ben-David, U., et al. Patient-derived xenografts undergo mouse-specific tumor evolution. Nat Genet. 49 (11), 1567-1575 (2017).
- Byrne, A. T., et al. Interrogating open issues in cancer precision medicine with patient-derived xenografts. Nat Rev Cancer. 17 (4), 254-268 (2017).
- Ivanics, T., et al. Patient-derived xenograft cryopreservation and reanimation outcomes are dependent on cryoprotectant type. Lab Invest. 98 (7), 947-956 (2018).
- Biju, T. S., Priya, V. V., Francis, A. P. Role of three-dimensional cell culture in therapeutics and diagnostics: an updated review. Drug Deliv and Transl Res. 13 (9), 2239-2253 (2023).
- Urzì, O., et al. Three-dimensional cell cultures: The bridge between in vitro and in vivo models. Int J Mol Sci. 24 (15), 12046 (2023).
- Cacciamali, A., Villa, R., Dotti, S. 3D cell cultures: Evolution of an ancient tool for new applications. Front Physiol. 13, 836480 (2022).
- Abuwatfa, W. H., Pitt, W. G. Scaffold-based 3D cell culture models in cancer research. J Biomed Sci. 31 (1), 7 (2024).
- Yakavets, I., et al. Advanced co-culture 3D breast cancer model for investigation of fibrosis induced by external stimuli: optimization study. Sci Rep. 10 (1), 21273 (2020).
- Mohammadrezaei, D., et al. Predicting and elucidating the post-printing behavior of 3D printed cancer cells in hydrogel structures by integrating in-vitro and in-silico experiments. Sci Rep. 13 (1), 1211 (2023).
- Kuen, J., Darowski, D., Kluge, T., Majety, M. Pancreatic cancer cell/fibroblast co-culture induces M2 like macrophages that influence therapeutic response in a 3D model. PLOS ONE. 12 (7), e0182039 (2017).
- Bray, F., et al. Global cancer statistics 2022: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin. 74 (3), 229-263 (2024).
- Kennecke, H., et al. Metastatic behavior of breast cancer subtypes. J Clin Oncol. 28 (20), 3271-3277 (2010).
- Neve, R. M., et al. A collection of breast cancer cell lines for the study of functionally distinct cancer subtypes. Cancer Cell. 10 (6), 515-527 (2006).
- Pingitore, P., et al. Human multilineage 3D spheroids as a model of liver steatosis and fibrosis. Int J Mol Sci. 20 (7), 1629 (2019).
- Bar-Ephraim, Y. E., Kretzschmar, K. Organoids in immunological research. Nat Rev Immunol. 20 (5), 279-293 (2020).
- Beerkens, A. P. M., et al. Characterizing OXPHOS inhibitor-mediated alleviation of hypoxia using high-throughput live cell-imaging. Cancer Metab. 12 (1), 13 (2024).
- Feaster, T. K., et al. Matrigel mattress. Cir Res. 117 (12), 995-1000 (2015).
- Huang, Z., Yu, P., Tang, J. Characterization of triple-negative breast cancer MDA-MB-231 cell spheroid model. Onco Targets Ther. 13, 5395-5405 (2020).
- Nam, S., Khawar, I. A., Park, J. K., Chang, S., Kuh, H. -. J. Cellular context-dependent interaction between cancer and stellate cells in hetero-type multicellular spheroids of pancreatic tumor. Biochem Biophys Res Commun. 515 (1), 183-189 (2019).
- Monteiro, M. V., Gaspar, V. M., Ferreira, L. P. Hydrogel 3D in vitro tumor models for screening cell aggregation mediated drug response. Biomater Sci. 8 (7), 1855-1864 (2020).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved