Method Article
Células estromales heteromulticelulares en cultivos 3D sin andamios de células de cáncer epitelial para impulsar la invasión
* Estos autores han contribuido por igual
En este artículo
Resumen
Existe una necesidad crítica de modelos de cáncer en 3D que capturen la diafonía heterocelular para estudiar la metástasis del cáncer. Nuestro estudio presenta la generación de estromas-epiteliales heteromulticelulares en un entorno de andamios y libres de andamios que pueden ser utilizados para estudiar la invasión y las distribuciones espaciales celulares.
Resumen
El cáncer de mama es la segunda causa principal de muerte relacionada con el cáncer entre las mujeres en los EE. UU. Se ha demostrado que los modelos de organoides de tumores sólidos recapitulan fielmente aspectos de la progresión del cáncer, como la proliferación y la invasión. Aunque los organoides derivados del paciente y los organoides de xenoinjerto derivados del paciente son fisiopatológicamente relevantes, son costosos de propagar, difíciles de manipular y están compuestos principalmente por los tipos de células más proliferativas dentro del microambiente tumoral (TME). Estas limitaciones impiden su uso para dilucidar los mecanismos celulares de la progresión de la enfermedad que dependen de las células estromales asociadas al tumor que se encuentran dentro de la TME y que se sabe que contribuyen a la metástasis y a la resistencia al tratamiento.
Aquí, informamos sobre los métodos para cultivar cultivos 3D multicelulares epitelio-estromales. Las ventajas de estos métodos incluyen un sistema rentable para generar rápidamente cultivos 3D similares a organoides dentro de entornos libres de andamios que se pueden usar para rastrear la invasión a resolución de una sola célula dentro de andamios de hidrogel. En concreto, demostramos cómo generar estos cultivos 3D heteromulticelulares utilizando células de cáncer de mama BT-474 en combinación con fibroblastos (BJ-5ta), células tipo monocitos (THP-1) y/o células endoteliales (EA.hy926). Además, el marcaje fluorescente diferencial de las poblaciones celulares permite que la microscopía de lapso de tiempo defina el ensamblaje del cultivo en 3D y la dinámica de invasión.
En particular, la adición de dos combinaciones de células estromales a los cultivos 3D de células BT-474 reduce significativamente la circularidad de los cultivos 3D, lo que es consistente con la presencia de estructuras esferoides secundarias o similares a organoides. En los experimentos con colorantes rastreadores, los fibroblastos y las células endoteliales se colocalizan en las protuberancias periféricas similares a organoides y se segregan espacialmente del esferoide primario BT-474. Por último, los cultivos 3D heteromulticelulares de células BT-474 han aumentado la capacidad de invasión de hidrogeles. Dado que observamos estas estructuras protrusivas en cultivos 3D heteromulticelulares de células epiteliales de mama tanto tumorigénicas como no tumorigénicas, este trabajo proporciona un método eficiente y reproducible para generar cultivos 3D similares a organoides en un entorno libre de andamios para análisis posteriores de fenotipos asociados con la progresión de tumores sólidos.
Introducción
En la actualidad se reconoce que la progresión del cáncer depende de dos factores principales: los cambios genéticos/epigenéticos en las células tumorales y una miríada de interacciones con células no tumorales en el microambiente tumoral (TME)1. Si bien se reconoce que los cambios genéticos en las células son necesarios para la iniciación del tumor, tales alteraciones por sí solas no son suficientes para la progresión del tumor y la metástasis2. Ahora se sabe que los componentes de la TME, que originalmente se pensaba que eran espectadores silenciosos, promueven activamente la progresión del cáncer a través de la diafonía mutua y dinámicacon las células tumorales. La composición de la TME difiere según el tejido del que se origina el tumor, el estadio del tumor y las características del paciente, pero las características distintivas incluyen fibroblastos asociados al cáncer estromal (CAF), matriz extracelular (MEC), células endoteliales vasculares, así como células inmunitarias adaptativas y mieloides 1,4.
Los CAF estromales en el TME están compuestos por subtipos de fibroblastos de diversos orígenes y funciones5. Estos CAF son componentes clave del TME, ya que interactúan con las células tumorales en varias interfaces. Los CAF secretan proteínas de la MEC que alteran la rigidez de la matriz, lo que puede limitar la administración del fármaco a través de la deposición excesiva de colágeno, proteoglicanos y fibronectina o permitir que las células tumorales invadan desde el sitio del tumor primario a través de la secreción de metaloproteinasas de la matriz (MMP) que degradan la MEC6,7. Además, los CAF promueven el crecimiento, la migración y la vascularización tumorales a través de la secreción de una variedad de factores de crecimiento, citocinas y factores angiogénicos como el factor de crecimiento epidérmico (EGF), el factor de crecimiento transformante β (TGF-β) y el factor de crecimiento endotelial vascular (VEGF), respectivamente 1,6. Paralelamente, las células endoteliales, impulsadas por la TME hipóxica, también promueven la vascularización tumoral y suprimen las funciones de las células inmunitarias a través del aumento de la secreción de factores angiogénicos y la disminución de la secreción de moléculas de adhesión leucocitaria 1,8.
Con la aparente complejidad de la progresión del cáncer, se ha vuelto esencial incorporar los componentes del estroma TME en la investigación básica del cáncer. Sin embargo, el establecimiento de modelos que recapitulen fielmente la fisiopatología tumoral conocida sigue siendo una importante necesidad insatisfecha 9,10. Si bien los modelos tradicionales de cultivo celular bidimensional (2D) son fáciles de manejar, se cultivan rápidamente y son altamente reproducibles, solo se componen de clones de células cancerosas que proliferan rápidamente y no reflejan la heterogeneidad celular que se encuentra en los tumores 10,11,12. De manera similar, los modelos de ratones transgénicos tampoco capturan la biología tumoral humana debido a la baja heterogeneidad genética de la endogamia, las diferencias significativas en el sistema inmune y la complejidad histológica13,14. Debido a estas limitaciones, las terapias desarrolladas a partir de modelos clásicos de cáncer a menudo no se traducen a los entornos clínicos.
Los modelos de cáncer derivados del paciente, como los xenoinjertos derivados del paciente y los organoides derivados del paciente, pueden abordar los inconvenientes de los modelos de cáncer convencionales mediante la captura de las características moleculares del tumor in situ, el fondo genético y la organización celular 10,11,15. Sin embargo, estos xenoinjertos y organoides derivados del paciente requieren procedimientos de injerto complicados y un largo tiempo de cultivo16,17. Combinado con la variación en los sitios de adquisición y muestreo de tumores y la baja eficiencia en la criopreservación, existe la necesidad de desarrollar modelos que actúen como un puente entre los cultivos celulares 2D clásicos y los modelos de cáncer derivados del paciente11,18. En este sentido, los modelos 3D de cultivo celular pueden servir como modelos que se pueden cultivar rápidamente y capturar características tumorales in vivo importantes como la interacción célula-célula, la interacción célula-ECM, la hipoxia, la angiogénesis y la producción de ECM19,20.
Los modelos de cultivo celular 3D se clasifican en sistemas de modelos sin andamios y basados en andamios. En los sistemas sin andamios, las células son inducidas a autoagregarse en una forma esférica mediante el uso de placas específicas de cultivo celular de baja adherencia o mediante la manipulación de los parámetros físicos de los métodos de cultivo. Los métodos establecidos para obtener esferoides 3D libres de andamios van desde simples cultivos de pellets celulares por centrifugación hasta gotas de microplacas colgantes, levitación magnética y biorreactores dinámicos y sistemas microfluídicos20,21. Los cultivos celulares 3D basados en andamios se establecen mediante la adición de andamios basados en polímeros o hidrogeles para imitar la matriz extracelular fisiológica19,22. Estos modelos tienen un inmenso potencial para modelar in vivo la organización celular, la topología, la unión a la matriz, la migración y la respuesta a los fármacos.
Además de la manipulación de andamios para modelos de composición de ECM en estados de enfermedad, los cultivos celulares en 3D también se pueden utilizar para modelar poblaciones celulares heterogéneas en un TME. Se han utilizado cultivos celulares 3D compuestos por células cancerosas y fibroblastos estromales o células endoteliales para estudiar la interacción del cáncer y las líneas celulares individuales no tumorales 23,24,25. Los métodos reproducibles y rentables para expandir estos cultivos celulares en 3D compuestos por múltiples líneas celulares heterogéneas ayudarían a los investigadores a dilucidar la progresión tumoral. Aquí, informamos sobre los métodos para cultivar cultivos 3D multicelulares epitelio-estromales para estudiar la proliferación, la invasión y la plasticidad del estado celular. El protocolo describe cultivos 3D de células de cáncer de mama sin andamio y con extracto de membrana basal cocultivadas con una combinación de células estromales que van desde fibroblastos (BJ-5ta), células endoteliales (Ea.hy926) y células similares a monocitos (THP-1). El cáncer de mama es actualmente el segundo cáncer más común en todo el mundo y el cáncer más diagnosticado en mujeres en los EE.UU.26. La muerte por cáncer de mama se debe en gran medida a la naturaleza metastásica y resistente al tratamiento de la enfermedad, ya que la supervivencia general y sin metástasis se reduce significativamente en las pacientes diagnosticadas con subtipos de cáncer de mama agresivos enriquecidos con HER2 y de tipo basal27. Nuestros protocolos de cultivo celular en 3D descritos pueden ayudar a desarrollar métodos de cultivo rentables, rápidos y reproducibles que pueden combinarse con métodos de preservación de tejidos fijados en formol e incluidos en parafina y aplicaciones posteriores de biología espacial.
Protocolo
1. Medio de cultivo celular
NOTA: Prepare todos los medios dentro de un gabinete de bioseguridad.
- Para preparar el medio de cultivo celular para BJ-5ta, BT474, EA.hy926 y MDA-MB-468, suplementar 500 mL de alto contenido de glucosa del Medio Eagle Modificado (DMEM) de Dulbecco con un 10% de suero fetal bovino (FBS) inactivado por calor y un 1% de penicilina-estreptomicina con una pipeta. Incorporar gentamicina al 0,1% con una micropipeta.
- Para preparar el medio de cultivo celular para MCF10A, suplementar 500 mL de DMEM/F12 con un 5% de suero de caballo y un 1% de penicilina-estreptomicina con una pipeta. Incorporar gentamicina al 0,1%, 1 mL de hidrocortisona de 1 μg/mL, 500 μL de insulina de 10 μg/mL, 50 μL de toxina del cólera de 100 ng/mL y 10 μL de factor de crecimiento epidérmico de 20 ng/mL con una micropipeta.
- Para preparar el medio de cultivo celular para MCF10Ca1h, suplementar 500 mL de DMEM/F12 con un 5% de suero de caballo y un 1% de penicilina-estreptomicina con una pipeta. Incorporar gentamicina al 0,1% con una micropipeta.
- Para preparar el medio de cultivo celular para THP-1, suplementar 500 mL de RPMI 1640 con FBS al 10% y penicilina-estreptomicina al 1% con una pipeta. Incorporar gentamicina al 0,1% con una micropipeta.
- Cambie el medio de cultivo celular cada 2-3 días para BJ-5ta, BT474, EA.hy926, MDA-MB-468, MCF10A y MCF10Ca1h hasta que las células alcancen el 70-80% de confluencia evaluando su crecimiento diariamente con un microscopio de campo claro. Cambie el medio de cultivo celular una vez a la semana para las células THP-1.
- Cultive células BJ-5ta, BT474, EA.hy926, MDA-MB-468, MCF10A y MCF10Ca1h en placas de 100 mm con superficies tratadas con cultivo celular en incubadoras de cultivo celular estándar con 5% de CO2.
- Cultive células THP-1 en matraces tratados con cultivo celular T75 en incubadoras de cultivo celular estándar con 5% de CO2.
2. Recolección de células
- Encienda la luz ultravioleta para desinfectar el interior de la cabina de bioseguridad durante 15 minutos.
- Abra la hoja de la ventana del gabinete de bioseguridad para estabilizar el flujo de aire y encienda el sistema de aspiración al vacío.
- Limpie la superficie interior del capó y el tubo del sistema de aspiración al vacío con etanol al 70%.
- Prepare un medio de cultivo celular fresco sin suero dentro de la cabina de bioseguridad: complemente 500 ml de medio de Eagle modificado (DMEM) de Dulbecco con alto contenido de glucosa con penicilina/estreptomicina al 1% utilizando una pipeta. Incorporar gentamicina al 0,1% con una micropipeta.
- Calentar el medio de cultivo celular, solución salina tamponada con fosfato (PBS) y tripsina-EDTA (0,25%) a 37 °C colocando los artículos en un baño de perlas antes de comenzar el experimento.
- Asegúrese de que las células estén confluentes en un 70-80% mediante una inspección visual a través de un microscopio.
- Aspire y deseche el medio de cultivo de las células plateadas con el aspirador de vacío. Lave el medio restante una vez con 2 mL de PBS con una pipeta, luego aspire y deseche el PBS con el aspirador de vacío.
NOTA: Las células THP-1 se cultivan en suspensión; Se pueden omitir los pasos 2.7-2.9. - Añadir 1 mL de tripsina a la placa de cultivo celular con una micropipeta y colocar la placa dentro de una incubadora de CO2 al 5% a 37 °C durante 5 min.
- Inactive la tripsina añadiendo 1 mL del inhibidor de tripsina de soja (en 1x PBS) a la placa con una micropipeta. Disperse los grupos de células pipeteando la mezcla líquida con una micropipeta P1000 y recoja la suspensión celular de la parte inferior de la placa. Transfiera la suspensión celular con una micropipeta a un tubo cónico de 15 mL y centrifugue a 100 × g durante 5 min a temperatura ambiente. Deseche el sobrenadante con el aspirador de vacío.
- Continúe con el conteo de células.
3. Preparación de la solución de colorante de trabajo y las células de tinción en suspensión
- Antes de abrir el vial de las sondas fluorescentes moleculares de seguimiento celular (ver Tabla de Materiales), deje que el producto se caliente a temperatura ambiente durante 15 min en un baño de perlas a 37 °C.
- Disuelva el colorante azul rastreador de células liofilizado (masa = 5 mg, peso molecular = 209,6 g/mol) hasta una concentración final de 10 mM con 2,385 mL de DMSO utilizando una micropipeta.
- Disuelva el colorante naranja liofilizado Cell Tracker (masa = 50 μg, peso molecular = 550,4 g/mol) hasta una concentración final de 10 mM con 9,084 μL de DMSO utilizando una micropipeta.
- Disuelva el colorante rojo intenso liofilizado (masa = 15 μg, peso molecular = 698,3 g/mol) hasta una concentración final de 1 mM con 20 μL de DMSO utilizando una micropipeta.
- Prepare la solución de medio de colorante azul de rastreador de células de trabajo (5 μM) diluyendo 1 μL del colorante en 2 ml de medio DMEM sin suero con una micropipeta.
- Prepare la solución de medio de colorante naranja del seguidor de células de trabajo (5 μM) diluyendo 1 μL del colorante en 2 ml de medio DMEM sin suero con una micropipeta.
- Prepare la solución de medio de colorante rojo intenso del rastreador de células de trabajo (1 μM) diluyendo 2 μL del colorante en 2 ml de medio DMEM sin suero con una micropipeta.
- Vuelva a suspender las células epiteliales, los fibroblastos BJ-5ta y las células endoteliales Ea.hy926 en las soluciones de medios de colorante azul, naranja y rojo intenso del seguidor de células de trabajo preparadas (2 ml), respectivamente, con una micropipeta.
- Incubar los tubos a 37 °C en la incubadora de 5% de CO2 durante 30 min.
- Después de 30 minutos de incubación, centrifugar los tubos a 100 x g durante 5 minutos a temperatura ambiente.
- Aspire y deseche el sobrenadante con el aspirador de vacío y vuelva a suspender bien el pellet en 1 ml de medio DMEM que contenga suero FBS al 10% con una micropipeta.
- Continúe con el conteo de células.
4. Recuento de células
- Recoja 10 μL de la suspensión celular y transfiérala a un microtubo con una micropipeta.
- Mezclar con 10 μL de azul de tripano y pipetear bien.
- Transfiera 20 μL de la solución de tripano celular con una micropipeta a un portaobjetos de la cámara de recuento de células. Inserte y cuente las celdas usando un contador de celdas automatizado.
- Calcule el número total promedio de células vivas a partir de dos lecturas.
5. Cálculos
- Prepare las celdas de trabajo para cada tipo de celda a una concentración de 6,67 × 103 células/mL, lo que equivale a 2.000 células/300 μL.
NOTA: El volumen total de existencias dependerá del tamaño de la muestra experimental. - En el caso de los esferoides de monocultivo, asegúrese de que cada muestra independiente conste de 300 μL de material de trabajo de células epiteliales equivalente a 2.000 células epiteliales.
- En el caso de los esferoides de cocultivo (dos tipos de células), asegúrese de que cada muestra independiente conste de 150 μl de material de trabajo de células epiteliales y 150 μl de material de trabajo de células estromales. La muestra contendrá 1.000 células epiteliales y 1.000 células estromalas.
- En el caso de los esferoides de cocultivo (tres tipos de células), asegúrese de que cada muestra independiente conste de 150 μL de material de trabajo de células epiteliales, 75 μL de material de trabajo de células estromales #1 y 75 μL de material de trabajo de células estromales #2. La muestra contendrá 1.000 células epiteliales, 500 células estromales de material de trabajo #1 y 500 células estromales de material de trabajo #2.
6. Enchapado
- Transfiera el volumen requerido con una micropipeta para tres réplicas técnicas, más una extra, a un microtubo. Mezcle bien con una pipeta, luego transfiera 300 μL de la muestra a un pocillo de una microplaca de 96 pocillos con fondo ultrabajo y fondo en forma de U.
- Repita el proceso para cada réplica técnica adicional.
- Coloque la placa de 96 pocillos en una incubadora a 37 °C.
7. Imágenes de campo claro
- Observe el crecimiento y la morfología de los esferoides cada 24 h hasta 96 h con un microscopio.
- Obtención de imágenes de esferoides utilizando un microscopio de contraste de fase.
8. Configuración del protocolo de imágenes de campo amplio para esferoides teñidos con tintes seguidores y esferoides superpuestos con extracto de membrana basal
- Encienda los dispositivos de generación de imágenes e incubadora automatizada enumerados en la Tabla de materiales y cree un nuevo protocolo de imágenes en el administrador de tareas del software de generación de imágenes. En la pestaña Procedimiento , establezca el punto de ajuste de temperatura de la incubadora automática en 37 °C y permita que la incubadora equilibre elCO2 % y la temperatura antes de continuar con el siguiente paso.
NOTA: Se puede utilizar un generador de imágenes fluorescente alternativo si tiene los filtros adecuados para cada uno de los tintes (azul, rojo intenso y naranja) utilizados. - Ajuste la configuración de la imagen a las siguientes especificaciones: Ampliación: Fase 4X PL FL, Campo de visión: 3185 X 3185 μm, WFOV completo.
- Utilice las siguientes especificaciones para los canales: DAPI: 377/447 nm, iluminación = 10, tiempo de integración = 107 ms, ganancia = 10, RFP: 531/593 nm, iluminación = 10, tiempo de integración = 137 ms, ganancia = 10, CY5: 628/685 nm, iluminación = 10, tiempo de integración = 137 ms, ganancia = 10.
- Para obtener imágenes de esferoides en una superposición de solución de extracto de membrana basal, utilice las siguientes especificaciones de campo claro: iluminación = 10, tiempo de integración = 5 ms y ganancia = 17,1.
- Seleccione los pozos deseados para la creación de imágenes y apruebe los cambios en las especificaciones haciendo clic en el icono de selección de pozos .
- Vaya a la pestaña Reducción de datos para ajustar la configuración del análisis celular.
- Establezca el valor de umbral en 19.500 con un fondo claro y seleccione Rellenar agujeros en máscaras.
- Para la selección de objetos, establezca el tamaño mínimo del objeto en 100 μm y el tamaño máximo del objeto en 1.000 μm, y seleccione Analizar toda la imagen.
NOTA: Solo se necesita una máscara principal y un recuento de objetos para este análisis. - Guarde todos los cambios y abra la aplicación imager.
- Coloque la microplaca experimental con fondo en forma de U en la incubadora abriendo el cajón, luego ciérrelo con el software del generador de imágenes.
- Para ejecutar el protocolo, haga clic en la pestaña Información del procedimiento , agregue un usuario y elija el protocolo.
- Asegúrese de seleccionar el tipo de placa correcto y establezca el tiempo de imagen en 30 minutos por placa.
- Seleccione el intervalo de imagen deseado, indique si la placa tiene tapa y ajuste la hora y la duración de inicio de la imagen.
- Haga clic en Programar placa/recipiente para iniciar el proceso de creación de imágenes.
9. Superposición de solución de extracto de membrana basal (opcional)
NOTA: La solución de extracto de membrana basal se puede aplicar a los esferoides 24 h después del enchapado.
- Llene una cubitera con hielo para mantener fría la solución de extracto de membrana basal y guárdela a 4 °C cuando no esté en uso.
- Aspire aproximadamente 170 μL de medio con una pipeta multicanal.
- Use una lupa y una mini caja de luz para observar de cerca a los pequeños esferoides. Coloque la placa esferoide de 96 pocillos sobre la caja de luz y coloque la lupa en lo alto.
- Ajuste la pipeta P200 a 30 μL y recoja el extracto de la membrana basal para crear tres microgotas.
- Añadir una microgota sobre cada esferoide de las tres réplicas técnicas con una micropipeta.
- Asegúrese de que la placa de 96 pocillos esté plana y coloque la pipeta verticalmente sobre el esferoide. Suelta la gota sin tocar el fondo del pozo.
- Coloque la placa en una incubadora a 37 °C durante 20 min.
- Cubra los esferoides con 50 μL adicionales de la solución de extracto de membrana basal por pocillo con una micropipeta.
- Vuelva a colocar los esferoides en el centro del pozo con una punta de pipeta.
- Incubar a 37 °C durante 30 min.
- Agregue 100 μL de medio de cultivo celular a cada pocillo.
10. Cuantificación
- Descargue y abra el software ImageJ. Cargue las imágenes de esferoides.
- Establezca las medidas haciendo clic en Analizar | Establezca Medidas y seleccione Área | Centroide. Mida los esferoides utilizando la herramienta de lazo para trazar el esferoide y medir el objeto.
- Registre los valores de tres réplicas biológicas y calcule el área media y la circularidad.
- Convierta el área de píxeles a metros cuadrados usando la siguiente fórmula:
Área (m2) = ((550/504) × √ (área en píxeles)) 2 - Analice los datos.
- Seleccione Introducir valores replicados, apilados en columnas.
- Introduzca los datos en las columnas y seleccione el control de esferoides de monocultivo y las muestras de esferoides de tratamiento de cocultivo.
- Realice un análisis de columna ANOVA unidireccional.
- Utilice los siguientes parámetros de ANOVA:
- Evite hacer coincidir o emparejar.
- Supongamos una distribución gaussiana de residuos.
- Supongamos que las desviaciones estándar son iguales.
- Utilice la prueba de comparación múltiple de Tukey para comparar la media de cada columna con la media de todas las demás columnas.
11. Procesamiento de imágenes inmunofluorescentes de campo amplio
- Guarde las imágenes directamente desde el software del generador de imágenes en formato de archivo PNG o Tiff.
- Seleccione cada canal individual o canales superpuestos y guárdelos como archivo PNG.
- Ajuste el brillo y el contraste en el software del generador de imágenes o en ImageJ si las imágenes se exportan como archivos Tiff.
Resultados
En este estudio, desarrollamos un sistema de cultivo celular para generar esferoides 3D heteromulticelulares formados por células epiteliales y estromales con morfología similar a la de un organoide. Los esferoides se establecieron mediante la siembra de 2.000 células epiteliales en condiciones de monocultivo. En condiciones de cocultivo de dos tipos de células, se establecieron esferoides mediante la siembra de 1.000 células epiteliales y 1.000 células estromales. En condiciones de cocultivo de tres tipos de células, se establecieron esferoides mediante la siembra de 1.000 células epiteliales y dos tipos diferentes de células estromales de 500 células de cada tipo de célula. Antes del establecimiento de los esferoides, las células se pueden teñir con tintes rastreadores de células fluorescentes que permiten monitorear la organización espacial celular. Después de 24 h de la formación inicial del esferoide, las aplicaciones posteriores incluyen perturbaciones farmacológicas, imágenes y recolección de muestras. Las imágenes de lapso de tiempo son útiles para evaluar los cambios en el comportamiento y la morfología de los esferoides, incluido el área y la circularidad (Figura 1A). A las 24 horas después del recubrimiento, los esferoides se pueden incrustar en un entorno de andamio, y las imágenes de lapso de tiempo se pueden usar para evaluar el inicio de estructuras invasivas del esferoide (Figura 1B). La recolección de muestras de esferoides heteromulticelulares tiene muchas aplicaciones, incluida la elaboración de perfiles genómicos y proteómicos a nivel global y unicelular a través de técnicas experimentales como la secuenciación de ARN, la secuenciación de ARN de una sola célula, la secuenciación proteómica y la inmunofluorescencia cíclica.
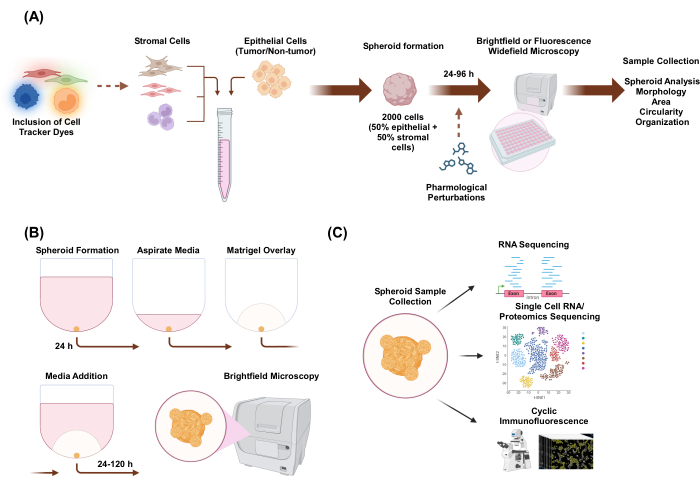
Figura 1: Representación esquemática del proceso de cultivo celular en 3D y posibles aplicaciones. (A) La suspensión celular de células epiteliales con células estromales no epiteliales se pipetea en placas de unión ultrabajas 3D para formar esferoides. Las imágenes de los esferoides se obtienen mediante microscopía de campo claro cada 24 h durante 96 h. Las líneas celulares se pueden teñir con tintes fluorescentes rastreadores de células para la microscopía de campo amplio posterior antes de inducir la formación de esferoides, o se pueden perturbar farmacológicamente después de la formación de esferoides. Se pueden analizar parámetros esferoides como la morfología, el área, la circularidad y la organización. (B) Los esferoides de células epiteliales y epiteliales con células estromales se forman utilizando el protocolo de A. Los esferoides se establecieron mediante la siembra de 2.000 células epiteliales en condiciones de monocultivo. En condiciones de cocultivo de dos tipos de células, se establecieron esferoides mediante la siembra de 1.000 células epiteliales y 1.000 células estromales. En condiciones de cocultivo de tres tipos de células, se establecieron esferoides mediante la siembra de 1.000 células epiteliales y dos tipos diferentes de células estromales de 500 células de cada tipo de célula. Después de 24 h, se superpone una solución de extracto de membrana basal similar a un andamio y se capturan imágenes en microscopía de campo claro cada 24 h durante 120 h. (C) Los cultivos 3D heteromulticelulares establecidos sin andamio y basados en andamios se pueden usar para una variedad de aplicaciones posteriores, como la inmunofluorescencia cíclica, la secuenciación de ARN de una sola célula y la proteómica de una sola célula. Haga clic aquí para ver una versión más grande de esta figura.
Los esferoides de monocultivo MCF10A, MCF10Ca1h y BT-474 mantienen un fenotipo esférico compacto hasta 96 h después del recubrimiento. Cuando se cocultivaron con células endoteliales microvasculares EA.hy926, fibroblastos BJ-5ta y/o células similares a monocitos THP-1, los esferoides desarrollaron protuberancias celulares en la periferia, que se hicieron más pronunciadas a las 96 h (Figura 2A-C). Es importante destacar que estos fenómenos de protuberancia, gemación y compactación de los esferoides representan variaciones de la organización celular del esferoide canceroso y las células estromales cocultivadas que se correlacionaron con la invasividad 3D después de la adición de un hidrogel basado en la membrana basal como Matrigel. La morfología de la gemación varió de agregados celulares sólidos a sueltos, asemejándose a la morfología de los organoides. Por el contrario, los esferoides de monocultivo MDA-MB-468 aparecieron como agregados celulares grandes y sueltos. Sin embargo, cuando las células MDA-MB-468 se cocultivaron con EA.hy926, BJ-5ta y/o THP-1, formaron esferoides compactos (Figura 2D).
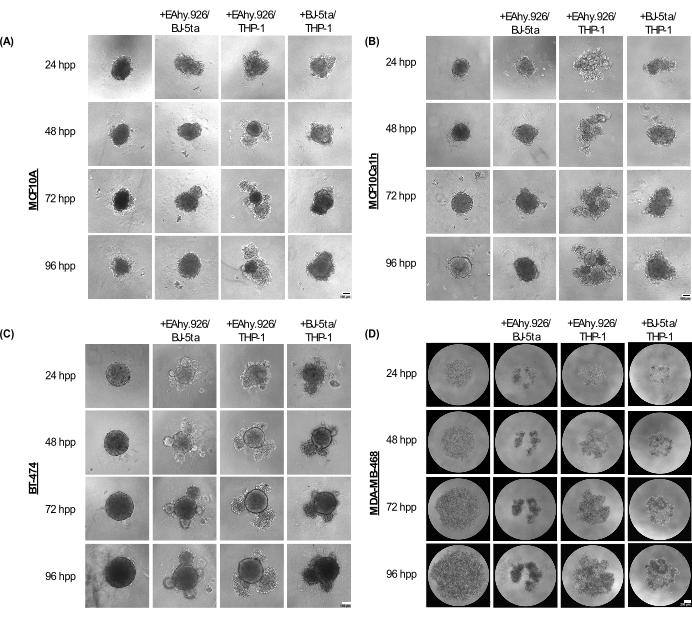
Figura 2: Gama de arquitecturas y morfologías adoptadas por las combinaciones de células estromales no epiteliales en combinación cuando se combinan con células epiteliales tumorales/no tumorales en cultivos 3D sin andamios. Imágenes representativas de campo claro de (A) esferoides MCF10A, (B) MCF10Ca1h, (C) BT-474, (D) MDA-MB-468 en monocultivo o en cocultivo con fibroblastos estromales BJ-5ta/células endoteliales microvasculares Ea.hy926 o células cella similares a monocitos Ea.hy926/THP-1 o células BJ-5ta/THP-1 durante 96 h. Cada esferoide se formó mediante la siembra de 2.000 células. Los esferoides en condiciones de monocultivo se formaron utilizando 2.000 células epiteliales. Los esferoides en condiciones de cocultivo se formaron utilizando 1.000 células epiteliales y dos tipos diferentes de células estromales de 500 células. La formación de estructuras similares a organoides en gemación o agregadas se inició en condiciones de cocultivo de esferoides 24 h después de la siembra en células epiteliales MCF10A, MCF10Ca1h y BT-474. La compactación de las células MDA-MB-468 se observó en condiciones de cocultivo de esferoides 25 h después de la siembra. Barras de escala = 100 μm. Abreviatura: hpp = horas después del enchapado. Haga clic aquí para ver una versión más grande de esta figura.
A las 72 h después de la siembra, las células MCF10A, MCF10Ca1h y BT-474 cocultivadas con EA.hy926 y THP-1, o con BJ-5ta y THP-1, mostraron un aumento significativo en el área de esferoides en comparación con los esferoides epiteliales de monocultivo. MCF10Ca1h también mostró un aumento significativo en el área de esferoide cuando se co-cultivó con EA.hy926 y BJ-5ta. La aparición de estructuras en gemación en esferoides cocultivados condujo a una disminución significativa en la circularidad de los esferoides para MCF10A, MCF10Ca1h y BT-474 cocultivados con EA.hy926 y THP-1, o con BJ-5ta y THP-1. Se observaron efectos similares para BT-474 co-cultivado con EA.hy926 y BJ-5ta (Figura 3A,B). Por el contrario, las células MDA-MB-468 cocultivadas con EA.hy926 y BJ-5ta, EA.hy926 y THP-1, o BJ-5ta y THP-1, mostraron una disminución significativa en el área de esferoide en comparación con los esferoides MDA-MB-468 de monocultivo; sin embargo, no hubo ningún efecto sobre la circularidad (Figura 3A,B).

Figura 3: Gráficos de análisis de área y circularidad de cultivos sin andamio 3D estromales monocultivados y heteromulticelulares a las 72 h después de la siembra. (A) Área promedio (cm2) y (B) circularidad promedio de MCF10A, MCF10Ca1h, BT-474 y MDA-MB-468 en cultivos de esferoides estromales monocultivados y heteromulticelulares 72 h después de la siembra. Los datos reportados son representativos de al menos tres réplicas biológicas independientes y se reportan como promedios técnicos de réplicas ± SEM, a menos que se indique lo contrario. *, **, *** o **** representan valores p < 0,05, 0,01, 0,001 o 0,0001, respectivamente, a menos que se indique lo contrario. Haga clic aquí para ver una versión más grande de esta figura.
La aplicación del colorante rastreador de células a las células epiteliales tumorigénicas BT-474 y a las células estromales antes del establecimiento del esferoide demostró que las células estromales, incluidas EA.hy926 y BJ-5ta, formaron las estructuras en ciernes en el perímetro de los esferoides centrales BT474 (Figura 4, Video Suplementario S1, Video Suplementario S2, Video Suplementario S3 y Video Suplementario S4 ). A las 48 h después de la siembra, las imágenes individuales de fluorescencia de campo amplio de esferoides cocultivados con fibroblastos revelan que los esferoides de fibroblastos se colocalizaron junto con las células endoteliales, pero no se colocalizaron con los esferoides BT-474. También se encontró que una minoría de células endoteliales se colocalizan con los esferoides BT-474 en condiciones de cocultivo. Esto sugiere que la disposición de las células estromales dentro del esferoide se correlaciona con una morfología similar a la de un organoide.
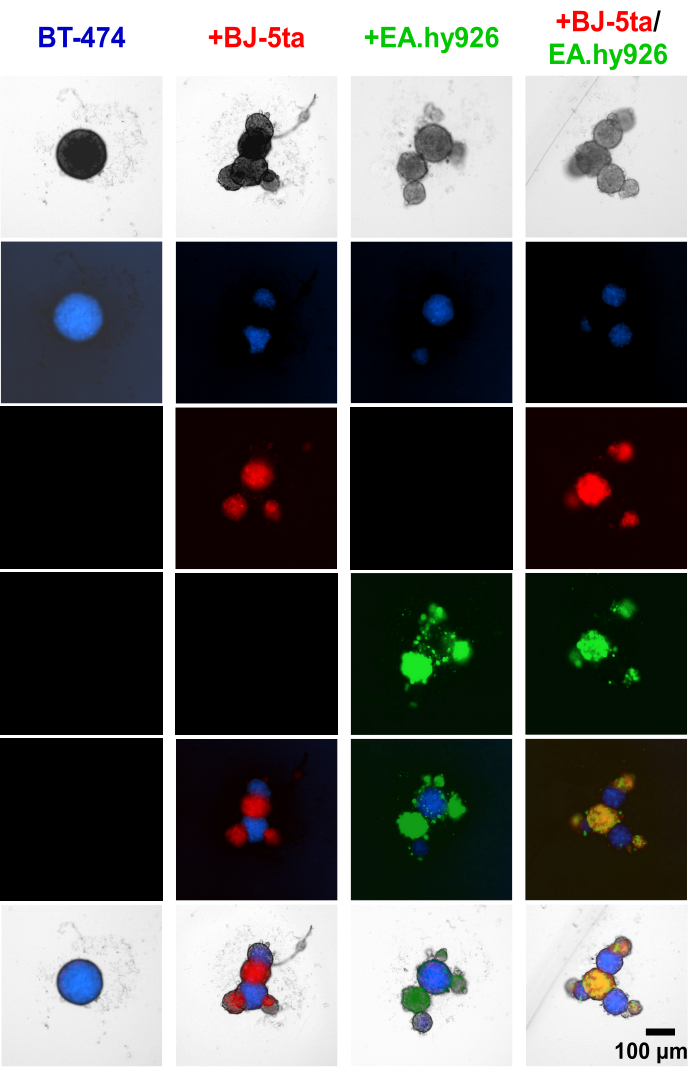
Figura 4: Imágenes fijas de fluorescencia de campo amplio de células estromales y BT-474 teñidas diferencialmente en cultivos 3D heteromulticelulares a las 48 h después de la siembra. Los esferoides BT-474 se tiñen con un tinte fluorescente Blue Cell Tracker. Los fibroblastos BJ-5ta se tiñen con un colorante rastreador de células naranja, representado en color rojo. Las células endoteliales Ea.hy926 se tiñen con un tinte rastreador de glóbulos rojos intensos, representados en color verde. Cada esferoide se formó mediante la siembra de 2.000 células. Los esferoides en condiciones de monocultivo se formaron utilizando 2.000 células epiteliales. Los esferoides en condiciones de cocultivo (BT-474/BJ-5ta, BT-474/Ea.hy926) se formaron utilizando 1.000 células epiteliales y 1.000 células estromales. Se formaron esferoides en condiciones de doble cocultivo (BT-474/BJ-5ta/Ea.hy926) utilizando 1.000 células epiteliales y 500 células de cada tipo de célula estromal. Las figuras son representativas de al menos tres réplicas biológicas. Barra de escala = 100 μm. Haga clic aquí para ver una versión más grande de esta figura.
Para evaluar la relevancia biológica de nuestro modelo de esferoide organoide, los esferoides se recubrieron con una solución de extracto de membrana basal 24 h después de la siembra. Los esferoides de monocultivo BT-474 no mostraron propiedades invasivas 120 h después de la siembra. Sin embargo, los esferoides BT-474 cocultivados con BJ-5ta o EA.hy926 desarrollaron estructuras en la periferia del esferoide, que invadieron el entorno de la solución de extracción de membrana basal del andamio. El número y la longitud de estas protuberancias aumentaron significativamente en los esferoides BT-474 cocultivados con BJ-5ta y EA.hy926 a 48 h a 120 h después de la siembra (Figura 5, Video Suplementario S5, Video Suplementario S6, Video Suplementario S7 y Video Suplementario S8).
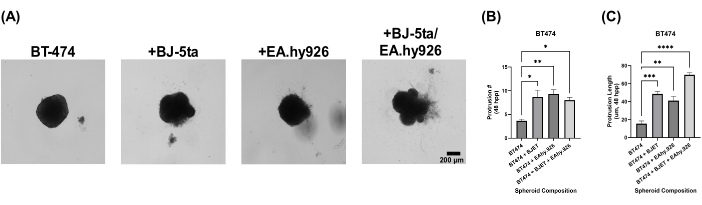
Figura 5: Imágenes fijas de campo claro de células BT-474 en cultivos 3D heteromulticelulares con superposición de solución de extracto de membrana basal a los 5 días posteriores a la superposición. Cada esferoide se formó mediante la siembra de 2.000 células. La solución de extracto de membrana basal se superpuso sobre esferoides 24 h después de la siembra. Los esferoides en condiciones de monocultivo se formaron utilizando 2.000 células epiteliales. Los esferoides en condiciones de cocultivo (BT-474/BJ-5ta y BT-474/Ea.hy926) se formaron utilizando 1.000 células epiteliales y 1.000 células estromales. Se formaron esferoides en condiciones de doble cocultivo (BT-474/BJ-5ta/Ea.hy926) utilizando 1.000 células epiteliales y 500 células de cada tipo de célula estromal. (A) Las estructuras invasivas que sobresalen del esferoide del cáncer incrustadas en la solución de extracto de membrana basal se pueden observar en condiciones de cocultivo. (B) Calificación de conteo de protuberancias invasivas en el tiempo 48 hpp. (C) Calificación de la longitud de la protuberancia invasiva en el tiempo 48 hpp. Las figuras son representativas de al menos tres réplicas biológicas. Barra de escala = 200 μm. Abreviatura: hpp = horas después del enchapado. Haga clic aquí para ver una versión más grande de esta figura.
Video suplementario S1: Esferoide de monocultivo BT-474 con colorante azul rastreador de células. Las células BT-474 (2.000) se resuspendieron en una microplaca de 96 pocillos con fondo ultrabajo y fondo en forma de U para formar esferoides. Se capturó una superposición de imágenes de fluorescencia de campo claro y campo amplio durante 48 h. Abreviatura: ULA = fijación ultrabaja. Haga clic aquí para descargar este video.
Video complementario S2: Esferoides BT-474 cocultivados con fibroblastos BJ-5ta. Los fibroblastos BT-474 (1.000) y 1.000 fibroblastos BJ-5ta se resuspendieron en placas de ULA para formar esferoides. Las células BT-474 se incubaron con colorante azul rastreador celular y los fibroblastos BJ-5ta con colorante naranja rastreador celular. Se capturó una superposición de imágenes de fluorescencia de campo claro y campo amplio (azul = BT-474, rojo = BJ-5ta) durante 48 h. Abreviatura: ULA = fijación ultrabaja. Haga clic aquí para descargar este video.
Video complementario S3: Esferoides BT-474 cocultivados con células endoteliales Ea.hy926. Las células endoteliales BT-474 (1.000) y 1.000 Ea.hy926 se resuspendieron en placas de ULA para formar esferoides. Las células BT-474 se incubaron con colorante azul rastreador de células y las células endoteliales Ea.hy926 con colorante rojo intenso rastreador de células. Se capturó una superposición de imágenes fluorescentes de campo claro y campo amplio (azul = BT-474, verde = Ea.hy926) durante 48 h. Abreviatura: ULA = fijación ultrabaja. Haga clic aquí para descargar este video.
Video suplementario S4: Esferoides BT-474 cocultivados con fibroblastos BJ-5ta y células endoteliales Ea.hy926. BT-474 (1.000), 500 fibroblastos BJ-5ta y 500 células endoteliales Ea.hy926 se resuspendieron en placas de ULA para formar esferoides. Las células BT-474 se incubaron con tinte azul rastreador de células. Los fibroblastos BJ-5ta y las células endoteliales Ea.hy926 se incubaron con colorante naranja rastreador de células y colorante rojo intenso, respectivamente. Se capturó una superposición de imágenes fluorescentes de campo claro y campo amplio (azul = BT-474, rojo = BJ-5ta, verde = Ea.hy926) durante 48 h. Abreviatura: ULA = fijación ultrabaja. Haga clic aquí para descargar este video.
Video complementario S5: Esferoide de monocultivo BT-474 en solución de extracto de membrana basal. Las células BT-474 (2.000) se resuspendieron en placas de ULA para formar esferoides, y los esferoides se incrustaron en una solución de membrana basal 24 h después de la siembra. Las imágenes de campo claro se tomaron durante 60 h. Abreviatura: ULA = fijación ultrabaja. Haga clic aquí para descargar este video.
Video complementario S6: Esferoides BT-474 cocultivados con fibroblastos BJ-5ta en solución de extracto de membrana basal. Los fibroblastos BT-474 (1.000) y 1.000 BJ-5ta se resuspendieron en placas de ULA para formar esferoides, y los esferoides se incrustaron en una solución de extracto de membrana basal 24 h después de la siembra. Las imágenes de campo claro se tomaron durante 60 h. Abreviatura: ULA = fijación ultrabaja. Haga clic aquí para descargar este video.
Video complementario S7: Esferoides BT-474 cocultivados con células endoteliales Ea.hy926 en solución de extracto de membrana basal. Las células endoteliales BT-474 (1.000) y 1.000 Ea.hy926 se resuspendieron en placas de ULA para formar esferoides, y los esferoides se incrustaron en una solución de extracto de membrana basal 24 h después de la siembra. Las imágenes de campo claro se tomaron durante 60 h. Abreviatura: ULA = fijación ultrabaja. Haga clic aquí para descargar este video.
Video complementario S8: Esferoides BT-474 cocultivados con fibroblastos BJ-5ta y células endoteliales Ea.hy926 en solución de extracto de membrana basal. BT-474 (1.000), 500 fibroblastos BJ-5ta y 500 células endoteliales Ea.hy926 se resuspendieron en placas de ULA para formar esferoides, y los esferoides se incrustaron en una solución de extracto de membrana basal 24 h después de la siembra. Las imágenes de campo claro fueron tomadas durante 60 h. Haga clic aquí para descargar este video.
Discusión
Nuestro modelo esferoide hetero-multicelular demuestra que las interacciones entre las células epiteliales y las células estromales impulsan la gemación de las células estromales en condiciones de cultivo 3D sin andamios y la formación de estructuras invasivas en condiciones de cultivo 3D basadas en andamios. Observamos la formación consistente de estructuras de gemación tanto en las líneas celulares tumorigénicas (MCF10Ca1h y BT-474) como en la línea celular epitelial no tumorigénica MCF10A (Figura 2A-C). Curiosamente, mientras que los esferoides de las líneas celulares MCF10A, MCF10Ca1h y BT-474, ya sea en monocultivo o cocultivo con fibroblastos y células endoteliales, formaron estructuras circulares y compactas en gemación en entornos libres de andamios, los esferoides de la línea celular MDA-MB-468 mostraron menos compactación (Figura 2D). Esto fue inesperado, ya que se anticipó que las células MDA-MB-468 formarían esferoides circulares, al igual que las otras líneas celulares epiteliales probadas. Se descubrió que la línea celular SUM-149, una línea celular híbrida de cáncer de mama primario epitelio-mesenquimatoso, forma esferoides compactos como MCF10A, MCF10Ca1h y BT-474 (datos no mostrados)28. Las investigaciones futuras deben investigar las vías de señalización que median la formación de esferoides menos compactos en la línea celular MDA-MB-468, ya que tales anomalías pueden indicar vulnerabilidades celulares que pueden aprovecharse para el desarrollo de nuevas estrategias terapéuticas.
En cuanto a la combinación de diferentes líneas celulares, las células similares a monocitos THP-1 inducen la formación de estructuras de agregados sueltos en todas las condiciones de cocultivo de esferoides. Se observa menos compactación en las estructuras en gemación en condiciones de cocultivo con células THP-1/Ea.hy926 en comparación con las de las estructuras de cocultivo con células THP-1/BJ-5ta (Figura 2A-D). Por lo tanto, la compactación de los esferoides está influenciada por la composición de las células estromales en el modelo29,30.
La placa inconsistente de las combinaciones de heterocélulas puede resultar en un desarrollo incompleto de esferoides o variabilidad en el tamaño de los esferoides, en comparación con sus réplicas técnicas. Asegurar la consistencia en la placa celular es crucial, ya que la disposición espacial de las células que determina el fenotipo y el desarrollo de los esferoides, ocurre principalmente dentro de las primeras 48 h31. Durante este período crítico, las proporciones celulares juegan un papel crucial, y la proporción de células estromales afecta tanto al área esferoide como a la circularidad.
Los agregados esferoides sueltos, que dependen del tipo de celda, pueden desmontarse fácilmente durante la manipulación manual. Sin embargo, la manipulación manual es necesaria cuando se superponen esferoides con una solución de extracto de membrana basal similar a un andamio o cuando se recolectan muestras de esferoides completas. Para mitigar este problema, es aconsejable trabajar a un ritmo más lento cuando se recojan los esferoides mediante aspiración con pipeta y minimizar la manipulación manual siempre que sea posible. Durante la superposición de la solución de extracción de membrana basal, los esferoides son propensos a desplazarse dentro del pozo, a menudo asentándose en el borde del pozo. Una relación solución-medio de extracto de membrana basal es importante para mantener las propiedades de la matriz del sistema 3D; Sin embargo, los esferoides no pueden ser envueltos completamente debido a la viscosidad de la solución de extracto de membrana basal, por lo que se requiere intervención manual32. El posicionamiento no centrado del esferoide plantea un desafío para la obtención de imágenes, ya que la refracción de la luz cerca del borde plástico del pozo puede interferir con la claridad de la imagen.
Los esferoides utilizados en este estudio estaban compuestos por líneas celulares de cáncer humano; Los métodos descritos aquí aún no se han aplicado a las líneas celulares primarias. Nuestros resultados sugieren que las interacciones específicas célula-célula pueden impulsar la formación de estructuras similares a organoides, lo que indica la aplicabilidad potencial de este método a una amplia gama de líneas celulares tumorigénicas. Sin embargo, aunque nuestro modelo intenta imitar la complejidad del microambiente tumoral, las diferentes tasas de proliferación celular presentan un desafío para los estudios a largo plazo33. Las células que proliferan rápidamente tienden a crecer más que las que proliferan más lentamente, lo que hace que este modelo sea menos adecuado para experimentos prolongados. Además, los diferentes requisitos de tipo de medio de crecimiento para las líneas celulares pueden introducir factores adicionales que pueden conducir a fenotipos esferoides. La mayoría de las líneas celulares de este estudio se cultivaron en medios DMEM. Los estudios con líneas celulares cultivadas en diferentes medios pueden requerir diferentes condiciones de cultivo, probando una variedad de proporciones de medios; Sin embargo, este efecto se observa en la experimentación a largo plazo30.
Nuestro modelo ofrece varias ventajas sobre otros modelos 3D de cáncer. Los esferoides que generamos tienen una morfología y un tamaño iniciales uniformes y reproducibles, lo que facilita la comparación de los resultados del tratamiento con los controles. Por el contrario, algunos modelos que utilizan células individuales suspendidas en medios o andamios pueden dar lugar a distribuciones espaciales celulares variables, lo que lleva a inconsistencias. Este modelo demuestra que las interacciones entre distintas poblaciones celulares pueden estudiarse de manera efectiva.
Tradicionalmente, los modelos de organoides y esferoides se han compuesto por células cancerosas de monocultivo o cocultivos de células cancerosas para investigar gradientes de nutrientes, hipoxia o disposición celular34. Además, este modelo se puede estudiar en un entorno de andamiaje dentro de las 24 horas posteriores al siembra, lo que brinda la oportunidad de explorar eventos de invasión temprana impulsados por diversas interacciones célula-célula. Mientras que los enfoques alternativos del cáncer en 3D emplean diferentes componentes de la matriz del andamio para estudiar los cambios en la morfología y la invasividad de los esferoides, este modelo los complementa al permitir la investigación de estos cambios en el contexto de la dinámica de la población celular y la composición del andamio35.
La mayoría de los esferoides producidos con nuestros métodos conservan su integridad estructural después de la manipulación manual, lo que permite la recolección de muestras en aplicaciones posteriores. Las modificaciones genéticas convencionales como CRISPR-Cas9, la transducción lentiviral de shRNA y la interferencia de siRNA pueden introducirse antes de la formación de esferoides. Los comportamientos complejos observados en estos esferoides sugieren alteraciones dinámicas en la expresión génica, que pueden investigarse más a fondo utilizando RNA-seq. También se pueden emplear técnicas avanzadas como CycIF, scRNA-seq, CosMx y Visium para estudiar la genómica y la proteómica a nivel espacial o de una sola célula. Este modelo esferoide tiene el potencial de imitar estudios in vivo de terapias tumorales dirigidas al capturar las interacciones entre las yemas de las células estromales y los agentes terapéuticos antes de que lleguen a las células cancerosas. Esto es importante porque puede ayudar a determinar si las células estromales influyen en la potencia del fármaco, protegiendo potencialmente a las células cancerosas de los efectos terapéuticos.
Divulgaciones
Los autores no tienen conflictos de intereses que declarar.
Agradecimientos
Agradecemos a los miembros del Laboratorio de Oncogenes del Desarrollo de la Universidad de Baylor por sus útiles comentarios y comentarios durante la preparación de este manuscrito. El apoyo financiero fue proporcionado por el Departamento de Biología y la Facultad de Artes y Ciencias de la Universidad de Baylor, NIH-NIGMS 2SC1GM121182 (a J.A.K.).
Materiales
| Name | Company | Catalog Number | Comments |
| 15 mL Polypropylene Centrifuge Tubes | Falcon | 14-959-53A | |
| 96-Well, Treated, U-Shaped-Bottom Microplate | Thermo Scientific | 12566432 | |
| 100 mm Dish Cell Culture Treated Surface | Thermo Scientific | 130182 | |
| 170 L CO2 Incubators | VWR | VWR51014991(10810902) | |
| 200 Self-Sealing Barrier Pipet Tips | Fisher Scientific | 02-682-255 | |
| 500 mL DMEM/Hams F-12, [+] L-glutamine | Corning | 10-090-CV | |
| 1000 Self-Sealing Barrier Pipet Tips | Molecular Biology Products Inc. | 2179HR | |
| Animal-Free Recombinant Human EGF | PeproTech | AF-100-15 | |
| Automated Pipette Repeater E3x | Eppendorf | 4987000410 | |
| Basement membrane solution | Huntsman Cancer Institute | https://healthcare.utah.edu/huntsmancancerinstitute/ | |
| Bead Bath | Lab Armor | 74300706 | |
| Biorender | Biorender | Biorender.com | |
| Biosafety Laminar Flow Cabinets | Thermo Scientific | 300590389 | |
| BioSpa 8 Automated Incubator | Agilent | 23082120 | |
| Cell Counter | Invitrogen | AMQAF2000 | |
| Cell Counting Chamber Slides | Thermo Scientific | C10283 | |
| CellTracker Deep Red | Thermo Fisher Scientific | C34565 | |
| Centrifuge | Thermo Scientific | 13100675 | |
| Cholera Toxin B subunit | Sigma-Aldrich | C9903-1MG | |
| Combitips advanced, Sterile, 5.0 mL | Fisher Scientific | 13-683-714 | |
| Cytation 10 Reader Imager | Agilent | 2105245 | |
| Defined Trypsin Inhibitor | Gibco | R007100 | soybean trypsin inhibitor in 1x PBS |
| Donor Horse Serum, 500 mL, United States Origin | Corning | 35-030-CV | |
| Dulbecco's Modified Eagle's Medium | Corning | 10-013-CV | |
| Excel Sofware | Microsoft office 365 | https://www.microsoft.com/en-us/microsoft-365/excel | |
| Fetal Bovine Serum | Thermo Scientific | 26140079 | |
| Fetal Bovine Serum, qualified, US origin | Thermo Scientific | 26140079 | |
| Gentamicin Sulfate, Liquid | Corning | 30-005-CR | |
| GraphPad Prism | |||
| Hydrocortisone solution,50 µM, sterile-filtered, BioXtra | Sigma-Aldrich | H6909-10ML | |
| Image J Software | Fiji | https://imagej.net/ij/ | |
| Insulin solution human | Sigma-Aldrich | I9278-5ML | |
| Magnifying Glass | Fisher Scientific | 01-182-392 | |
| Microcentrifuge Tube | Costar | 3621 | |
| Microscope | Olympus | CKX53SF | |
| Mini Lightbox | Fisher Scientific | 361044708 | |
| Molecular Probes CellTracker Blue CMAC Dye | Fisher Scientific | C2110 | |
| Molecular Probes CellTracker Orange CMRA Dye | Fisher Scientific | C34551 | |
| Penicillin-Streptomycin Solution | Cytiva | SV30010 | |
| Penicillin-Streptomycin Solution | Cytiva | SV30010 | |
| Phase-Contrast Microscope | Echo | RVSF1000 | |
| Phosphate Buffered Saline | Fisher Scientific | SH3025601 | |
| Pipet Controller | Corning | 4099 | |
| Pipette 100 – 1,000 µL | Eppendorf | 3123000063 | |
| Pipette 20 – 200 µL | Eppendorf | 3123000055 | |
| Prism | GraphPad Software | https://www.graphpad.com/features | |
| RPMI 1640 with L-glutamine and 25 mM HEPES | Corning | 10-041-CV | |
| Serological Pipette, 10 mL | Thermo Scientific | 170356N | |
| Serological Pipette, 25 mL | Thermo Scientific | 170357N | |
| Serological Pipette, 5 mL | Thermo Scientific | 170355N | |
| Trypan Blue Solution, 0.4% | Corning | 25900CI | |
| Trypsin-EDTA, 0.25% | Corning | 25053CI |
Referencias
- de Visser, K. E., Joyce, J. A. The evolving tumor microenvironment: From cancer initiation to metastatic outgrowth. Cancer Cell. 41 (3), 374-403 (2023).
- Hanahan, D., Weinberg, R. A. Hallmarks of cancer: The next generation. Cell. 144 (5), 646-674 (2011).
- Anderson, N. M., Simon, M. C. The tumor microenvironment. Curr Biol. 30 (16), R921-R925 (2020).
- Baghban, R., et al. Tumor microenvironment complexity and therapeutic implications at a glance. Cell Commun Signal. 18 (1), 59 (2020).
- Sahai, E., et al. A framework for advancing our understanding of cancer-associated fibroblasts. Nat Rev Cancer. 20 (3), 174-186 (2020).
- Erdogan, B., Webb, D. J. Cancer-associated fibroblasts modulate growth factor signaling and extracellular matrix remodeling to regulate tumor metastasis. Biochem Soc Trans. 45 (1), 229-236 (2017).
- Iozzo, R. V., Sanderson, R. D. Proteoglycans in cancer biology, tumour microenvironment and angiogenesis. J Cell Mol Med. 15 (5), 1013-1031 (2011).
- Amersfoort, J., Eelen, G. Immunomodulation by endothelial cells - partnering up with the immune system. Nat Rev Immunol. 22 (9), 576-588 (2022).
- Balani, S., Nguyen, L. V., Eaves, C. J. Modeling the process of human tumorigenesis. Nat Commun. 8 (1), 15422 (2017).
- Drost, J., Clevers, H. Organoids in cancer research. Nat Rev Cancer. 18 (7), 407-418 (2018).
- Wang, E., Xiang, K., Zhang, Y., Wang, X. -. F. Patient-derived organoids (PDOs) and PDO-derived xenografts (PDOXs): New opportunities in establishing faithful pre-clinical cancer models. J Natl Cancer Cent. 2 (4), 263-276 (2022).
- Kamb, A. What's wrong with our cancer models. Nat Rev Drug Discov. 4 (2), 161-165 (2005).
- Tuveson, D., Clevers, H. Cancer modeling meets human organoid technology. Science. 364 (6444), 952-955 (2019).
- Zitvogel, L., Pitt, J. M., Daillère, R., Smyth, M. J. Mouse models in oncoimmunology. Nat Rev Cancer. 16 (12), 759-773 (2016).
- Liu, Y., et al. Patient-derived xenograft models in cancer therapy: technologies and applications. Signal Transduct Target Ther. 8 (1), 160 (2023).
- Ben-David, U., et al. Patient-derived xenografts undergo mouse-specific tumor evolution. Nat Genet. 49 (11), 1567-1575 (2017).
- Byrne, A. T., et al. Interrogating open issues in cancer precision medicine with patient-derived xenografts. Nat Rev Cancer. 17 (4), 254-268 (2017).
- Ivanics, T., et al. Patient-derived xenograft cryopreservation and reanimation outcomes are dependent on cryoprotectant type. Lab Invest. 98 (7), 947-956 (2018).
- Biju, T. S., Priya, V. V., Francis, A. P. Role of three-dimensional cell culture in therapeutics and diagnostics: an updated review. Drug Deliv and Transl Res. 13 (9), 2239-2253 (2023).
- Urzì, O., et al. Three-dimensional cell cultures: The bridge between in vitro and in vivo models. Int J Mol Sci. 24 (15), 12046 (2023).
- Cacciamali, A., Villa, R., Dotti, S. 3D cell cultures: Evolution of an ancient tool for new applications. Front Physiol. 13, 836480 (2022).
- Abuwatfa, W. H., Pitt, W. G. Scaffold-based 3D cell culture models in cancer research. J Biomed Sci. 31 (1), 7 (2024).
- Yakavets, I., et al. Advanced co-culture 3D breast cancer model for investigation of fibrosis induced by external stimuli: optimization study. Sci Rep. 10 (1), 21273 (2020).
- Mohammadrezaei, D., et al. Predicting and elucidating the post-printing behavior of 3D printed cancer cells in hydrogel structures by integrating in-vitro and in-silico experiments. Sci Rep. 13 (1), 1211 (2023).
- Kuen, J., Darowski, D., Kluge, T., Majety, M. Pancreatic cancer cell/fibroblast co-culture induces M2 like macrophages that influence therapeutic response in a 3D model. PLOS ONE. 12 (7), e0182039 (2017).
- Bray, F., et al. Global cancer statistics 2022: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin. 74 (3), 229-263 (2024).
- Kennecke, H., et al. Metastatic behavior of breast cancer subtypes. J Clin Oncol. 28 (20), 3271-3277 (2010).
- Neve, R. M., et al. A collection of breast cancer cell lines for the study of functionally distinct cancer subtypes. Cancer Cell. 10 (6), 515-527 (2006).
- Pingitore, P., et al. Human multilineage 3D spheroids as a model of liver steatosis and fibrosis. Int J Mol Sci. 20 (7), 1629 (2019).
- Bar-Ephraim, Y. E., Kretzschmar, K. Organoids in immunological research. Nat Rev Immunol. 20 (5), 279-293 (2020).
- Beerkens, A. P. M., et al. Characterizing OXPHOS inhibitor-mediated alleviation of hypoxia using high-throughput live cell-imaging. Cancer Metab. 12 (1), 13 (2024).
- Feaster, T. K., et al. Matrigel mattress. Cir Res. 117 (12), 995-1000 (2015).
- Huang, Z., Yu, P., Tang, J. Characterization of triple-negative breast cancer MDA-MB-231 cell spheroid model. Onco Targets Ther. 13, 5395-5405 (2020).
- Nam, S., Khawar, I. A., Park, J. K., Chang, S., Kuh, H. -. J. Cellular context-dependent interaction between cancer and stellate cells in hetero-type multicellular spheroids of pancreatic tumor. Biochem Biophys Res Commun. 515 (1), 183-189 (2019).
- Monteiro, M. V., Gaspar, V. M., Ferreira, L. P. Hydrogel 3D in vitro tumor models for screening cell aggregation mediated drug response. Biomater Sci. 8 (7), 1855-1864 (2020).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados