Method Article
上皮癌細胞のスキャフォールドフリー3D培養におけるヘテロ多細胞間質細胞による浸潤の促進
要約
がんの転移を研究するためには、ヘテロセルのクロストークを捉える3Dがんモデルが急務となっています。私たちの研究は、侵入と細胞空間分布の研究に使用できる足場および足場のない環境でのヘテロ多細胞間質-上皮の生成を示しています。
要約
乳がんは、米国の女性のがん関連死の2番目に多い原因であり、固形腫瘍のオルガノイドモデルは、増殖や浸潤などのがん進行の側面を忠実に再現することが示されています。患者由来オルガノイドおよび患者由来異種移植オルガノイドは病態生理学的に関連性がありますが、増殖に費用がかかり、操作が難しく、主に腫瘍微小環境(TME)内で最も増殖性の高い細胞タイプで構成されています。これらの制限は、TME内に見られ、転移と治療抵抗性に寄与することが知られている腫瘍関連間質細胞に依存する疾患進行の細胞メカニズムを解明するための使用を妨げます。
ここでは、上皮間質多細胞3D培養の培養方法について報告します。これらの方法の利点には、足場のない環境内でオルガノイド様3D培養を迅速に生成するための費用対効果の高いシステムがあり、ハイドロゲル足場内の単一細胞分解能で浸潤を追跡するために使用できます。具体的には、BT-474乳がん細胞を線維芽細胞(BJ-5ta)、単球様細胞(THP-1)、および/または内皮細胞(EA.hy926)と組み合わせて使用することで、これらのヘテロ多細胞3D培養物を作製する方法を示します。さらに、細胞集団の示差蛍光標識により、タイムラプス顕微鏡で3D培養アセンブリと浸潤ダイナミクスを定義することができます。
特に、BT−474細胞の3D培養物に任意の2つの間質細胞の組み合わせを添加すると、オルガノイド様または二次スフェロイド構造の存在と一致する3D培養物の真円度が有意に減少します。トラッカー色素実験では、線維芽細胞と内皮細胞が末梢オルガノイド様突起に共局在し、一次BT-474スフェロイドから空間的に分離されます。最後に、BT-474細胞のヘテロ多細胞3D培養により、ハイドロゲルの侵入能力が増加しました。これらの突起構造は、非腫瘍性乳房上皮細胞と腫瘍形成性乳房上皮細胞の両方のヘテロ多細胞3D培養で観察されたため、この研究は、固形腫瘍の進行に関連する表現型のその後の解析のために、足場のない環境でオルガノイド様3D培養物を生成するための効率的で再現性のある方法を提供します。
概要
がんの進行は、腫瘍細胞の遺伝的/エピジェネティックな変化と、腫瘍微小環境(TME)1における非腫瘍細胞との無数の相互作用という2つの主要な要因に依存していると認識されています。細胞の遺伝的変化は腫瘍の開始に必要であると認識されていますが、そのような変化だけでは腫瘍の進行と転移には不十分です2。TMEの構成要素は、当初は沈黙の傍観者と考えられていましたが、現在では腫瘍細胞との相互的かつ動的なクロストークを通じて、がんの進行を積極的に促進することが知られています3。TMEの組成は、腫瘍の発生元組織、腫瘍の病期、および患者の特性によって異なりますが、特徴的な特徴には、間質がん関連線維芽細胞(CAF)、細胞外マトリックス(ECM)、血管内皮細胞、および適応免疫細胞と骨髄性免疫細胞が含まれます1,4。
TMEの間質CAFは、多様な起源と機能の線維芽細胞サブタイプで構成されています5。このようなCAFは、いくつかの界面で腫瘍細胞と相互作用するため、TMEの重要な構成要素です。CAFは、マトリックスの硬さを変化させるECMタンパク質を分泌し、コラーゲン、プロテオグリカン、およびフィブロネクチンの過剰な沈着によって薬物送達を制限するか、またはECM分解マトリックスメタロプロテイナーゼ(MMP)の分泌を介して腫瘍細胞が原発腫瘍部位から浸潤することを可能にする可能性があります6,7。さらに、CAFは、上皮成長因子(EGF)、トランスフォーミング成長因子β(TGF-β)、血管内皮増殖因子(VEGF)などのさまざまな成長因子、サイトカイン、血管新生因子の分泌を介して、腫瘍の成長、遊走、および血管新生を促進します1,6。並行して、低酸素TMEによって促される内皮細胞は、血管新生因子の分泌の増加と白血球接着分子の分泌の低下を通じて、腫瘍の血管新生を促進し、免疫細胞の機能を抑制します1,8。
がんの進行は明らかに複雑であるため、がんの基礎研究にTME間質成分を組み込むことが不可欠になっています。しかし、既知の腫瘍の病態生理学を忠実に再現するモデルの確立は、依然として重要なアンメットニーズである9,10。従来の2次元(2D)細胞培養モデルは、取り扱いが容易で、迅速に培養され、高い再現性を備えていますが、急速に増殖するがん細胞クローンのみで構成されており、腫瘍10、11、12に見られる細胞の不均一性を反映していません。同様に、トランスジェニックマウスモデルも、近親交配による遺伝的不均一性が低いこと、免疫系の有意な違い、および組織学的複雑さのために、ヒト腫瘍生物学を捕捉しない13,14。このような制限があるため、古典的ながんモデルから開発された治療法は、臨床現場に応用できないことがよくあります。
患者由来の異種移植片や患者由来オルガノイドなどの患者由来のがんモデルは、in-situ腫瘍の分子的特徴、遺伝的背景、および細胞組織を捕捉することにより、従来のがんモデルの欠点に対処できる10,11,15。しかし、このような患者由来の異種移植片やオルガノイドは、複雑な生着手順と長い培養時間を必要とする16,17。腫瘍の獲得部位とサンプリング部位のばらつき、および凍結保存の効率の低さと相まって、従来の2D細胞培養と患者由来のがんモデルとの間の橋渡しとして機能するモデルを開発する必要があります11,18。この点で、細胞培養の3Dモデルは、迅速に培養でき、細胞間相互作用、細胞-ECM相互作用、低酸素症、血管新生、ECM産生などの重要なin vivo腫瘍の特徴を捉えることができるモデルとして役立つことができます19,20。
3D細胞培養モデルは、スキャフォールドフリーモデルシステムとスキャフォールドベースモデルシステムに分類されます。スキャフォールドフリーシステムでは、特定の低接着細胞培養プレートを使用するか、培養方法の物理的パラメータを操作することにより、細胞が球状に自己凝集するように誘導されます。スキャフォールドフリーの3Dスフェロイドを得るための確立された方法は、遠心分離による単純な細胞ペレット培養から、吊り下げ式マイクロプレート滴、磁気浮上、および動的バイオリアクターおよびマイクロ流体システム20,21にまで及ぶ。スキャフォールドベースの3D細胞培養は、生理学的細胞外マトリックス19,22を模倣するためにポリマーまたはヒドロゲルベースのスキャフォールドを添加することによって確立される。このようなモデルは、in vivoの細胞組織、トポロジー、マトリックスの付着、遊走、および薬物応答をモデル化する大きな可能性を秘めています。
3D細胞培養は、疾患状態におけるECM組成モデルのスキャフォールド操作に加えて、TME内の不均一な細胞集団をモデル化するためにも使用できます。癌細胞、および間質線維芽細胞または内皮細胞からなる3D細胞培養は、癌と個々の非腫瘍細胞株23,24,25の相互作用を研究するために使用されてきた。複数の不均一な細胞株で構成されるこのような3D細胞培養を増殖するための再現性と費用対効果の高い方法は、研究者が腫瘍の進行を解明するのに役立ちます。ここでは、増殖、浸潤、細胞状態の可塑性を研究するための上皮間質多細胞3D培養の培養方法について報告します。このプロトコルは、線維芽細胞(BJ-5ta)、内皮(Ea.hy926)細胞、および単球様細胞(THP-1)の範囲の間質細胞の組み合わせと共培養された乳癌細胞のスキャフォールドフリーおよび基底膜抽出物足場ベースの3D培養物を説明しています。乳がんは現在、世界で2番目に多いがんであり、米国の女性で最も診断されているがんです26。乳がんによる死亡は、主にこの疾患の転移性および治療抵抗性の性質によるものであり、侵攻性のHER2が豊富で基底様乳がんサブタイプと診断された患者では、全体的および転移のない生存率が大幅に減少します27。当社の3D細胞培養プロトコルは、ホルマリン固定パラフィン包埋組織保存法およびその後の空間生物学アプリケーションと組み合わせることができる、費用対効果が高く、迅速で再現性のある培養方法の開発に役立つ可能性があります。
プロトコル
1. 細胞培養培地
注意: バイオセーフティキャビネット内にすべてのメディアを準備します。
- BJ-5ta、BT474、EA.hy926、およびMDA-MB-468用の細胞培養培地を調製するには、500 mLのダルベッコ改変イーグル培地(DMEM)高グルコースに10%熱不活化ウシ胎児血清(FBS)および1%ペニシリン-ストレプトマイシンをピペットで補給します。0.1%ゲンタマイシンをマイクロピペットに組み込みます。
- MCF10A用の細胞培養培地を調製するには、500 mLのDMEM/F12に5%ウマ血清および1%ペニシリン-ストレプトマイシンをピペットで添加します。0.1%ゲンタマイシン、1 mLの1 μg/mLヒドロコルチゾン、500 μLの10 μg/mLインスリン、50 μLの100 ng/mLコレラ毒素、および10 μLの20 ng/mL上皮成長因子10 μLをマイクロピペットで組み込みます。
- MCF10Ca1h用の細胞培養培地を調製するには、500 mLのDMEM/F12に5%ウマ血清および1%ペニシリン-ストレプトマイシンをピペットで添加します。0.1%ゲンタマイシンをマイクロピペットに組み込みます。
- THP-1用の細胞培養培地を調製するには、500 mLのRPMI 1640に10% FBSおよび1%ペニシリン-ストレプトマイシンをピペットで添加します。0.1%ゲンタマイシンをマイクロピペットに組み込みます。
- BJ-5ta、BT474、EA.hy926、MDA-MB-468、MCF10A、およびMCF10Ca1hについて、明視野顕微鏡で毎日成長を評価して、細胞が70〜80%の密度に達するまで、2〜3日ごとに細胞培養培地を交換します。THP-1細胞の細胞培養培地を週に一度交換してください。
- BJ-5ta、BT474、EA.hy926、MDA-MB-468、MCF10A、およびMCF10Ca1h細胞を、5% CO2の標準細胞培養インキュベーターで、細胞培養処理表面を備えた100 mmディッシュで増殖します。
- 標準的な細胞培養インキュベーターのT75細胞培養処理フラスコでTHP-1細胞を5% CO2で増殖させます。
2. 細胞コレクション
- UVライトをオンにして、バイオセーフティキャビネットの内部を15分間消毒します。
- バイオセーフティキャビネットの窓サッシを開いて空気の流れを安定させ、真空吸引システムをオンにします。
- 真空吸引システムの内部フード表面とチューブを70%エタノールで清掃します。
- バイオセーフティキャビネット内で新鮮な無血清細胞培養培地を調製する:ピペットを使用して、500 mLのダルベッコ改変イーグル培地(DMEM)高グルコースに1%ペニシリン/ストレプトマイシンを添加します。0.1%ゲンタマイシンをマイクロピペットに組み込みます。
- 実験を開始する前に、細胞培養培地、リン酸緩衝生理食塩水(PBS)、およびトリプシン-EDTA(0.25%)をビーズバスに入れて37°Cに温めます。
- 顕微鏡による目視検査により、細胞が70〜80%コンフルエントであることを確認します。
- 真空吸引器で播種した細胞から培地を吸引し、廃棄します。残りの培地をピペットで2mLのPBSで一度洗浄し、真空吸引器でPBSを吸引して廃棄します。
注:THP-1細胞は懸濁液中で増殖します。手順 2.7 から 2.9 は省略できます。 - マイクロピペットを使用して1 mLのトリプシンを細胞培養皿に加え、プレートを57°Cの5%CO2インキュベーター内に5分間置きます。
- マイクロピペットでプレートに大豆トリプシン阻害剤1 mL(1x PBS中)を追加して、トリプシンを不活性化します。.P1000マイクロピペットで液体混合物をピペッティングして細胞クラスターを分散させ、プレートの底から細胞懸濁液を回収します。マイクロピペットで細胞懸濁液を15 mLコニカルチューブに移し、室温で100 × g で5分間遠心分離します。真空吸引器で上清を捨てます。
- セルカウントに進みます。
3. ワーキング色素溶液の調製と懸濁液中細胞の染色
- Cell Tracker分子蛍光プローブのバイアルを開封する前に( 材料の表を参照)、37°Cに設定したビーズ浴で製品を室温まで15分間温めます。
- 凍結乾燥したCell Tracker Blue色素(質量=5 mg、分子量=209.6 g/mol)を、マイクロピペットを使用して2.385 mLのDMSOで最終濃度10 mMまで溶解します。
- 凍結乾燥したCell Tracker Orange色素(質量 = 50 μg、分子量 = 550.4 g/mol)を、マイクロピペットを使用して9.084 μLのDMSOで最終濃度10 mMまで溶解します。
- 凍結乾燥したCell Trackerの深赤色色素(質量 = 15 μg、分子量 = 698.3 g/mol)を、マイクロピペットを使用して20 μLのDMSOで最終濃度1 mMまで溶解します。
- マイクロピペットで1 μLの色素を2 mLの無血清DMEM培地に希釈することにより、Working Cell Tracker Blue dye Media溶液(5 μM)を調製します。
- マイクロピペットで1 μLの色素を2 mLの無血清DMEM培地に希釈することにより、Working Cell Tracker Orange dye Media溶液(5 μM)を調製します。
- マイクロピペットで2 mLの無血清DMEM培地に2 μLの色素を希釈することにより、Working Cell Trackerの深赤色色素培地溶液(1 μM)を調製します。
- 上皮細胞、BJ-5ta線維芽細胞、およびEa.hy926内皮細胞を、調製した作業用セルトラッカーブルー、オレンジ、および深赤色の色素培地溶液(2 mL)にそれぞれマイクロピペットで再懸濁します。
- チューブを37°Cの5%CO2 インキュベーターで30分間インキュベートします。
- 30分間のインキュベーション後、チューブを100 x g で室温で5分間遠心分離します。
- 真空吸引器で上清を吸引して廃棄し、ペレットをマイクロピペットで10%FBS血清含有DMEM培地1mLに完全に再懸濁します。.
- セルカウントに進みます。
4. 細胞カウント
- 細胞懸濁液10μLを採取し、マイクロピペットでマイクロチューブに移します。
- 10μLのトリパンブルーと混合し、ピペットで十分にピペットします。
- マイクロピペットで20 μLの細胞トリパン溶液を細胞計数チャンバースライドに移します。自動セルカウンターを使用してセルを挿入し、カウントします。
- 2つの測定値から平均合計生細胞数を計算します。
5. 計算
- 各細胞タイプに対して、2,000細胞/300 μLに相当する3細胞/ mL 10×6.67の濃度でワーキングセルストックを調製します。
注:総ストック量は、実験サンプルサイズによって異なります。 - 単一培養スフェロイドの場合、各独立したサンプルが2,000個の上皮細胞に相当する300 μLの上皮細胞ワーキングストックで構成されていることを確認してください。
- 共培養スフェロイド(2種類の細胞タイプ)の場合、各独立したサンプルが150 μLの上皮細胞ワーキングストックと150 μLの間質細胞ワーキングストックで構成されていることを確認してください。サンプルには、1,000個の上皮細胞と1,000個の間質細胞が含まれます。
- 共培養スフェロイド(3種類の細胞)の場合、各独立したサンプルが150 μLの上皮細胞ワーキングストック、75 μLの間質細胞#1ワーキングストック、および75 μLの間質細胞#2ワーキングストックで構成されていることを確認してください。サンプルには、1,000 個の上皮細胞、500 個のワーキング ストック #1 の間質細胞、および 500 個のワーキング ストック #2 の間質細胞が含まれます。
6. めっき
- マイクロピペットで必要な量をマイクロピペットで3回のテクニカルレプリケートと1回の追加複製でマイクロチューブに移します。ピペットで十分に混合し、サンプルの300μLをU字型の超低アタッチメント96ウェルマイクロプレートのウェルに移します。
- 追加のテクニカルレプリケートごとにこのプロセスを繰り返します。
- 96ウェルプレートを37°Cのインキュベーターに入れます。
7. 明視野イメージング
- 顕微鏡を使用して、24時間ごとに96時間ごとにスフェロイドの成長と形態を観察します。
- 位相差顕微鏡を使用したスフェロイドの画像化。
8. トラッカー色素で染色したスフェロイドおよび基底膜抽出物でオーバーレイしたスフェロイドの広視野イメージングプロトコルのセットアップ
- 材料表に記載されているイメージングおよび自動インキュベーターデバイスの電源を入れ、イメージングソフトウェアのタスクマネージャーで新しいイメージングプロトコルを作成します。Procedureタブで、自動インキュベーターの温度設定値を37°Cに設定し、インキュベーターがCO2%と温度を平衡化してから次のステップに進みます。
注:使用する色素(青、深紅、オレンジ)のそれぞれに適したフィルターを備えている場合は、別の蛍光イメージャーを使用できます。 - 画像設定を次の仕様に設定します:倍率:4X PL FL Phase、視野:3185 x 3185 μm、フルWFOV。
- チャネルには、 DAPI:377/447 nm、照明= 10、積分時間= 107 ms、ゲイン = 10、RFP:531/593 nm、照明 = 10、積分時間 = 137 ms、ゲイン = 10、CY5:628/685 nm、照明 = 10、積分時間 = 137 ms、ゲイン = 10の仕様を使用します。
- 基底膜抽出溶液のオーバーレイでスフェロイドをイメージングするには、明視野仕様として、 照明 = 10、積分時間 = 5 ms、ゲイン = 17.1 を使用します。
- イメージングに必要なウェルを選択し、 ウェル選択 アイコンをクリックして仕様の変更を承認します。
- [Data Reduction]タブに移動して、細胞解析の設定を調整します。
- しきい値を 19,500 に設定し、背景が明るい場合は、[マスクの穴を埋める] を選択します。
- オブジェクト選択では、 最小オブジェクト サイズ を 100 μm に、 最大オブジェクト サイズ を 1,000 μm に設定し、[ 画像全体を解析] を選択します。
注:この分析に必要なのは、プライマリマスクとオブジェクト数のみです。 - すべての変更を保存し、イメージャーアプリケーションを開きます。
- 実験用のU字型底マイクロプレートを引き出しを開いてインキュベーターに入れ、イメージャーソフトウェアを使用して閉じます。
- プロトコルを実行するには、[ Procedure Info ] タブをクリックし、ユーザーを追加して、プロトコルを選択します。
- 正しいプレートタイプが選択されていることを確認し、イメージング時間をプレートあたり30分に設定します。
- 目的のイメージング間隔を選択し、プレートに蓋があるかどうかを示し、イメージングの開始時間と時間を調整します。
- Schedule Plate/Vessel(スケジュールプレート/容器)をクリックして、イメージングプロセスを開始します。
9.基底膜抽出液オーバーレイ(オプション)
注:基底膜抽出液は、めっき後24時間でスフェロイドに適用できます。
- 氷のバケツに氷を入れて基底膜抽出液を冷たく保ち、使用しないときは4°Cで保存します。
- 約170 μLの培地をマルチチャンネルピペットで吸引します。
- 虫眼鏡とミニライトボックスを使用して、小さな回転楕円体を詳しく観察します。96ウェル回転楕円板をライトボックスの上に置き、虫眼鏡を頭上に置きます。
- P200ピペットを30μLに設定し、基底膜抽出物を採取して3つの微小液滴を作成します。
- マイクロピペットで、3つのテクニカルレプリケートの各スフェロイドに1つのマイクロ液滴を追加します。
- 96ウェルプレートが平らであることを確認し、ピペットを回転楕円体の上に垂直に置きます。ウェルの底に触れずに液滴を放出します。
- プレートを37°Cのインキュベーターに20分間置きます。
- マイクロピペットで、ウェルあたり50 μLの基底膜抽出溶液をスフェロイドに重ねます。
- ピペットチップを使用して、スフェロイドをウェルの中心に再配置します。
- 37°Cで30分間インキュベートします。
- 各ウェルに100 μLの細胞培養培地を加えます。
10. 定量化
- ImageJソフトウェアをダウンロードして開きます。回転楕円体画像をアップロードします。
- 測定値を設定するには、[ 分析] |計測値の設定 と エリアの選択 |重心。なげなわツールを使用して回転楕円体を測定し、回転楕円体をトレースし、オブジェクトを測定します。
- 3つの生物学的複製の値を記録し、平均面積と真円度を計算します。
- 次の式を使用して、面積をピクセルから平方メートルに変換します。
面積 (m2) = ((550/504) × √ (ピクセル単位の面積)) 2 - データを分析します。
- [Enter replicate values, stacked into columns] を選択します。
- 列にデータを入力し、モノカルチャースフェロイドコントロールと共培養処理スフェロイドサンプルを選択します。
- 一元配置ANOVAカラム分析を実行します。
- 次の分散分析パラメータを使用します。
- マッチングやペアリングは避けてください。
- 残差のガウス分布を仮定します。
- 標準偏差が等しいと仮定します。
- テューキーの多重比較検定を使用して、各列の平均を他のすべての列の平均と比較します。
11. 広視野免疫蛍光画像処理
- イメージャーソフトウェアから直接画像をPNGまたはTiffファイル形式で保存します。
- 個々のチャンネルまたは重なり合うチャンネルを選択し、PNGファイルとして保存します。
- イメージャーソフトウェアで、または画像がTiffファイルとしてエクスポートされている場合はImageJで明るさとコントラストを調整します。
結果
本研究では、オルガノイド様の形態を持つ上皮細胞と間質細胞からなるヘテロ多細胞3Dスフェロイドを作製する細胞培養系を開発した。スフェロイドは、2,000個の上皮細胞を単一培養条件でプレーティングすることによって確立されました。2種類の細胞の共培養条件において、上皮細胞1,000個、間質細胞1,000個をプレーティングすることによりスフェロイドを樹立しました。3種類の細胞の共培養条件で、1,000個の上皮細胞と各細胞型の500個の異なる間質細胞タイプ2種類をプレーティングすることにより、スフェロイドを樹立しました。スフェロイドの確立の上流では、細胞を蛍光セルトラッカー色素で染色することができ、細胞の空間的組織をモニタリングすることができます。最初のスフェロイド形成から24時間後、下流のアプリケーションには、薬理学的摂動、イメージング、およびサンプル収集が含まれます。タイムラプスイメージングは、面積や真円度など、スフェロイドの挙動や形態の変化を評価するのに役立ちます(図1A)。めっき後24時間で、スフェロイドを足場環境に埋め込むことができ、タイムラプスイメージングを使用してスフェロイドからの浸潤構造の開始を評価できます(図1B)。ヘテロ多細胞スフェロイドサンプルのコレクションには、RNAシーケンシング、シングルセルRNAシーケンシング、プロテオミクスシーケンシング、サイクリック免疫蛍光などの実験技術による、グローバルレベルおよびシングルセルレベルでのゲノムおよびプロテオミクスプロファイリングなど、多くの用途があります。
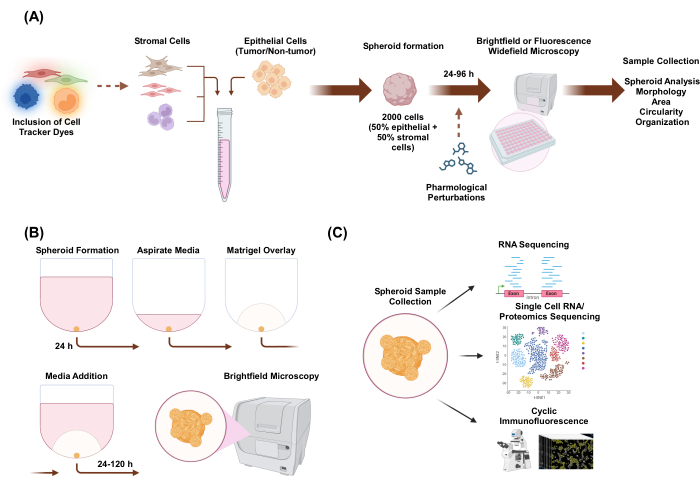
図1:3D細胞培養プロセスと潜在的なアプリケーションの概略図(A)非上皮間質細胞を持つ上皮細胞の細胞懸濁液を3D超低接着プレートにピペットで移動してスフェロイドを形成します。スフェロイドは、明視野顕微鏡法により、24時間ごとに96時間にわたって画像化されます。細胞株は、スフェロイド形成を誘導する前に、下流の広視野顕微鏡法のために蛍光セルトラッカー色素で染色したり、スフェロイド形成後に薬理学的に摂動することができます。形態、面積、真円度、組織化などの回転楕円体パラメータを解析できます。(B)上皮細胞および間質細胞を有する上皮細胞のスフェロイドは、Aのプロトコールを使用して形成されます。スフェロイドは、2,000個の上皮細胞を単一培養条件でプレーティングすることによって確立されました。2種類の細胞の共培養条件において、上皮細胞1,000個、間質細胞1,000個をプレーティングすることによりスフェロイドを樹立しました。3種類の細胞の共培養条件で、1,000個の上皮細胞と各細胞型の500個の異なる間質細胞タイプ2種類をプレーティングすることにより、スフェロイドを樹立しました。(C) 確立されたスキャフォールドフリーおよびスキャフォールドベースのヘテロマルチセル3D培養物は、サイクリック免疫蛍光法、シングルセルRNAシーケンシング、シングルセルプロテオミクスなどのさまざまなダウンストリームアプリケーションに使用できます。この図の拡大版を表示するには、ここをクリックしてください。
MCF10A、MCF10Ca1h、およびBT-474モノカルチャースフェロイドは、めっき後最大96時間にわたってコンパクトな球状表現型を維持します。EA.hy926微小血管内皮細胞、BJ-5ta線維芽細胞、および/またはTHP-1単球様細胞と共培養すると、スフェロイドは末梢に細胞突起を発達させ、96時間でより顕著になりました(図2A-C)。重要なことに、スフェロイドのこれらの突起、出芽、圧縮現象は、がんスフェロイドと共培養された間質細胞の細胞構成の変動を表しており、これはマトリゲルのような基底膜ベースのハイドロゲルを添加した後の3D侵襲性と相関していました。出芽形態は、固体から緩い細胞凝集体までさまざまで、オルガノイドの形態に似ていました。対照的に、MDA-MB-468モノカルチャースフェロイドは、大きくて緩い細胞凝集体として現れました。しかし、MDA-MB-468細胞をEA.hy926、BJ-5ta、および/またはTHP-1と共培養すると、コンパクトなスフェロイドが形成されました(図2D)。
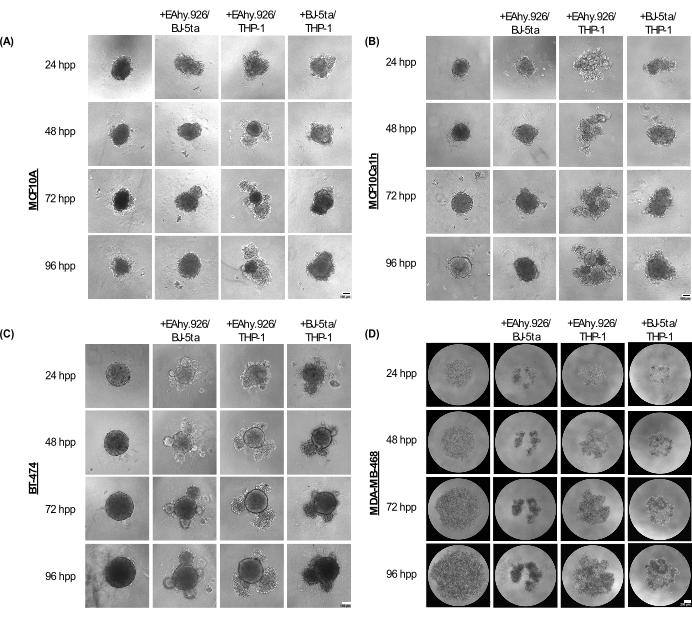
図2:スキャフォールドフリーの3D培養で上皮性腫瘍/非腫瘍細胞と組み合わせた場合に、非上皮性間質細胞の組み合わせによって採用されるアーキテクチャと形態の範囲。 (A)MCF10A、(B)MCF10Ca1h、(C)BT-474、(D)MDA-MB-468スフェロイドのモノカルチャーまたは間質BJ-5ta線維芽細胞/Ea.hy926微小血管内皮細胞またはEa.hy926/THP-1単球様セラまたはBJ-5ta/THP-1細胞との共培養条件での96時間にわたる代表的な明視野画像。各スフェロイドは、2,000個の細胞をプレーティングして形成しました。単一培養条件のスフェロイドは、2,000個の上皮細胞を使用して形成されました。共培養条件でのスフェロイドは、1,000個の上皮細胞と500個の細胞からなる2つの異なる間質細胞タイプを使用して形成されました。出芽または凝集したオルガノイド様構造の形成は、MCF10A、MCF10Ca1h、およびBT-474上皮細胞のプレーティング後24時間後のスフェロイド共培養条件で開始されました。MDA-MB-468細胞の圧縮は、めっき後25時間のスフェロイド共培養条件で観察されました。スケールバー = 100 μm。略語:hpp = めっき後数時間。 この図の拡大版を表示するには、ここをクリックしてください。
プレーティング後72時間で、EA.hy926とTHP-1、またはBJ-5taとTHP-1と共培養したMCF10A、MCF10Ca1h、およびBT-474細胞は、単培養上皮スフェロイドと比較してスフェロイド面積の有意な増加を示しました。また、MCF10Ca1hは、EA.hy926およびBJ-5taと共培養した場合、スフェロイド面積の有意な増加を示しました。共培養したスフェロイドの出芽構造の開始により、EA.hy926およびTHP-1、またはBJ-5taおよびTHP-1と共培養したMCF10A、MCF10Ca1h、およびBT-474のスフェロイド真円度が大幅に低下しました。EA.hy926およびBJ-5taの両方と共培養したBT-474についても同様の効果が観察されました(図3A、B)。対照的に、EA.hy926とBJ-5ta、EA.hy926とTHP-1、またはBJ-5taとTHP-1と共培養したMDA-MB-468細胞は、単一培養MDA-MB-468スフェロイドと比較してスフェロイド面積の有意な減少を示しました。しかし、真円度への影響はありませんでした(図3A、B)。

図3:めっき後72時間における単培養およびヘテロ多細胞間質3Dスキャフォールドフリー培養の平均面積および真円度解析グラフ。(A)めっき後72時間におけるMCF10A、MCF10Ca1h、BT-474、MDA-MB-468の平均真円度。報告されたデータは、少なくとも3つの独立した生物学的複製を代表するものであり、特に明記されていない限り、SEM±技術的複製平均として報告されています。*、**、***、または **** は、特に断りのない限り、それぞれ 0.05、0.01、0.001、または 0.0001 < p 値を表します。この図の拡大版を表示するには、ここをクリックしてください。
スフェロイド樹立に先立ってBT-474腫瘍形成上皮細胞および間質細胞にCell Tracker色素を適用したところ、EA.hy926およびBJ-5taを含む間質細胞が中央のBT474スフェロイドの周囲に出芽構造を形成することが実証されました(図4、 補足ビデオS1、 補足ビデオS2、 補足ビデオS3、および 補足ビデオS4).めっき後48時間で、線維芽細胞と共培養したスフェロイドの個々の広視野蛍光画像は、線維芽細胞スフェロイドが内皮細胞とともに共局在したが、BT-474スフェロイドと共局在しなかったことを明らかにした。また、少数の内皮細胞が共培養条件でBT-474スフェロイドと共局在することもわかりました。このことは、スフェロイド内の間質細胞の配置がオルガノイド様の形態と相関していることを示唆しています。
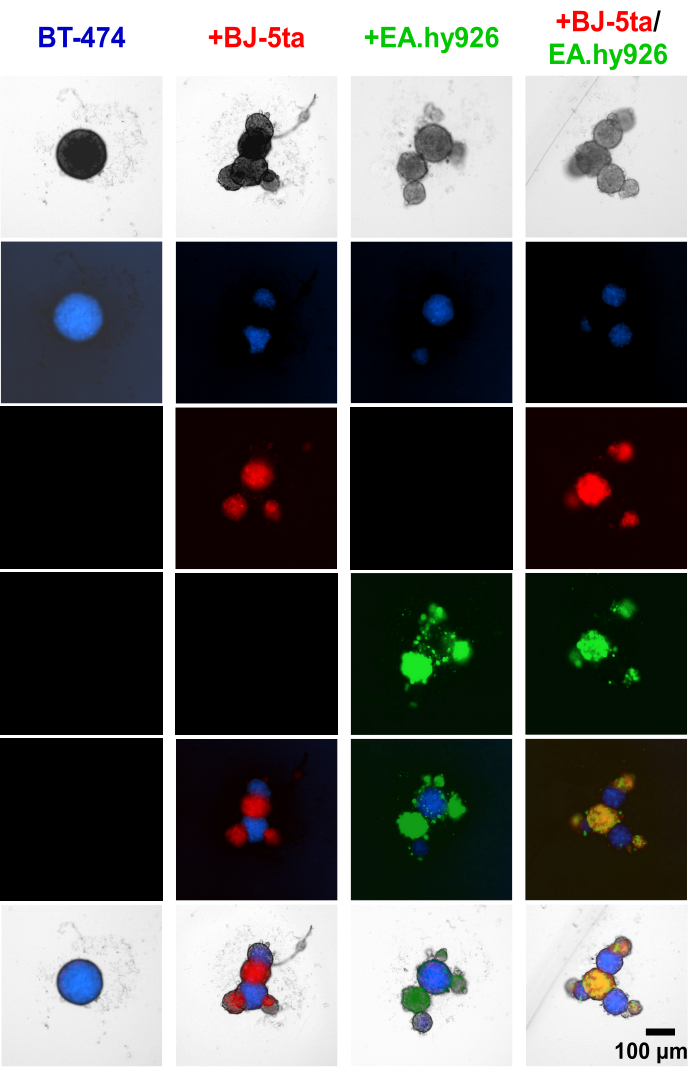
図4:めっき後48時間でのヘテロ多細胞3D培養における差次的に染色された間質細胞およびBT-474細胞の広視野蛍光静止画。 BT-474スフェロイドは、青色細胞トラッカー蛍光色素で染色されています。BJ-5ta線維芽細胞は、赤色で表されるオレンジ色のセルトラッカー色素で染色されます。Ea.hy926内皮細胞は、緑色で表される深赤色細胞トラッカー色素で染色されます。各スフェロイドは、2,000個の細胞をプレーティングして形成しました。単一培養条件のスフェロイドは、2,000個の上皮細胞を使用して形成されました。共培養条件(BT-474/BJ-5ta、BT-474/Ea.hy926)のスフェロイドは、1,000個の上皮細胞と1,000個の間質細胞を用いて作製しました。二重共培養条件(BT-474/BJ-5ta/Ea.hy926)のスフェロイドは、各間質細胞タイプの上皮細胞1,000個と500個の細胞を使用して形成されました。この数値は、少なくとも 3 つの生物学的複製を表しています。スケールバー = 100 μm. この図の拡大版を表示するには、ここをクリックしてください。
オルガノイドスフェロイドモデルの生物学的関連性を評価するために、スフェロイドをめっきの24時間後に基底膜抽出溶液で覆いました。モノカルチャーBT-474スフェロイドは、めっき後120時間で侵襲性を示さなかった。しかし、BJ-5taやEA.hy926と共培養したBT-474スフェロイドは、スフェロイドの周辺に構造を発達させ、足場基底膜抽出液環境に侵入した。これらの突起の数と長さは、BJ-5taおよびEA.hy926の両方と共培養したBT-474スフェロイドにおいて、めっき後48時間から120時間までに有意に増加しました(図5、補足ビデオS5、補足ビデオS6、補足ビデオS7、および補足ビデオS8)。
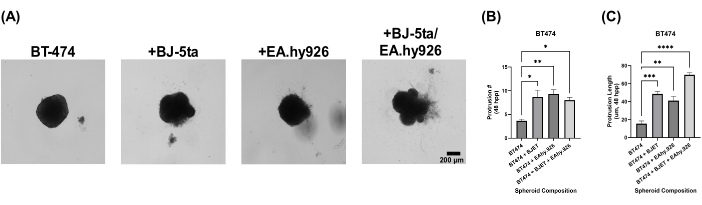
図5:重ね合わせ後5日目の基底膜抽出溶液を重ね合わせたヘテロ多細胞3D培養におけるBT-474細胞の明視野静止画。 各スフェロイドは、2,000個の細胞をプレーティングして形成しました。基底膜抽出溶液をスフェロイド上に24時間播種後24時間で重ね合わせた。単一培養条件のスフェロイドは、2,000個の上皮細胞を使用して形成されました。共培養条件(BT-474/BJ-5taおよびBT-474/Ea.hy926)のスフェロイドは、1,000個の上皮細胞と1,000個の間質細胞を用いて形成されました。二重共培養条件(BT-474/BJ-5ta/Ea.hy926)のスフェロイドは、各間質細胞タイプの上皮細胞1,000個と500個の細胞を使用して形成されました。(A)共培養条件では、基底膜抽出液に埋入されたがんスフェロイドから突出した浸潤構造が観察できる。(B)時間48 hppでの侵襲的突起数の認定。(C)時間48馬力での侵襲的突起の長さの認定。この数値は、少なくとも 3 つの生物学的複製を表しています。スケールバー = 200 μm。略語:hpp = めっき後数時間。 この図の拡大版を表示するには、ここをクリックしてください。
補足動画S1:BT-474モノカルチャースフェロイドとセルトラッカーブルー色素。 BT-474(2,000)細胞をU字型の超低付着96ウェルマイクロプレートに再懸濁してスフェロイドを作製しました。明視野と広視野の蛍光画像の重なりは、48時間にわたって撮影されました。略称:ULA=超低アタッチメント。 このビデオをダウンロードするには、ここをクリックしてください。
補足ビデオS2:BT-474スフェロイドとBJ-5ta線維芽細胞の共培養。 BT-474(1,000)と1,000のBJ-5ta線維芽細胞をULAプレートに再懸濁してスフェロイドを形成しました。BT-474細胞をCell Tracker Blue色素と、BJ-5ta線維芽細胞をCell Tracker Orange色素とインキュベートしました。明視野と広視野蛍光(青=BT-474、赤=BJ-5ta)の重なりを48時間にわたって撮影しました。略称:ULA=超低アタッチメント。 このビデオをダウンロードするには、ここをクリックしてください。
補足ビデオS3:BT-474スフェロイドをEa.hy926内皮細胞と共培養。BT-474(1,000)および1,000個のEa.hy926内皮細胞をULAプレートに再懸濁してスフェロイドを作製しました。BT-474細胞をCell tracker Blue色素とインキュベートし、Ea.hy926内皮細胞をCell Tracker Deep Red Dyeとインキュベートしました。明視野と広視野蛍光(青=BT-474、緑=Ea.hy926)画像の重なりを48時間にわたって撮影しました。略称:ULA=超低アタッチメント。 このビデオをダウンロードするには、ここをクリックしてください。
補足動画S4:BT-474スフェロイドをBJ-5ta線維芽細胞およびEa.hy926内皮細胞と共培養 。BT-474(1,000)、500個のBJ-5ta線維芽細胞、および500個のEa.hy926内皮細胞をULAプレートに再懸濁してスフェロイドを形成しました。BT-474細胞をCell Tracker Blue色素とインキュベートしました。BJ-5ta線維芽細胞とEa.hy926内皮細胞を、それぞれCell Tracker Orange色素とDeep Red Dyeとインキュベートしました。明視野と広視野蛍光(青=BT-474、赤=BJ-5ta、緑=Ea.hy926)の画像の重なりを48時間にわたって撮影しました。略称:ULA=超低アタッチメント。 このビデオをダウンロードするには、ここをクリックしてください。
補足ビデオS5:基底膜抽出溶液中のBT-474モノカルチャースフェロイド。 BT-474細胞(2,000)をULAプレートに再懸濁してスフェロイドを形成し、スフェロイドをめっき後24時間で基底膜溶液に包埋しました。明視野画像は60時間以上にわたって撮影されました。略称:ULA=超低アタッチメント。 このビデオをダウンロードするには、ここをクリックしてください。
補足ビデオS6:基底膜抽出液中でBJ-5ta線維芽細胞と共培養したBT-474スフェロイド。 BT-474(1,000)および1,000本のBJ-5ta線維芽細胞をULAプレートに再懸濁してスフェロイドを形成し、スフェロイドをめっき後24時間で基底膜抽出液に包埋した。明視野画像は60時間以上にわたって撮影されました。略称:ULA=超低アタッチメント。 このビデオをダウンロードするには、ここをクリックしてください。
補足ビデオS7:基底膜抽出液中でEa.hy926内皮細胞と共培養したBT-474スフェロイド。 BT-474(1,000)および1,000個のEa.hy926内皮細胞をULAプレートに再懸濁してスフェロイドを形成し、スフェロイドをめっき後24時間で基底膜抽出液に包埋した。明視野画像は60時間以上にわたって撮影されました。略称:ULA=超低アタッチメント。 このビデオをダウンロードするには、ここをクリックしてください。
補足ビデオS8:基底膜抽出液中でBJ-5ta線維芽細胞およびEa.hy926内皮細胞と共培養したBT-474スフェロイド。 BT-474(1,000)、BJ-5ta線維芽細胞500個、Ea.hy926内皮細胞500個をULAプレートに再懸濁してスフェロイドを作製し、めっき後24時間でスフェロイドを基底膜抽出液に包埋した。明視野画像は60時間以上撮影されました。 このビデオをダウンロードするには、ここをクリックしてください。
ディスカッション
私たちのヘテロ-多細胞スフェロイドモデルは、上皮-間質細胞の相互作用が、足場のない3D培養条件で間質細胞の出芽を促進し、足場ベースの3D培養条件で浸潤構造の形成を促進することを示しています。腫瘍形成細胞株(MCF10Ca1hおよびBT-474)と非腫瘍形成性上皮細胞株MCF10A(図2A-C)の両方で一貫した出芽構造形成が観察されました。興味深いことに、MCF10A、MCF10Ca1h、BT-474細胞株のスフェロイドは、単培養でも線維芽細胞や内皮細胞との共培養でも、スキャフォールドフリー環境で円形でコンパクトな出芽構造を形成していましたが、MDA-MB-468細胞株のスフェロイドは圧縮が少なかった(図2D)。MDA-MB-468細胞は、試験した他の上皮細胞株と同様に環状スフェロイドを形成すると予想されていたため、これは予想外でした。細胞株SUM-149は、ハイブリッド上皮-間葉系初代乳癌細胞株であり、MCF10A、MCF10Ca1h、およびBT-474のようなコンパクトなスフェロイドを形成することがわかった(データは示さず)28。今後の研究では、MDA-MB-468細胞株におけるコンパクトでないスフェロイドの形成を媒介するシグナル伝達経路を調査する必要があります。なぜなら、このような異常は、新しい治療戦略の開発に活用できる可能性のある細胞の脆弱性を示している可能性があるためです。
異なる細胞株の組み合わせに関しては、THP-1単球様細胞は、スフェロイドのすべての共培養条件で緩い凝集構造の形成を誘導します。THP-1/Ea.hy926細胞との共培養条件での出芽構造では、THP-1/BJ-5ta細胞との共培養条件での出芽構造と比較して、圧縮が少なくなります(図2A-D)。したがって、スフェロイドの圧縮は、モデル29,30の間質細胞組成の影響を受けます。
ヘテロ細胞の組み合わせのプレーティングに一貫性がないと、スフェロイドの発達が不完全になったり、技術的な複製と比較してスフェロイドのサイズにばらつきが生じたりする可能性があります。スフェロイドの表現型と発生を決定する細胞の空間配置は、主に最初の48時間31以内に発生するため、細胞プレーティングの一貫性を確保することは非常に重要です。この臨界期には、細胞比が重要な役割を果たし、間質細胞の割合がスフェロイド面積と真円度の両方に影響を与えます。
細胞の種類に依存する緩いスフェロイド凝集体は、手作業での取り扱いで簡単に分解できます。ただし、スフェロイドを足場状の基底膜抽出溶液でオーバーレイする場合、またはスフェロイドサンプル全体を収集する場合は、手動操作が必要です。この問題を軽減するには、ピペット吸引でスフェロイドを採取する際はゆっくりとしたペースで作業し、可能な限り手作業による取り扱いを最小限に抑えることをお勧めします。基底膜抽出溶液のオーバーレイ中、スフェロイドはウェル内を移動する傾向があり、多くの場合、ウェルの端に沈殿します。基底膜抽出液と培地の比率は、3Dシステムのマトリックス特性を維持するために重要です。しかし、スフェロイドは基底膜抽出液の粘度のために完全に包み込むことができないので、手動介入が必要である32。非中心性スフェロイドの位置決めは、ウェルのプラスチックエッジ付近の光の屈折が画像の鮮明さを妨げる可能性があるため、イメージングに課題をもたらします。
この研究で使用されたスフェロイドは、ヒトの癌細胞株で構成されていました。ここで説明する方法は、初代細胞株にはまだ適用されていません。私たちの結果は、特定の細胞間相互作用がオルガノイド様構造の形成を促進する可能性があることを示唆しており、この方法が広範囲の腫瘍形成細胞株に適用できる可能性を示しています。しかし、我々のモデルは腫瘍微小環境の複雑さを模倣しようとする一方で、細胞増殖の速度が異なることが長期研究の課題を提示している33。急速に増殖する細胞は、増殖が遅い細胞よりも成長する傾向があるため、このモデルは長時間の実験にはあまり適していません。さらに、細胞株の増殖培地の種類の要件が異なると、スフェロイド表現型につながる可能性のある追加の要因が導入される可能性があります。この研究のほとんどの細胞株は、DMEM培地で増殖しました。異なる培地で増殖した細胞株を用いた研究では、さまざまな培地比を試験する異なる培養条件が必要になる場合があります。しかし、この効果は長期実験30で観察されます。
当社のモデルには、他の3Dがんモデルに比べていくつかの利点があります。私たちが作製するスフェロイドは、初期形態とサイズが均一で再現性が高いため、治療結果をコントロールと比較することが容易になります。対照的に、培地やスキャフォールドに懸濁した単一細胞を使用するモデルの中には、細胞の空間分布が変動し、一貫性がなくなるものがあります。このモデルは、異なる細胞集団間の相互作用を効果的に研究できることを示しています。
従来、オルガノイドモデルとスフェロイドモデルは、栄養素、低酸素症、または細胞配置の勾配を調べるために、単一培養がん細胞またはがん細胞共培養物で構成されてきました34。さらに、このモデルは、めっき後24時間以内に足場環境で研究できるため、多様な細胞間相互作用によって引き起こされる早期浸潤イベントを探索する機会を提供します。代替の3Dがんアプローチは、スフェロイドの形態と浸潤性の変化を研究するために異なる足場マトリックスコンポーネントを使用しますが、このモデルは、細胞集団のダイナミクスと足場組成35の両方のコンテキストでこれらの変化を調査することを可能にすることにより、これらを補完します。
当社の方法を使用して製造されたほとんどのスフェロイドは、手作業での取り扱い後も構造的完全性を保持し、ダウンストリームアプリケーションでのサンプル収集を可能にします。CRISPR-Cas9、レンチウイルスshRNA形質導入、siRNA干渉などの従来の遺伝子改変は、スフェロイド形成の上流に導入することができます。これらのスフェロイドで観察された複雑な挙動は、遺伝子発現の動的な変化を示唆しており、これはRNA-seqを使用してさらに調査することができます。CycIF、scRNA-seq、CosMx、Visiumなどの高度な技術も、空間レベルまたはシングルセルレベルでのゲノミクスおよびプロテオミクスの研究にも使用できます。このスフェロイドモデルは、間質細胞芽と治療薬との間の相互作用をがん細胞に到達する前に捕捉することにより、標的腫瘍治療薬の in vivo 研究を模倣する可能性を秘めています。これは、間質細胞が薬物の効力に影響を与え、がん細胞を治療効果から保護する可能性があるかどうかを判断するのに役立つため、重要です。
開示事項
著者は、宣言する利益相反を持っていません。
謝辞
ベイラー大学Developmental Oncogene Laboratoryのメンバーの皆様には、この原稿の作成中に有益なご意見やフィードバックをいただき、誠にありがとうございます。資金援助は、ベイラー大学生物学部および教養学部、NIH-NIGMS 2SC1GM121182(J.A.K.へ)によって提供されました。
資料
| Name | Company | Catalog Number | Comments |
| 15 mL Polypropylene Centrifuge Tubes | Falcon | 14-959-53A | |
| 96-Well, Treated, U-Shaped-Bottom Microplate | Thermo Scientific | 12566432 | |
| 100 mm Dish Cell Culture Treated Surface | Thermo Scientific | 130182 | |
| 170 L CO2 Incubators | VWR | VWR51014991(10810902) | |
| 200 Self-Sealing Barrier Pipet Tips | Fisher Scientific | 02-682-255 | |
| 500 mL DMEM/Hams F-12, [+] L-glutamine | Corning | 10-090-CV | |
| 1000 Self-Sealing Barrier Pipet Tips | Molecular Biology Products Inc. | 2179HR | |
| Animal-Free Recombinant Human EGF | PeproTech | AF-100-15 | |
| Automated Pipette Repeater E3x | Eppendorf | 4987000410 | |
| Basement membrane solution | Huntsman Cancer Institute | https://healthcare.utah.edu/huntsmancancerinstitute/ | |
| Bead Bath | Lab Armor | 74300706 | |
| Biorender | Biorender | Biorender.com | |
| Biosafety Laminar Flow Cabinets | Thermo Scientific | 300590389 | |
| BioSpa 8 Automated Incubator | Agilent | 23082120 | |
| Cell Counter | Invitrogen | AMQAF2000 | |
| Cell Counting Chamber Slides | Thermo Scientific | C10283 | |
| CellTracker Deep Red | Thermo Fisher Scientific | C34565 | |
| Centrifuge | Thermo Scientific | 13100675 | |
| Cholera Toxin B subunit | Sigma-Aldrich | C9903-1MG | |
| Combitips advanced, Sterile, 5.0 mL | Fisher Scientific | 13-683-714 | |
| Cytation 10 Reader Imager | Agilent | 2105245 | |
| Defined Trypsin Inhibitor | Gibco | R007100 | soybean trypsin inhibitor in 1x PBS |
| Donor Horse Serum, 500 mL, United States Origin | Corning | 35-030-CV | |
| Dulbecco's Modified Eagle's Medium | Corning | 10-013-CV | |
| Excel Sofware | Microsoft office 365 | https://www.microsoft.com/en-us/microsoft-365/excel | |
| Fetal Bovine Serum | Thermo Scientific | 26140079 | |
| Fetal Bovine Serum, qualified, US origin | Thermo Scientific | 26140079 | |
| Gentamicin Sulfate, Liquid | Corning | 30-005-CR | |
| GraphPad Prism | |||
| Hydrocortisone solution,50 µM, sterile-filtered, BioXtra | Sigma-Aldrich | H6909-10ML | |
| Image J Software | Fiji | https://imagej.net/ij/ | |
| Insulin solution human | Sigma-Aldrich | I9278-5ML | |
| Magnifying Glass | Fisher Scientific | 01-182-392 | |
| Microcentrifuge Tube | Costar | 3621 | |
| Microscope | Olympus | CKX53SF | |
| Mini Lightbox | Fisher Scientific | 361044708 | |
| Molecular Probes CellTracker Blue CMAC Dye | Fisher Scientific | C2110 | |
| Molecular Probes CellTracker Orange CMRA Dye | Fisher Scientific | C34551 | |
| Penicillin-Streptomycin Solution | Cytiva | SV30010 | |
| Penicillin-Streptomycin Solution | Cytiva | SV30010 | |
| Phase-Contrast Microscope | Echo | RVSF1000 | |
| Phosphate Buffered Saline | Fisher Scientific | SH3025601 | |
| Pipet Controller | Corning | 4099 | |
| Pipette 100 – 1,000 µL | Eppendorf | 3123000063 | |
| Pipette 20 – 200 µL | Eppendorf | 3123000055 | |
| Prism | GraphPad Software | https://www.graphpad.com/features | |
| RPMI 1640 with L-glutamine and 25 mM HEPES | Corning | 10-041-CV | |
| Serological Pipette, 10 mL | Thermo Scientific | 170356N | |
| Serological Pipette, 25 mL | Thermo Scientific | 170357N | |
| Serological Pipette, 5 mL | Thermo Scientific | 170355N | |
| Trypan Blue Solution, 0.4% | Corning | 25900CI | |
| Trypsin-EDTA, 0.25% | Corning | 25053CI |
参考文献
- de Visser, K. E., Joyce, J. A. The evolving tumor microenvironment: From cancer initiation to metastatic outgrowth. Cancer Cell. 41 (3), 374-403 (2023).
- Hanahan, D., Weinberg, R. A. Hallmarks of cancer: The next generation. Cell. 144 (5), 646-674 (2011).
- Anderson, N. M., Simon, M. C. The tumor microenvironment. Curr Biol. 30 (16), R921-R925 (2020).
- Baghban, R., et al. Tumor microenvironment complexity and therapeutic implications at a glance. Cell Commun Signal. 18 (1), 59 (2020).
- Sahai, E., et al. A framework for advancing our understanding of cancer-associated fibroblasts. Nat Rev Cancer. 20 (3), 174-186 (2020).
- Erdogan, B., Webb, D. J. Cancer-associated fibroblasts modulate growth factor signaling and extracellular matrix remodeling to regulate tumor metastasis. Biochem Soc Trans. 45 (1), 229-236 (2017).
- Iozzo, R. V., Sanderson, R. D. Proteoglycans in cancer biology, tumour microenvironment and angiogenesis. J Cell Mol Med. 15 (5), 1013-1031 (2011).
- Amersfoort, J., Eelen, G. Immunomodulation by endothelial cells - partnering up with the immune system. Nat Rev Immunol. 22 (9), 576-588 (2022).
- Balani, S., Nguyen, L. V., Eaves, C. J. Modeling the process of human tumorigenesis. Nat Commun. 8 (1), 15422 (2017).
- Drost, J., Clevers, H. Organoids in cancer research. Nat Rev Cancer. 18 (7), 407-418 (2018).
- Wang, E., Xiang, K., Zhang, Y., Wang, X. -. F. Patient-derived organoids (PDOs) and PDO-derived xenografts (PDOXs): New opportunities in establishing faithful pre-clinical cancer models. J Natl Cancer Cent. 2 (4), 263-276 (2022).
- Kamb, A. What's wrong with our cancer models. Nat Rev Drug Discov. 4 (2), 161-165 (2005).
- Tuveson, D., Clevers, H. Cancer modeling meets human organoid technology. Science. 364 (6444), 952-955 (2019).
- Zitvogel, L., Pitt, J. M., Daillère, R., Smyth, M. J. Mouse models in oncoimmunology. Nat Rev Cancer. 16 (12), 759-773 (2016).
- Liu, Y., et al. Patient-derived xenograft models in cancer therapy: technologies and applications. Signal Transduct Target Ther. 8 (1), 160 (2023).
- Ben-David, U., et al. Patient-derived xenografts undergo mouse-specific tumor evolution. Nat Genet. 49 (11), 1567-1575 (2017).
- Byrne, A. T., et al. Interrogating open issues in cancer precision medicine with patient-derived xenografts. Nat Rev Cancer. 17 (4), 254-268 (2017).
- Ivanics, T., et al. Patient-derived xenograft cryopreservation and reanimation outcomes are dependent on cryoprotectant type. Lab Invest. 98 (7), 947-956 (2018).
- Biju, T. S., Priya, V. V., Francis, A. P. Role of three-dimensional cell culture in therapeutics and diagnostics: an updated review. Drug Deliv and Transl Res. 13 (9), 2239-2253 (2023).
- Urzì, O., et al. Three-dimensional cell cultures: The bridge between in vitro and in vivo models. Int J Mol Sci. 24 (15), 12046 (2023).
- Cacciamali, A., Villa, R., Dotti, S. 3D cell cultures: Evolution of an ancient tool for new applications. Front Physiol. 13, 836480 (2022).
- Abuwatfa, W. H., Pitt, W. G. Scaffold-based 3D cell culture models in cancer research. J Biomed Sci. 31 (1), 7 (2024).
- Yakavets, I., et al. Advanced co-culture 3D breast cancer model for investigation of fibrosis induced by external stimuli: optimization study. Sci Rep. 10 (1), 21273 (2020).
- Mohammadrezaei, D., et al. Predicting and elucidating the post-printing behavior of 3D printed cancer cells in hydrogel structures by integrating in-vitro and in-silico experiments. Sci Rep. 13 (1), 1211 (2023).
- Kuen, J., Darowski, D., Kluge, T., Majety, M. Pancreatic cancer cell/fibroblast co-culture induces M2 like macrophages that influence therapeutic response in a 3D model. PLOS ONE. 12 (7), e0182039 (2017).
- Bray, F., et al. Global cancer statistics 2022: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin. 74 (3), 229-263 (2024).
- Kennecke, H., et al. Metastatic behavior of breast cancer subtypes. J Clin Oncol. 28 (20), 3271-3277 (2010).
- Neve, R. M., et al. A collection of breast cancer cell lines for the study of functionally distinct cancer subtypes. Cancer Cell. 10 (6), 515-527 (2006).
- Pingitore, P., et al. Human multilineage 3D spheroids as a model of liver steatosis and fibrosis. Int J Mol Sci. 20 (7), 1629 (2019).
- Bar-Ephraim, Y. E., Kretzschmar, K. Organoids in immunological research. Nat Rev Immunol. 20 (5), 279-293 (2020).
- Beerkens, A. P. M., et al. Characterizing OXPHOS inhibitor-mediated alleviation of hypoxia using high-throughput live cell-imaging. Cancer Metab. 12 (1), 13 (2024).
- Feaster, T. K., et al. Matrigel mattress. Cir Res. 117 (12), 995-1000 (2015).
- Huang, Z., Yu, P., Tang, J. Characterization of triple-negative breast cancer MDA-MB-231 cell spheroid model. Onco Targets Ther. 13, 5395-5405 (2020).
- Nam, S., Khawar, I. A., Park, J. K., Chang, S., Kuh, H. -. J. Cellular context-dependent interaction between cancer and stellate cells in hetero-type multicellular spheroids of pancreatic tumor. Biochem Biophys Res Commun. 515 (1), 183-189 (2019).
- Monteiro, M. V., Gaspar, V. M., Ferreira, L. P. Hydrogel 3D in vitro tumor models for screening cell aggregation mediated drug response. Biomater Sci. 8 (7), 1855-1864 (2020).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved