Method Article
Гетеромногоклеточные стромальные клетки в бескаркасных 3D-культурах эпителиальных раковых клеток стимулируют инвазию
* Эти авторы внесли равный вклад
В этой статье
Резюме
Существует острая потребность в 3D-моделях рака, которые улавливают гетероклеточные перекрестные помехи для изучения метастазирования рака. В нашем исследовании представлено генерирование гетеромногоклеточного стромально-эпителиального в скаффолде и свободной от скаффолда среде, что может быть использовано для изучения инвазии и клеточного пространственного распределения.
Аннотация
Рак молочной железы является второй по значимости причиной смерти от рака среди женщин в США. Было показано, что органоидные модели солидных опухолей точно повторяют аспекты прогрессирования рака, такие как пролиферация и инвазия. Несмотря на то, что органоиды, полученные от пациента, и органоиды ксенотрансплантата, полученные от пациента, являются патофизиологически значимыми, они дорогостоящи в распространении, трудны в манипулировании и состоят в основном из наиболее пролиферативных типов клеток в микроокружении опухоли (TME). Эти ограничения препятствуют их использованию для выяснения клеточных механизмов прогрессирования заболевания, которые зависят от опухолеассоциированных стромальных клеток, которые находятся в ТМЭ и, как известно, способствуют метастазированию и резистентности к терапии.
Здесь мы рассказываем о методах культивирования эпителиально-стромальных многоклеточных 3D-культур. Преимущества этих методов включают в себя экономически эффективную систему для быстрого создания органоидоподобных 3D-культур в средах, свободных от скаффолдов, которая может быть использована для отслеживания инвазии с разрешением одной клетки в гидрогелевых каркасах. В частности, мы демонстрируем, как можно получить эти гетеромногоклеточные 3D-культуры с использованием клеток рака молочной железы BT-474 в сочетании с фибробластами (BJ-5ta), моноцитоподобными клетками (THP-1) и/или эндотелиальными клетками (EA.hy926). Кроме того, дифференциальное флуоресцентное мечение клеточных популяций позволяет с помощью покадровой микроскопии определить динамику сборки и инвазии 3D-культуры.
Примечательно, что добавление любых двух комбинаций стромальных клеток к 3D-культурам клеток BT-474 значительно снижает круговость 3D-культур, что согласуется с наличием органоидных или вторичных сфероидных структур. В экспериментах с трекерным красителем фибробласты и эндотелиальные клетки колакализуются в периферических органоидоподобных выступах и пространственно отделены от первичного сфероида BT-474. Наконец, гетеромногоклеточные 3D-культуры клеток BT-474 обладают повышенной способностью к гидрогелевой инвазии. Поскольку мы наблюдали эти выступающие структуры в гетеромногоклеточных 3D-культурах как неопухолегенных, так и опухолевых эпителиальных клеток молочной железы, эта работа обеспечивает эффективный и воспроизводимый метод генерации органоидоподобных 3D-культур в среде, свободной от каркасов, для последующего анализа фенотипов, связанных с прогрессированием солидных опухолей.
Введение
В настоящее время признано, что прогрессирование рака зависит от двух основных факторов: генетических/эпигенетических изменений в опухолевых клетках и множества взаимодействий с неопухолевыми клетками в опухолевом микроокружении (TME)1. В то время как генетические изменения в клетках признаны необходимыми для инициации опухоли, такие изменения сами по себе недостаточны для прогрессирования опухоли и метастазирования. Компоненты ТМЭ, первоначально считавшиеся молчаливыми наблюдателями, теперь известно, что они активно способствуют прогрессированию рака посредством взаимного и динамического перекрестного взаимодействия с опухолевымиклетками. Состав ТМЭ различается в зависимости от ткани, из которой происходит опухоль, стадии опухоли и характеристик пациента, но отличительными особенностями являются фибробласты, ассоциированные со стромальным раком (КАФ), внеклеточный матрикс (ВКМ), сосудистые эндотелиальные клетки, а также адаптивные и миелоидные иммунные клетки 1,4.
Стромальные КАФ в ТМЭ состоят из подтипов фибробластов различного происхождения и функций5. Такие CAF являются ключевыми компонентами ТМЭ, поскольку они взаимодействуют с опухолевыми клетками на нескольких границах. CAF секретируют белки ВКМ, которые изменяют жесткость матрикса, что может либо ограничивать доставку лекарств за счет чрезмерного отложения коллагена, протеогликанов и фибронектина, либо позволять опухолевым клеткам проникать из первичного опухолевого очага путем секреции металлопротеиназ, разрушающих ВКМ матричных металлопротеиназ (ММП)6,7. Кроме того, CAF способствуют росту, миграции и васкуляризации опухоли за счет секреции различных факторов роста, цитокинов и ангиогенных факторов, таких как эпидермальный фактор роста (EGF), трансформирующий фактор роста β (TGF-β) и фактор роста эндотелия сосудов (VEGF) соответственно 1,6. Параллельно эндотелиальные клетки, стимулируемые гипоксической ТМЭ, также способствуют васкуляризации опухоли и подавляют функции иммунных клеток за счет увеличения секреции ангиогенных факторов и снижения секреции молекул адгезии лейкоцитов 1,8.
В связи с очевидной сложностью прогрессирования рака, стало необходимым включить стромальные компоненты ТМЭ в фундаментальные исследования рака. Тем не менее, создание моделей, которые точно повторяют известную патофизиологию опухолей, все еще является значительной неудовлетворенной потребностью 9,10. В то время как традиционные двумерные (2D) модели клеточных культур просты в обращении, быстро культивируются и обладают высокой воспроизводимостью, они состоят только из быстро размножающихся клонов раковых клеток и не отражают клеточную гетерогенность, обнаруженную в опухолях 10,11,12. Аналогичным образом, трансгенные модели мышей также не отражают биологию опухолей человека из-за низкой генетической гетерогенности от инбридинга, значительных различий в иммунной системе и гистологическойсложности. Из-за таких ограничений терапевтические средства, разработанные на основе классических моделей рака, часто не могут быть перенесены в клинические условия.
Модели рака, полученные от пациента, такие как ксенотрансплантаты, полученные от пациента, и органоиды, полученные от пациента, могут устранить недостатки традиционных моделей рака, захватывая молекулярные особенности опухоли in-situ, генетический фон и клеточную организацию 10,11,15. Однако такие ксенотрансплантаты и органоиды, полученные от пациентов, требуют сложных процедур приживления и длительного времени культивирования16,17. В сочетании с вариациями в местах получения и отбора проб опухолей и низкой эффективностью криоконсервации, существует потребность в разработке моделей, которые выступают в качестве моста между классическими двумерными культурами клеток и моделями рака, полученными от пациента11,18. В связи с этим 3D-модели клеточных культур могут служить моделями, которые могут быть быстро культивированы и захватывать важные особенности опухоли in vivo, такие как межклеточное взаимодействие, взаимодействие между клетками и ВКМ, гипоксия, ангиогенез и продукция ВКМ19,20.
3D-модели клеточных культур подразделяются на модельные системы без скаффолдов и на основе скаффолдов. В системах без скаффолдов клетки индуцируют к самоагрегации в сферическую форму с помощью специальных пластин для клеточных культур с низким уровнем прикрепления или путем манипулирования физическими параметрами методов культивирования. Установленные методы получения 3D-сфероидов без каркасов варьируются от простых клеточных гранул с помощью центрифугирования до подвесных микропланшетов, магнитной левитации, а также динамических биореакторов и микрофлюидных систем20,21. Трехмерные клеточные культуры на основе скаффолдов получают путем добавления каркасов на основе полимеров или гидрогелей для имитации физиологического внеклеточного матрикса19,22. Такие модели обладают огромным потенциалом для моделирования in vivo клеточной организации, топологии, прикрепления матрицы, миграции и реакции на лекарства.
В дополнение к манипуляциям со скаффолдом для моделирования состава ВКМ при заболеваниях, 3D-культуры клеток также могут быть использованы для моделирования гетерогенных клеточных популяций в TME. Трехмерные клеточные культуры, состоящие из раковых клеток и стромальных фибробластов или эндотелиальных клеток, были использованы для изучения взаимодействия рака и отдельных неопухолевых клеточных линий 23,24,25. Воспроизводимые и экономически эффективные методы расширения таких трехмерных клеточных культур, состоящих из нескольких гетерогенных клеточных линий, помогут исследователям выяснить прогрессию опухоли. В этой статье мы рассказываем о методах культивирования эпителиально-стромальных многоклеточных 3D-культур для изучения пролиферации, инвазии и пластичности клеточного состояния. Протокол описывает 3D-культуры клеток рака молочной железы на основе скаффолда без скаффолда и экстракта базальной мембраны, культивируемые совместно с комбинацией стромальных клеток, начиная от фибробластов (BJ-5ta), эндотелиальных (Ea.hy926) и моноцитоподобных клеток (THP-1). Рак молочной железы в настоящее время является вторым по распространенности раком во всем мире и наиболее часто диагностируемым раком у женщин в США26. Смертность от рака молочной железы в значительной степени обусловлена метастатическим и резистентным к терапии характером заболевания, поскольку общая выживаемость и выживаемость без метастазов значительно снижается у пациентов с диагнозом агрессивный HER2-обогащенный и базальноподобный рак молочной железыподтипов 27. Описанные нами протоколы 3D-культивирования клеток могут помочь в разработке экономически эффективных, быстрых и воспроизводимых методов культивирования, которые могут сочетаться с методами сохранения тканей, залитых формалином, и последующими приложениями в пространственной биологии.
протокол
1. Среда для культивирования клеток
ПРИМЕЧАНИЕ: Подготовьте все среды внутри шкафа биобезопасности.
- Для приготовления питательной среды для клеток BJ-5ta, BT474, EA.hy926 и MDA-MB-468 добавьте 500 мл модифицированной орлиной среды (DMEM) от Dulbecco с высоким содержанием глюкозы с 10% инактивированной при нагревании фетальной бычьей сыворотки (FBS) и 1% пенициллин-стрептомицина с помощью пипетки. Добавьте 0,1% гентамицин с помощью микропипетки.
- Для приготовления питательной среды для клеточной культуры MCF10A добавьте 500 мл DMEM/F12 с 5% лошадиной сывороткой и 1% пенициллин-стрептомицином с помощью пипетки. Добавьте 0,1% гентамицина, 1 мл 1 г/мл гидрокортизона, 500 мл 10 г/мл инсулина, 50 мл 100 нг/мл холерного токсина и 10 мл 20 нг/мл эпидермального фактора роста с помощью микропипетки.
- Для приготовления питательной среды для клеточной культуры MCF10Ca1h добавьте 500 мл DMEM/F12 с 5% лошадиной сывороткой и 1% пенициллин-стрептомицином с помощью пипетки. Добавьте 0,1% гентамицин с помощью микропипетки.
- Для приготовления питательной среды для клеточных культур для ТГП-1 добавляют 500 мл RPMI 1640 с 10% FBS и 1% пенициллин-стрептомицином с помощью пипетки. Добавьте 0,1% гентамицин с помощью микропипетки.
- Меняйте среду для культивирования клеток каждые 2-3 дня для BJ-5ta, BT474, EA.hy926, MDA-MB-468, MCF10A и MCF10Ca1h до тех пор, пока клетки не достигнут 70-80% конфлюенции, ежедневно оценивая их рост с помощью светлопольного микроскопа. Меняйте среду для культивирования клеток THP-1 один раз в неделю.
- Выращивайте клетки BJ-5ta, BT474, EA.hy926, MDA-MB-468, MCF10A и MCF10Ca1h в чашках 100 мм с обработанными клеточными культурами поверхностями в стандартных инкубаторах для клеточных культур с 5%CO2.
- Выращивайте клетки THP-1 в колбах, обработанных клеточными культурами T75, в стандартных инкубаторах для клеточных культур с 5%CO2.
2. Сбор клеток
- Включите ультрафиолетовую лампу для дезинфекции внутренней части шкафа биобезопасности на 15 минут.
- Откройте створку окна шкафа биобезопасности, чтобы стабилизировать поток воздуха и включить систему вакуумной аспирации.
- Очистите внутреннюю поверхность капота и трубки системы вакуумной аспирации 70% этанолом.
- Приготовьте свежую бессывороточную среду для клеточных культур в биобезопасном шкафу: добавьте 500 мл модифицированной среды Dulbecco Eagle's Medium (DMEM) с высоким содержанием глюкозы с 1% пенициллином/стрептомицином с помощью пипетки. Добавьте 0,1% гентамицин в микропипетку.
- Нагрейте среду для клеточных культур, фосфатно-солевой буфер (PBS) и трипсин-ЭДТА (0,25%) до 37 °C, поместив предметы в ванну с шариками перед началом эксперимента.
- Убедитесь, что клетки сливаются на 70-80% с помощью визуального осмотра через микроскоп.
- Отсадите и отбросьте питательную среду из покрытых клеток с помощью вакуумного аспиратора. Один раз промойте оставшуюся среду 2 мл PBS с помощью пипетки, затем отсадите и выбросьте PBS с помощью вакуумного аспиратора.
ПРИМЕЧАНИЕ: Клетки THP-1 выращивают в суспензии; Шаги 2.7-2.9 можно не указывать. - Добавьте 1 мл трипсина в чашку для клеточной культуры с помощью микропипетки и поместите планшет в инкубатор с 5% содержаниемCO2 при температуре 37 °C на 5 минут.
- Инактивируйте трипсин, добавив 1 мл ингибитора соевого трипсина (в 1x PBS) в планшет с помощью микропипетки. Диспергируйте клеточные кластеры путем пипетирования жидкой смеси с помощью микропипетки P1000 и соберите клеточную суспензию со дна планшета. Перенесите клеточную суспензию с помощью микропипетки в коническую пробирку объемом 15 мл и центрифугируйте при 100 × г в течение 5 минут при комнатной температуре. Выбросьте надосадочную жидкость с помощью вакуумного аспиратора.
- Продолжайте подсчет клеток.
3. Приготовление раствора рабочего красителя и окрашивание клеток в суспензию
- Перед открытием флакона с молекулярными флуоресцентными зондами клеточного трекера (см. Таблицу материалов) дайте изделию нагреться до комнатной температуры в течение 15 минут в ванне с шариками, установленной при температуре 37 °C.
- Растворите лиофилизированный синий краситель клеточного трекера (масса = 5 мг, молекулярная масса = 209,6 г/моль) до конечной концентрации 10 мМ с помощью 2,385 мл ДМСО с помощью микропипетки.
- Лиофилизированный клеточный трекер оранжевый краситель (масса = 50 мкг, молекулярная масса = 550,4 г/моль) растворить до конечной концентрации 10 мМ с 9,084 мкл ДМСО с помощью микропипетки.
- Растворите лиофилизированный клеточный трекер темно-красного красителя (масса = 15 мкг, молекулярная масса = 698,3 г/моль) до конечной концентрации 1 мМ с 20 мкл ДМСО с помощью микропипетки.
- Приготовьте раствор рабочей среды для отслеживания клеток синего красителя (5 мкМ) путем разведения 1 мкл красителя в 2 мл бессывороточной среды DMEM с помощью микропипетки.
- Приготовьте рабочий раствор клеточного трекера оранжевого красителя (5 мкМ), разбавив 1 мкл красителя в 2 мл бессывороточной среды DMEM с помощью микропипетки.
- Приготовьте рабочий раствор красителя глубокого красного цвета (1 мкМ) путем разведения 2 мкл красителя в 2 мл бессывороточной среды DMEM с помощью микропипетки.
- Ресуспендируйте эпителиальные клетки, фибробласты BJ-5ta и эндотелиальные клетки Ea.hy926 в подготовленных рабочих средах клеточного трекера синего, оранжевого и темно-красного цветов (2 мл) соответственно с помощью микропипетки.
- Инкубируйте пробирки при температуре 37 °C в инкубаторе с 5%CO2 в течение 30 минут.
- После 30 минут инкубации центрифугируйте пробирки при давлении 100 x g в течение 5 минут при комнатной температуре.
- Отсадите и выбросьте надосадочную жидкость с помощью вакуумного аспиратора и тщательно суспендируйте гранулу в 1 мл 10% FBS-сыворотки DMEM-среды с микропипеткой.
- Продолжайте подсчет клеток.
4. Подсчет ячеек
- Соберите 10 мкл клеточной суспензии и перенесите ее в микропробирку с помощью микропипетки.
- Тщательно перемешайте с 10 μL трипанового синего и пипеткой.
- Перенесите 20 мкл раствора трипана с помощью микропипетки на предметное стекло камеры для подсчета клеток. Вставьте и подсчитайте ячейки с помощью автоматического счетчика ячеек.
- Рассчитайте среднее общее количество живых клеток по двум показаниям.
5. Расчеты
- Готовьте рабочие запасы клеток для каждого типа клеток в концентрации 6,67 ×10 3 ячейки/мл, что эквивалентно 2000 ячейкам/300 мкл.
ПРИМЕЧАНИЕ: Общий объем запасов будет зависеть от размера экспериментальной выборки. - Для монокультуральных сфероидов убедитесь, что каждый независимый образец состоит из 300 мкл рабочего фонда эпителиальных клеток, что эквивалентно 2000 эпителиальным клеткам.
- Для совместной культивирования сфероидов (два типа клеток) убедитесь, что каждый независимый образец состоит из 150 мкл рабочего фонда эпителиальных клеток и 150 мкл рабочего фонда стромальных клеток. Образец будет содержать 1000 эпителиальных клеток и 1000 стромальных клеток.
- Для сфероидов совместной культивирования (три типа клеток) убедитесь, что каждый независимый образец состоит из 150 мкл рабочего фонда эпителиальных клеток, 75 мкл рабочего фонда стромальных клеток #1 и 75 μл рабочего фонда стромальных клеток #2. Образец будет содержать 1000 эпителиальных клеток, 500 стромальных клеток рабочего фонда #1 и 500 стромальных клеток рабочего фонда #2.
6. Гальваническое покрытие
- Перенесите необходимый объем с помощью микропипетки на три технических повтора плюс один дополнительный, в микропробирку. Тщательно перемешайте с помощью пипетки, затем перенесите 300 мкл образца в лунку 96-луночного микропланшета с U-образным дном и сверхнизким уровнем крепления.
- Повторяйте этот процесс для каждой дополнительной технической реплики.
- Поместите планшет на 96 лунок в инкубатор при температуре 37 °C.
7. Светлопольная визуализация
- Наблюдайте за ростом и морфологией сфероидов каждые 24 часа до 96 часов с помощью микроскопа.
- Изображение сфероидов с помощью фазово-контрастного микроскопа.
8. Настройка протокола широкопольной визуализации для сфероидов, окрашенных трекерными красителями, и сфероидов, покрытых экстрактом базальной мембраны
- Включите устройства визуализации и автоматизированный инкубатор, перечисленные в таблице материалов, и создайте новый протокол визуализации в диспетчере задач программного обеспечения для обработки изображений. На вкладке Процедура установите заданное значение температуры автоматического инкубатора на 37 °C и дайте инкубатору уравновесить CO2% и температуру, прежде чем продолжить следующий шаг.
ПРИМЕЧАНИЕ: Можно использовать альтернативный флуоресцентный тепловизор, если он имеет соответствующие фильтры для каждого из используемых красителей (синий, темно-красный и оранжевый). - Установите следующие параметры изображения: Увеличение: 4x PL FL Фаза, поле зрения: 3185 x 3185 μм, полное WFOV.
- Используйте следующие характеристики для каналов: DAPI: 377/447 нм, освещенность = 10, время интегрирования = 107 мс, усиление = 10, RFP: 531/593 нм, освещенность = 10, время интегрирования = 137 мс, усиление = 10, CY5: 628/685 нм, освещенность = 10, время интегрирования = 137 мс, усиление = 10.
- Для визуализации сфероидов в наложении экстрактивного раствора базальной мембраны используйте следующие характеристики светлого поля: освещенность = 10, время интегрирования = 5 мс и усиление = 17,1.
- Выберите нужные скважины для визуализации и подтвердите изменения спецификации, нажав на иконку выбора скважин.
- Перейдите на вкладку «Сжатие данных », чтобы настроить параметры клеточного анализа.
- Установите пороговое значение на 19 500 на светлом фоне и выберите Заполнить отверстия в масках.
- Для выбора объекта установите минимальный размер объекта на 100 μм и максимальный размер объекта на 1 000 μм, а затем выберите Анализировать все изображение.
ПРИМЕЧАНИЕ: Для этого анализа требуются только первичная маска и количество объектов. - Сохраните все изменения и откройте приложение имидж-сканера.
- Поместите экспериментальную микропластину с U-образным дном в инкубатор, открыв ящик, затем закройте его с помощью программного обеспечения имидж-сканера.
- Чтобы запустить протокол, перейдите на вкладку «Информация о процедуре », добавьте пользователя и выберите протокол.
- Убедитесь, что выбран правильный тип пластины, и установите время визуализации на 30 минут для каждой пластины.
- Выберите нужный интервал съемки, укажите, есть ли у пластины крышка, и отрегулируйте время и продолжительность начала съемки.
- Нажмите кнопку Schedule Plate/Vessel, чтобы начать процесс визуализации.
9. Наложение раствора экстракта базальной мембраны (по желанию)
ПРИМЕЧАНИЕ: Раствор экстракта базальной мембраны можно наносить на сфероиды через 24 часа после нанесения покрытия.
- Наполните ведро со льдом льдом, чтобы раствор экстракта базальной мембраны оставался холодным, и храните его при температуре 4 °C, когда он не используется.
- Отсасывайте примерно 170 мкл среды с помощью многоканальной пипетки.
- Используйте увеличительное стекло и мини-лайтбокс, чтобы внимательно наблюдать за маленькими сфероидами. Поместите 96-луночную сфероидальную пластину над световым коробом и расположите увеличительное стекло над головой.
- Установите дозатор P200 на 30 мкл и соберите экстракт базальной мембраны, чтобы создать три микрокапли.
- Добавьте по одной микрокапле на каждый сфероид из трех технических реплик с помощью микропипетки.
- Убедитесь, что 96-луночный планшет плоский, и расположите пипетку вертикально над сфероидом. Выпустите каплю, не касаясь дна лунки.
- Поместите тарелку в инкубатор при температуре 37 °C на 20 минут.
- Нанесите на сфероиды дополнительно 50 мкл раствора экстракта базальной мембраны на лунку с помощью микропипетки.
- Переместите сфероиды в центр лунки с помощью наконечника пипетки.
- Выдерживать при 37 °C в течение 30 минут.
- Добавьте в каждую лунку по 100 мкл среды для культивирования клеток.
10. Количественная оценка
- Загрузите и откройте программное обеспечение ImageJ. Загрузите изображения сфероидов.
- Установите измерения, нажав на кнопку «Анализ» | Установите Измерения и выберите Площадь | Центроид. Измерьте сфероиды с помощью инструмента лассо, чтобы обвести сфероид и измерить объект.
- Запишите значения для трех биологических реплик и рассчитайте среднюю площадь и окружность.
- Преобразуйте площадь из пикселей в квадратные метры по следующей формуле:
Площадь (м2) = ((550/504) × √ (площадь в пикселях)) 2 - Анализируйте данные.
- Выберите Ввести повторяющиеся значения, уложенные в столбцы.
- Введите данные в столбцы и выберите монокультуральный контроль сфероида и образцы сфероида для совместной обработки культурой.
- Выполнение одностороннего анализа столбцов ANOVA.
- Используйте следующие параметры ANOVA:
- Избегайте сопоставления или сопряжения.
- Предположим гауссово распределение невязок.
- Предположим, что равные стандартные отклонения.
- Используйте тест множественного сравнения Тьюки, чтобы сравнить среднее значение каждого столбца со средним значением каждого другого столбца.
11. Широкопольная иммунофлуоресцентная обработка изображений
- Сохраняйте изображения непосредственно из программного обеспечения имидж-сканера в формате PNG или Tiff.
- Выберите каждый отдельный канал или перекрывающиеся каналы и сохраните как файл PNG.
- Отрегулируйте яркость и контрастность в программном обеспечении имидж-сканера или в ImageJ, если изображения экспортируются в виде файлов Tiff.
Результаты
В этом исследовании мы разработали систему клеточных культур для получения гетеромногоклеточных 3D-сфероидов, состоящих из эпителиальных и стромальных клеток с органоидной морфологией. Сфероиды были установлены путем осаждения 2000 эпителиальных клеток в монокультурных условиях. В условиях совместного культивирования двух типов клеток сфероиды были установлены путем осаждения 1000 эпителиальных клеток и 1000 стромальных клеток. В условиях совместного культивирования трех типов клеток сфероиды были установлены путем осаждения 1000 эпителиальных клеток и двух различных типов стромальных клеток по 500 клеток каждого типа клеток. Перед созданием сфероидов клетки могут быть окрашены флуоресцентными клеточными трекерными красителями, которые позволяют контролировать клеточную пространственную организацию. Через 24 часа после первоначального формирования сфероида последующие приложения включают фармакологические возмущения, визуализацию и сбор образцов. Покадровая съемка полезна для оценки изменений в поведении и морфологии сфероидов, включая площадь и круговость (рис. 1A). Через 24 часа после нанесения покрытия сфероиды могут быть внедрены в среду каркаса, а для оценки возникновения инвазивных структур из сфероида можно использовать покадровую визуализацию (рис. 1B). Сбор образцов гетеромногоклеточных сфероидов имеет множество применений, включая геномное и протеомное профилирование на глобальном и одноклеточном уровнях с помощью экспериментальных методов, таких как секвенирование РНК, секвенирование РНК отдельных клеток, протеомное секвенирование и циклическая иммунофлюоресценция.
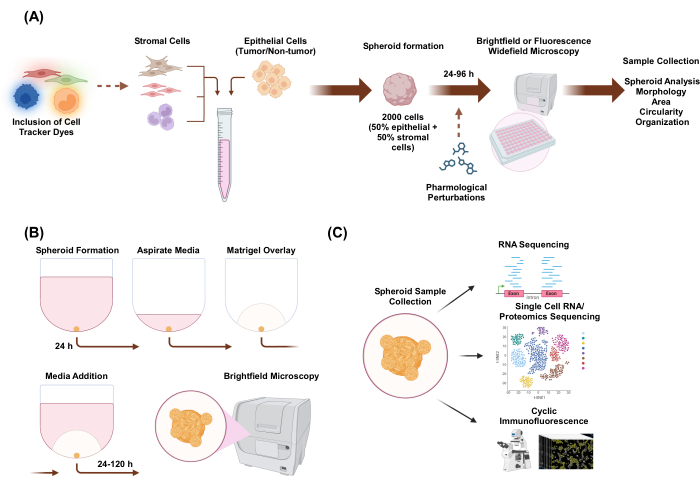
Рисунок 1: Схематическое изображение процесса 3D-культивирования клеток и потенциальных применений. (A) Клеточная суспензия эпителиальных клеток с неэпителиальными стромальными клетками пипетируется в 3D-планшеты со сверхнизким уровнем прикрепления с образованием сфероидов. Сфероиды визуализируются с помощью светлопольной микроскопии каждые 24 часа в течение 96 часов. Клеточные линии могут быть окрашены флуоресцентными клеточными трекерными красителями для последующего широкопольного микроскопии до индуцирования образования сфероидов или могут быть нарушены фармакологически после формирования сфероидов. Можно анализировать такие параметры сфероида, как морфология, площадь, круговость и организация. (В) Сфероиды эпителиальных и эпителиальных клеток со стромальными клетками формируют по протоколу из А. Сфероиды были установлены путем осаждения 2000 эпителиальных клеток в монокультурных условиях. В условиях совместного культивирования двух типов клеток сфероиды были установлены путем осаждения 1000 эпителиальных клеток и 1000 стромальных клеток. В условиях совместного культивирования трех типов клеток сфероиды были установлены путем осаждения 1000 эпителиальных клеток и двух различных типов стромальных клеток по 500 клеток каждого типа клеток. Через 24 ч накладывают раствор экстракта базальной мембраны, похожий на скаффолд, и изображения получают с помощью светлопольной микроскопии каждые 24 ч в течение 120 ч. (C) Созданные гетеромногоклеточные 3D-культуры без скаффолда и на основе скаффолда могут быть использованы для различных последующих применений, таких как циклическая иммунофлуоресценция, секвенирование РНК одиночных клеток и протеомика одиночных клеток. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Монокультурные сфероиды MCF10A, MCF10Ca1h и BT-474 сохраняют компактный сферический фенотип в течение 96 часов после нанесения покрытия. При совместном культивировании с микрососудистыми эндотелиальными клетками EA.hy926, фибробластами BJ-5ta и/или моноцитоподобными клетками THP-1 у сфероидов развивались клеточные выпячивания на периферии, которые становились более выраженными через 96 ч (рис. 2A-C). Важно отметить, что эти выпячивания, почкование и явления уплотнения сфероидов представляют собой вариации клеточной организации ракового сфероида и ко-культивируемых стромальных клеток, которые коррелируют с 3D-инвазивностью после добавления гидрогеля на основе базальной мембраны, такого как Матригель. Морфология почек варьировалась от твердых до рыхлых клеточных агрегатов, напоминающих морфологию органоидов. В отличие от них, монокультурные сфероиды MDA-MB-468 представляли собой большие рыхлые клеточные агрегаты. Однако, когда клетки MDA-MB-468 были совместно культивированы с EA.hy926, BJ-5ta и/или THP-1, они образовали компактные сфероиды (рис. 2D).
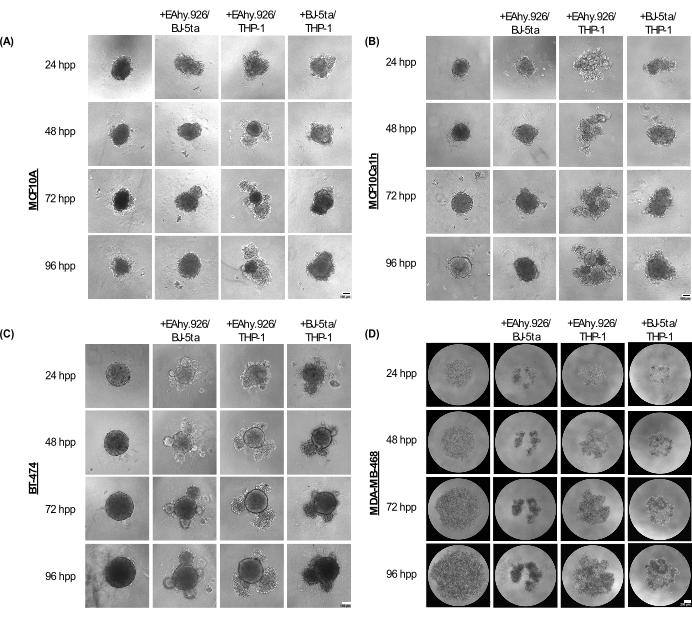
Рисунок 2: Диапазон архитектур и морфологий, принятых комбинациями неэпителиальных стромальных клеток в комбинации с эпителиальными опухолевыми/неопухолевыми клетками в 3D-культурах без скаффолда. Репрезентативные светлопольные изображения (A) MCF10A, (B) MCF10Ca1h, (C) BT-474, (D) сфероидов MDA-MB-468 в монокультуре или в условиях совместного культивирования с микрососудистыми эндотелиальными клетками стромы BJ-5ta/Ea.hy926 или моноцитоподобной клеткой Ea.hy926/THP-1 или клетками BJ-5ta/THP-1 в течение 96 ч. Каждый сфероид был образован путем покрытия 2000 клеток. Сфероиды в монокультурных условиях были сформированы с использованием 2000 эпителиальных клеток. Сфероиды в условиях ко-культивирования были сформированы с использованием 1000 эпителиальных клеток и двух различных типов стромальных клеток по 500 клеток. Формирование почковающихся или агрегированных органоидоподобных структур было инициировано в условиях сфероидной кокультуры через 24 ч после нанесения покрытия в эпителиальных клетках MCF10A, MCF10Ca1h и BT-474. Уплотнение клеток MDA-MB-468 наблюдалось в условиях совместного культивирования сфероидов через 25 ч после осаждения. Масштабные линейки = 100 μм. Сокращение: hpp = часы после нанесения покрытия. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Через 72 ч после нанесения покрытия клетки MCF10A, MCF10Ca1h и BT-474, совместно культивируемые с EA.hy926 и THP-1 или с BJ-5ta и THP-1, продемонстрировали значительное увеличение площади сфероидов по сравнению с монокультуральными эпителиальными сфероидами. MCF10Ca1h также показал значительное увеличение площади сфероида при совместном культивировании с EA.hy926 и BJ-5ta. Появление почковающихся структур у сфероидов с совместным культивированием привело к значительному снижению круглости сфероидов для MCF10A, MCF10Ca1h и BT-474, совместно культивируемых с EA.hy926 и THP-1 или с BJ-5ta и THP-1. Аналогичные эффекты наблюдались при совместном культивировании BT-474 с EA.hy926 и BJ-5ta (рис. 3A, B). Напротив, клетки MDA-MB-468, совместно культивируемые с EA.hy926 и BJ-5ta, EA.hy926 и THP-1 или BJ-5ta и THP-1, показали значительное уменьшение площади сфероидов по сравнению с монокультуральными сфероидами MDA-MB-468; тем не менее, не было никакого влияния на круговость (рис. 3A, B).

Рисунок 3: Графики анализа площади и кругового анализа монокультурных и гетеромногоклеточных стромальных 3D-скаффолдных культур через 72 ч после осаждения. (A) Средняя площадь (см2) и (B) Средняя круговая величина MCF10A, MCF10Ca1h, BT-474 и MDA-MB-468 в монокультуральных и гетеромногоклеточных стромальных сфероидных культурах через 72 ч после осаждения. Представленные данные являются репрезентативными, по крайней мере, для трех независимых биологических реплик и представлены в виде средних технических значений репликации ± SEM, если не указано иное. *, **, *** или **** представляют значения p < 0,05, 0,01, 0,001 или 0,0001 соответственно, если не указано иное. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Применение клеточного трекера к опухолевым эпителиальным клеткам BT-474 и стромальным клеткам до формирования сфероидов показало, что стромальные клетки, включая EA.hy926 и BJ-5ta, образуют почковающиеся структуры по периметру центральных сфероидов BT474 (рис. 4, дополнительное видео S1, дополнительное видео S2, дополнительное видео S3 и дополнительное видео S4). Через 48 ч после нанесения покрытия отдельные широкопольные флуоресцентные изображения сфероидов, совместно культивируемых с фибробластами, показывают, что сфероиды фибробластов колакализовались вместе с эндотелиальными клетками, но не совпадали со сфероидами BT-474. Также было обнаружено, что меньшинство эндотелиальных клеток колонизируется с сфероидами BT-474 в условиях совместного культивирования. Это говорит о том, что расположение стромальных клеток внутри сфероида коррелирует с органоидной морфологией.
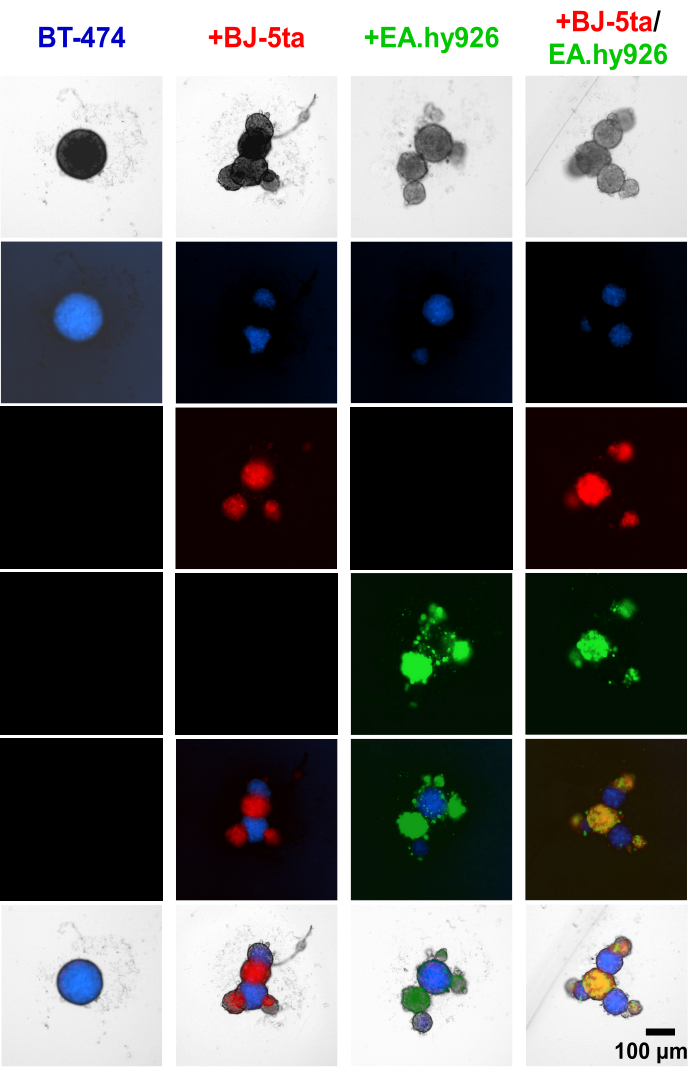
Рисунок 4: Широкопольные флуоресцентные неподвижные изображения дифференциально окрашенных стромальных клеток и клеток BT-474 в гетеромногоклеточных 3D-культурах через 48 ч после осаждения. Сфероиды BT-474 окрашиваются флуоресцентным красителем Blue Cell Tracker. Фибробласты BJ-5ta окрашены оранжевым клеточным трекерным красителем, представленным в красном цвете. Эндотелиальные клетки Ea.hy926 окрашены красителем Dark Red Cell Tracker, представленным в зеленом цвете. Каждый сфероид был образован путем покрытия 2000 клеток. Сфероиды в монокультурных условиях были сформированы с использованием 2000 эпителиальных клеток. Сфероиды в условиях ко-культивирования (BT-474/BJ-5ta, BT-474/Ea.hy926) были сформированы с использованием 1000 эпителиальных клеток и 1000 стромальных клеток. Сфероиды в условиях двойного ко-культивирования (BT-474/BJ-5ta/Ea.hy926) формировали с использованием 1000 эпителиальных клеток и 500 клеток каждого типа стромальных клеток. Рисунки репрезентативны, по крайней мере, для трех биологических репликатов. Масштабная линейка = 100 μм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Для оценки биологической значимости нашей модели сфероида органоида сфероиды были покрыты раствором экстракта базальной мембраны через 24 ч после осаждения. Монокультурные сфероиды BT-474 не проявляли инвазивных свойств через 120 ч после осаждения. Тем не менее, сфероиды BT-474, совместно культивируемые с BJ-5ta или EA.hy926, развили структуры на периферии сфероида, которые вторглись в среду раствора экстракта базальной мембраны каркаса. Количество и длина этих выступов были значительно увеличены у сфероидов BT-474, совместно культивируемых с BJ-5ta и EA.hy926 через 48-120 часов после гальванического покрытия (рис. 5, дополнительное видео S5, дополнительное видео S6, дополнительное видео S7 и дополнительное видео S8).
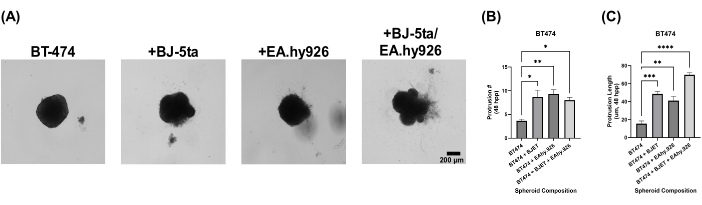
Рисунок 5: Светлопольные неподвижные изображения клеток BT-474 в гетеромногоклеточных 3D-культурах с наложением раствора экстракта базальной мембраны через 5 дней после наложения. Каждый сфероид был образован путем покрытия 2000 клеток. Раствор экстракта базальной мембраны накладывали на сфероиды через 24 ч после гальванического покрытия. Сфероиды в монокультурных условиях были сформированы с использованием 2000 эпителиальных клеток. Сфероиды в условиях ко-культивирования (BT-474/BJ-5ta и BT-474/Ea.hy926) были сформированы с использованием 1000 эпителиальных клеток и 1000 стромальных клеток. Сфероиды в условиях двойного ко-культивирования (BT-474/BJ-5ta/Ea.hy926) формировали с использованием 1000 эпителиальных клеток и 500 клеток каждого типа стромальных клеток. (А) Инвазивные структуры, выступающие из ракового сфероида, встроенного в раствор экстракта базальной мембраны, могут наблюдаться в условиях совместного культивирования. (B) Квалификация количества инвазивных выступов при времени 48 hppp. (C) Квалификация длины инвазивного выступа при времени 48 hppp. Рисунки репрезентативны, по крайней мере, для трех биологических репликатов. Масштабная линейка = 200 мкм. Сокращение: hpp = часы после нанесения покрытия. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Дополнительное видео S1: Монокультуральный сфероид BT-474 с синим красителем для отслеживания клеток. Клетки BT-474 (2000) были ресуспендированы в 96-луночной микропластине с U-образным дном и сверхнизким прикреплением для образования сфероидов. Наложение светлопольных и широкопольных флуоресцентных изображений было получено в течение 48 часов. Сокращение: ULA = сверхнизкое крепление. Пожалуйста, нажмите здесь, чтобы скачать это видео.
Дополнительное видео S2: Сфероиды BT-474 совместно культивируются с фибробластами BJ-5ta. BT-474 (1000) и 1000 фибробластов BJ-5ta ресуспендировали в пластинах ULA с образованием сфероидов. Клетки BT-474 инкубировали с использованием синего красителя для отслеживания клеток, а фибробласты BJ-5ta — с помощью оранжевого красителя для отслеживания клеток. Наложение светлопольных и широкопольных флуоресцентных изображений (синий = BT-474, красный = BJ-5ta) было получено за 48 часов. Сокращение: ULA = сверхнизкое крепление. Пожалуйста, нажмите здесь, чтобы скачать это видео.
Дополнительное видео S3: Сфероиды BT-474 совместно культивируются с эндотелиальными клетками Ea.hy926. BT-474 (1000) и 1000 эндотелиальных клеток Ea.hy926 ресуспендировали в пластинах ULA с образованием сфероидов. Клетки BT-474 инкубировали с синим красителем для отслеживания клеток и эндотелиальными клетками Ea.hy926 с темно-красным красителем. Наложение светлопольных и широкопольных флуоресцентных изображений (синий = BT-474, зеленый = Ea.hy926) было получено за 48 часов. Сокращение: ULA = сверхнизкое крепление. Пожалуйста, нажмите здесь, чтобы скачать это видео.
Дополнительное видео S4: Сфероиды BT-474 совместно культивируются с фибробластами BJ-5ta и эндотелиальными клетками Ea.hy926. BT-474 (1000), 500 фибробластов BJ-5ta и 500 эндотелиальных клеток Ea.hy926 ресуспендировали в пластинах ULA с образованием сфероидов. Клетки BT-474 инкубировали с помощью синего красителя для отслеживания клеток. Фибробласты BJ-5ta и эндотелиальные клетки Ea.hy926 инкубировали с оранжевым красителем Cell Tracker и темно-красным красителем соответственно. Наложение светлых и широкопольных флуоресцентных изображений (синий = BT-474, красный = BJ-5ta, зеленый = Ea.hy926) было получено за 48 часов. Сокращение: ULA = сверхнизкое крепление. Пожалуйста, нажмите здесь, чтобы скачать это видео.
Дополнительное видео S5: Монокультуральный сфероид BT-474 в растворе экстракта базальной мембраны. Клетки BT-474 (2000) ресуспендировали в пластинах ULA с образованием сфероидов, а сфероиды встраивали в раствор базальной мембраны через 24 часа после осаждения. Снимки светлого поля были сделаны в течение 60 часов. Сокращение: ULA = сверхнизкое крепление. Пожалуйста, нажмите здесь, чтобы скачать это видео.
Дополнительное видео S6: Сфероиды BT-474 совместно культивируются с фибробластами BJ-5ta в растворе экстракта базальной мембраны. Фибробласты BT-474 (1000) и 1000 BJ-5ta ресуспендировали в пластинах ULA с образованием сфероидов, а сфероиды встраивали в раствор экстракта базальной мембраны через 24 часа после осаждения. Снимки светлого поля были сделаны в течение 60 часов. Сокращение: ULA = сверхнизкое крепление. Пожалуйста, нажмите здесь, чтобы скачать это видео.
Дополнительное видео S7: Сфероиды BT-474 совместно культивируются с эндотелиальными клетками Ea.hy926 в растворе экстракта базальной мембраны. BT-474 (1000) и 1000 эндотелиальных клеток Ea.hy926 ресуспендировали в планшетах ULA с образованием сфероидов, а сфероиды встраивали в раствор экстракта базальной мембраны через 24 часа после осаждения. Снимки светлого поля были сделаны в течение 60 часов. Сокращение: ULA = сверхнизкое крепление. Пожалуйста, нажмите здесь, чтобы скачать это видео.
Дополнительное видео S8: Сфероиды BT-474 совместно культивируются с фибробластами BJ-5ta и эндотелиальными клетками Ea.hy926 в растворе экстракта базальной мембраны. BT-474 (1000), 500 фибробластов BJ-5ta и 500 эндотелиальных клеток Ea.hy926 ресуспендировали в пластинах ULA с образованием сфероидов, а сфероиды встраивали в раствор экстракта базальной мембраны через 24 ч после осаждения. Снимки Brightfield были сделаны в течение 60 часов. Пожалуйста, нажмите здесь, чтобы загрузить это видео.
Обсуждение
Наша модель гетеро-многоклеточного сфероида демонстрирует, что взаимодействия эпителиально-стромальных клеток стимулируют почкование стромальных клеток в условиях 3D-культивирования без скаффолда и формирование инвазивных структур в условиях 3D-культивирования на основе скаффолдов. Мы наблюдали последовательное формирование почковающей структуры как в опухолевых клеточных линиях (MCF10Ca1h и BT-474), так и в неопухолегенной эпителиальной клеточной линии MCF10A (рис. 2A-C). Интересно, что в то время как сфероиды из клеточных линий MCF10A, MCF10Ca1h и BT-474, будь то в монокультуре или в кокультуре с фибробластами и эндотелиальными клетками, образовывали круглые и компактные почковающиеся структуры в средах, свободных от каркасов, сфероиды из клеточной линии MDA-MB-468 показали меньшее уплотнение (рис. 2D). Это было неожиданно, так как ожидалось, что клетки MDA-MB-468 образуют кольцевые сфероиды, как и другие исследованные эпителиальные клеточные линии. Было обнаружено, что клеточная линия SUM-149, гибридная эпителиально-мезенхимальная клеточная линия первичного рака молочной железы, образует компактные сфероиды, такие как MCF10A, MCF10Ca1h и BT-474 (данные не показаны)28. Будущие исследования должны изучить сигнальные пути, опосредующие образование менее компактных сфероидов в клеточной линии MDA-MB-468, поскольку такие аномалии могут указывать на клеточную уязвимость, которая может быть использована для разработки новых терапевтических стратегий.
Что касается комбинации различных клеточных линий, моноцитоподобные клетки THP-1 индуцируют образование рыхлых агрегатных структур во всех условиях совместного культивирования сфероидов. Меньшее уплотнение наблюдается в почковающихся структурах в условиях совместного культивирования с клетками THP-1/Ea.hy926 по сравнению с таковыми в условиях совместного культивирования с клетками THP-1/BJ-5ta (рис. 2A-D). Таким образом, на уплотнение сфероидов влияет стромальный клеточный состав в модели29,30.
Несогласованное покрытие комбинаций гетеро-клеток может привести к неполному развитию сфероидов или изменчивости размера сфероидов по сравнению с их техническими репликациями. Обеспечение постоянства в нанесении клеток имеет решающее значение, так как пространственное расположение клеток, определяющее фенотип сфероида, и развитие происходит в основном в течение первых 48 ч31. В этот критический период соотношение клеток играет решающую роль, при этом доля стромальных клеток влияет как на сфероидную площадь, так и на круговую форму.
Незакрепленные сфероидальные агрегаты, которые зависят от типа ячейки, могут быть легко разобраны при ручном перемещении. Тем не менее, ручные манипуляции необходимы при наложении сфероидов на шероиды раствором экстракта базальной мембраны, похожем на скаффолд, или при сборе целых образцов сфероидов. Чтобы смягчить эту проблему, рекомендуется работать в более медленном темпе при сборе сфероидов с помощью пипеточной аспирации и по возможности свести к минимуму ручную обработку. Во время наложения раствора экстракта базальной мембраны сфероиды склонны к смещению внутри скважины, часто оседая на краю скважины. Соотношение раствора экстракта базальной мембраны к среде важно для поддержания матричных свойств 3D-системы; Однако сфероиды не могут быть полностью обтянуты из-за вязкости раствора экстракта базальной мембраны, поэтому требуется ручное вмешательство32. Нецентрированное расположение сфероида представляет собой проблему для визуализации, так как преломление света вблизи пластикового края лунки может повлиять на четкость изображения.
Сфероиды, использованные в этом исследовании, состояли из линий раковых клеток человека; Описанные здесь методы еще не применялись к первичным клеточным линиям. Наши результаты свидетельствуют о том, что специфические межклеточные взаимодействия могут приводить к образованию органоидоподобных структур, что указывает на потенциальную применимость этого метода к широкому спектру опухолевых клеточных линий. Однако, в то время как наша модель пытается имитировать сложность опухолевого микроокружения, различные скорости клеточной пролиферации представляют собой проблему длядолгосрочных исследований. Быстро пролиферирующие клетки, как правило, перерастают более медленно пролиферирующие, что делает эту модель менее подходящей для длительных экспериментов. Кроме того, различные требования к типам питательных сред для клеточных линий могут вносить дополнительные факторы, которые могут привести к фенотипам сфероидов. Большинство клеточных линий в этом исследовании были выращены в среде DMEM. Исследования с клеточными линиями, выращенными в различных средах, могут потребовать различных условий культивирования, тестирования различных соотношений сред; Тем не менее, этот эффект наблюдается при длительных экспериментах30.
Наша модель имеет ряд преимуществ по сравнению с другими 3D-моделями рака. Полученные нами сфероиды имеют однородную и воспроизводимую исходную морфологию и размер, что облегчает сравнение результатов лечения с контрольной группой. Напротив, некоторые модели с использованием одиночных клеток, подвешенных в средах или скаффолдах, могут привести к переменному пространственному распределению клеток, что приведет к несогласованности. Эта модель демонстрирует, что взаимодействия между отдельными клеточными популяциями могут быть эффективно изучены.
Традиционно органоидные и сфероидные модели состояли из монокультурных раковых клеток или кокультур раковых клеток для исследования градиентов питательных веществ, гипоксии или клеточного расположения34. Кроме того, эта модель может быть изучена в каркасной среде в течение 24 часов после нанесения покрытия, что дает возможность исследовать ранние события инвазии, вызванные различными межклеточными взаимодействиями. В то время как альтернативные подходы к 3D-раку используют различные компоненты матрицы скаффолда для изучения изменений морфологии сфероида и инвазивности, эта модель дополняет их, позволяя исследовать эти изменения в контексте как динамики клеточной популяции, таки состава скаффолда.
Большинство сфероидов, полученных с использованием наших методов, сохраняют свою структурную целостность после ручной обработки, что позволяет собирать образцы на последующих этапах производства. Обычные генетические модификации, такие как CRISPR-Cas9, лентивирусная трансдукция шРНК и интерференция миРНК, могут быть введены до образования сфероидов. Сложное поведение, наблюдаемое у этих сфероидов, предполагает динамические изменения в экспрессии генов, которые могут быть дополнительно исследованы с помощью РНК-секвенирования. Передовые методы, такие как CycIF, scRNA-seq, CosMx и Visium, также могут быть использованы для изучения геномики и протеомики на пространственном или одноклеточном уровнях. Эта сфероидальная модель обладает потенциалом для имитации in vivo исследований таргетной терапии опухолей путем улавливания взаимодействий между почками стромальных клеток и терапевтическими агентами до того, как они достигнут раковых клеток. Это важно, потому что это может помочь определить, влияют ли стромальные клетки на активность препарата, потенциально защищая раковые клетки от терапевтических эффектов.
Раскрытие информации
У авторов нет конфликта интересов, о котором можно было бы заявить.
Благодарности
Мы благодарим сотрудников Лаборатории онкогена развития Университета Бэйлора за их полезные замечания и отзывы во время подготовки этой рукописи. Финансовая поддержка была предоставлена Факультетом биологии Университета Бэйлора и Колледжем искусств и наук, NIH-NIGMS 2SC1GM121182 (J.A.K.).
Материалы
| Name | Company | Catalog Number | Comments |
| 15 mL Polypropylene Centrifuge Tubes | Falcon | 14-959-53A | |
| 96-Well, Treated, U-Shaped-Bottom Microplate | Thermo Scientific | 12566432 | |
| 100 mm Dish Cell Culture Treated Surface | Thermo Scientific | 130182 | |
| 170 L CO2 Incubators | VWR | VWR51014991(10810902) | |
| 200 Self-Sealing Barrier Pipet Tips | Fisher Scientific | 02-682-255 | |
| 500 mL DMEM/Hams F-12, [+] L-glutamine | Corning | 10-090-CV | |
| 1000 Self-Sealing Barrier Pipet Tips | Molecular Biology Products Inc. | 2179HR | |
| Animal-Free Recombinant Human EGF | PeproTech | AF-100-15 | |
| Automated Pipette Repeater E3x | Eppendorf | 4987000410 | |
| Basement membrane solution | Huntsman Cancer Institute | https://healthcare.utah.edu/huntsmancancerinstitute/ | |
| Bead Bath | Lab Armor | 74300706 | |
| Biorender | Biorender | Biorender.com | |
| Biosafety Laminar Flow Cabinets | Thermo Scientific | 300590389 | |
| BioSpa 8 Automated Incubator | Agilent | 23082120 | |
| Cell Counter | Invitrogen | AMQAF2000 | |
| Cell Counting Chamber Slides | Thermo Scientific | C10283 | |
| CellTracker Deep Red | Thermo Fisher Scientific | C34565 | |
| Centrifuge | Thermo Scientific | 13100675 | |
| Cholera Toxin B subunit | Sigma-Aldrich | C9903-1MG | |
| Combitips advanced, Sterile, 5.0 mL | Fisher Scientific | 13-683-714 | |
| Cytation 10 Reader Imager | Agilent | 2105245 | |
| Defined Trypsin Inhibitor | Gibco | R007100 | soybean trypsin inhibitor in 1x PBS |
| Donor Horse Serum, 500 mL, United States Origin | Corning | 35-030-CV | |
| Dulbecco's Modified Eagle's Medium | Corning | 10-013-CV | |
| Excel Sofware | Microsoft office 365 | https://www.microsoft.com/en-us/microsoft-365/excel | |
| Fetal Bovine Serum | Thermo Scientific | 26140079 | |
| Fetal Bovine Serum, qualified, US origin | Thermo Scientific | 26140079 | |
| Gentamicin Sulfate, Liquid | Corning | 30-005-CR | |
| GraphPad Prism | |||
| Hydrocortisone solution,50 µM, sterile-filtered, BioXtra | Sigma-Aldrich | H6909-10ML | |
| Image J Software | Fiji | https://imagej.net/ij/ | |
| Insulin solution human | Sigma-Aldrich | I9278-5ML | |
| Magnifying Glass | Fisher Scientific | 01-182-392 | |
| Microcentrifuge Tube | Costar | 3621 | |
| Microscope | Olympus | CKX53SF | |
| Mini Lightbox | Fisher Scientific | 361044708 | |
| Molecular Probes CellTracker Blue CMAC Dye | Fisher Scientific | C2110 | |
| Molecular Probes CellTracker Orange CMRA Dye | Fisher Scientific | C34551 | |
| Penicillin-Streptomycin Solution | Cytiva | SV30010 | |
| Penicillin-Streptomycin Solution | Cytiva | SV30010 | |
| Phase-Contrast Microscope | Echo | RVSF1000 | |
| Phosphate Buffered Saline | Fisher Scientific | SH3025601 | |
| Pipet Controller | Corning | 4099 | |
| Pipette 100 – 1,000 µL | Eppendorf | 3123000063 | |
| Pipette 20 – 200 µL | Eppendorf | 3123000055 | |
| Prism | GraphPad Software | https://www.graphpad.com/features | |
| RPMI 1640 with L-glutamine and 25 mM HEPES | Corning | 10-041-CV | |
| Serological Pipette, 10 mL | Thermo Scientific | 170356N | |
| Serological Pipette, 25 mL | Thermo Scientific | 170357N | |
| Serological Pipette, 5 mL | Thermo Scientific | 170355N | |
| Trypan Blue Solution, 0.4% | Corning | 25900CI | |
| Trypsin-EDTA, 0.25% | Corning | 25053CI |
Ссылки
- de Visser, K. E., Joyce, J. A. The evolving tumor microenvironment: From cancer initiation to metastatic outgrowth. Cancer Cell. 41 (3), 374-403 (2023).
- Hanahan, D., Weinberg, R. A. Hallmarks of cancer: The next generation. Cell. 144 (5), 646-674 (2011).
- Anderson, N. M., Simon, M. C. The tumor microenvironment. Curr Biol. 30 (16), R921-R925 (2020).
- Baghban, R., et al. Tumor microenvironment complexity and therapeutic implications at a glance. Cell Commun Signal. 18 (1), 59 (2020).
- Sahai, E., et al. A framework for advancing our understanding of cancer-associated fibroblasts. Nat Rev Cancer. 20 (3), 174-186 (2020).
- Erdogan, B., Webb, D. J. Cancer-associated fibroblasts modulate growth factor signaling and extracellular matrix remodeling to regulate tumor metastasis. Biochem Soc Trans. 45 (1), 229-236 (2017).
- Iozzo, R. V., Sanderson, R. D. Proteoglycans in cancer biology, tumour microenvironment and angiogenesis. J Cell Mol Med. 15 (5), 1013-1031 (2011).
- Amersfoort, J., Eelen, G. Immunomodulation by endothelial cells - partnering up with the immune system. Nat Rev Immunol. 22 (9), 576-588 (2022).
- Balani, S., Nguyen, L. V., Eaves, C. J. Modeling the process of human tumorigenesis. Nat Commun. 8 (1), 15422 (2017).
- Drost, J., Clevers, H. Organoids in cancer research. Nat Rev Cancer. 18 (7), 407-418 (2018).
- Wang, E., Xiang, K., Zhang, Y., Wang, X. -. F. Patient-derived organoids (PDOs) and PDO-derived xenografts (PDOXs): New opportunities in establishing faithful pre-clinical cancer models. J Natl Cancer Cent. 2 (4), 263-276 (2022).
- Kamb, A. What's wrong with our cancer models. Nat Rev Drug Discov. 4 (2), 161-165 (2005).
- Tuveson, D., Clevers, H. Cancer modeling meets human organoid technology. Science. 364 (6444), 952-955 (2019).
- Zitvogel, L., Pitt, J. M., Daillère, R., Smyth, M. J. Mouse models in oncoimmunology. Nat Rev Cancer. 16 (12), 759-773 (2016).
- Liu, Y., et al. Patient-derived xenograft models in cancer therapy: technologies and applications. Signal Transduct Target Ther. 8 (1), 160 (2023).
- Ben-David, U., et al. Patient-derived xenografts undergo mouse-specific tumor evolution. Nat Genet. 49 (11), 1567-1575 (2017).
- Byrne, A. T., et al. Interrogating open issues in cancer precision medicine with patient-derived xenografts. Nat Rev Cancer. 17 (4), 254-268 (2017).
- Ivanics, T., et al. Patient-derived xenograft cryopreservation and reanimation outcomes are dependent on cryoprotectant type. Lab Invest. 98 (7), 947-956 (2018).
- Biju, T. S., Priya, V. V., Francis, A. P. Role of three-dimensional cell culture in therapeutics and diagnostics: an updated review. Drug Deliv and Transl Res. 13 (9), 2239-2253 (2023).
- Urzì, O., et al. Three-dimensional cell cultures: The bridge between in vitro and in vivo models. Int J Mol Sci. 24 (15), 12046 (2023).
- Cacciamali, A., Villa, R., Dotti, S. 3D cell cultures: Evolution of an ancient tool for new applications. Front Physiol. 13, 836480 (2022).
- Abuwatfa, W. H., Pitt, W. G. Scaffold-based 3D cell culture models in cancer research. J Biomed Sci. 31 (1), 7 (2024).
- Yakavets, I., et al. Advanced co-culture 3D breast cancer model for investigation of fibrosis induced by external stimuli: optimization study. Sci Rep. 10 (1), 21273 (2020).
- Mohammadrezaei, D., et al. Predicting and elucidating the post-printing behavior of 3D printed cancer cells in hydrogel structures by integrating in-vitro and in-silico experiments. Sci Rep. 13 (1), 1211 (2023).
- Kuen, J., Darowski, D., Kluge, T., Majety, M. Pancreatic cancer cell/fibroblast co-culture induces M2 like macrophages that influence therapeutic response in a 3D model. PLOS ONE. 12 (7), e0182039 (2017).
- Bray, F., et al. Global cancer statistics 2022: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin. 74 (3), 229-263 (2024).
- Kennecke, H., et al. Metastatic behavior of breast cancer subtypes. J Clin Oncol. 28 (20), 3271-3277 (2010).
- Neve, R. M., et al. A collection of breast cancer cell lines for the study of functionally distinct cancer subtypes. Cancer Cell. 10 (6), 515-527 (2006).
- Pingitore, P., et al. Human multilineage 3D spheroids as a model of liver steatosis and fibrosis. Int J Mol Sci. 20 (7), 1629 (2019).
- Bar-Ephraim, Y. E., Kretzschmar, K. Organoids in immunological research. Nat Rev Immunol. 20 (5), 279-293 (2020).
- Beerkens, A. P. M., et al. Characterizing OXPHOS inhibitor-mediated alleviation of hypoxia using high-throughput live cell-imaging. Cancer Metab. 12 (1), 13 (2024).
- Feaster, T. K., et al. Matrigel mattress. Cir Res. 117 (12), 995-1000 (2015).
- Huang, Z., Yu, P., Tang, J. Characterization of triple-negative breast cancer MDA-MB-231 cell spheroid model. Onco Targets Ther. 13, 5395-5405 (2020).
- Nam, S., Khawar, I. A., Park, J. K., Chang, S., Kuh, H. -. J. Cellular context-dependent interaction between cancer and stellate cells in hetero-type multicellular spheroids of pancreatic tumor. Biochem Biophys Res Commun. 515 (1), 183-189 (2019).
- Monteiro, M. V., Gaspar, V. M., Ferreira, L. P. Hydrogel 3D in vitro tumor models for screening cell aggregation mediated drug response. Biomater Sci. 8 (7), 1855-1864 (2020).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены