Method Article
Heteromultizelluläre Stromazellen in gerüstfreien 3D-Kulturen von Epithelkarzinomzellen treiben die Invasion voran
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Es besteht ein dringender Bedarf an 3D-Krebsmodellen, die heterozelluläre Wechselwirkungen erfassen, um Krebsmetastasen zu untersuchen. Unsere Studie stellt die Erzeugung von heteromultizellulären Stroma-Epithel-Epithelen in einer gerüstfreien und gerüstfreien Umgebung vor, die zur Untersuchung der Invasion und der zellulären räumlichen Verteilungen verwendet werden kann.
Zusammenfassung
Brustkrebs ist die zweithäufigste krebsbedingte Todesursache bei Frauen in den USA. Es hat sich gezeigt, dass Organoid-Modelle solider Tumoren Aspekte des Fortschreitens von Krebs wie Proliferation und Invasion getreu rekapitulieren. Obwohl patienteneigene Organoide und patienteneigene Xenotransplantat-Organoide pathophysiologisch relevant sind, sind sie kostspielig in der Vermehrung, schwer zu manipulieren und bestehen hauptsächlich aus den proliferativsten Zelltypen in der Tumormikroumgebung (TME). Diese Einschränkungen verhindern ihre Verwendung zur Aufklärung zellulärer Mechanismen des Krankheitsverlaufs, die von tumorassoziierten Stromazellen abhängen, die in der TME vorkommen und von denen bekannt ist, dass sie zur Metastasierung und Therapieresistenz beitragen.
Hier berichten wir über Methoden zur Kultivierung von epithelial-stromalen mehrzelligen 3D-Kulturen. Zu den Vorteilen dieser Methoden gehört ein kostengünstiges System zur schnellen Erzeugung organoidähnlicher 3D-Kulturen in gerüstfreien Umgebungen, die zur Verfolgung der Invasion mit Einzelzellauflösung in Hydrogelgerüsten verwendet werden können. Konkret zeigen wir, wie diese heteromultizellulären 3D-Kulturen mit BT-474-Brustkrebszellen in Kombination mit Fibroblasten (BJ-5ta), monozytenähnlichen Zellen (THP-1) und/oder Endothelzellen (EA.hy926) erzeugt werden können. Darüber hinaus ermöglicht die differentielle Fluoreszenzmarkierung von Zellpopulationen die Zeitraffermikroskopie, um die Assemblierung und Invasionsdynamik von 3D-Kulturen zu definieren.
Insbesondere reduziert die Zugabe von zwei beliebigen Stromazellkombinationen zu 3D-Kulturen von BT-474-Zellen signifikant die Zirkularität der 3D-Kulturen, was mit dem Vorhandensein von organoidähnlichen oder sekundären Sphäroidstrukturen übereinstimmt. In Tracker-Farbstoffexperimenten kolokalisieren Fibroblasten und Endothelzellen in den peripheren organoidartigen Ausstülpungen und sind räumlich vom primären BT-474-Sphäroid getrennt. Schließlich haben heteromultizelluläre 3D-Kulturen von BT-474-Zellen eine erhöhte Hydrogel-Invasionskapazität. Da wir diese protrusiven Strukturen in heteromultizellulären 3D-Kulturen sowohl von nicht-tumorigenen als auch von tumorigenen Brustepithelzellen beobachtet haben, bietet diese Arbeit eine effiziente und reproduzierbare Methode zur Generierung organoidähnlicher 3D-Kulturen in einer gerüstfreien Umgebung für die anschließende Analyse von Phänotypen, die mit der Progression solider Tumore assoziiert sind.
Einleitung
Es ist inzwischen bekannt, dass das Fortschreiten der Krebserkrankung von zwei Hauptfaktoren abhängt: den genetischen/epigenetischen Veränderungen in den Tumorzellen und einer Vielzahl von Wechselwirkungen mit Nicht-Tumorzellen in der Tumormikroumgebung (TME)1. Während genetische Veränderungen in Zellen als notwendig für die Tumorentstehung anerkannt sind, reichen solche Veränderungen allein für die Tumorprogression und Metastasierung nicht aus2. Komponenten der TME, die ursprünglich als stille Zuschauer galten, sind heute dafür bekannt, das Fortschreiten der Krebserkrankung durch gegenseitige und dynamische Wechselwirkung mit Tumorzellen aktiv zu fördern3. Die TME-Zusammensetzung unterscheidet sich je nach Gewebe, aus dem der Tumor stammt, dem Tumorstadium und den Patientenmerkmalen, aber zu den charakteristischen Merkmalen gehören Stromakarzinom-assoziierte Fibroblasten (CAFs), extrazelluläre Matrix (ECM), vaskuläre Endothelzellen sowie adaptive und myeloische Immunzellen 1,4.
Stromale CAFs in der TME setzen sich aus Fibroblasten-Subtypen unterschiedlicher Herkunft und Funktionzusammen 5. Solche CAFs sind Schlüsselkomponenten der TME, da sie an mehreren Schnittstellen mit Tumorzellen interagieren. CAFs sezernieren EZM-Proteine, die die Steifigkeit der Matrix verändern, was entweder die Wirkstoffabgabe durch übermäßige Ablagerung von Kollagen, Proteoglykanen und Fibronektin einschränken oder es Tumorzellen ermöglichen kann, über die Sekretion von EZM-abbauenden Matrix-Metalloproteinasen (MMPs) von der primären Tumorstelle einzudringen6,7. Darüber hinaus fördern CAFs das Tumorwachstum, die Migration und die Vaskularisierung durch die Sekretion einer Vielzahl von Wachstumsfaktoren, Zytokinen und angiogenen Faktoren wie dem epidermalen Wachstumsfaktor (EGF), dem transformierenden Wachstumsfaktor β (TGF-β) bzw. dem vaskulären endothelialen Wachstumsfaktor (VEGF) 1,6. Parallel dazu fördern Endothelzellen, ausgelöst durch die hypoxische TME, auch die Vaskularisierung von Tumoren und unterdrücken die Immunzellfunktionen über die erhöhte Sekretion von angiogenen Faktoren und eine verminderte Sekretion von Leukozytenadhäsionsmolekülen 1,8.
Angesichts der scheinbar komplizierten Komplexität des Fortschreitens von Krebs ist es unerlässlich geworden, TME-Stromakomponenten in die Krebsgrundlagenforschung einzubeziehen. Die Etablierung von Modellen, die die bekannte Tumorpathophysiologie getreu rekapitulieren, ist jedoch nach wie vor ein erheblicher ungedeckter Bedarf 9,10. Während herkömmliche zweidimensionale (2D) Zellkulturmodelle einfach zu handhaben, schnell kultivierbar und hochgradig reproduzierbar sind, bestehen sie nur aus schnell proliferierenden Krebszellklonen und spiegeln nicht die zelluläre Heterogenität wider, die in Tumoren gefunden wird 10,11,12. In ähnlicher Weise erfassen transgene Mausmodelle auch nicht die menschliche Tumorbiologie aufgrund der geringen genetischen Heterogenität durch Inzucht, signifikanter Unterschiede im Immunsystem und der histologischen Komplexität13,14. Aufgrund dieser Einschränkungen lassen sich Therapeutika, die aus klassischen Krebsmodellen entwickelt wurden, oft nicht in das klinische Umfeld übertragen.
Patienteneigene Krebsmodelle wie patienteneigene Xenotransplantate und patienteneigene Organoide können die Nachteile herkömmlicher Krebsmodelle beheben, indem sie in-situ die molekularen Merkmale des Tumors, den genetischen Hintergrund und die zelluläre Organisation erfassen 10,11,15. Solche patienteneigenen Xenotransplantate und Organoide erfordern jedoch komplizierte Transplantationsverfahren und eine lange Kultivierungszeit16,17. In Kombination mit der Variation der Tumorentnahme- und Probenahmestellen und der geringen Effizienz bei der Kryokonservierung besteht die Notwendigkeit, Modelle zu entwickeln, die als Brücke zwischen klassischen 2D-Zellkulturen und patienteneigenen Krebsmodellen fungieren11,18. In dieser Hinsicht können 3D-Modelle von Zellkulturen als Modelle dienen, die schnell kultiviert werden können und wichtige In-vivo-Tumormerkmale wie Zell-Zell-Interaktion, Zell-EZM-Interaktion, Hypoxie, Angiogenese und die Produktion von EZM erfassen19,20.
3D-Zellkulturmodelle werden in gerüstfreie und gerüstbasierte Modellsysteme eingeteilt. In gerüstfreien Systemen werden die Zellen dazu gebracht, sich selbst in eine kugelförmige Form zu aggregieren, indem spezifische Zellkulturplatten mit geringer Bindung verwendet werden oder die physikalischen Parameter von Kultivierungsmethoden manipuliert werden. Etablierte Methoden zur Gewinnung von gerüstfreien 3D-Sphäroiden reichen von einfachen Zellpelletkulturen durch Zentrifugation über hängende Mikroplattentropfen, Magnetschwebetechnik bis hin zu dynamischen Bioreaktor- und Mikrofluidiksystemen20,21. Gerüstbasierte 3D-Zellkulturen werden durch Zugabe von polymer- oder hydrogelbasierten Gerüsten etabliert, um die physiologische extrazelluläre Matrix zu imitieren19,22. Solche Modelle bergen ein immenses Potenzial für die Modellierung der zellulären Organisation, Topologie, Matrixbindung, Migration und Wirkstoffreaktion in vivo.
Neben der Gerüstmanipulation für EZM-Zusammensetzungsmodelle in Krankheitszuständen können 3D-Zellkulturen auch zur Modellierung heterogener zellulärer Populationen in einer TME verwendet werden. 3D-Zellkulturen, die aus Krebszellen und stromalen Fibroblasten oder Endothelzellen bestehen, wurden verwendet, um die Interaktion von Krebs und einzelnen Nicht-Tumorzelllinien zu untersuchen 23,24,25. Reproduzierbare und kostengünstige Methoden zur Erweiterung solcher 3D-Zellkulturen, die aus mehreren heterogenen Zelllinien bestehen, würden den Forschern helfen, das Fortschreiten des Tumors aufzuklären. Hier berichten wir über Methoden zur Kultivierung von epithelial-stromalen mehrzelligen 3D-Kulturen, um Proliferation, Invasion und Plastizität des Zellzustands zu untersuchen. Das Protokoll beschreibt gerüstfreie und Basalmembranextrakt-basierte 3D-Kulturen von Brustkrebszellen, die mit einer Kombination von Stromazellen kokultiviert wurden, die von Fibroblasten (BJ-5ta), Endothelzellen (Ea.hy926) und monozytenähnlichen Zellen (THP-1) reichen. Brustkrebs ist derzeit die zweithäufigste Krebserkrankung weltweit und in den USA die am häufigsten diagnostizierte Krebserkrankung bei Frauen26. Die Sterblichkeit durch Brustkrebs ist weitgehend auf die metastasierende und therapieresistente Natur der Erkrankung zurückzuführen, da die allgemeine und metastasenfreie Überlebensrate bei Patientinnen, bei denen aggressive HER2-angereicherte und basale Brustkrebs-Subtypen diagnostiziert wurden, signifikant reduziert ist27. Die von uns beschriebenen 3D-Zellkulturprotokolle können bei der Entwicklung kostengünstiger, schneller und reproduzierbarer Kultivierungsmethoden hilfreich sein, die mit formalinfixierten, in Paraffin eingebetteten Gewebekonservierungsmethoden und nachfolgenden Anwendungen in der räumlichen Biologie kombiniert werden können.
Protokoll
1. Zellkulturmedium
HINWEIS: Bereiten Sie alle Medien in einer Biosicherheitswerkbank vor.
- Zur Vorbereitung von Zellkulturmedium für BJ-5ta, BT474, EA.hy926 und MDA-MB-468 ergänzen Sie mit einer Pipette 500 ml Dulbecco's Modified Eagle Medium (DMEM) mit hoher Glukose mit 10 % hitzeinaktiviertem fötalem Rinderserum (FBS) und 1 % Penicillin-Streptomycin. 0,1 % Gentamicin mit einer Mikropipette einarbeiten.
- Zur Vorbereitung des Zellkulturmediums für MCF10A sind 500 ml DMEM/F12 mit 5 % Pferdeserum und 1 % Penicillin-Streptomycin mit einer Pipette zu ergänzen. Integrieren Sie 0,1 % Gentamicin, 1 ml 1 μg/ml Hydrocortison, 500 μl 10 μg/ml Insulin, 50 μl 100 ng/ml Choleratoxin und 10 μl 20 ng/ml epidermalen Wachstumsfaktor mit einer Mikropipette.
- Zur Vorbereitung des Zellkulturmediums für MCF10Ca1h sind 500 ml DMEM/F12 mit 5 % Pferdeserum und 1 % Penicillin-Streptomycin mit einer Pipette zu ergänzen. 0,1 % Gentamicin mit einer Mikropipette einarbeiten.
- Zur Vorbereitung von Zellkulturmedium für THP-1 sind 500 ml RPMI 1640 mit 10 % FBS und 1 % Penicillin-Streptomycin mit einer Pipette zu ergänzen. 0,1 % Gentamicin mit einer Mikropipette einarbeiten.
- Wechseln Sie das Zellkulturmedium alle 2-3 Tage für BJ-5ta, BT474, EA.hy926, MDA-MB-468, MCF10A und MCF10Ca1h, bis die Zellen eine Konfluenz von 70-80 % erreichen, indem Sie ihr Wachstum täglich mit einem Hellfeldmikroskop beurteilen. Wechseln Sie das Zellkulturmedium für THP-1-Zellen einmal pro Woche.
- Züchten Sie BJ-5ta-, BT474-, EA.hy926-, MDA-MB-468-, MCF10A- und MCF10Ca1h-Zellen in 100-mm-Schalen mit zellkulturbehandelten Oberflächen in Standard-Zellkultur-Inkubatoren mit 5 % CO2.
- Züchten Sie THP-1-Zellen in T75-Zellkultur-behandelten Kolben in Standard-Zellkultur-Inkubatoren mit 5 % CO2.
2. Entnahme von Zellen
- Schalten Sie das UV-Licht ein, um das Innere der Biosicherheitswerkbank 15 Minuten lang zu desinfizieren.
- Öffnen Sie den Fensterflügel der Biosicherheitswerkbank, um den Luftstrom zu stabilisieren, und schalten Sie das Vakuumabsaugsystem ein.
- Reinigen Sie die Oberfläche der Innenhaube und die Schläuche des Vakuumabsaugsystems mit 70 % Ethanol.
- Bereiten Sie frisches serumfreies Zellkulturmedium in der Biosicherheitswerkbank vor: Ergänzen Sie 500 ml Dulbecco's modifiziertes Eagle's Medium (DMEM) mit hohem Glukosegehalt mit 1 % Penicillin/Streptomycin mit einer Pipette. Integrieren Sie 0,1% Gentamicin mit einer Mikropipette.
- Erwärmen Sie das Zellkulturmedium, die phosphatgepufferte Kochsalzlösung (PBS) und Trypsin-EDTA (0,25 %) auf 37 °C, indem Sie die Gegenstände vor Beginn des Experiments in ein Bead-Bad legen.
- Stellen Sie sicher, dass die Zellen zu 70-80 % konfluent sind, indem Sie sie durch ein Mikroskop visuell untersuchen.
- Aspirieren und verwerfen Sie das Kulturmedium mit dem Vakuumaspirator aus den plattierten Zellen. Waschen Sie das restliche Medium einmal mit 2 mL PBS mit einer Pipette, aspirieren und verwerfen Sie dann das PBS mit dem Vakuumsauger.
HINWEIS: THP-1-Zellen werden in Suspension gezüchtet; Die Schritte 2.7-2.9 können entfallen. - Geben Sie mit einer Mikropipette 1 ml Trypsin in die Zellkulturschale und stellen Sie die Platte 5 Minuten lang bei 37 °C in einen 5 %CO 2 -Inkubator.
- Inaktivieren Sie das Trypsin, indem Sie 1 ml des Sojabohnen-Trypsin-Inhibitors (in 1x PBS) mit einer Mikropipette auf die Platte geben. Dispergieren Sie Zellcluster, indem Sie die flüssige Mischung mit einer P1000-Mikropipette pipettieren und die Zellsuspension vom Boden der Platte auffangen. Die Zellsuspension mit einer Mikropipette in ein konisches 15-ml-Röhrchen überführen und 5 Minuten lang bei Raumtemperatur bei 100 × g zentrifugieren. Entsorgen Sie den Überstand mit dem Vakuumsauger.
- Fahren Sie mit der Zellzählung fort.
3. Herstellung der Arbeitsfärbelösung und der Färbezellen in Suspension
- Lassen Sie das Produkt vor dem Öffnen des Fläschchens mit den molekularen Fluoreszenzsonden des Zelltrackers (siehe Materialtabelle) in einem auf 37 °C eingestellten Bead-Bad 15 Minuten lang auf Raumtemperatur erwärmen.
- Lösen Sie den lyophilisierten Zelltracker-Blue-Farbstoff (Masse = 5 mg, Molekulargewicht = 209,6 g/mol) mit einer Mikropipette auf eine Endkonzentration von 10 mM mit 2,385 mL DMSO auf.
- Lösen Sie den lyophilisierten Zelltracker-Orangenfarbstoff (Masse = 50 μg, Molekulargewicht = 550,4 g/mol) mit einer Mikropipette auf eine Endkonzentration von 10 mM mit 9,084 μl DMSO auf.
- Lösen Sie den gefriergetrockneten Zelltracker tiefroter Farbstoff (Masse = 15 μg, Molekulargewicht = 698,3 g/mol) mit einer Mikropipette auf eine Endkonzentration von 1 mM mit 20 μl DMSO auf.
- Bereiten Sie die Arbeitszellentracker-Blaufarbstoffmedienlösung (5 μM) vor, indem Sie 1 μl des Farbstoffs in 2 ml serumfreiem DMEM-Medium mit einer Mikropipette verdünnen.
- Bereiten Sie die Arbeitszellentracker-Lösung für orangefarbene Farbstoffmedien (5 μM) vor, indem Sie 1 μl des Farbstoffs in 2 mL serumfreiem DMEM-Medium mit einer Mikropipette verdünnen.
- Bereiten Sie die tiefrote Farbstoffmedienlösung (1 μM) des Arbeitszelltrackers vor, indem Sie 2 μl des Farbstoffs in 2 mL serumfreiem DMEM-Medium mit einer Mikropipette verdünnen.
- Resuspendieren Sie die Epithelzellen, BJ-5ta-Fibroblasten und Ea.hy926-Endothelzellen in den vorbereiteten blauen, orangefarbenen und tiefroten Farbstoffmedienlösungen (2 ml) mit einer Mikropipette.
- Inkubieren Sie die Röhrchen bei 37 °C im 5% CO2 -Inkubator für 30 min.
- Nach 30 min Inkubation zentrifugieren Sie die Röhrchen bei 100 x g für 5 min bei Raumtemperatur.
- Aspirieren und verwerfen Sie den Überstand mit dem Vakuumsauger und resuspendieren Sie das Pellet gründlich in 1 mL 10 % FBS-serumhaltigem DMEM-Medium mit einer Mikropipette.
- Fahren Sie mit der Zellzählung fort.
4. Zellzählung
- Sammeln Sie 10 μl der Zellsuspension und geben Sie sie mit einer Mikropipette in ein Mikroröhrchen.
- Mit 10 μl Trypanblau mischen und gründlich pipettieren.
- Übertragen Sie 20 μl der Zell-Trypan-Lösung mit einer Mikropipette auf einen Objektträger der Zellzählkammer. Fügen Sie die Zellen ein und zählen Sie sie mit einem automatisierten Zellzähler.
- Berechnen Sie die durchschnittliche Gesamtzahl lebender Zellen aus zwei Messungen.
5. Berechnungen
- Bereiten Sie für jeden Zelltyp Arbeitszellbestände in einer Konzentration von 6,67 × 103 Zellen/ml entsprechend 2.000 Zellen/300 μl vor.
HINWEIS: Das Gesamtbestandsvolumen hängt von der experimentellen Stichprobengröße ab. - Bei Monokultur-Sphäroiden ist darauf zu achten, dass jede unabhängige Probe aus 300 μl des Arbeitsbestands der Epithelzellen besteht, was 2.000 Epithelzellen entspricht.
- Bei Co-Kultur-Sphäroiden (zwei Zelltypen) ist sicherzustellen, dass jede unabhängige Probe aus 150 μl Arbeitsmaterial aus Epithelzellen und 150 μl Arbeitsmaterial aus Stromazellen besteht. Die Probe wird 1.000 Epithelzellen und 1.000 Stromazellen enthalten.
- Bei Co-Kultur-Sphäroiden (drei Zelltypen) stellen Sie sicher, dass jede unabhängige Probe aus 150 μl Arbeitsmaterial aus Epithelzellen, 75 μl Arbeitsmaterial aus Stromazelle #1 und 75 μl Arbeitsmaterial aus Stromazelle #2 besteht. Die Probe wird 1.000 Epithelzellen, 500 Stromazellen des Arbeitsbestands #1 und 500 Stromazellen des Arbeitsbestands #2 enthalten.
6. Plattieren
- Übertragen Sie das erforderliche Volumen mit einer Mikropipette für drei technische Replikate plus eine zusätzliche in ein Mikroröhrchen. Mischen Sie gründlich mit einer Pipette und geben Sie dann 300 μl der Probe in eine Vertiefung einer 96-Well-Mikroplatte mit U-förmigem Boden und ultraniedriger Befestigung.
- Wiederholen Sie den Vorgang für jede weitere technische Wiederholung.
- Stellen Sie die 96-Well-Platte in einen Inkubator bei 37 °C.
7. Hellfeld-Bildgebung
- Beobachten Sie das Wachstum und die Morphologie der Sphäroide alle 24 bis 96 Stunden mit einem Mikroskop.
- Abbildung von Sphäroiden mit einem Phasenkontrastmikroskop.
8. Aufbau eines Weitfeld-Bildgebungsprotokolls für Sphäroide, die mit Tracker-Farbstoffen gefärbt wurden, und Sphäroide, die mit Basalmembranextrakt überlagert sind
- Schalten Sie die Imaging- und automatisierten Inkubatorgeräte ein, die in der Materialtabelle aufgeführt sind, und erstellen Sie ein neues Imaging-Protokoll im Task-Manager der Imaging-Software. Legen Sie auf der Registerkarte Verfahren den Sollwert für die Temperatur des automatischen Inkubators auf 37 °C fest und lassen Sie den Inkubator CO2 % und die Temperatur ausgleichen, bevor Sie mit dem nächsten Schritt fortfahren.
HINWEIS: Ein alternativer Fluoreszenz-Imager kann verwendet werden, wenn er über die entsprechenden Filter für jeden der verwendeten Farbstoffe (Blau, Tiefrot und Orange) verfügt. - Stellen Sie die Bildeinstellungen auf die folgenden Spezifikationen ein: Vergrößerung: 4X PL FL Phase, Sichtfeld: 3185 x 3185 μm, Full WFOV.
- Für die Kanäle sind folgende Spezifikationen zu verwenden: DAPI: 377/447 nm, Beleuchtung = 10, Integrationszeit = 107 ms, Gain = 10, RFP: 531/593 nm, Beleuchtung = 10, Integrationszeit = 137 ms, Gain = 10, CY5: 628/685 nm, Beleuchtung = 10, Integrationszeit = 137 ms, Gain = 10.
- Für die Abbildung von Sphäroiden in einem Basalmembran-Extrakt-Lösungs-Overlay verwenden Sie die folgenden Hellfeldspezifikationen: Beleuchtung = 10, Integrationszeit = 5 ms und Verstärkung = 17,1.
- Wählen Sie die gewünschten Wells für die Bildgebung aus und genehmigen Sie die Spezifikationsänderungen, indem Sie auf das Symbol Wells auswählen klicken.
- Navigieren Sie zur Registerkarte Datenreduktion , um die Einstellungen für die Mobilfunkanalyse anzupassen.
- Legen Sie den Schwellenwert auf 19.500 mit hellem Hintergrund fest und wählen Sie "Löcher in Masken füllen".
- Legen Sie für die Objektauswahl die minimale Objektgröße auf 100 μm und die maximale Objektgröße auf 1.000 μm fest und wählen Sie Gesamtes Bild analysieren.
HINWEIS: Für diese Analyse werden nur eine primäre Maske und die Anzahl der Objekte benötigt. - Speichern Sie alle Änderungen, und öffnen Sie die Imager-Anwendung.
- Legen Sie die experimentelle Mikroplatte mit U-förmigem Boden in den Inkubator, indem Sie die Schublade öffnen und sie dann mit der Imager-Software schließen.
- Um das Protokoll auszuführen, klicken Sie auf die Registerkarte Prozedur-Info , fügen Sie einen Benutzer hinzu und wählen Sie das Protokoll aus.
- Stellen Sie sicher, dass der richtige Plattentyp ausgewählt ist, und stellen Sie die Bildgebungszeit auf 30 Minuten pro Platte ein.
- Wählen Sie das gewünschte Bildgebungsintervall aus, geben Sie an, ob die Platte einen Deckel hat, und passen Sie die Startzeit und Dauer der Bildgebung an.
- Klicken Sie auf Platte/Gefäß planen , um den Bildgebungsprozess zu starten.
9. Auflage der Basalmembran-Extraktionslösung (optional)
HINWEIS: Basalmembran-Extraktlösung kann 24 Stunden nach der Beschichtung auf Sphäroide aufgetragen werden.
- Füllen Sie einen Eiskübel mit Eis, um die Basalmembran-Extraktlösung kalt zu halten, und lagern Sie sie bei Nichtgebrauch bei 4 °C.
- Aspirieren Sie ca. 170 μl Medium mit einer Mehrkanalpipette.
- Verwenden Sie eine Lupe und einen Mini-Leuchtkasten, um die kleinen Sphäroide genau zu beobachten. Platzieren Sie die 96-Well-Sphäroidplatte über dem Leuchtkasten und positionieren Sie die Lupe darüber.
- Stellen Sie die P200-Pipette auf 30 μl ein und sammeln Sie den Basalmembranextrakt, um drei Mikrotröpfchen zu erzeugen.
- Geben Sie mit einer Mikropipette ein Mikrotröpfchen über jedes Sphäroid der drei technischen Replikate.
- Stellen Sie sicher, dass die 96-Well-Platte flach ist, und positionieren Sie die Pipette senkrecht über dem Sphäroid. Lassen Sie das Tröpfchen los, ohne den Boden der Vertiefung zu berühren.
- Stellen Sie die Platte für 20 min bei 37 °C in einen Inkubator.
- Überlagern Sie die Sphäroide mit einer Mikropipette mit zusätzlichen 50 μl der Basalmembran-Extraktlösung pro Well.
- Positionieren Sie die Sphäroide mit einer Pipettenspitze wieder in der Mitte der Vertiefung.
- Bei 37 °C 30 min inkubieren.
- Geben Sie 100 μl Zellkulturmedium in jede Vertiefung.
10. Quantifizierung
- Laden Sie die ImageJ-Software herunter und öffnen Sie sie. Laden Sie die Sphäroid-Bilder hoch.
- Legen Sie Messungen fest, indem Sie auf Analysieren | Legen Sie Maße fest und wählen Sie Bereich | Schwerpunkt. Messen Sie die Sphäroide, indem Sie das Lasso-Werkzeug verwenden, um das Sphäroid nachzuzeichnen und das Objekt zu messen.
- Notieren Sie die Werte für drei biologische Replikate und berechnen Sie die durchschnittliche Fläche und Zirkularität.
- Konvertieren Sie die Fläche von Pixel in Quadratmeter mit der folgenden Formel:
Fläche (m2) = ((550/504) × √ (Fläche in Pixel)) 2 - Analysieren Sie Daten.
- Wählen Sie Replikatwerte eingeben aus, die in Spalten gestapelt sind.
- Geben Sie die Daten in die Spalten ein und wählen Sie die Monokultur-Sphäroidkontrolle und die Sphäroidproben für die Co-Kulturbehandlung aus.
- Führen Sie eine unidirektionale ANOVA-Spaltenanalyse durch.
- Verwenden Sie die folgenden ANOVA-Parameter:
- Vermeiden Sie Matching oder Pairing.
- Nehmen wir eine Gaußsche Verteilung der Residuen an.
- Gehen Sie von gleichen Standardabweichungen aus.
- Verwenden Sie den Mehrfachvergleichstest von Tukey, um den Mittelwert jeder Spalte mit dem Mittelwert jeder anderen Spalte zu vergleichen.
11. Weitfeld-Immunfluoreszenz-Bildverarbeitung
- Speichern Sie die Bilder direkt aus der Imager-Software im PNG- oder TIFF-Dateiformat.
- Wählen Sie jeden einzelnen Kanal oder überlappende Kanäle aus und speichern Sie sie als PNG-Datei.
- Passen Sie Helligkeit und Kontrast in der Imager-Software oder in ImageJ an, wenn Bilder als Tiff-Dateien exportiert werden.
Ergebnisse
In dieser Studie haben wir ein Zellkultursystem entwickelt, um heteromultizelluläre 3D-Sphäroide zu erzeugen, die aus Epithel- und Stromazellen mit organoidähnlicher Morphologie bestehen. Sphäroide wurden durch Plattieren von 2.000 Epithelzellen unter Monokulturbedingungen etabliert. Unter Co-Kulturbedingungen von zwei Zelltypen wurden Sphäroide durch Plattieren von 1.000 Epithelzellen und 1.000 Stromazellen etabliert. Unter Co-Kulturbedingungen von drei Zelltypen wurden Sphäroide etabliert, indem 1.000 Epithelzellen und zwei verschiedene Stromazelltypen mit 500 Zellen jedes Zelltyps plattiert wurden. Vor der Etablierung von Sphäroiden können Zellen mit fluoreszierenden Zell-Tracker-Farbstoffen gefärbt werden, die eine Überwachung der räumlichen Organisation der Zellen ermöglichen. Nach 24 Stunden der anfänglichen Sphäroidbildung umfassen nachgelagerte Anwendungen pharmakologische Störungen, Bildgebung und Probenentnahme. Die Zeitraffer-Bildgebung ist nützlich für die Beurteilung von Veränderungen des Sphäroidverhaltens und der Morphologie, einschließlich der Fläche und der Zirkularität (Abbildung 1A). 24 Stunden nach der Beschichtung können Sphäroide in eine Gerüstumgebung eingebettet werden, und die Zeitrafferbildgebung kann verwendet werden, um das Auftreten invasiver Strukturen aus dem Sphäroid zu beurteilen (Abbildung 1B). Die Entnahme von heteromultizellulären Sphäroidproben hat viele Anwendungen, einschließlich genomischer und proteomischer Profilerstellung auf globaler und Einzelzellebene durch experimentelle Techniken wie RNA-Sequenzierung, Einzelzell-RNA-Sequenzierung, Proteomsequenzierung und zyklische Immunfluoreszenz.
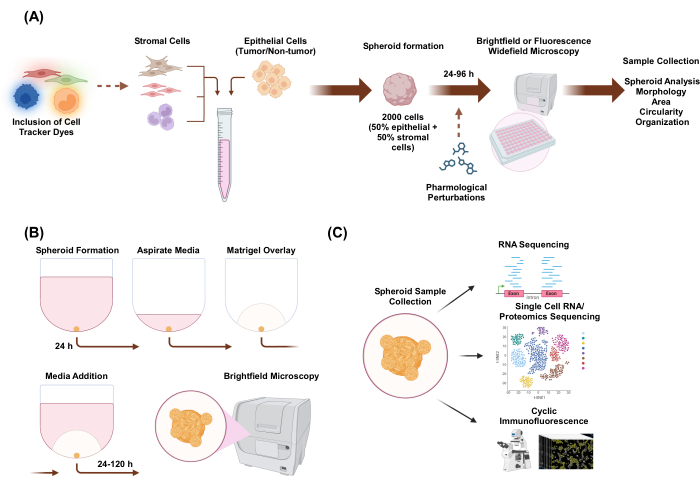
Abbildung 1: Schematische Darstellung des 3D-Zellkulturprozesses und möglicher Anwendungen. (A) Die Zellsuspension von Epithelzellen mit nicht-epithelialen Stromazellen wird in ultraniedrige 3D-Anhaftungsplatten pipettiert, um Sphäroide zu bilden. Sphäroide werden durch Hellfeldmikroskopie alle 24 h über 96 h abgebildet. Zelllinien können mit fluoreszierenden Zell-Tracker-Farbstoffen für die nachgeschaltete Weitfeldmikroskopie gefärbt werden, bevor sie die Sphäroidbildung induzieren , oder sie können pharmakologisch nach der Sphäroidbildung gestört werden. Sphäroidparameter wie Morphologie, Fläche, Zirkularität und Organisation können analysiert werden. (B) Sphäroide von Epithelzellen und Epithelzellen mit Stromazellen werden unter Verwendung des Protokolls von A gebildet. Sphäroide wurden durch Plattieren von 2.000 Epithelzellen unter Monokulturbedingungen etabliert. Unter Co-Kulturbedingungen von zwei Zelltypen wurden Sphäroide durch Plattieren von 1.000 Epithelzellen und 1.000 Stromazellen etabliert. Unter Co-Kulturbedingungen von drei Zelltypen wurden Sphäroide etabliert, indem 1.000 Epithelzellen und zwei verschiedene Stromazelltypen mit 500 Zellen jedes Zelltyps plattiert wurden. Nach 24 Stunden wird eine gerüstartige Basalmembran-Extraktlösung überlagert, und die Bilder werden alle 24 Stunden für 120 Stunden in der Hellfeldmikroskopie aufgenommen. (C) Etablierte gerüstfreie und gerüstbasierte hetero-multizelluläre 3D-Kulturen können für eine Vielzahl von Downstream-Anwendungen wie zyklische Immunfluoreszenz, Einzelzell-RNA-Sequenzierung und Einzelzell-Proteomik verwendet werden. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Die Monokultur-Sphäroide MCF10A, MCF10Ca1h und BT-474 behalten einen kompakten sphärischen Phänotyp für bis zu 96 Stunden nach der Beschichtung bei. Bei der Co-Kultivierung mit mikrovaskulären Endothelzellen von EA.hy926, BJ-5ta-Fibroblasten und/oder THP-1-Monozyten-ähnlichen Zellen entwickelten die Sphäroide zelluläre Ausstülpungen an der Peripherie, die nach 96 h stärker ausgeprägt wurden (Abbildung 2A-C). Wichtig ist, dass diese Vorsprünge, Knospungen und Verdichtungsphänomene von Sphäroiden Variationen der zellulären Organisation des Krebssphäroids und der co-kultivierten Stromazellen darstellen, die mit der 3D-Invasivität nach Zugabe eines auf Basalmembranbasis basierenden Hydrogels wie Matrigel korrelierten. Die Morphologie der Knospe reichte von festen bis hin zu lockeren Zellaggregaten, die der Morphologie von Organoiden ähnelten. Im Gegensatz dazu erschienen MDA-MB-468-Monokultur-Sphäroide als große, lose Zellaggregate. Wenn MDA-MB-468-Zellen jedoch mit EA.hy926, BJ-5ta und/oder THP-1 cokultiviert wurden, bildeten sie kompakte Sphäroide (Abbildung 2D).
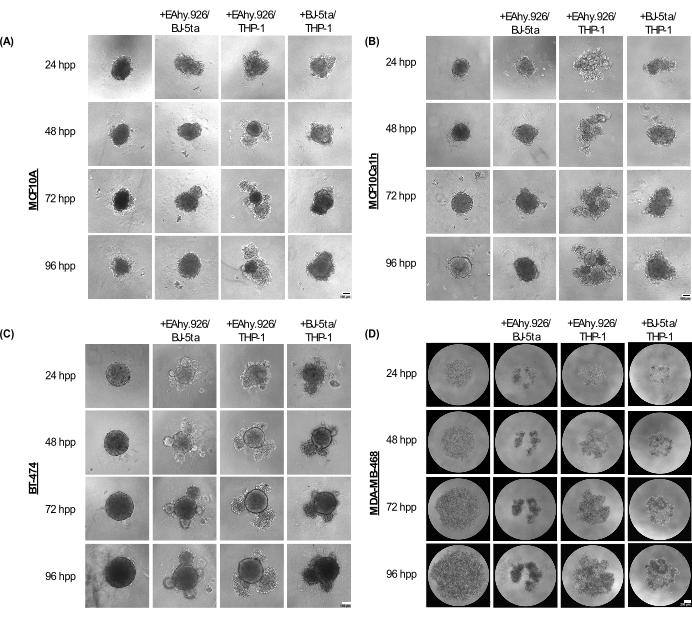
Abbildung 2: Die Bandbreite der Architekturen und Morphologien, die von Kombinationen von nicht-epithelialen Stromazellen in Kombination mit epithelialen Tumor-/Nicht-Tumorzellen in gerüstfreien 3D-Kulturen angenommen werden. Repräsentative Hellfeldbilder von (A) MCF10A, (B) MCF10Ca1h, (C) BT-474, (D) MDA-MB-468 Sphäroiden in Monokultur oder in Co-Kultur mit stromalen BJ-5ta-Fibroblasten/Ea.hy926 mikrovaskulären Endothelzellen oder Ea.hy926/THP-1 Monozyten-ähnlichen Zellen oder BJ-5ta/THP-1 Zellen über 96 Stunden. Jedes Sphäroid wurde durch die Beschichtung von 2.000 Zellen gebildet. Sphäroide wurden unter Monokulturbedingungen aus 2.000 Epithelzellen gebildet. Sphäroide wurden unter Co-Kulturbedingungen aus 1.000 Epithelzellen und zwei verschiedenen Stromazelltypen von 500 Zellen gebildet. Die Bildung von knospenden oder aggregierten organoidähnlichen Strukturen wurde unter sphäroiden Co-Kulturbedingungen 24 h nach der Beschichtung in MCF10A-, MCF10Ca1h- und BT-474-Epithelzellen initiiert. Die Verdichtung von MDA-MB-468-Zellen wurde unter Sphäroid-Co-Kulturbedingungen 25 h nach der Plating beobachtet. Maßstabsleisten = 100 μm. Abkürzung: hpp = Stunden nach dem Plattieren. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
72 Stunden nach der Beschichtung zeigten MCF10A-, MCF10Ca1h- und BT-474-Zellen, die mit EA.hy926 und THP-1 oder mit BJ-5ta und THP-1 kokultiviert wurden, eine signifikante Zunahme der Sphäroidfläche im Vergleich zu epithelialen Sphäroiden in Monokulturen. MCF10Ca1h zeigte auch eine signifikante Zunahme des Sphäroidbereichs, wenn es mit EA.hy926 und BJ-5ta co-kultiviert wurde. Das Auftreten von knospenden Strukturen in co-kultivierten Sphäroiden führte zu einer signifikanten Abnahme der Sphäroid-Zirkularität für MCF10A, MCF10Ca1h und BT-474, die mit EA.hy926 und THP-1 oder mit BJ-5ta und THP-1 kokultiviert wurden. Ähnliche Effekte wurden für BT-474 beobachtet, das sowohl mit EA.hy926 als auch mit BJ-5ta cokultiviert wurde (Abbildung 3A,B). Im Gegensatz dazu zeigten MDA-MB-468-Zellen, die mit EA.hy926 und BJ-5ta, EA.hy926 und THP-1 oder BJ-5ta und THP-1 kokultiviert wurden, eine signifikante Abnahme der Sphäroidfläche im Vergleich zu Monokultur-MDA-MB-468-Sphäroiden; es gab jedoch keinen Einfluss auf die Zirkularität (Abbildung 3A,B).

Abbildung 3: Diagramme zur Flächen- und Zirkularitätsanalyse von monokulturellen und heteromultizellulären stromalen 3D-Kulturen ohne Gerüste 72 Stunden nach der Beschichtung. (A) Durchschnittliche Fläche (cm 2) und (B) durchschnittliche Zirkularität von MCF10A, MCF10Ca1h, BT-474 und MDA-MB-468 in monokulturellen und heteromultizellulären stromalen Sphäroidkulturen 72 Stunden nach der Beschichtung. Die gemeldeten Daten sind repräsentativ für mindestens drei unabhängige biologische Replikate und werden, sofern nicht anders angegeben, als technische Replikatmittelwerte ± SEM angegeben. *, **, *** oder **** stellen p-Werte < 0,05, 0,01, 0,001 bzw. 0,0001 dar, sofern nicht anders angegeben. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Die Anwendung des Zelltracker-Farbstoffs auf BT-474-tumorigene Epithelzellen und Stromazellen vor der Etablierung der Sphäroiden zeigte, dass Stromazellen, einschließlich EA.hy926 und BJ-5ta, die knospenden Strukturen am Rand der zentralen BT474-Sphäroide bildeten (Abbildung 4, Ergänzendes Video S1, Ergänzendes Video S2, Ergänzendes Video S3 und Ergänzendes Video S4). 48 Stunden nach der Platingierung zeigen einzelne Weitfeld-Fluoreszenzbilder von Sphäroiden, die mit Fibroblasten kokultiviert wurden, dass Fibroblasten-Sphäroide zusammen mit Endothelzellen kolokalisierten, aber nicht mit BT-474-Sphäroiden. Es wurde auch festgestellt, dass eine Minderheit der Endothelzellen unter Co-Kulturbedingungen mit BT-474-Sphäroiden kolokalisiert. Dies deutet darauf hin, dass die Anordnung der Stromazellen innerhalb des Sphäroids mit einer organoidartigen Morphologie korreliert.
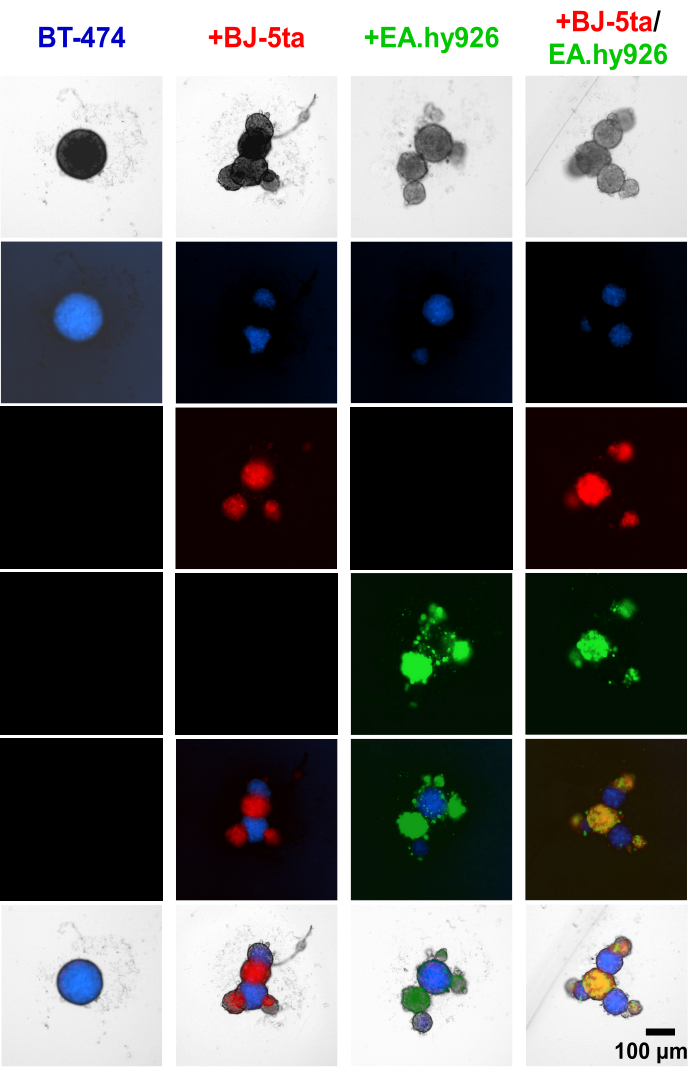
Abbildung 4: Weitfeld-Fluoreszenz-Standbilder von differentiell gefärbten Stroma- und BT-474-Zellen in heteromultizellulären 3D-Kulturen 48 Stunden nach der Beschichtung. BT-474-Sphäroide werden mit dem Fluoreszenzfarbstoff Blue Cell Tracker gefärbt. BJ-5ta-Fibroblasten sind mit orangefarbenem Zelltracker-Farbstoff gefärbt, der in roter Farbe dargestellt ist. Ea.hy926 Endothelzellen werden mit tiefrotem Zelltracker-Farbstoff gefärbt, der in grüner Farbe dargestellt ist. Jedes Sphäroid wurde durch die Beschichtung von 2.000 Zellen gebildet. Sphäroide wurden unter Monokulturbedingungen aus 2.000 Epithelzellen gebildet. Sphäroide unter Co-Kulturbedingungen (BT-474/BJ-5ta, BT-474/Ea.hy926) wurden unter Verwendung von 1.000 Epithelzellen und 1.000 Stromazellen gebildet. Sphäroide in Doppel-Co-Kultur (BT-474/BJ-5ta/Ea.hy926) wurden unter Verwendung von 1.000 Epithelzellen und 500 Zellen jedes Stromazelltyps gebildet. Die Abbildungen sind repräsentativ für mindestens drei biologische Replikate. Maßstabsleiste = 100 μm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Um die biologische Relevanz unseres organoiden Sphäroidmodells zu beurteilen, wurden die Sphäroide 24 h nach der Beschichtung mit Basalmembran-Extraktlösung überlagert. Monokultur-BT-474-Sphäroide zeigten 120 h nach der Beschichtung keine invasiven Eigenschaften. BT-474-Sphäroide, die mit BJ-5ta oder EA.hy926 kokultiviert wurden, entwickelten jedoch Strukturen an der Peripherie des Sphäroids, die in die Umgebung der Gerüst-Basalmembran-Extraktlösung eindrangen. Die Anzahl und Länge dieser Protrusionen war in BT-474-Sphäroiden, die sowohl mit BJ-5ta als auch mit EA.hy926 kokultiviert wurden, um 48 h bis 120 h nach der Plattierung signifikant erhöht (Abbildung 5, Ergänzendes Video S5, Ergänzendes Video S6, Ergänzendes Video S7 und Ergänzendes Video S8).
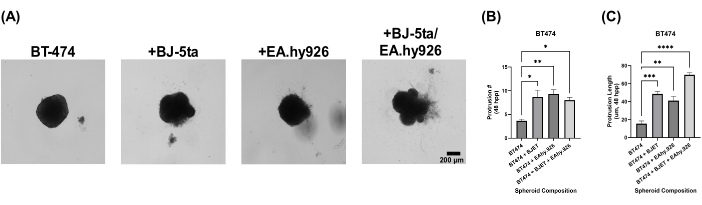
Abbildung 5: Hellfeld-Standbilder von BT-474-Zellen in heteromultizellulären 3D-Kulturen mit Basalmembran-Extrakt-Lösungs-Overlay 5 Tage nach dem Overlay. Jedes Sphäroid wurde durch die Beschichtung von 2.000 Zellen gebildet. Die Basalmembran-Extraktionslösung wurde 24 Stunden nach der Beschichtung über Sphäroide gelegt. Sphäroide wurden unter Monokulturbedingungen aus 2.000 Epithelzellen gebildet. Sphäroide unter Co-Kulturbedingungen (BT-474/BJ-5ta und BT-474/Ea.hy926) wurden unter Verwendung von 1.000 Epithelzellen und 1.000 Stromazellen gebildet. Sphäroide in Doppel-Co-Kultur (BT-474/BJ-5ta/Ea.hy926) wurden unter Verwendung von 1.000 Epithelzellen und 500 Zellen jedes Stromazelltyps gebildet. (A) Invasive Strukturen, die aus dem Krebssphäroid herausragen, das in Basalmembran-Extraktlösung eingebettet ist, können unter Co-Kulturbedingungen beobachtet werden. (B) Qualifizierung der invasiven Protrusionszahl zum Zeitpunkt 48 hpp. (C) Qualifizierung der invasiven Protrusionslänge zum Zeitpunkt 48 hpp. Die Abbildungen sind repräsentativ für mindestens drei biologische Replikate. Maßstabsleiste = 200 μm. Abkürzung: hpp = Stunden nach dem Plattieren. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Ergänzendes Video S1: BT-474 Monokultur-Sphäroid mit blauem Farbstoff des Cell Trackers. BT-474 (2.000) Zellen wurden in einer 96-Well-Mikroplatte mit U-förmigem Boden und ultrageringer Bindung resuspendiert, um Sphäroide zu bilden. Eine Überlappung von Hellfeld- und Weitfeld-Fluoreszenzbildern wurde über 48 h aufgenommen. Abkürzung: ULA = ultralow attachment. Bitte klicken Sie hier, um dieses Video herunterzuladen.
Ergänzendes Video S2: BT-474-Sphäroide, die mit BJ-5ta-Fibroblasten kokultiviert wurden. BT-474 (1.000) und 1.000 BJ-5ta-Fibroblasten wurden in ULA-Platten resuspendiert, um Sphäroide zu bilden. BT-474-Zellen wurden mit dem blauen Farbstoff des Zelltrackers und BJ-5ta-Fibroblasten mit dem orangefarbenen Farbstoff des Zelltrackers inkubiert. Eine Überlappung von Hellfeld- und Weitfeld-Fluoreszenzbildern (blau = BT-474, rot = BJ-5ta) wurde über 48 h aufgenommen. Abkürzung: ULA = ultralow attachment. Bitte klicken Sie hier, um dieses Video herunterzuladen.
Ergänzendes Video S3: BT-474-Sphäroide, die mit Ea.hy926-Endothelzellen kokultiviert wurden. BT-474 (1.000) und 1.000 Ea.hy926 Endothelzellen wurden in ULA-Platten resuspendiert, um Sphäroide zu bilden. BT-474-Zellen wurden mit dem blauen Farbstoff des Cell Trackers und Endothelzellen von Ea.hy926 mit dem tiefroten Farbstoff des Cell trackers inkubiert. Eine Überlappung von Hellfeld- und Weitfeld-Fluoreszenzbildern (blau = BT-474, grün = Ea.hy926) wurde über 48 h aufgenommen. Abkürzung: ULA = ultralow attachment. Bitte klicken Sie hier, um dieses Video herunterzuladen.
Ergänzendes Video S4: BT-474-Sphäroide, die mit BJ-5ta-Fibroblasten und Ea.hy926-Endothelzellen kokultiviert wurden. BT-474 (1.000), 500 BJ-5ta-Fibroblasten und 500 Ea.hy926-Endothelzellen wurden in ULA-Platten resuspendiert, um Sphäroide zu bilden. BT-474-Zellen wurden mit dem blauen Farbstoff des Zelltrackers inkubiert. BJ-5ta-Fibroblasten und Ea.hy926-Endothelzellen wurden mit dem orangefarbenen Farbstoff des Zelltrackers bzw. dem tiefroten Farbstoff inkubiert. Eine Überlappung von Hellfeld- und Weitfeld-Fluoreszenzbildern (blau = BT-474, rot = BJ-5ta, grün = Ea.hy926) wurde über 48 h aufgenommen. Abkürzung: ULA = ultralow attachment. Bitte klicken Sie hier, um dieses Video herunterzuladen.
Ergänzendes Video S5: BT-474 Monokultur-Sphäroid in Basalmembran-Extraktlösung. BT-474-Zellen (2.000) wurden in ULA-Platten resuspendiert, um Sphäroide zu bilden, und die Sphäroide wurden 24 Stunden nach der Beschichtung in eine Basalmembranlösung eingebettet. Hellfeldbilder wurden über 60 h aufgenommen. Abkürzung: ULA = ultralow attachment. Bitte klicken Sie hier, um dieses Video herunterzuladen.
Ergänzendes Video S6: BT-474-Sphäroide, cokultiviert mit BJ-5ta-Fibroblasten in Basalmembran-Extraktlösung. BT-474 (1.000) und 1.000 BJ-5ta-Fibroblasten wurden in ULA-Platten resuspendiert, um Sphäroide zu bilden, und die Sphäroide wurden 24 Stunden nach der Beschichtung in eine Basalmembran-Extraktlösung eingebettet. Hellfeldbilder wurden über 60 h aufgenommen. Abkürzung: ULA = ultralow attachment. Bitte klicken Sie hier, um dieses Video herunterzuladen.
Ergänzendes Video S7: BT-474-Sphäroide, cokultiviert mit Ea.hy926-Endothelzellen in Basalmembran-Extraktlösung. BT-474 (1.000) und 1.000 Ea.hy926 Endothelzellen wurden in ULA-Platten resuspendiert, um Sphäroide zu bilden, und die Sphäroide wurden 24 Stunden nach der Beschichtung in eine Basalmembran-Extraktlösung eingebettet. Hellfeldbilder wurden über 60 h aufgenommen. Abkürzung: ULA = ultralow attachment. Bitte klicken Sie hier, um dieses Video herunterzuladen.
Ergänzendes Video S8: BT-474-Sphäroide, kokultiviert mit BJ-5ta-Fibroblasten und Ea.hy926-Endothelzellen in Basalmembran-Extraktlösung. BT-474 (1.000), 500 BJ-5ta-Fibroblasten und 500 Ea.hy926-Endothelzellen wurden in ULA-Platten resuspendiert, um Sphäroide zu bilden, und die Sphäroide wurden 24 Stunden nach der Beschichtung in eine Basalmembran-Extraktlösung eingebettet. Die Hellfeldbilder wurden über 60 Stunden aufgenommen. Bitte klicken Sie hier, um dieses Video herunterzuladen.
Diskussion
Unser hetero-multizelluläres Sphäroidmodell zeigt, dass epithelial-stromale Zellinteraktionen die Knospung von Stromazellen unter gerüstfreien 3D-Kulturbedingungen und die Bildung invasiver Strukturen unter gerüstbasierten 3D-Kulturbedingungen vorantreiben. Wir beobachteten eine konsistente Bildung von knospenden Strukturen sowohl in tumorigenen Zelllinien (MCF10Ca1h und BT-474) als auch in der nicht-tumorigenen Epithelzelllinie MCF10A (Abbildung 2A-C). Während Sphäroide aus den Zelllinien MCF10A, MCF10Ca1h und BT-474, sei es in Monokultur oder Co-Kultur mit Fibroblasten und Endothelzellen, in gerüstfreien Umgebungen kreisförmige und kompakte Knospenstrukturen bildeten, zeigten Sphäroide aus der Zelllinie MDA-MB-468 eine geringere Verdichtung (Abbildung 2D). Dies war unerwartet, da davon ausgegangen wurde, dass MDA-MB-468-Zellen wie die anderen getesteten Epithelzelllinien zirkuläre Sphäroide bilden. Es wurde festgestellt, dass die Zelllinie SUM-149, eine hybride epithelial-mesenchymale primäre Brustkrebszelllinie, kompakte Sphäroide wie MCF10A, MCF10Ca1h und BT-474 bildet (Daten nicht gezeigt)28. Zukünftige Forschungen sollten die Signalwege untersuchen, die die Bildung von weniger kompakten Sphäroiden in der MDA-MB-468-Zelllinie vermitteln, da solche Anomalien auf zelluläre Schwachstellen hinweisen könnten, die für die Entwicklung neuer therapeutischer Strategien genutzt werden können.
Hinsichtlich der Kombination verschiedener Zelllinien induzieren THP-1-Monozyten-ähnliche Zellen die Bildung loser Aggregatstrukturen unter allen Co-Kulturbedingungen von Sphäroiden. In knospenden Strukturen wird unter Co-Kulturbedingungen mit THP-1/Ea.hy926-Zellen eine geringere Verdichtung beobachtet als in Co-Kulturbedingungen mit THP-1/BJ-5ta-Zellen (Abbildung 2A-D). Daher wird die Verdichtung der Sphäroide durch die Zusammensetzung der Stromazellen im Modellbeeinflusst 29,30.
Eine inkonsistente Plattierung der Heterozellkombinationen kann zu einer unvollständigen Sphäroidentwicklung oder Variabilität der Sphäroidgröße im Vergleich zu ihren technischen Replikaten führen. Die Sicherstellung der Konsistenz bei der Zellbeschichtung ist von entscheidender Bedeutung, da die räumliche Anordnung der Zellen, die den Sphäroid-Phänotyp und die Entwicklung bestimmt, hauptsächlich innerhalb der ersten 48 h31 erfolgt. Während dieser kritischen Phase spielen die Zellverhältnisse eine entscheidende Rolle, wobei der Anteil der Stromazellen sowohl die sphäroide Fläche als auch die Zirkularität beeinflusst.
Lose Sphäroidaggregate, die vom Zelltyp abhängig sind, können sich bei manueller Handhabung leicht zerlegen. Bei der Überlagerung von Sphäroiden mit einer gerüstartigen Basalmembran-Extraktlösung oder bei der Entnahme ganzer Sphäroidproben ist jedoch eine manuelle Manipulation erforderlich. Um dieses Problem zu entschärfen, ist es ratsam, bei der Entnahme von Sphäroiden per Pipettenaspiration langsamer zu arbeiten und die manuelle Handhabung nach Möglichkeit zu minimieren. Während der Überlagerung der Basalmembran-Extraktionslösung neigen Sphäroide dazu, sich innerhalb des Bohrlochs zu verschieben und sich oft am Rand des Bohrlochs abzusetzen. Ein Lösungs-zu-Medien-Verhältnis des Basalmembranextrakts ist wichtig für die Aufrechterhaltung der Matrixeigenschaften des 3D-Systems. Die Sphäroide können jedoch aufgrund der Viskosität der Basalmembranextraktlösung nicht vollständig umhüllt werden, so dass ein manueller Eingriff erforderlich ist32. Die unzentrierte Positionierung der Sphäroide stellt eine Herausforderung für die Bildgebung dar, da die Lichtbrechung in der Nähe des plastischen Randes der Vertiefung die Bildschärfe beeinträchtigen kann.
Die in dieser Studie verwendeten Sphäroide bestanden aus menschlichen Krebszelllinien; Die hier beschriebenen Methoden wurden bisher nicht auf primäre Zelllinien angewendet. Unsere Ergebnisse deuten darauf hin, dass spezifische Zell-Zell-Interaktionen die Bildung von organoidähnlichen Strukturen vorantreiben können, was auf die potenzielle Anwendbarkeit dieser Methode auf eine Vielzahl von tumorigenen Zelllinien hinweist. Während unser Modell jedoch versucht, die Komplexität der Tumormikroumgebung nachzuahmen, stellen die unterschiedlichen Raten der zellulären Proliferation eine Herausforderung für Langzeitstudiendar 33. Schnell proliferierende Zellen neigen dazu, aus langsamer proliferierenden Zellen herauszuwachsen, was dieses Modell für längere Experimente weniger geeignet macht. Darüber hinaus können unterschiedliche Anforderungen an den Wachstumsmedientyp für Zelllinien zusätzliche Faktoren mit sich bringen, die zu Sphäroid-Phänotypen führen können. Die meisten Zelllinien in dieser Studie wurden in DMEM-Medien gezüchtet. Studien mit Zelllinien, die in verschiedenen Medien gezüchtet wurden, können unterschiedliche Kulturbedingungen erfordern, um eine Vielzahl von Medienverhältnissen zu testen; Dieser Effekt wird jedoch in Langzeitexperimenten beobachtet30.
Unser Modell bietet mehrere Vorteile gegenüber anderen 3D-Krebsmodellen. Die von uns erzeugten Sphäroide haben eine einheitliche und reproduzierbare Ausgangsmorphologie und -größe, was den Vergleich der Behandlungsergebnisse mit denen der Kontrollen erleichtert. Im Gegensatz dazu können einige Modelle, die einzelne Zellen verwenden, die in Medien oder Gerüsten suspendiert sind, zu variablen zellulären räumlichen Verteilungen führen, was zu Inkonsistenzen führt. Dieses Modell zeigt, dass Wechselwirkungen zwischen verschiedenen Zellpopulationen effektiv untersucht werden können.
Traditionell wurden Organoid- und Sphäroidmodelle aus Monokultur-Krebszellen oder Krebszell-Cokulturen zusammengesetzt, um Gradienten von Nährstoffen, Hypoxie oder zellulärer Anordnung zu untersuchen34. Darüber hinaus kann dieses Modell innerhalb von 24 Stunden nach der Beschichtung in einer Gerüstumgebung untersucht werden, was die Möglichkeit bietet, frühe Invasionsereignisse zu untersuchen, die durch verschiedene Zell-Zell-Interaktionen ausgelöst werden. Während alternative 3D-Krebsansätze unterschiedliche Gerüstmatrixkomponenten verwenden, um Veränderungen in der Sphäroidmorphologie und Invasivität zu untersuchen, ergänzt dieses Modell diese, indem es die Untersuchung dieser Veränderungen sowohl im Kontext der Zellpopulationsdynamik als auch der Gerüstzusammensetzung ermöglicht35.
Die meisten Sphäroide, die mit unseren Methoden hergestellt werden, behalten ihre strukturelle Integrität nach manueller Handhabung, was eine Probenentnahme in nachgelagerten Anwendungen ermöglicht. Konventionelle genetische Modifikationen wie CRISPR-Cas9, lentivirale shRNA-Transduktion und siRNA-Interferenz können vor der Sphäroidbildung eingeführt werden. Die komplexen Verhaltensweisen, die bei diesen Sphäroiden beobachtet werden, deuten auf dynamische Veränderungen in der Genexpression hin, die mit Hilfe von RNA-seq weiter untersucht werden können. Fortschrittliche Techniken wie CycIF, scRNA-seq, CosMx und Visium können auch zur Untersuchung der Genomik und Proteomik auf räumlicher oder Einzelzellebene eingesetzt werden. Dieses Sphäroidmodell hat das Potenzial, In-vivo-Studien mit zielgerichteten Tumortherapeutika nachzuahmen, indem es Wechselwirkungen zwischen Stromazellknospen und Therapeutika erfasst, bevor es die Krebszellen erreicht. Dies ist von Bedeutung, da es helfen kann festzustellen, ob Stromazellen die Wirksamkeit des Medikaments beeinflussen und die Krebszellen möglicherweise vor den therapeutischen Wirkungen schützen.
Offenlegungen
Die Autoren haben keine Interessenkonflikte anzugeben.
Danksagungen
Wir danken den Mitgliedern des Baylor University Developmental Oncogene Laboratory für ihre hilfreichen Anmerkungen und ihr Feedback während der Erstellung dieses Manuskripts. Die finanzielle Unterstützung wurde von der Baylor University Department of Biology und dem College of Arts and Sciences, NIH-NIGMS 2SC1GM121182 (an J.A.K.), bereitgestellt.
Materialien
| Name | Company | Catalog Number | Comments |
| 15 mL Polypropylene Centrifuge Tubes | Falcon | 14-959-53A | |
| 96-Well, Treated, U-Shaped-Bottom Microplate | Thermo Scientific | 12566432 | |
| 100 mm Dish Cell Culture Treated Surface | Thermo Scientific | 130182 | |
| 170 L CO2 Incubators | VWR | VWR51014991(10810902) | |
| 200 Self-Sealing Barrier Pipet Tips | Fisher Scientific | 02-682-255 | |
| 500 mL DMEM/Hams F-12, [+] L-glutamine | Corning | 10-090-CV | |
| 1000 Self-Sealing Barrier Pipet Tips | Molecular Biology Products Inc. | 2179HR | |
| Animal-Free Recombinant Human EGF | PeproTech | AF-100-15 | |
| Automated Pipette Repeater E3x | Eppendorf | 4987000410 | |
| Basement membrane solution | Huntsman Cancer Institute | https://healthcare.utah.edu/huntsmancancerinstitute/ | |
| Bead Bath | Lab Armor | 74300706 | |
| Biorender | Biorender | Biorender.com | |
| Biosafety Laminar Flow Cabinets | Thermo Scientific | 300590389 | |
| BioSpa 8 Automated Incubator | Agilent | 23082120 | |
| Cell Counter | Invitrogen | AMQAF2000 | |
| Cell Counting Chamber Slides | Thermo Scientific | C10283 | |
| CellTracker Deep Red | Thermo Fisher Scientific | C34565 | |
| Centrifuge | Thermo Scientific | 13100675 | |
| Cholera Toxin B subunit | Sigma-Aldrich | C9903-1MG | |
| Combitips advanced, Sterile, 5.0 mL | Fisher Scientific | 13-683-714 | |
| Cytation 10 Reader Imager | Agilent | 2105245 | |
| Defined Trypsin Inhibitor | Gibco | R007100 | soybean trypsin inhibitor in 1x PBS |
| Donor Horse Serum, 500 mL, United States Origin | Corning | 35-030-CV | |
| Dulbecco's Modified Eagle's Medium | Corning | 10-013-CV | |
| Excel Sofware | Microsoft office 365 | https://www.microsoft.com/en-us/microsoft-365/excel | |
| Fetal Bovine Serum | Thermo Scientific | 26140079 | |
| Fetal Bovine Serum, qualified, US origin | Thermo Scientific | 26140079 | |
| Gentamicin Sulfate, Liquid | Corning | 30-005-CR | |
| GraphPad Prism | |||
| Hydrocortisone solution,50 µM, sterile-filtered, BioXtra | Sigma-Aldrich | H6909-10ML | |
| Image J Software | Fiji | https://imagej.net/ij/ | |
| Insulin solution human | Sigma-Aldrich | I9278-5ML | |
| Magnifying Glass | Fisher Scientific | 01-182-392 | |
| Microcentrifuge Tube | Costar | 3621 | |
| Microscope | Olympus | CKX53SF | |
| Mini Lightbox | Fisher Scientific | 361044708 | |
| Molecular Probes CellTracker Blue CMAC Dye | Fisher Scientific | C2110 | |
| Molecular Probes CellTracker Orange CMRA Dye | Fisher Scientific | C34551 | |
| Penicillin-Streptomycin Solution | Cytiva | SV30010 | |
| Penicillin-Streptomycin Solution | Cytiva | SV30010 | |
| Phase-Contrast Microscope | Echo | RVSF1000 | |
| Phosphate Buffered Saline | Fisher Scientific | SH3025601 | |
| Pipet Controller | Corning | 4099 | |
| Pipette 100 – 1,000 µL | Eppendorf | 3123000063 | |
| Pipette 20 – 200 µL | Eppendorf | 3123000055 | |
| Prism | GraphPad Software | https://www.graphpad.com/features | |
| RPMI 1640 with L-glutamine and 25 mM HEPES | Corning | 10-041-CV | |
| Serological Pipette, 10 mL | Thermo Scientific | 170356N | |
| Serological Pipette, 25 mL | Thermo Scientific | 170357N | |
| Serological Pipette, 5 mL | Thermo Scientific | 170355N | |
| Trypan Blue Solution, 0.4% | Corning | 25900CI | |
| Trypsin-EDTA, 0.25% | Corning | 25053CI |
Referenzen
- de Visser, K. E., Joyce, J. A. The evolving tumor microenvironment: From cancer initiation to metastatic outgrowth. Cancer Cell. 41 (3), 374-403 (2023).
- Hanahan, D., Weinberg, R. A. Hallmarks of cancer: The next generation. Cell. 144 (5), 646-674 (2011).
- Anderson, N. M., Simon, M. C. The tumor microenvironment. Curr Biol. 30 (16), R921-R925 (2020).
- Baghban, R., et al. Tumor microenvironment complexity and therapeutic implications at a glance. Cell Commun Signal. 18 (1), 59 (2020).
- Sahai, E., et al. A framework for advancing our understanding of cancer-associated fibroblasts. Nat Rev Cancer. 20 (3), 174-186 (2020).
- Erdogan, B., Webb, D. J. Cancer-associated fibroblasts modulate growth factor signaling and extracellular matrix remodeling to regulate tumor metastasis. Biochem Soc Trans. 45 (1), 229-236 (2017).
- Iozzo, R. V., Sanderson, R. D. Proteoglycans in cancer biology, tumour microenvironment and angiogenesis. J Cell Mol Med. 15 (5), 1013-1031 (2011).
- Amersfoort, J., Eelen, G. Immunomodulation by endothelial cells - partnering up with the immune system. Nat Rev Immunol. 22 (9), 576-588 (2022).
- Balani, S., Nguyen, L. V., Eaves, C. J. Modeling the process of human tumorigenesis. Nat Commun. 8 (1), 15422 (2017).
- Drost, J., Clevers, H. Organoids in cancer research. Nat Rev Cancer. 18 (7), 407-418 (2018).
- Wang, E., Xiang, K., Zhang, Y., Wang, X. -. F. Patient-derived organoids (PDOs) and PDO-derived xenografts (PDOXs): New opportunities in establishing faithful pre-clinical cancer models. J Natl Cancer Cent. 2 (4), 263-276 (2022).
- Kamb, A. What's wrong with our cancer models. Nat Rev Drug Discov. 4 (2), 161-165 (2005).
- Tuveson, D., Clevers, H. Cancer modeling meets human organoid technology. Science. 364 (6444), 952-955 (2019).
- Zitvogel, L., Pitt, J. M., Daillère, R., Smyth, M. J. Mouse models in oncoimmunology. Nat Rev Cancer. 16 (12), 759-773 (2016).
- Liu, Y., et al. Patient-derived xenograft models in cancer therapy: technologies and applications. Signal Transduct Target Ther. 8 (1), 160 (2023).
- Ben-David, U., et al. Patient-derived xenografts undergo mouse-specific tumor evolution. Nat Genet. 49 (11), 1567-1575 (2017).
- Byrne, A. T., et al. Interrogating open issues in cancer precision medicine with patient-derived xenografts. Nat Rev Cancer. 17 (4), 254-268 (2017).
- Ivanics, T., et al. Patient-derived xenograft cryopreservation and reanimation outcomes are dependent on cryoprotectant type. Lab Invest. 98 (7), 947-956 (2018).
- Biju, T. S., Priya, V. V., Francis, A. P. Role of three-dimensional cell culture in therapeutics and diagnostics: an updated review. Drug Deliv and Transl Res. 13 (9), 2239-2253 (2023).
- Urzì, O., et al. Three-dimensional cell cultures: The bridge between in vitro and in vivo models. Int J Mol Sci. 24 (15), 12046 (2023).
- Cacciamali, A., Villa, R., Dotti, S. 3D cell cultures: Evolution of an ancient tool for new applications. Front Physiol. 13, 836480 (2022).
- Abuwatfa, W. H., Pitt, W. G. Scaffold-based 3D cell culture models in cancer research. J Biomed Sci. 31 (1), 7 (2024).
- Yakavets, I., et al. Advanced co-culture 3D breast cancer model for investigation of fibrosis induced by external stimuli: optimization study. Sci Rep. 10 (1), 21273 (2020).
- Mohammadrezaei, D., et al. Predicting and elucidating the post-printing behavior of 3D printed cancer cells in hydrogel structures by integrating in-vitro and in-silico experiments. Sci Rep. 13 (1), 1211 (2023).
- Kuen, J., Darowski, D., Kluge, T., Majety, M. Pancreatic cancer cell/fibroblast co-culture induces M2 like macrophages that influence therapeutic response in a 3D model. PLOS ONE. 12 (7), e0182039 (2017).
- Bray, F., et al. Global cancer statistics 2022: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin. 74 (3), 229-263 (2024).
- Kennecke, H., et al. Metastatic behavior of breast cancer subtypes. J Clin Oncol. 28 (20), 3271-3277 (2010).
- Neve, R. M., et al. A collection of breast cancer cell lines for the study of functionally distinct cancer subtypes. Cancer Cell. 10 (6), 515-527 (2006).
- Pingitore, P., et al. Human multilineage 3D spheroids as a model of liver steatosis and fibrosis. Int J Mol Sci. 20 (7), 1629 (2019).
- Bar-Ephraim, Y. E., Kretzschmar, K. Organoids in immunological research. Nat Rev Immunol. 20 (5), 279-293 (2020).
- Beerkens, A. P. M., et al. Characterizing OXPHOS inhibitor-mediated alleviation of hypoxia using high-throughput live cell-imaging. Cancer Metab. 12 (1), 13 (2024).
- Feaster, T. K., et al. Matrigel mattress. Cir Res. 117 (12), 995-1000 (2015).
- Huang, Z., Yu, P., Tang, J. Characterization of triple-negative breast cancer MDA-MB-231 cell spheroid model. Onco Targets Ther. 13, 5395-5405 (2020).
- Nam, S., Khawar, I. A., Park, J. K., Chang, S., Kuh, H. -. J. Cellular context-dependent interaction between cancer and stellate cells in hetero-type multicellular spheroids of pancreatic tumor. Biochem Biophys Res Commun. 515 (1), 183-189 (2019).
- Monteiro, M. V., Gaspar, V. M., Ferreira, L. P. Hydrogel 3D in vitro tumor models for screening cell aggregation mediated drug response. Biomater Sci. 8 (7), 1855-1864 (2020).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten