Method Article
İstilayı Yönlendirmek İçin Epitelyal Kanser Hücrelerinin İskelesiz 3D Kültürlerinde Heteromultihücreli Stromal Hücreler
* Bu yazarlar eşit katkıda bulunmuştur
Bu Makalede
Özet
Kanser metastazını incelemek için heteroselüler karışmayı yakalayan 3D kanser modellerine kritik bir ihtiyaç vardır. Çalışmamız, invazyon ve hücresel mekansal dağılımları incelemek için kullanılabilecek iskele ve iskelesiz bir ortamda heteromultisellüler stromal-epitel oluşumunu sunmaktadır.
Özet
Meme kanseri, ABD'deki kadınlar arasında kansere bağlı ölümlerin ikinci önde gelen nedenidir. Organoid katı tümör modellerinin, proliferasyon ve invazyon gibi kanser ilerlemesinin yönlerini sadık bir şekilde özetlediği gösterilmiştir. Hasta kaynaklı organoidler ve hasta kaynaklı ksenogreft organoidler patofizyolojik olarak anlamlı olsalar da, yayılmaları maliyetlidir, manipüle edilmeleri zordur ve esas olarak tümör mikroçevresi (TME) içindeki en proliferatif hücre tiplerinden oluşurlar. Bu sınırlamalar, TME içinde bulunan ve metastaz ve tedavi direncine katkıda bulunduğu bilinen tümörle ilişkili stromal hücrelere bağlı olan hastalık ilerlemesinin hücresel mekanizmalarını aydınlatmak için kullanılmalarını engeller.
Burada, epitelyal-stromal çok hücreli 3D kültürlerin yetiştirilmesi için yöntemler hakkında rapor veriyoruz. Bu yöntemlerin avantajları arasında, hidrojel iskeleleri içinde tek hücre çözünürlüğünde istilayı izlemek için kullanılabilen, iskele içermeyen ortamlarda hızlı bir şekilde organoid benzeri 3D kültürler oluşturmak için uygun maliyetli bir sistem yer alır. Spesifik olarak, fibroblastlar (BJ-5ta), monosit benzeri hücreler (THP-1) ve/veya endotel hücreleri (EA.hy926) ile kombinasyon halinde BT-474 meme kanseri hücrelerini kullanarak bu heteroçok hücreli 3D kültürlerin nasıl oluşturulacağını gösteriyoruz. Ek olarak, hücre popülasyonlarının diferansiyel floresan etiketlemesi, 3D kültür montajı ve istila dinamiklerini tanımlamak için hızlandırılmış mikroskopi sağlar.
Özellikle, BT-474 hücrelerinin 3D kültürlerine herhangi iki stromal hücre kombinasyonunun eklenmesi, organoid benzeri veya ikincil küresel yapıların varlığı ile tutarlı olarak 3D kültürlerin daireselliğini önemli ölçüde azaltır. İzleyici boya deneylerinde, fibroblastlar ve endotel hücreleri periferik organoid benzeri çıkıntılarda birlikte lokalize olur ve birincil BT-474 sferoidinden uzamsal olarak ayrılır. Son olarak, BT-474 hücrelerinin heteroçok hücreli 3D kültürleri, hidrojel invazyon kapasitesini arttırmıştır. Bu çıkıntılı yapıları hem tümörjenik olmayan hem de tümörijenik meme epitel hücrelerinin heteroçok hücreli 3D kültürlerinde gözlemlediğimizden, bu çalışma, katı tümör ilerlemesi ile ilişkili fenotiplerin sonraki analizleri için iskelesiz bir ortamda organoid benzeri 3D kültürler oluşturmak için verimli ve tekrarlanabilir bir yöntem sağlar.
Giriş
Kanserin ilerlemesinin artık iki ana faktöre bağlı olduğu kabul edilmektedir: tümör hücrelerindeki genetik/epigenetik değişiklikler ve tümör mikroçevresindeki (TME) tümör olmayan hücrelerle sayısız etkileşim1. Hücrelerdeki genetik değişikliklerin tümör başlangıcı için gerekli olduğu kabul edilmekle birlikte, bu tür değişiklikler tek başına tümörün ilerlemesi ve metastazı için yeterli değildir2. Başlangıçta sessiz seyirciler olduğu düşünülen TME'nin bileşenlerinin, şimdi tümör hücreleri ile karşılıklı ve dinamik karışma yoluyla kanserin ilerlemesini aktif olarak teşvik ettiği bilinmektedir3. TME bileşimi, tümörün kaynaklandığı dokuya, tümörün evresine ve hasta özelliklerine bağlı olarak farklılık gösterir, ancak ayırt edici özellikler arasında stromal kanserle ilişkili fibroblastlar (CAF'ler), hücre dışı matris (ECM), vasküler endotel hücreleri ve ayrıca adaptif ve miyeloid bağışıklık hücreleribulunur 1,4.
TME'deki stromal KAF'ler, farklı köken ve fonksiyonlara sahip fibroblast alt tiplerinden oluşur5. Bu tür CAF'ler, çeşitli arayüzlerde tümör hücreleri ile etkileşime girdikleri için TME'nin temel bileşenleridir. CAF'ler, matrisin sertliğini değiştiren ECM proteinleri salgılar, bu da kolajen, proteoglikanlar ve fibronektinin aşırı birikmesi yoluyla ilaç dağıtımını sınırlayabilir veya ECM parçalayıcı matris metaloproteinazların (MMP'ler) salgılanması yoluyla tümör hücrelerinin birincil tümör bölgesinden istila etmesine izin verebilir6,7. Ek olarak, CAF'ler, çeşitli büyüme faktörleri, sitokinler ve epidermal büyüme faktörü (EGF), dönüştürücü büyüme faktörü β (TGF-β) ve vasküler endotelyal büyüme faktörü (VEGF) gibi anjiyojenik faktörlerin salgılanması yoluyla tümör büyümesini, göçünü ve vaskülarizasyonunu teşvik eder(VEGF), sırasıyla 1,6. Paralel olarak, hipoksik TME tarafından uyarılan endotel hücreleri, anjiyojenik faktörlerin artan salgılanması ve lökosit adezyon moleküllerininsalgılanmasının azalması yoluyla tümör vaskülarizasyonunu teşvik eder ve bağışıklık hücresi fonksiyonlarını baskılar 1,8.
Kanser ilerlemesinin belirgin karmaşık karmaşıklığı ile, TME stromal bileşenlerinin temel kanser araştırmalarına dahil edilmesi zorunlu hale gelmiştir. Bununla birlikte, bilinen tümör patofizyolojisini aslına uygun olarak özetleyen modellerin oluşturulması hala karşılanmamış önemli bir ihtiyaçtır 9,10. Geleneksel iki boyutlu (2D) hücre kültürü modellerinin kullanımı kolay, hızlı kültürlenmiş ve yüksek oranda tekrarlanabilir olsa da, yalnızca hızla çoğalan kanser hücresi klonlarından oluşur ve tümörlerde bulunan hücresel heterojenliği yansıtmaz 10,11,12. Benzer şekilde, transgenik fare modelleri de akrabalı yetiştirmeden kaynaklanan düşük genetik heterojenlik, bağışıklık sistemindeki önemli farklılıklar ve histolojik karmaşıklık nedeniyle insan tümör biyolojisini yakalamaz13,14. Bu tür sınırlamalar nedeniyle, klasik kanser modellerinden geliştirilen terapötikler genellikle klinik ortamlara çevrilemez.
Hasta kaynaklı ksenogreftler ve hasta kaynaklı organoidler gibi hasta kaynaklı kanser modelleri, yerinde tümör moleküler özelliklerini, genetik arka planı ve hücresel organizasyonu yakalayarak geleneksel kanser modellerinin dezavantajlarını ele alabilir 10,11,15. Bununla birlikte, bu tür hasta kaynaklı ksenogreftler ve organoidler, karmaşık aşılama prosedürleri ve uzun kültür süresi gerektirir 16,17. Tümör edinimi ve örnekleme bölgelerindeki varyasyon ve kriyoprezervasyondaki düşük verimlilik ile birleştiğinde, klasik 2D hücre kültürleri ile hasta kaynaklı kanser modelleri arasında bir köprü görevi gören modellerin geliştirilmesine ihtiyaç vardır11,18. Bu bağlamda, hücre kültürünün 3D modelleri, hızlı bir şekilde kültürlenebilen ve hücre-hücre etkileşimi, hücre-ECM etkileşimi, hipoksi, anjiyogenez ve ECM19,20 üretimi gibi önemli in vivo tümör özelliklerini yakalayabilen modeller olarak hizmet edebilir.
3D hücre kültürü modelleri, iskelesiz ve iskele tabanlı model sistemleri olarak kategorize edilir. İskelesiz sistemlerde, hücreler, spesifik düşük bağlı hücre kültürü plakaları kullanılarak veya kültür yöntemlerinin fiziksel parametrelerini manipüle ederek küresel bir şekle kendi kendine toplanmaya teşvik edilir. İskelesiz 3D sferoidler elde etmek için yerleşik yöntemler, santrifüjleme yoluyla basit hücre pelet kültürlerinden asılı mikroplaka damlalarına, manyetik levitasyona ve dinamik biyoreaktör ve mikroakışkan sistemlere kadar uzanır20,21. İskele tabanlı 3D hücre kültürleri, fizyolojik hücre dışı matrisi taklit etmek için polimer veya hidrojel bazlı iskelelerin eklenmesiyle oluşturulur19,22. Bu tür modeller, in vivo hücresel organizasyon, topoloji, matris bağlanması, göç ve ilaç tepkisini modellemek için muazzam bir potansiyele sahiptir.
Hastalık durumlarında ECM bileşim modelleri için iskele manipülasyonuna ek olarak, 3D hücre kültürleri bir TME'deki heterojen hücresel popülasyonları modellemek için de kullanılabilir. Kanser hücreleri ve stromal fibroblastlar veya endotel hücrelerinden oluşan 3D hücre kültürleri, kanser ve bireysel tümör olmayan hücre hatlarının etkileşimini incelemek için kullanılmıştır 23,24,25. Çoklu heterojen hücre dizilerinden oluşan bu tür 3D hücre kültürlerini genişletmek için tekrarlanabilir ve uygun maliyetli yöntemler, araştırmacıların tümör ilerlemesini aydınlatmasına yardımcı olacaktır. Burada, proliferasyon, invazyon ve hücre durumu plastisitesini incelemek için epitelyal-stromal çok hücreli 3D kültürlerin yetiştirilmesi için yöntemler hakkında rapor veriyoruz. Protokol, fibroblastlar (BJ-5ta), endotelyal (Ea.hy926) hücreler ve monosit benzeri hücrelerden (THP-1) oluşan stromal hücrelerin bir kombinasyonu ile birlikte kültürlenmiş meme kanseri hücrelerinin iskelesiz ve bazal membran özütü iskele tabanlı 3D kültürlerini tanımlar. Meme kanseri şu anda dünya çapında en sık görülen ikinci kanserdir ve ABD'de kadınlarda en çok teşhis edilen kanserdir26. Meme kanserinden ölüm, agresif HER2 ile zenginleştirilmiş ve bazal benzeri meme kanseri alt tipleri ile tanı konan hastalarda genel ve metastazsız sağkalım önemli ölçüde azaldığından, büyük ölçüde hastalığın metastatik ve tedaviye dirençli doğasından kaynaklanmaktadır27. Açıklanan 3D hücre kültürü protokollerimiz, formalinle sabitlenmiş parafine gömülü doku koruma yöntemleri ve sonraki mekansal biyoloji uygulamaları ile eşleştirilebilecek uygun maliyetli, hızlı ve tekrarlanabilir kültür yöntemlerinin geliştirilmesine yardımcı olabilir.
Protokol
1. Hücre kültürü ortamı
NOT: Tüm ortamları bir biyogüvenlik kabini içinde hazırlayın.
- BJ-5ta, BT474, EA.hy926 ve MDA-MB-468 için hücre kültürü ortamı hazırlamak için, 500 mL Dulbecco'nun Modifiye Eagle Medium (DMEM) yüksek glikozunu %10 ısıyla inaktive edilmiş fetal sığır serumu (FBS) ve %1 penisilin-streptomisin ile takviye edin bir pipet ile. Bir mikropipet ile% 0.1 gentamisin ekleyin.
- MCF10A için hücre kültürü ortamı hazırlamak için,% 5 at serumu ve% 1 penisilin-streptomisin ile 500 mL DMEM / F12'yi bir pipetle destekleyin. Bir mikropipet ile% 0.1 gentamisin, 1 mL 1 μg / mL hidrokortizon, 500 μL 10 μg / mL insülin, 50 μL 100 ng / mL kolera toksini ve 10 μL 20 ng / mL epidermal büyüme faktörü ekleyin.
- MCF10Ca1h için hücre kültürü ortamı hazırlamak için, 500 mL DMEM / F12'yi %5 at serumu ve %1 penisilin-streptomisin ile bir pipetle takviye edin. Bir mikropipet ile% 0.1 gentamisin ekleyin.
- THP-1 için hücre kültürü ortamı hazırlamak için, 500 mL RPMI 1640'ı %10 FBS ve %1 penisilin-streptomisin ile bir pipetle takviye edin. Bir mikropipet ile% 0.1 gentamisin ekleyin.
- BJ-5ta, BT474, EA.hy926, MDA-MB-468, MCF10A ve MCF10Ca1h için hücre kültürü ortamını her 2-3 günde bir, hücreler büyümelerini günlük olarak bir parlak alan mikroskobu ile değerlendirerek %70-80 birleşmeye ulaşana kadar değiştirin. THP-1 hücreleri için hücre kültürü ortamını haftada bir kez değiştirin.
- BJ-5ta, BT474, EA.hy926, MDA-MB-468, MCF10A ve MCF10Ca1h hücrelerini, %5 CO2 içeren standart hücre kültürü inkübatörlerinde hücre kültürü ile muamele edilmiş yüzeylere sahip 100 mm'lik kaplarda büyütün.
- T75 Hücre Kültürü ile Muamele Edilmiş Şişelerde THP-1 hücrelerini% 5 CO2 ile standart hücre kültürü inkübatörlerinde büyütün.
2. Hücre toplama
- Biyogüvenlik kabininin içini 15 dakika boyunca sterilize etmek için UV ışığını açın.
- Hava akışını stabilize etmek için biyogüvenlik kabini pencere kanadını açın ve vakum aspirasyon sistemini açın.
- Kaputun iç yüzeyini ve vakum aspirasyon sisteminin borusunu %70 etanol ile temizleyin.
- Biyogüvenlik kabini içinde taze serumsuz hücre kültürü ortamı hazırlayın: bir pipet kullanarak 500 mL Dulbecco'nun modifiye edilmiş Eagle's medium (DMEM) yüksek glikozunu %1 penisilin/streptomisin ile destekleyin. % 0.1 Gentamisin'i bir mikropipet ile birleştirin.
- Deneye başlamadan önce hücre kültürü ortamını, fosfat tamponlu salini (PBS) ve tripsin-EDTA'yı (%0.25) 37 ° C'ye ısıtın.
- Mikroskopla görsel inceleme yoluyla hücrelerin %70-80 oranında birleştiğinden emin olun.
- Vakum aspiratörü ile kaplanmış hücrelerden kültür ortamını aspire edin ve atın. Kalan ortamı bir pipetle 2 mL PBS ile bir kez yıkayın, ardından PBS'yi vakum aspiratörü ile aspire edin ve atın.
NOT: THP-1 hücreleri süspansiyon halinde büyütülür; Adım 2.7-2.9 atlanabilir. - Bir mikropipet kullanarak hücre kültürü kabına 1 mL tripsin ekleyin ve plakayı 5 dakika boyunca 37 ° C'de% 5 CO2 inkübatörüne yerleştirin.
- Bir mikropipet ile plakaya 1 mL soya fasulyesi tripsin inhibitörü (1x PBS'de) ekleyerek tripsini etkisiz hale getirin. Sıvı karışımı bir P1000 mikropipet ile pipetleyerek hücre kümelerini dağıtın ve hücre süspansiyonunu plakanın altından toplayın. Hücre süspansiyonunu bir mikropipet ile 15 mL'lik konik bir tüpe aktarın ve oda sıcaklığında 5 dakika boyunca 100 × g'da santrifüjleyin. Süpernatanı vakum aspiratörü ile atın.
- Hücre sayımına devam edin.
3. Süspansiyonda çalışma boyası çözeltisi ve boyama hücrelerinin hazırlanması
- Hücre izleyici moleküler floresan probların şişesini açmadan önce ( Malzeme Tablosuna bakınız), ürünün 37 °C'ye ayarlanmış bir boncuk banyosunda 15 dakika oda sıcaklığına ısınmasına izin verin.
- Liyofilize hücre izleyici mavi boyayı (kütle = 5 mg, moleküler ağırlık = 209.6 g / mol) bir mikropipet kullanarak 2.385 mL DMSO ile 10 mM'lik bir nihai konsantrasyona çözün.
- Liyofilize hücre izleyici turuncu boyayı (kütle = 50 μg, moleküler ağırlık = 550.4 g/mol) bir mikropipet kullanarak 9.084 μL DMSO ile 10 mM'lik bir nihai konsantrasyona çözün.
- Liyofilize hücre izleyici koyu kırmızı boyayı (kütle = 15 μg, moleküler ağırlık = 698.3 g / mol) bir mikropipet kullanarak 20 μL DMSO ile 1 mM'lik bir nihai konsantrasyona çözün.
- 1 μL boyayı bir mikropipet ile 2 mL serumsuz DMEM ortamında seyrelterek çalışma hücresi izleyici mavi boya ortamı çözeltisini (5 μM) hazırlayın.
- 1 μL boyayı bir mikropipet ile 2 mL serumsuz DMEM ortamında seyrelterek çalışma hücresi izleyici turuncu boya ortamı solüsyonunu (5 μM) hazırlayın.
- 2 μL boyayı bir mikropipet ile 2 mL serumsuz DMEM ortamında seyrelterek çalışma hücresi izleyici koyu kırmızı boya ortamı çözeltisini (1 μM) hazırlayın.
- Hazırlanan çalışma hücresi izleyici mavi, turuncu ve koyu kırmızı boya ortamı solüsyonlarında (5 mL) epitel hücrelerini, BJ-926 endotel hücrelerini sırasıyla bir mikropipet ile yeniden süspansiyon haline getirin.
- Tüpleri 37 °C'de% 5 CO2 inkübatörde 30 dakika inkübe edin.
- 30 dakikalık inkübasyondan sonra, tüpleri oda sıcaklığında 5 dakika boyunca 100 x g'da santrifüjleyin.
- Süpernatanı vakum aspiratörü ile aspire edin ve atın ve peleti bir mikropipet ile 1 mL% 10 FBS serum içeren DMEM ortamında iyice yeniden süspanse edin.
- Hücre sayımına devam edin.
4. Hücre sayımı
- 10 μL hücre süspansiyonunu toplayın ve bir mikropipet ile bir mikrotüpe aktarın.
- 10 μL tripan mavisi ile karıştırın ve iyice pipetleyin.
- 20 μL hücre-tripan çözeltisini bir mikropipet ile bir hücre sayma odası slaytına aktarın. Otomatik bir hücre sayacı kullanarak hücreleri yerleştirin ve sayın.
- İki okumadan ortalama toplam canlı hücre sayısını hesaplayın.
5. Hesaplamalar
- Her hücre tipi için 2.000 hücre/300 μL'ye eşdeğer 6.67 × 103 hücre/mL konsantrasyonda çalışma hücresi stokları hazırlayın.
NOT: Toplam stok hacmi, deneysel numune boyutuna bağlı olacaktır. - Mono-kültür sferoidleri için, her bağımsız numunenin 2.000 epitel hücresine eşdeğer 300 μL epitel hücresi çalışma stoğundan oluştuğundan emin olun.
- Ko-kültür sferoidleri (iki hücre tipi) için, her bağımsız numunenin 150 μL epitel hücresi çalışma stoğu ve 150 μL stromal hücre çalışma stoğundan oluştuğundan emin olun. Numune, 1.000 epitel hücresi ve 1.000 stromal hücre içerecektir.
- Ko-kültür sferoidleri (üç hücre tipi) için, her bağımsız numunenin 150 μL epitel hücresi çalışma stoğu, 75 μL stromal hücre #1 çalışma stoğu ve 75 μL stromal hücre #2 çalışma stoğundan oluştuğundan emin olun. Numune, 1.000 epitel hücresi, 500 stromal çalışma stoğu #1 hücresi ve 500 stromal çalışma stoğu #2 hücresi içerecektir.
6. Kaplama
- Gerekli hacmi üç teknik kopya için bir mikropipet ile ve bir ekstra pipetle bir mikrotüpe aktarın. Bir pipetle iyice karıştırın, ardından numunenin 300 μL'sini U şeklinde tabanlı, ultra düşük bağlantılı 96 oyuklu bir mikroplakaya aktarın.
- Her ek teknik çoğaltma için işlemi tekrarlayın.
- 96 oyuklu plakayı 37 °C'de bir inkübatöre yerleştirin.
7. Parlak alan görüntüleme
- Mikroskop kullanarak her 24 saatte bir 96 saate kadar küresel büyümeyi ve morfolojiyi gözlemleyin.
- Faz kontrast mikroskobu kullanarak görüntü sferoidleri.
8. İzleyici boyalarla boyanmış sferoidler ve bazal membran özütü ile kaplanmış sferoidler için geniş alan görüntüleme protokolü kurulumu
- Malzeme Tablosu'nda listelenen görüntüleme ve otomatik inkübatör cihazlarını açın ve görüntüleme yazılımının görev yöneticisinde yeni bir görüntüleme protokolü oluşturun. Prosedür sekmesi altında, otomatik inkübatör sıcaklık ayar noktasını 37 °C'ye ayarlayın ve bir sonraki adıma geçmeden önce inkübatörün CO%2 ve sıcaklığı dengelemesine izin verin.
NOT: Kullanılan boyaların her biri (mavi, koyu kırmızı ve turuncu) için uygun filtrelere sahipse alternatif bir floresan görüntüleyici kullanılabilir. - Görüntü ayarlarını aşağıdaki özelliklere göre ayarlayın: Büyütme: 4X PL FL Faz, Görüş Alanı: 3185 X 3185 μm, Tam WFOV.
- Kanallar için aşağıdaki özellikleri kullanın: DAPI: 377/447 nm, aydınlatma = 10, entegrasyon süresi = 107 ms, kazanç = 10, RFP: 531/593 nm, aydınlatma = 10, entegrasyon süresi = 137 ms, kazanç = 10, CY5: 628/685 nm, aydınlatma = 10, entegrasyon süresi = 137 ms, kazanç = 10.
- Bir bazal membran ekstrakt çözeltisi kaplamasındaki sferoidleri görüntülemek için aşağıdaki parlak alan özelliklerini kullanın: aydınlatma = 10, entegrasyon süresi = 5 ms ve kazanç = 17.1.
- Görüntüleme için istenen kuyuları seçin ve kuyu seç simgesine tıklayarak spesifikasyon değişikliklerini onaylayın.
- Hücresel analiz ayarlarını yapmak için Veri Azaltma sekmesine gidin.
- Açık renkli bir arka planla eşik değerini 19.500 olarak ayarlayın ve Maskelerdeki delikleri doldur'u seçin.
- Nesne seçimi için minimum nesne boyutunu 100 μm ve maksimum nesne boyutunu 1.000 μm olarak ayarlayın ve Tüm görüntüyü analiz et'i seçin.
NOT: Bu analiz için yalnızca birincil maske ve nesne sayısı gereklidir. - Tüm değişiklikleri kaydedin ve görüntüleyici uygulamasını açın.
- Çekmeceyi açarak deneysel U şeklindeki alt mikro plakayı inkübatöre yerleştirin, ardından görüntüleyici yazılımını kullanarak kapatın.
- Protokolü çalıştırmak için Prosedür Bilgisi sekmesine tıklayın, bir kullanıcı ekleyin ve protokolü seçin.
- Doğru plaka tipinin seçildiğinden emin olun ve görüntüleme süresini plaka başına 30 dakika olarak ayarlayın.
- İstenen görüntüleme aralığını seçin, plakanın kapağı olup olmadığını belirtin ve görüntüleme başlangıç zamanını ve süresini ayarlayın.
- Görüntüleme işlemini başlatmak için Plaka / Damar Planla'ya tıklayın.
9. Bodrum membran özü çözeltisi kaplaması (isteğe bağlı)
NOT: Bazal membran ekstrakt çözeltisi, kaplamadan 24 saat sonra sferoidlere uygulanabilir.
- Bodrum membran ekstrakt solüsyonunu soğuk tutmak için bir buz kovasını buzla doldurun ve kullanılmadığı zaman 4 °C'de saklayın.
- Çok kanallı bir pipetle yaklaşık 170 μL ortamı aspire edin.
- Küçük sferoidleri yakından gözlemlemek için bir büyüteç ve mini bir ışık kutusu kullanın. 96 delikli küresel plakayı ışık kutusunun üzerine yerleştirin ve büyüteci baş üstü yerleştirin.
- P200 pipetini 30 μL'ye ayarlayın ve üç mikro damlacık oluşturmak için bazal membran ekstraktını toplayın.
- Bir mikropipet ile üç teknik kopyanın her birinin üzerine bir mikro damlacık ekleyin.
- 96 oyuklu plakanın düz olduğundan emin olun ve pipeti kürenin üzerine dikey olarak yerleştirin. Kuyunun dibine dokunmadan damlacığı serbest bırakın.
- Plakayı 20 dakika boyunca 37 ° C'de bir inkübatöre yerleştirin.
- Sferoidleri bir mikropipet ile oyuk başına 50 μL ilave bazal membran ekstrakt çözeltisi ile kaplayın.
- Bir pipet ucu kullanarak sferoidleri kuyunun ortasına yeniden konumlandırın.
- 37 °C'de 30 dakika inkübe edin.
- Her oyuğa 100 μL hücre kültürü ortamı ekleyin.
10. Nicelik belirleme
- ImageJ yazılımını indirin ve açın. Küresel görüntüleri yükleyin.
- Analiz Et'e tıklayarak ölçümleri ayarlayın | Ölçümleri ayarlayın ve Alanı seçin | Merkez. Küreyi izlemek ve nesneyi ölçmek için kement aracını kullanarak sferoidleri ölçün.
- Üç biyolojik kopya için değerleri kaydedin ve ortalama alanı ve daireselliği hesaplayın.
- Aşağıdaki formülü kullanarak alanı piksellerden metrekareye dönüştürün:
Alan (m2) = ((550/504) × √ (piksel cinsinden alan)) 2 - Verileri analiz edin.
- Sütunlar halinde yığılmış çoğaltma değerlerini girin'i seçin.
- Verileri sütunlara girin ve monokültür sferoid kontrolünü ve ko-kültür muamelesi sferoid örneklerini seçin.
- Tek yönlü ANOVA sütun analizi gerçekleştirin.
- Aşağıdaki ANOVA parametrelerini kullanın:
- Eşleştirmekten veya eşleştirmekten kaçının.
- Artıkların Gauss dağılımını varsayalım.
- Standart sapmaların eşit olduğunu varsayalım.
- Her sütunun ortalamasını diğer tüm sütunların ortalamasıyla karşılaştırmak için Tukey'in çoklu karşılaştırma testini kullanın.
11. Geniş alan immünofloresan görüntü işleme
- Görüntüleri doğrudan görüntüleyici yazılımından PNG veya Tiff dosya biçiminde kaydedin.
- Her bir kanalı veya çakışan kanalları seçin ve PNG dosyası olarak kaydedin.
- Görüntüleyici yazılımında veya görüntüler Tiff dosyaları olarak dışa aktarılıyorsa ImageJ'de parlaklığı ve kontrastı ayarlayın.
Sonuçlar
Bu çalışmada, organoid benzeri morfolojiye sahip epitelyal ve stromal hücrelerden oluşan heteromultiselüler 3D sferoidler oluşturmak için bir hücre kültürü sistemi geliştirdik. Spheroidler, monokültür koşullarında 2.000 epitel hücresinin kaplanmasıyla oluşturulmuştur. İki hücre tipinin ko-kültür koşullarında, 1.000 epitel hücresi ve 1.000 stromal hücre kaplanarak sferoidler oluşturuldu. Üç hücre tipinin ko-kültür koşullarında, 1.000 epitel hücresi ve her hücre tipinden 500 hücreden oluşan iki farklı stromal hücre tipi kaplanarak sferoidler oluşturuldu. Küresel oluşumun yukarı akışında, hücreler, hücresel mekansal organizasyonun izlenmesine izin veren floresan hücre izleyici boyalarla boyanabilir. İlk sferoid oluşumundan 24 saat sonra, aşağı akış uygulamaları farmakolojik bozulmaları, görüntülemeyi ve numune toplamayı içerir. Hızlandırılmış görüntüleme, alan ve dairesellik dahil olmak üzere küresel davranış ve morfolojideki değişiklikleri değerlendirmek için kullanışlıdır (Şekil 1A). Kaplamadan 24 saat sonra, sferoidler bir iskele ortamına gömülebilir ve sferoidden invaziv yapıların başlangıcını değerlendirmek için hızlandırılmış görüntüleme kullanılabilir (Şekil 1B). Heteroçok hücreli sferoid örneklerinin toplanması, RNA dizilimi, tek hücreli RNA dizilimi, proteomik dizileme ve döngüsel immünofloresan gibi deneysel teknikler yoluyla küresel ve tek hücre seviyelerinde genomik ve proteomik profilleme dahil olmak üzere birçok uygulamaya sahiptir.
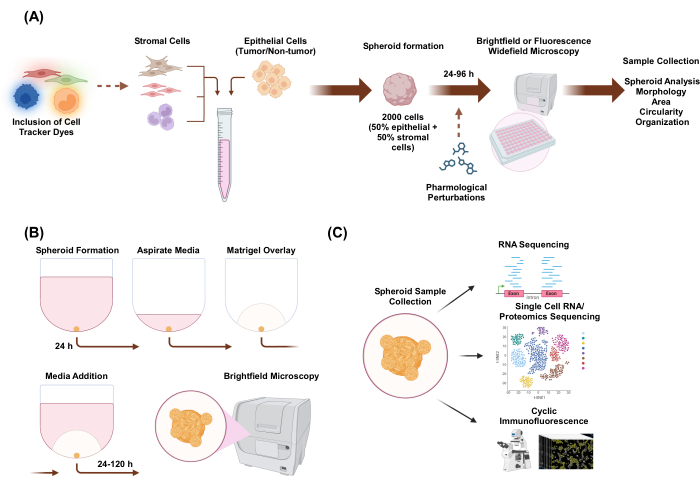
Şekil 1: 3D hücre kültürü sürecinin şematik gösterimi ve potansiyel uygulamalar. (A) Epitel hücrelerinin epitel olmayan stromal hücrelere sahip hücre süspansiyonu, sferoidler oluşturmak için 3D ultra düşük bağlantı plakalarına pipetlenir. Sferoidler, 96 saat boyunca her 24 saatte bir parlak alan mikroskobu ile görüntülenir. Hücre hatları, sferoid oluşumunu indüklemeden önce aşağı akış geniş alan mikroskobu için floresan hücre izleyici boyalarla boyanabilir veya sferoid oluşumundan sonra farmakolojik olarak bozulabilir. Morfoloji, alan, dairesellik ve organizasyon gibi küresel parametreler analiz edilebilir. (B) Stromal hücreli epitel ve epitel hücrelerinin sferoidleri, A'nın protokolü kullanılarak oluşturulur. Spheroidler, monokültür koşullarında 2.000 epitel hücresinin kaplanmasıyla oluşturulmuştur. İki hücre tipinin ko-kültür koşullarında, 1.000 epitel hücresi ve 1.000 stromal hücre kaplanarak sferoidler oluşturuldu. Üç hücre tipinin ko-kültür koşullarında, 1.000 epitel hücresi ve her hücre tipinden 500 hücreden oluşan iki farklı stromal hücre tipi kaplanarak sferoidler oluşturuldu. 24 saat sonra, iskele benzeri bir bazal membran ekstrakt çözeltisi üzerine yerleştirilir ve görüntüler, 120 saat boyunca her 24 saatte bir parlak alan mikroskobunda yakalanır. (C) Yerleşik iskelesiz ve iskele tabanlı hetero-çok hücreli 3D kültürler, döngüsel immünofloresan, tek hücreli RNA dizilimi ve tek hücreli proteomik gibi çeşitli aşağı akış uygulamaları için kullanılabilir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
MCF10A, MCF10Ca1h ve BT-474 monokültür sferoidleri, kaplama sonrası 96 saate kadar kompakt bir küresel fenotipi korur. EA.hy926 mikrovasküler endotel hücreleri, BJ-5ta fibroblastlar ve / veya THP-1 monosit benzeri hücreler ile birlikte kültürlendiğinde, sferoidler periferde hücresel çıkıntılar geliştirdi ve bu da 96 saatte daha belirgin hale geldi (Şekil 2A-C). Daha da önemlisi, sferoidlerin bu çıkıntıları, tomurcuklanma ve sıkışma fenomenleri, kanser sferoidinin hücresel organizasyonunun varyasyonlarını ve Matrigel gibi bir bazal membran bazlı hidrojelin eklenmesini takiben 3D invazivliği ile ilişkili olan ko-kültürlenmiş stromal hücreleri temsil eder. Tomurcuklanan morfoloji, organoid morfolojiye benzeyen katıdan gevşek hücre agregatlarına kadar değişiyordu. Buna karşılık, MDA-MB-468 monokültür sferoidleri büyük, gevşek hücre agregatları olarak ortaya çıktı. Bununla birlikte, MDA-MB-468 hücreleri EA.hy926, BJ-5ta ve / veya THP-1 ile birlikte kültürlendiğinde, kompakt sferoidler oluşturdular (Şekil 2D).
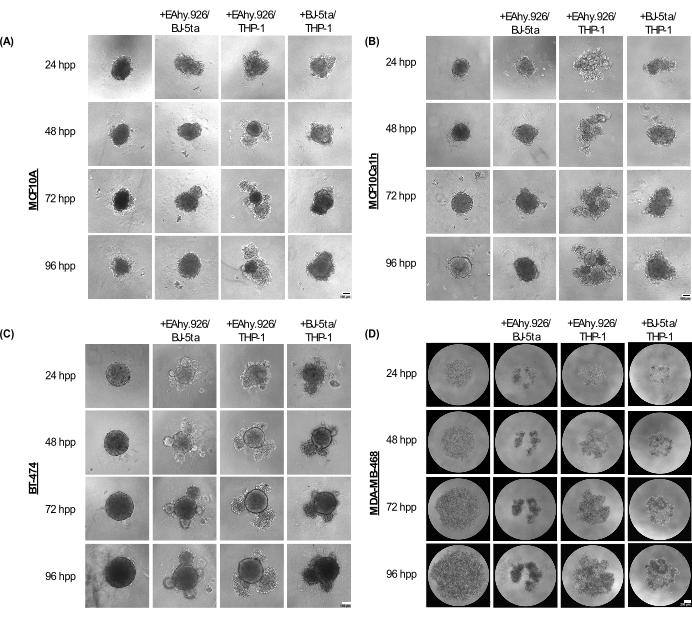
Şekil 2: Yapı iskelesi içermeyen 3D kültürlerde epitelyal tümör/tümör olmayan hücrelerle kombine edildiğinde epitelyal olmayan stromal hücrelerin kombinasyonları tarafından benimsenen mimari ve morfoloji yelpazesi. (A) MCF10A, (B) MCF10Ca1h, (C) BT-474, (D) MDA-MB-468 sferoidlerinin monokültürde veya stromal BJ-5ta fibroblastlar/Ea.hy926 mikrovasküler endotel hücreleri veya Ea.hy926/THP-1 monosit benzeri cella veya BJ-5ta/THP-1 hücreleri ile 96 saat boyunca ko-kültür koşullarında temsili parlak alan görüntüleri. Her sferoid, 2.000 hücrenin kaplanmasıyla oluşturuldu. Monokültür koşullarındaki sferoidler, 2.000 epitel hücresi kullanılarak oluşturuldu. Ko-kültür koşullarındaki sferoidler, 1.000 epitel hücresi ve 500 hücreli iki farklı stromal hücre tipi kullanılarak oluşturuldu. Tomurcuklanan veya agrega organoid benzeri yapıların oluşumu, MCF10A, MCF10Ca1h ve BT-474 epitel hücrelerinde kaplamadan 24 saat sonra sferoid ko-kültür koşullarında başlatıldı. MDA-MB-468 hücrelerinin sıkıştırılması, kaplamadan 25 saat sonra sferoid ko-kültür koşullarında gözlendi. Ölçek çubukları = 100 μm. Kısaltma: hpp = kaplama sonrası saat. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Kaplamadan 72 saat sonra, EA.hy926 ve THP-1 veya BJ-5ta ve THP-1 ile birlikte kültürlenen MCF10A, MCF10Ca1h ve BT-474 hücreleri, monokültür epitel sferoidlerine kıyasla sferoid alanında önemli bir artış gösterdi. MCF10Ca1h ayrıca EA.hy926 ve BJ-5ta ile birlikte kültürlendiğinde sferoid alanda önemli bir artış gösterdi. Birlikte kültürlenmiş sferoidlerde tomurcuklanan yapıların başlangıcı, EA.hy926 ve THP-1 veya BJ-5ta ve THP-1 ile birlikte kültürlenmiş MCF10A, MCF10Ca1h ve BT-474 için küresel dairesellikte önemli bir azalmaya yol açtı. Hem EA.hy926 hem de BJ-5ta ile birlikte kültürlenmiş BT-474 için benzer etkiler gözlenmiştir (Şekil 3A, B). Buna karşılık, EA.hy926 ve BJ-5ta, EA.hy926 ve THP-1 veya BJ-5ta ve THP-1 ile birlikte kültürlenen MDA-MB-468 hücreleri, monokültür MDA-MB-468 sferoidlerine kıyasla sferoid alanında önemli bir azalma gösterdi; ancak döngüsellik üzerinde herhangi bir etkisi olmamıştır (Şekil 3A,B).

Şekil 3: Kaplamadan 72 saat sonra tek kültürlü ve heteroçok hücreli stromal 3D iskelesiz kültürlerin alan ve dairesellik analizi grafikleri. (A) Tek kültürlü ve heteromultiselüler stromal sferoid kültürlerde MCF10A, MCF10Ca1h, BT-474 ve MDA-MB-468'in ortalama alanı (cm2) ve (B) kaplamadan 72 saat sonra. Rapor edilen veriler en az üç bağımsız biyolojik kopyayı temsil eder ve aksi belirtilmedikçe SEM ± teknik kopya ortalamaları olarak rapor edilir. *, **, *** veya ***, aksi belirtilmedikçe sırasıyla 0,05, 0,01, 0,001 veya 0,0001 < p değerlerini temsil eder. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Hücre izleyici boyasının sferoid oluşumundan önce BT-474 tümörjenik epitel hücrelerine ve stromal hücrelere uygulanması, EA.hy926 ve BJ-5ta dahil olmak üzere stromal hücrelerin, merkezi BT474 sferoidlerinin çevresinde tomurcuklanan yapıları oluşturduğunu gösterdi (Şekil 4, Ek Video S1, Ek Video S2, Ek Video S3 ve Ek Video S4). Kaplamadan 48 saat sonra, fibroblastlarla birlikte kültürlenen sferoidlerin bireysel geniş alan floresan görüntüleri, fibroblast sferoidlerinin endotel hücreleri ile birlikte lokalize olduğunu, ancak BT-474 sferoidleri ile ko-lokalize olmadığını ortaya koymaktadır. Endotel hücrelerinin bir azınlığının da ko-kültür koşullarında BT-474 sferoidleri ile birlikte lokalize olduğu bulundu. Bu, sferoid içindeki stromal hücrelerin düzenlenmesinin organoid benzeri bir morfoloji ile ilişkili olduğunu göstermektedir.
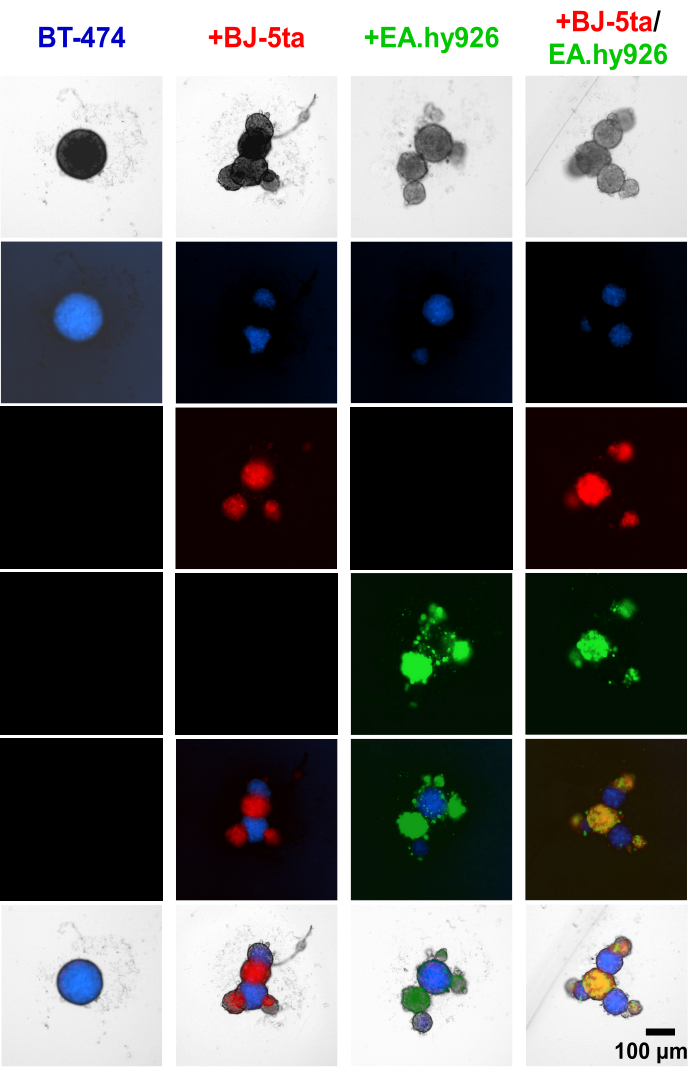
Şekil 4: Kaplamadan 48 saat sonra heteroçok hücreli 3D kültürlerde diferansiyel olarak boyanmış stromal ve BT-474 hücrelerinin geniş alanlı floresan hareketsiz görüntüleri. BT-474 sferoidleri mavi hücre izleyici floresan boya ile boyanır. BJ-5ta fibroblastları, kırmızı renkle temsil edilen turuncu hücre izleyici boya ile boyanır. Ea.hy926 endotel hücreleri, yeşil renkle temsil edilen koyu kırmızı hücre izleyici boyası ile boyanır. Her sferoid, 2.000 hücrenin kaplanmasıyla oluşturuldu. Monokültür koşullarındaki sferoidler, 2.000 epitel hücresi kullanılarak oluşturuldu. Ko-kültür koşullarındaki sferoidler (BT-474 / BJ-5ta, BT-474 / Ea.hy926) 1.000 epitel hücresi ve 1.000 stromal hücre kullanılarak oluşturuldu. Çift ko-kültür koşullarında (BT-474 / BJ-5ta / Ea.hy926) sferoidler, 1.000 epitel hücresi ve her stromal hücre tipinden 500 hücre kullanılarak oluşturuldu. Rakamlar en az üç biyolojik kopyayı temsil etmektedir. Ölçek çubuğu = 100 μm. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Organoid sferoid modelimizin biyolojik uygunluğunu değerlendirmek için, sferoidler, kaplamadan 24 saat sonra bazal membran özü çözeltisi ile kaplandı. Monokültür BT-474 sferoidleri, kaplamadan 120 saat sonra hiçbir invaziv özellik göstermedi. Bununla birlikte, BJ-5ta veya EA.hy926 ile birlikte kültürlenen BT-474 sferoidleri, sferoidin çevresinde, iskele bazal membran ekstrakt çözeltisi ortamını istila eden yapılar geliştirdi. Bu çıkıntıların sayısı ve uzunluğu, hem BJ-5ta hem de EA.hy926 ile birlikte kültürlenen BT-474 sferoidlerinde, kaplamadan 48 saat ila 120 saat sonra önemli ölçüde artmıştır (Şekil 5, Ek Video S5, Ek Video S6, Ek Video S7 ve Ek Video S8).
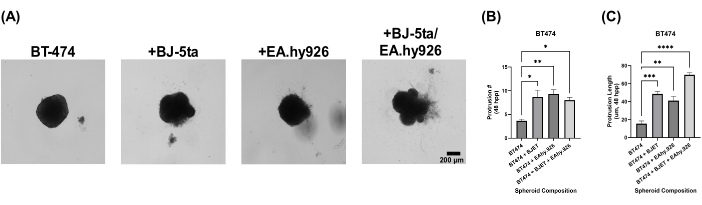
Şekil 5: Kaplamadan 5 gün sonra bazal membran ekstrakt çözeltisi kaplaması ile heteroçok hücreli 3D kültürlerde BT-474 hücrelerinin parlak alan hareketsiz görüntüleri. Her sferoid, 2.000 hücrenin kaplanmasıyla oluşturuldu. Bazal membran ekstrakt çözeltisi, kaplamadan 24 saat sonra sferoidlerin üzerine kaplandı. Monokültür koşullarındaki sferoidler, 2.000 epitel hücresi kullanılarak oluşturuldu. Ko-kültür koşullarında (BT-474 / BJ-5ta ve BT-474 / Ea.hy926) sferoidler, 1.000 epitel hücresi ve 1.000 stromal hücre kullanılarak oluşturuldu. Çift ko-kültür koşullarında (BT-474 / BJ-5ta / Ea.hy926) sferoidler, 1.000 epitel hücresi ve her stromal hücre tipinden 500 hücre kullanılarak oluşturuldu. (A) Bazal membran ekstrakt çözeltisine gömülü kanser sferoidinden çıkıntı yapan istilacı yapılar, ko-kültür koşullarında gözlemlenebilir. (B) 48 hpp zamanındaki invaziv çıkıntı sayısının kalifikasyonu. (C) Zaman itibariyle invaziv çıkıntı uzunluğunun kalifikasyonu 48 hpp. Rakamlar en az üç biyolojik kopyayı temsil etmektedir. Ölçek çubuğu = 200 μm. Kısaltma: hpp = kaplama sonrası saat. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Ek Video S1: Hücre izleyici mavi boya ile BT-474 monokültür sferoidi. BT-474 (2.000) hücreleri, sferoidler oluşturmak için U şeklinde tabanlı, ultra düşük bağlantılı 96 oyuklu bir mikroplaka içinde yeniden süspanse edildi. Parlak alan ve geniş alan floresan görüntülerinin örtüşmesi 48 saat boyunca yakalandı. Kısaltma: ULA = ultra düşük bağlantı. Bu videoyu indirmek için lütfen buraya tıklayın.
Ek Video S2: BT-474 sferoidleri, BJ-5ta fibroblastları ile birlikte kültürlenmiştir. BT-474 (1.000) ve 1.000 BJ-5ta fibroblastları, sferoidler oluşturmak için ULA plakalarında yeniden süspanse edildi. BT-474 hücreleri hücre izleyici mavi boya ile ve BJ-5ta fibroblastlar hücre izleyici turuncu boya ile inkübe edildi. Parlak alan ve geniş alan floresan (mavi = BT-474, kırmızı = BJ-5ta) görüntülerinin örtüşmesi 48 saat boyunca yakalandı. Kısaltma: ULA = ultra düşük bağlantı. Bu videoyu indirmek için lütfen buraya tıklayın.
Ek Video S3: BT-474 sferoidleri, Ea.hy926 endotel hücreleri ile birlikte kültürlenmiştir. BT-474 (1.000) ve 1.000 Ea.hy926 endotel hücresi, sferoidler oluşturmak için ULA plakalarında yeniden süspanse edildi. BT-474 hücreleri hücre izleyici mavi boya ile ve Ea.hy926 endotel hücreleri hücre izleyici koyu kırmızı boya ile inkübe edildi. Parlak alan ve geniş alan floresan (mavi = BT-474, yeşil = Ea.hy926) görüntülerin örtüşmesi 48 saat boyunca yakalandı. Kısaltma: ULA = ultra düşük bağlantı. Bu videoyu indirmek için lütfen buraya tıklayın.
Ek Video S4: BT-474 sferoidleri, BJ-5ta fibroblastları ve Ea.hy926 endotel hücreleri ile birlikte kültürlenmiştir. BT-474 (1.000), 500 BJ-5ta fibroblast ve 500 Ea.hy926 endotel hücresi, sferoidler oluşturmak için ULA plakalarında yeniden süspanse edildi. BT-474 hücreleri, hücre izleyici mavi boya ile inkübe edildi. BJ-5ta fibroblastlar ve Ea.hy926 endotel hücreleri sırasıyla hücre izleyici turuncu boya ve koyu kırmızı boya ile inkübe edildi. Parlak alan ve geniş alan floresan (mavi = BT-474, kırmızı = BJ-5ta, yeşil = Ea.hy926) görüntülerinin örtüşmesi 48 saat boyunca yakalandı. Kısaltma: ULA = ultra düşük bağlantı. Bu videoyu indirmek için lütfen buraya tıklayın.
Ek Video S5: Bazal membran ekstrakt çözeltisinde BT-474 monokültür sferoidi. BT-474 hücreleri (2.000), sferoidler oluşturmak için ULA plakalarında yeniden süspanse edildi ve sferoidler, kaplamadan 24 saat sonra bir bazal membran çözeltisine gömüldü. Brightfield görüntüleri 60 saat boyunca çekildi. Kısaltma: ULA = ultra düşük bağlantı. Bu videoyu indirmek için lütfen buraya tıklayın.
Ek Video S6: BT-474 sferoidleri, bazal membran ekstrakt çözeltisinde BJ-5ta fibroblastları ile birlikte kültürlenmiştir. BT-474 (1.000) ve 1.000 BJ-5ta fibroblastları, sferoidler oluşturmak için ULA plakalarında yeniden süspanse edildi ve sferoidler, kaplamadan 24 saat sonra bir bazal membran ekstrakt çözeltisine gömüldü. Brightfield görüntüleri 60 saat boyunca çekildi. Kısaltma: ULA = ultra düşük bağlantı. Bu videoyu indirmek için lütfen buraya tıklayın.
Ek Video S7: BT-474 sferoidleri, bazal membran ekstrakt çözeltisinde Ea.hy926 endotel hücreleri ile birlikte kültürlenmiştir. BT-474 (1.000) ve 1.000 Ea.hy926 endotel hücreleri, sferoidler oluşturmak için ULA plakalarında yeniden süspanse edildi ve sferoidler, kaplamadan 24 saat sonra bir bazal membran ekstrakt çözeltisine gömüldü. Brightfield görüntüleri 60 saat boyunca çekildi. Kısaltma: ULA = ultra düşük bağlantı. Bu videoyu indirmek için lütfen buraya tıklayın.
Ek Video S8: BT-474 sferoidleri, bazal membran ekstrakt çözeltisinde BJ-5ta fibroblastları ve Ea.hy926 endotel hücreleri ile birlikte kültürlenmiştir. BT-474 (1.000), 500 BJ-5ta fibroblast ve 500 Ea.hy926 endotel hücresi, sferoidler oluşturmak için ULA plakalarında yeniden süspanse edildi ve sferoidler, kaplamadan 24 saat sonra bir bazal membran ekstrakt çözeltisine gömüldü. Brightfield görüntüleri 60 saat boyunca çekildi. Bu videoyu indirmek için lütfen buraya tıklayın.
Tartışmalar
Hetero-çok hücreli sferoid modelimiz, epitelyal-stromal hücre etkileşimlerinin, iskele içermeyen 3D kültür koşullarında stromal hücre tomurcuklanmasını ve iskele tabanlı 3D kültür koşullarında istilacı yapıların oluşumunu tetiklediğini göstermektedir. Hem tümörjenik hücre hatlarında (MCF10Ca1h ve BT-474) hem de tümörjenik olmayan epitel hücre hattı MCF10A'da (Şekil 2A-C) tutarlı tomurcuklanma yapısı oluşumu gözlemledik. İlginç bir şekilde, MCF10A, MCF10Ca1h ve BT-474 hücre hatlarından gelen sferoidler, ister monokültürde ister fibroblastlar ve endotel hücreleri ile ko-kültürde olsun, iskele içermeyen ortamlarda dairesel ve kompakt tomurcuklanma yapıları oluştururken, MDA-MB-468 hücre hattından gelen sferoidler daha az sıkıştırma gösterdi (Şekil 2D). MDA-MB-468 hücrelerinin, test edilen diğer epitel hücre dizileri gibi dairesel sferoidler oluşturması beklendiğinden, bu beklenmedik bir durumdu. Hibrit bir epitelyal-mezenkimal primer meme kanseri hücre hattı olan hücre hattı SUM-149'un MCF10A, MCF10Ca1h ve BT-474 gibi kompakt sferoidler oluşturduğu bulundu (veriler gösterilmemiştir)28. Gelecekteki araştırmalar, MDA-MB-468 hücre hattında daha az kompakt sferoidlerin oluşumuna aracılık eden sinyal yolaklarını araştırmalıdır, çünkü bu tür anormallikler, yeni terapötik stratejilerin geliştirilmesi için kullanılabilecek hücresel güvenlik açıklarını gösterebilir.
Farklı hücre hatlarının kombinasyonu ile ilgili olarak, THP-1 monosit benzeri hücreler, sferoidlerin tüm ko-kültür koşullarında gevşek agrega yapılarının oluşumunu indükler. THP-1 / Ea.hy926 hücreleri ile ko-kültür koşullarında, THP-1 / BJ-5ta hücreleri ile ko-kültür koşullarındakilere kıyasla tomurcuklanan yapılarda daha az sıkıştırma gözlenir (Şekil 2A-D). Bu nedenle, sferoidlerin sıkıştırılması, model 29,30'daki stromal hücre bileşiminden etkilenir.
Hetero hücre kombinasyonlarının tutarsız bir şekilde kaplanması, teknik kopyalarına kıyasla eksik sferoid gelişimine veya sferoid boyutunda değişkenliğe neden olabilir. Hücre kaplamasında tutarlılığın sağlanması çok önemlidir, çünkü sferoid fenotipini ve gelişimini belirleyen hücrelerin uzamsal düzenlemesi esas olarak ilk 48 saatiçinde gerçekleşir 31. Bu kritik dönemde, hücre oranları çok önemli bir rol oynar ve stromal hücrelerin oranı hem küresel alanı hem de daireselliği etkiler.
Hücre tipine bağlı olan gevşek küresel agregalar, manuel kullanım sırasında kolayca sökülebilir. Bununla birlikte, sferoidleri iskele benzeri bir bazal membran ekstrakt çözeltisi ile kaplarken veya bütün sferoid numuneleri toplarken manuel manipülasyon gereklidir. Bu sorunu azaltmak için, pipet aspirasyonu ile sferoidleri toplarken daha yavaş bir hızda çalışılması ve mümkün olduğunda manuel kullanımı en aza indirmeniz önerilir. Bazal membran ekstrakt çözeltisi kaplaması sırasında, sferoidler kuyu içinde kaymaya eğilimlidir ve genellikle kuyunun kenarına yerleşir. 3D sistemin matris özelliklerini korumak için bir bazal membran ekstraktı çözeltisi-ortam oranı önemlidir; Bununla birlikte, bazal membran ekstrakt çözeltisinin viskozitesi nedeniyle sferoidler tam olarak sarılamaz, bu nedenle manuel müdahale gereklidir32. Kuyunun plastik kenarına yakın ışık kırılması görüntü netliğini etkileyebileceğinden, merkezlenmemiş küresel konumlandırma görüntüleme için bir zorluk oluşturur.
Bu çalışmada kullanılan sferoidler, insan kanser hücre dizilerinden oluşuyordu; Burada açıklanan yöntemler henüz birincil hücre hatlarına uygulanmamıştır. Sonuçlarımız, spesifik hücre-hücre etkileşimlerinin organoid benzeri yapıların oluşumunu yönlendirebileceğini ve bu yöntemin çok çeşitli tümörojenik hücre dizilerine potansiyel uygulanabilirliğini gösterdiğini göstermektedir. Bununla birlikte, modelimiz tümör mikroçevresinin karmaşıklığını taklit etmeye çalışırken, farklı hücresel proliferasyon oranları uzun süreli çalışmalar için bir zorluk teşkil etmektedir33. Hızla çoğalan hücreler, daha yavaş çoğalan hücrelerden daha fazla büyüme eğilimindedir ve bu da bu modeli uzun süreli deneyler için daha az uygun hale getirir. Ek olarak, hücre hatları için farklı büyüme ortamı tipi gereksinimleri, sferoid fenotiplere yol açabilecek ek faktörler ortaya çıkarabilir. Bu çalışmadaki hücre dizilerinin çoğu DMEM ortamında büyütülmüştür. Farklı ortamlarda büyütülen hücre dizileri ile yapılan çalışmalar, çeşitli ortam oranlarını test eden farklı kültür koşulları gerektirebilir; Ancak bu etki uzun süreli deneylerdegözlenmektedir 30.
Modelimiz diğer 3D kanser modellerine göre çeşitli avantajlar sunmaktadır. Ürettiğimiz sferoidler, tek tip ve tekrarlanabilir bir başlangıç morfolojisine ve boyutuna sahiptir, bu da tedavi sonuçlarını kontrollerle karşılaştırmayı kolaylaştırır. Buna karşılık, ortamda veya iskelelerde asılı duran tek hücreleri kullanan bazı modeller, değişken hücresel uzamsal dağılımlara neden olarak tutarsızlığa yol açabilir. Bu model, farklı hücre popülasyonları arasındaki etkileşimlerin etkili bir şekilde incelenebileceğini göstermektedir.
Geleneksel olarak, organoid ve sferoid modeller, besinlerin, hipoksinin veya hücresel düzenlemenin gradyanlarını araştırmak için monokültür kanser hücrelerinden veya kanser hücresi ko-kültürlerinden oluşmuştur34. Ek olarak, bu model, kaplamadan 24 saat sonra iskeleli bir ortamda incelenebilir ve çeşitli hücre-hücre etkileşimleri tarafından yönlendirilen erken istila olaylarını keşfetme fırsatı sağlar. Alternatif 3D kanser yaklaşımları, sferoid morfolojisi ve invazivliğindeki değişiklikleri incelemek için farklı iskele matrisi bileşenleri kullanırken, bu model, bu değişikliklerin hem hücre popülasyonu dinamikleri hem de iskele bileşimi bağlamında araştırılmasına izin vererek bunları tamamlar35.
Yöntemlerimiz kullanılarak üretilen çoğu sferoid, manuel kullanımdan sonra yapısal bütünlüklerini koruyarak sonraki uygulamalarda numune toplamaya olanak tanır. CRISPR-Cas9, lentiviral shRNA transdüksiyonu ve siRNA interferansı gibi geleneksel genetik modifikasyonlar, sferoid oluşumunun yukarı akışında tanıtılabilir. Bu sferoidlerde gözlenen karmaşık davranışlar, RNA-seq kullanılarak daha fazla araştırılabilen gen ekspresyonunda dinamik değişiklikler olduğunu düşündürmektedir. CycIF, scRNA-seq, CosMx ve Visium gibi gelişmiş teknikler, uzamsal veya tek hücre seviyelerinde genomik ve proteomik çalışmak için de kullanılabilir. Bu sferoid model, kanser hücrelerine ulaşmadan önce stromal hücre tomurcukları ve terapötik ajanlar arasındaki etkileşimleri yakalayarak hedeflenen tümör terapötiklerinin in vivo çalışmalarını taklit etme potansiyeline sahiptir. Bu önemlidir, çünkü stromal hücrelerin ilacın gücünü etkileyip etkilemediğini belirlemeye yardımcı olabilir ve potansiyel olarak kanser hücrelerini terapötik etkilerden koruyabilir.
Açıklamalar
Yazarların beyan edebilecekleri herhangi bir çıkar çatışması yoktur.
Teşekkürler
Baylor Üniversitesi Gelişimsel Onkogen Laboratuvarı üyelerine, bu makalenin hazırlanması sırasındaki yararlı görüşleri ve geri bildirimleri için teşekkür ederiz. Finansman desteği, Baylor Üniversitesi Biyoloji Bölümü ve Fen Edebiyat Fakültesi, NIH-NIGMS 2SC1GM121182 (J.A.K.'ye) tarafından sağlandı.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 15 mL Polypropylene Centrifuge Tubes | Falcon | 14-959-53A | |
| 96-Well, Treated, U-Shaped-Bottom Microplate | Thermo Scientific | 12566432 | |
| 100 mm Dish Cell Culture Treated Surface | Thermo Scientific | 130182 | |
| 170 L CO2 Incubators | VWR | VWR51014991(10810902) | |
| 200 Self-Sealing Barrier Pipet Tips | Fisher Scientific | 02-682-255 | |
| 500 mL DMEM/Hams F-12, [+] L-glutamine | Corning | 10-090-CV | |
| 1000 Self-Sealing Barrier Pipet Tips | Molecular Biology Products Inc. | 2179HR | |
| Animal-Free Recombinant Human EGF | PeproTech | AF-100-15 | |
| Automated Pipette Repeater E3x | Eppendorf | 4987000410 | |
| Basement membrane solution | Huntsman Cancer Institute | https://healthcare.utah.edu/huntsmancancerinstitute/ | |
| Bead Bath | Lab Armor | 74300706 | |
| Biorender | Biorender | Biorender.com | |
| Biosafety Laminar Flow Cabinets | Thermo Scientific | 300590389 | |
| BioSpa 8 Automated Incubator | Agilent | 23082120 | |
| Cell Counter | Invitrogen | AMQAF2000 | |
| Cell Counting Chamber Slides | Thermo Scientific | C10283 | |
| CellTracker Deep Red | Thermo Fisher Scientific | C34565 | |
| Centrifuge | Thermo Scientific | 13100675 | |
| Cholera Toxin B subunit | Sigma-Aldrich | C9903-1MG | |
| Combitips advanced, Sterile, 5.0 mL | Fisher Scientific | 13-683-714 | |
| Cytation 10 Reader Imager | Agilent | 2105245 | |
| Defined Trypsin Inhibitor | Gibco | R007100 | soybean trypsin inhibitor in 1x PBS |
| Donor Horse Serum, 500 mL, United States Origin | Corning | 35-030-CV | |
| Dulbecco's Modified Eagle's Medium | Corning | 10-013-CV | |
| Excel Sofware | Microsoft office 365 | https://www.microsoft.com/en-us/microsoft-365/excel | |
| Fetal Bovine Serum | Thermo Scientific | 26140079 | |
| Fetal Bovine Serum, qualified, US origin | Thermo Scientific | 26140079 | |
| Gentamicin Sulfate, Liquid | Corning | 30-005-CR | |
| GraphPad Prism | |||
| Hydrocortisone solution,50 µM, sterile-filtered, BioXtra | Sigma-Aldrich | H6909-10ML | |
| Image J Software | Fiji | https://imagej.net/ij/ | |
| Insulin solution human | Sigma-Aldrich | I9278-5ML | |
| Magnifying Glass | Fisher Scientific | 01-182-392 | |
| Microcentrifuge Tube | Costar | 3621 | |
| Microscope | Olympus | CKX53SF | |
| Mini Lightbox | Fisher Scientific | 361044708 | |
| Molecular Probes CellTracker Blue CMAC Dye | Fisher Scientific | C2110 | |
| Molecular Probes CellTracker Orange CMRA Dye | Fisher Scientific | C34551 | |
| Penicillin-Streptomycin Solution | Cytiva | SV30010 | |
| Penicillin-Streptomycin Solution | Cytiva | SV30010 | |
| Phase-Contrast Microscope | Echo | RVSF1000 | |
| Phosphate Buffered Saline | Fisher Scientific | SH3025601 | |
| Pipet Controller | Corning | 4099 | |
| Pipette 100 – 1,000 µL | Eppendorf | 3123000063 | |
| Pipette 20 – 200 µL | Eppendorf | 3123000055 | |
| Prism | GraphPad Software | https://www.graphpad.com/features | |
| RPMI 1640 with L-glutamine and 25 mM HEPES | Corning | 10-041-CV | |
| Serological Pipette, 10 mL | Thermo Scientific | 170356N | |
| Serological Pipette, 25 mL | Thermo Scientific | 170357N | |
| Serological Pipette, 5 mL | Thermo Scientific | 170355N | |
| Trypan Blue Solution, 0.4% | Corning | 25900CI | |
| Trypsin-EDTA, 0.25% | Corning | 25053CI |
Referanslar
- de Visser, K. E., Joyce, J. A. The evolving tumor microenvironment: From cancer initiation to metastatic outgrowth. Cancer Cell. 41 (3), 374-403 (2023).
- Hanahan, D., Weinberg, R. A. Hallmarks of cancer: The next generation. Cell. 144 (5), 646-674 (2011).
- Anderson, N. M., Simon, M. C. The tumor microenvironment. Curr Biol. 30 (16), R921-R925 (2020).
- Baghban, R., et al. Tumor microenvironment complexity and therapeutic implications at a glance. Cell Commun Signal. 18 (1), 59 (2020).
- Sahai, E., et al. A framework for advancing our understanding of cancer-associated fibroblasts. Nat Rev Cancer. 20 (3), 174-186 (2020).
- Erdogan, B., Webb, D. J. Cancer-associated fibroblasts modulate growth factor signaling and extracellular matrix remodeling to regulate tumor metastasis. Biochem Soc Trans. 45 (1), 229-236 (2017).
- Iozzo, R. V., Sanderson, R. D. Proteoglycans in cancer biology, tumour microenvironment and angiogenesis. J Cell Mol Med. 15 (5), 1013-1031 (2011).
- Amersfoort, J., Eelen, G. Immunomodulation by endothelial cells - partnering up with the immune system. Nat Rev Immunol. 22 (9), 576-588 (2022).
- Balani, S., Nguyen, L. V., Eaves, C. J. Modeling the process of human tumorigenesis. Nat Commun. 8 (1), 15422 (2017).
- Drost, J., Clevers, H. Organoids in cancer research. Nat Rev Cancer. 18 (7), 407-418 (2018).
- Wang, E., Xiang, K., Zhang, Y., Wang, X. -. F. Patient-derived organoids (PDOs) and PDO-derived xenografts (PDOXs): New opportunities in establishing faithful pre-clinical cancer models. J Natl Cancer Cent. 2 (4), 263-276 (2022).
- Kamb, A. What's wrong with our cancer models. Nat Rev Drug Discov. 4 (2), 161-165 (2005).
- Tuveson, D., Clevers, H. Cancer modeling meets human organoid technology. Science. 364 (6444), 952-955 (2019).
- Zitvogel, L., Pitt, J. M., Daillère, R., Smyth, M. J. Mouse models in oncoimmunology. Nat Rev Cancer. 16 (12), 759-773 (2016).
- Liu, Y., et al. Patient-derived xenograft models in cancer therapy: technologies and applications. Signal Transduct Target Ther. 8 (1), 160 (2023).
- Ben-David, U., et al. Patient-derived xenografts undergo mouse-specific tumor evolution. Nat Genet. 49 (11), 1567-1575 (2017).
- Byrne, A. T., et al. Interrogating open issues in cancer precision medicine with patient-derived xenografts. Nat Rev Cancer. 17 (4), 254-268 (2017).
- Ivanics, T., et al. Patient-derived xenograft cryopreservation and reanimation outcomes are dependent on cryoprotectant type. Lab Invest. 98 (7), 947-956 (2018).
- Biju, T. S., Priya, V. V., Francis, A. P. Role of three-dimensional cell culture in therapeutics and diagnostics: an updated review. Drug Deliv and Transl Res. 13 (9), 2239-2253 (2023).
- Urzì, O., et al. Three-dimensional cell cultures: The bridge between in vitro and in vivo models. Int J Mol Sci. 24 (15), 12046 (2023).
- Cacciamali, A., Villa, R., Dotti, S. 3D cell cultures: Evolution of an ancient tool for new applications. Front Physiol. 13, 836480 (2022).
- Abuwatfa, W. H., Pitt, W. G. Scaffold-based 3D cell culture models in cancer research. J Biomed Sci. 31 (1), 7 (2024).
- Yakavets, I., et al. Advanced co-culture 3D breast cancer model for investigation of fibrosis induced by external stimuli: optimization study. Sci Rep. 10 (1), 21273 (2020).
- Mohammadrezaei, D., et al. Predicting and elucidating the post-printing behavior of 3D printed cancer cells in hydrogel structures by integrating in-vitro and in-silico experiments. Sci Rep. 13 (1), 1211 (2023).
- Kuen, J., Darowski, D., Kluge, T., Majety, M. Pancreatic cancer cell/fibroblast co-culture induces M2 like macrophages that influence therapeutic response in a 3D model. PLOS ONE. 12 (7), e0182039 (2017).
- Bray, F., et al. Global cancer statistics 2022: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin. 74 (3), 229-263 (2024).
- Kennecke, H., et al. Metastatic behavior of breast cancer subtypes. J Clin Oncol. 28 (20), 3271-3277 (2010).
- Neve, R. M., et al. A collection of breast cancer cell lines for the study of functionally distinct cancer subtypes. Cancer Cell. 10 (6), 515-527 (2006).
- Pingitore, P., et al. Human multilineage 3D spheroids as a model of liver steatosis and fibrosis. Int J Mol Sci. 20 (7), 1629 (2019).
- Bar-Ephraim, Y. E., Kretzschmar, K. Organoids in immunological research. Nat Rev Immunol. 20 (5), 279-293 (2020).
- Beerkens, A. P. M., et al. Characterizing OXPHOS inhibitor-mediated alleviation of hypoxia using high-throughput live cell-imaging. Cancer Metab. 12 (1), 13 (2024).
- Feaster, T. K., et al. Matrigel mattress. Cir Res. 117 (12), 995-1000 (2015).
- Huang, Z., Yu, P., Tang, J. Characterization of triple-negative breast cancer MDA-MB-231 cell spheroid model. Onco Targets Ther. 13, 5395-5405 (2020).
- Nam, S., Khawar, I. A., Park, J. K., Chang, S., Kuh, H. -. J. Cellular context-dependent interaction between cancer and stellate cells in hetero-type multicellular spheroids of pancreatic tumor. Biochem Biophys Res Commun. 515 (1), 183-189 (2019).
- Monteiro, M. V., Gaspar, V. M., Ferreira, L. P. Hydrogel 3D in vitro tumor models for screening cell aggregation mediated drug response. Biomater Sci. 8 (7), 1855-1864 (2020).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır