Method Article
上皮癌细胞无支架 3D 培养物中的异多细胞基质细胞驱动侵袭
摘要
迫切需要能够捕获异细胞串扰的 3D 癌症模型来研究癌症转移。我们的研究展示了在支架和无支架环境中异多细胞基质-上皮细胞的产生,可用于研究侵袭和细胞空间分布。
摘要
乳腺癌是美国女性癌症相关死亡的第二大原因实体瘤的类器官模型已被证明可以忠实地概括癌症进展的各个方面,例如增殖和侵袭。尽管患者来源的类器官和患者来源的异种移植类器官具有病理生理学意义,但它们的繁殖成本高昂,难以作,并且主要由肿瘤微环境 (TME) 中增殖最严重的细胞类型组成。这些局限性阻止了它们用于阐明疾病进展的细胞机制,这些机制依赖于肿瘤相关基质细胞,这些基质细胞存在于 TME 中,已知会导致转移和治疗耐药。
在这里,我们报告了培养上皮-基质多细胞 3D 培养物的方法。这些方法的优点包括一种经济高效的系统,可在无支架的环境中快速生成类器官样 3D 培养物,可用于在水凝胶支架内以单细胞分辨率跟踪侵袭。具体来说,我们展示了如何使用 BT-474 乳腺癌细胞与成纤维细胞 (BJ-5ta)、单核细胞样细胞 (THP-1) 和/或内皮细胞 (EA.hy926) 相结合来生成这些异质多细胞 3D 培养物。此外,细胞群的差异荧光标记使延时显微镜能够定义 3D 培养组装和侵袭动力学。
值得注意的是,向 BT-474 细胞的 3D 培养物中添加任意两种基质细胞组合会显著降低 3D 培养物的圆度,这与类器官样或次级球状体结构的存在一致。在追踪染料实验中,成纤维细胞和内皮细胞共定位于外周类器官样突起中,并在空间上与初级 BT-474 球体分离。最后,BT-474 细胞的异多细胞 3D 培养物增加了水凝胶侵袭能力。由于我们在非致瘤性和致瘤乳腺上皮细胞的异质多细胞 3D 培养物中观察到了这些突出的结构,因此这项工作提供了一种高效且可重复的方法,用于在无支架环境中生成类器官样 3D 培养物,用于后续分析与实体瘤进展相关的表型。
引言
现在人们认为癌症进展取决于两个主要因素:肿瘤细胞的遗传/表观遗传变化以及与肿瘤微环境 (TME) 中非肿瘤细胞的无数相互作用1。虽然细胞的遗传变化被认为是肿瘤起始所必需的,但仅靠这种改变不足以预防肿瘤进展和转移2。TME 的组成部分最初被认为是无声的旁观者,现在已知通过与肿瘤细胞的相互和动态串扰来积极促进癌症进展3。TME 组成因肿瘤起源的组织、肿瘤分期和患者特征而异,但标志性特征包括基质癌相关成纤维细胞 (CAF)、细胞外基质 (ECM)、血管内皮细胞以及适应性和髓系免疫细胞 1,4。
TME 中的基质 CAF 由不同来源和功能的成纤维细胞亚型组成5。这种 CAF 是 TME 的关键组成部分,因为它们在多个界面与肿瘤细胞相互作用。CAF 分泌改变基质刚度的 ECM 蛋白,这可能通过胶原蛋白、蛋白聚糖和纤连蛋白的过度沉积来限制药物递送,或者允许肿瘤细胞通过分泌 ECM 降解基质金属蛋白酶 (MMP) 从原发肿瘤部位侵入6,7。此外,CAF 通过分泌多种生长因子、细胞因子和血管生成因子(如表皮生长因子 (EGF)、转化生长因子 β (TGF-β) 和血管内皮生长因子 (VEGF))来促进肿瘤生长、迁移和血管形成 1,6。同时,在缺氧 TME 的刺激下,内皮细胞还通过增加血管生成因子的分泌和降低白细胞粘附分子的分泌来促进肿瘤血管形成并抑制免疫细胞功能 1,8。
由于癌症进展明显复杂,将 TME 基质成分纳入基础癌症研究变得至关重要。然而,建立忠实概括已知肿瘤病理生理学的模型仍然是一个重要的未满足需求 9,10。虽然传统的二维 (2D) 细胞培养模型易于处理、培养速度快且可重复性高,但它仅由快速增殖的癌细胞克隆组成,并不反映肿瘤中发现的细胞异质性 10,11,12。以类似的方式,由于近亲繁殖的低遗传异质性、免疫系统的显著差异和组织学复杂性,转基因小鼠模型也无法捕获人类肿瘤生物学13,14。由于这些限制,从经典癌症模型开发的治疗方法往往无法转化为临床环境。
患者来源的癌症模型(如患者来源的异种移植物和患者来源的类器官)可以通过捕获原位肿瘤分子特征、遗传背景和细胞组织来解决传统癌症模型的缺点 10,11,15。然而,这种患者来源的异种移植物和类器官需要复杂的植入程序和较长的培养时间16,17。结合肿瘤采集和采样位点的变化以及冻存效率低下,需要开发模型作为经典 2D 细胞培养和患者来源癌症模型之间的桥梁11,18。在这方面,细胞培养的 3D 模型可以作为可以快速培养的模型,并捕获重要的体内肿瘤特征,例如细胞间相互作用、细胞间 ECM 相互作用、缺氧、血管生成和 ECM 的产生19,20。
3D 细胞培养模型分为无支架模型系统和基于支架的模型系统。在无支架系统中,通过使用特定的低附着细胞培养板或通过纵培养方法的物理参数,诱导细胞自聚集成球形。获得无支架 3D 球体的既定方法包括通过离心进行的简单细胞沉淀培养、悬挂微孔板液滴、磁悬浮以及动态生物反应器和微流体系统20,21。通过添加基于聚合物或水凝胶的支架来模拟生理细胞外基质,从而建立基于支架的 3D 细胞培养物 19,22。此类模型在模拟体内细胞组织、拓扑结构、基质附着、迁移和药物反应方面具有巨大潜力。
除了在疾病状态下对 ECM 组成模型进行支架作外,3D 细胞培养还可用于模拟 TME 中的异质细胞群。由癌细胞和基质成纤维细胞或内皮细胞组成的 3D 细胞培养物已用于研究癌症与单个非肿瘤细胞系的相互作用 23,24,25。扩增由多种异质细胞系组成的此类 3D 细胞培养物的可重现且具有成本效益的方法将有助于研究人员阐明肿瘤进展。在这里,我们报告了培养上皮-基质多细胞 3D 培养物以研究增殖、侵袭和细胞状态可塑性的方法。该方案描述了基于支架和基底膜提取物支架的乳腺癌细胞 3D 培养物,这些细胞与成纤维细胞 (BJ-5ta)、内皮细胞 (Ea.hy926) 和单核细胞样细胞 (THP-1) 的基质细胞组合共培养。乳腺癌目前是全球第二大最常见的癌症,也是美国女性确诊最多的癌症26。乳腺癌的死亡主要是由于该疾病的转移性和治疗耐药性,因为在被诊断患有侵袭性富含 HER2 和基底样乳腺癌亚型的患者中,总体和无转移生存期显着降低27。我们描述的 3D 细胞培养方案可能有助于开发经济高效、快速且可重复的培养方法,这些方法可以与福尔马林固定石蜡包埋的组织保存方法和随后的空间生物学应用配对。
研究方案
1. 细胞培养基
注意:在生物安全柜内准备所有培养基。
- 为了制备 BJ-5ta、BT474、EA.hy926 和 MDA-MB-468 的细胞培养基,用移液管补充 500 mL Dulbecco 改良 Eagle 培养基 (DMEM) 高葡萄糖,含 10% 热灭活胎牛血清 (FBS) 和 1% 青霉素-链霉素。用微量移液器掺入 0.1% 庆大霉素。
- 要制备 MCF10A 的细胞培养基,请用移液管补充 500 mL DMEM/F12 和 5% 马血清和 1% 青霉素-链霉素。用微量移液器加入 0.1% 庆大霉素、1 mL 1 μg/mL 氢化可的松、500 μL 10 μg/mL 胰岛素、50 μL 100 ng/mL 霍乱毒素和 10 μL 20 ng/mL 表皮生长因子。
- 要制备 MCF10Ca1h 的细胞培养基,请用移液管补充 500 mL DMEM/F12 和 5% 马血清和 1% 青霉素-链霉素。用微量移液器掺入 0.1% 庆大霉素。
- 要制备用于 THP-1 的细胞培养基,请用移液管补充 500 mL 含 10% FBS 和 1% 青霉素-链霉素的 RPMI 1640。用微量移液器掺入 0.1% 庆大霉素。
- 每 2-3 天更换一次 BJ-5ta、BT474、EA.hy926、MDA-MB-468、MCF10A 和 MCF10Ca1h 的细胞培养基,直到细胞达到 70-80% 汇合度,每天用明场显微镜评估它们的生长。THP-1 细胞每周更换一次细胞培养基。
- 在 5% CO2 的标准细胞培养箱中,在 100 mm 培养皿中培养 BJ-5ta、BT474、EA.hy926、MDA-MB-468、MCF10A 和 MCF10Ca1h 细胞,表面经过细胞培养处理。
- 在 5% CO2 的标准细胞培养箱中,在 T75 细胞培养处理的培养瓶中培养 THP-1 细胞。
2. 细胞采集
- 打开紫外线灯对生物安全柜内部消毒 15 分钟。
- 打开生物安全柜窗扇以稳定气流并打开真空吸液系统。
- 用 70% 乙醇清洁真空吸液系统的内罩表面和管道。
- 在生物安全柜内准备新鲜的无血清细胞培养基:使用移液管补充 500 mL Dulbecco 改良 Eagle 培养基 (DMEM) 高葡萄糖和 1% 青霉素/链霉素。用微量移液器掺入 0.1% 庆大霉素。
- 在开始实验之前,将细胞培养基、磷酸盐缓冲盐水 (PBS) 和胰蛋白酶-EDTA (0.25%) 置于微珠浴中,将细胞培养基、磷酸盐缓冲盐水 (PBS) 和胰蛋白酶-EDTA (0.25%) 加热至 37 °C。
- 通过显微镜目视检查,确保细胞 70-80% 汇合。
- 用真空吸液器从铺板的细胞中吸出并丢弃培养基。用移液管用 2 mL PBS 洗涤剩余培养基一次,然后用真空吸液器吸出并丢弃 PBS。
注意:THP-1 细胞在悬浮液中生长;步骤 2.7-2.9 可以省略。 - 使用微量移液器向细胞培养皿中加入 1 mL 胰蛋白酶,并将板置于 37 °C 的 5% CO2 培养箱中 5 分钟。
- 用微量移液管向板中加入 1 mL 大豆胰蛋白酶抑制剂(在 1x PBS 中)来灭活胰蛋白酶。用 P1000 微量移液器移液液体混合物分散细胞簇,并从板底部收集细胞悬液。用微量移液管将细胞悬液转移到 15 mL 锥形管中,并在室温下以 100 × g 离心 5 分钟。用真空吸液器弃去上清液。
- 继续进行细胞计数。
3. 制备工作染料溶液和悬浮细胞染色
- 在打开细胞追踪分子荧光探针的小瓶之前(参见 材料表),让产品在设置为 37 °C 的珠浴中加热至室温 15 分钟。
- 使用微量移液器将冻干的 Cell Tracker 蓝色染料(质量 = 5 mg,分子量 = 209.6 g/mol)溶解至终浓度为 10 mM,含 2.385 mL DMSO。
- 使用微量移液器将冻干的 Cell Tracker 橙色染料(质量 = 50 μg,分子量 = 550.4 g/mol)溶解至终浓度为 10 mM,含 9.084 μL DMSO。
- 使用微量移液器将冻干的细胞追踪器深红染料(质量 = 15 μg,分子量 = 698.3 g/mol)溶解至 1 mM 的终浓度,含 20 μL DMSO。
- 用微量移液管在 2 mL 无血清 DMEM 培养基中稀释 1 μL 染料,制备工作 Cell Tracker 蓝色染料培养基溶液 (5 μM)。
- 用微量移液管在 2 mL 无血清 DMEM 培养基中稀释 1 μL 染料,制备工作 Cell Tracker 橙色染料培养基溶液 (5 μM)。
- 用微量移液管在 2 mL 无血清 DMEM 培养基中稀释 2 μL 染料,制备工作细胞追踪器深红染料培养基溶液 (1 μM)。
- 用微量移液管分别将上皮细胞、BJ-5ta 成纤维细胞和 Ea.hy926 内皮细胞重悬于制备的工作细胞追踪器蓝色、橙色和深红色染料培养基溶液 (2 mL) 中。
- 将试管在 37 °C 下在 5% CO2 培养箱中孵育 30 分钟。
- 孵育 30 分钟后,在室温下以 100 x g 离心试管 5 分钟。
- 用真空吸液器吸出并丢弃上清液,然后用微量移液管将沉淀彻底重悬于 1 mL 含 FBS 血清的 DMEM 培养基中。
- 继续进行细胞计数。
4. 细胞计数
- 收集 10 μL 细胞悬液,并用微量移液器将其转移到微管中。
- 与 10 μL 台盼蓝混合并彻底移液。
- 用微量移液管将 20 μL 细胞-台盼溶液转移到细胞计数室载玻片上。使用自动细胞计数仪插入细胞并计数。
- 从两个读数计算平均总活细胞数。
5. 计算
- 为每种细胞类型制备浓度为 6.67 ×10 3 个细胞/mL 的工作细胞储备液,相当于 2,000 个细胞/300 μL。
注意:总库存量将取决于实验样品量。 - 对于单一培养的球状体,确保每个独立样品由 300 μL 相当于 2,000 个上皮细胞的上皮细胞工作储备液组成。
- 对于共培养球状体(两种细胞类型),确保每个独立样品由 150 μL 上皮细胞工作原液和 150 μL 基质细胞工作原液组成。该样本将包含 1,000 个上皮细胞和 1,000 个基质细胞。
- 对于共培养球状体(三种细胞类型),确保每个独立样品由 150 μL 上皮细胞工作储备液、75 μL 基质细胞 #1 工作储备液和 75 μL 基质细胞 #2 工作储备液组成。该样品将包含 1,000 个上皮细胞、500 个工作原液 #1 的基质细胞和 500 个工作原液 #2 的基质细胞。
6. 电镀
- 用微量移液器将所需体积转移至微管中,进行 3 次技术重复,外加 1 次。用移液管充分混合,然后将 300 μL 样品转移到 U 形底、超低附件 96 孔微孔板的孔中。
- 对每个额外的技术副本重复此过程。
- 将 96 孔板置于 37 °C 的培养箱中。
7. 明场成像
- 使用显微镜每 24 小时至 96 小时观察球体生长和形态。
- 使用相差显微镜对球体进行成像。
8. 用示踪剂染料染色的球体和覆盖有基底膜提取物的球体的宽场成像方案设置
- 打开 材料表中列出的成像和自动培养箱设备,并在成像软件的任务管理器中创建新的成像协议。在 Procedure(程序 )选项卡下,将自动 培养箱温度设定点 设置为 37 °C,并让培养箱平衡 CO2% 和温度,然后再继续下一步。
注:如果荧光成像仪为所使用的每种染料(蓝色、深红色和橙色)配备合适的滤光片,则可以使用替代荧光成像仪。 - 将图像设置设置为以下规格:放大倍率:4X PL FL 相位,视场:3185 x 3185 μm,全 WFOV。
- 对通道使用以下规格: DAPI:377/447 nm,照明 = 10,积分时间 = 107 ms,增益 = 10,RFP:531/593 nm,照明 = 10,积分时间 = 137 ms,增益 = 10,CY5:628/685 nm,照明 = 10,积分时间 = 137 ms,增益 = 10。
- 对于基底膜提取物溶液叠加层中的球体成像,使用以下明场规格: 照明 = 10,积分时间 = 5 毫秒,增益 = 17.1。
- 选择所需的成像孔,然后单击 Select wells 图标批准规格更改。
- 导航到 数据减少 选项卡以调整蜂窝分析设置。
- 将阈值设置为 19,500,背景较浅,然后选择 Fill holes in mask.
- 对于对象选择,将 最小对象大小 设置为 100 μm , 将最大对象大小 设置为 1,000 μm,然后选择 Analyze entire image(分析整个图像)。
注意:此分析只需要主掩码和对象计数。 - 保存所有更改并打开成像器应用程序。
- 打开抽屉,将实验性 U 形底微孔板放入培养箱中,然后使用成像软件将其关闭。
- 要运行协议,请单击 Procedure Info(过程信息 )选项卡,添加用户,然后选择协议。
- 确保选择正确的板类型,并将 成像时间 设置为 每个板 30 分钟。
- 选择所需的成像间隔,指示板是否有盖子,并调整成像开始时间和持续时间。
- 单击 Schedule Plate/Vessel 开始成像过程。
9. 基底膜提取物溶液覆盖层(可选)
注:基底膜提取物溶液可在接种后 24 小时应用于球状体。
- 在冰桶中装满冰块,以保持基底膜提取物溶液低温,并在不使用时将其储存在 4 °C 下。
- 用多通道移液器吸出约 170 μL 培养基。
- 使用放大镜和迷你灯箱仔细观察小球体。将 96 孔球状体板放在灯箱上,并将放大镜放在头顶上。
- 将 P200 移液器设置为 30 μL 并收集基底膜提取物以产生三个微滴。
- 用微量移液器在三个技术重复的每个球体上添加一个微滴。
- 确保 96 孔板平放,并将移液器垂直放置在球体上方。在不接触孔底的情况下释放液滴。
- 将板置于 37 °C 的培养箱中 20 分钟。
- 用微量移液管将球体与每孔额外的 50 μL 基底膜提取物溶液覆盖。
- 使用移液器吸头将球体重新定位到孔的中心。
- 在 37 °C 下孵育 30 分钟。
- 向每个孔中加入 100 μL 细胞培养基。
10. 定量
- 下载并打开 ImageJ 软件。上传 spheroid 图像。
- 通过单击 分析 |设置 Measurements 并选择 Area |质心。使用套索工具追踪椭球体并测量对象,从而测量椭球体。
- 记录三个生物学重复的值并计算平均面积和圆度。
- 使用以下公式将面积从像素转换为平方米:
面积 (m2) = ((550/504) × √ (面积,以像素为单位)) 2 - 分析数据。
- 选择 Enter replicate values, stacked into columns(输入堆叠到列中的复制值)。
- 将数据输入到列中,然后选择单一培养球体对照和共培养处理球体样品。
- 执行单因子方差分析列分析。
- 使用以下方差分析参数:
- 避免匹配或配对。
- 假设残差呈高斯分布。
- 假设标准差相等。
- 使用 Tukey 的多重比较检验将每列的均值与每隔一列的均值进行比较。
11. 宽场免疫荧光图像处理
- 直接从成像器软件将图像保存为 PNG 或 Tiff 文件格式。
- 选择每个单独的通道或重叠的通道,然后另存为 PNG 文件。
- 在成像器软件或 ImageJ 中调整亮度和对比度(如果图像导出为 Tiff 文件)。
结果
在这项研究中,我们开发了一种细胞培养系统来生成由具有类器官样形态的上皮细胞和基质细胞组成的异质多细胞 3D 球体。通过在单一培养条件下接种 2,000 个上皮细胞来建立球状体。在两种细胞类型的共培养条件下,通过接种 1,000 个上皮细胞和 1,000 个基质细胞来建立球状体。在三种细胞类型的共培养条件下,通过接种 1,000 个上皮细胞和两种不同的基质细胞类型(每种细胞类型 500 个细胞)来建立球状体。在球状体建立的上游,可以用荧光细胞示踪染料对细胞进行染色,从而监测细胞空间组织。初始球状体形成 24 小时后,下游应用包括药理学扰动、成像和样品采集。延时成像可用于评估球体行为和形态的变化,包括面积和圆度(图 1A)。在电镀后 24 小时,球体可以嵌入支架环境中,延时成像可用于评估球体侵袭结构的发生(图 1B)。异源多细胞球状体样品的采集有许多应用,包括通过 RNA 测序、单细胞 RNA 测序、蛋白质组学测序和循环免疫荧光等实验技术在整体和单细胞水平进行基因组和蛋白质组学分析。
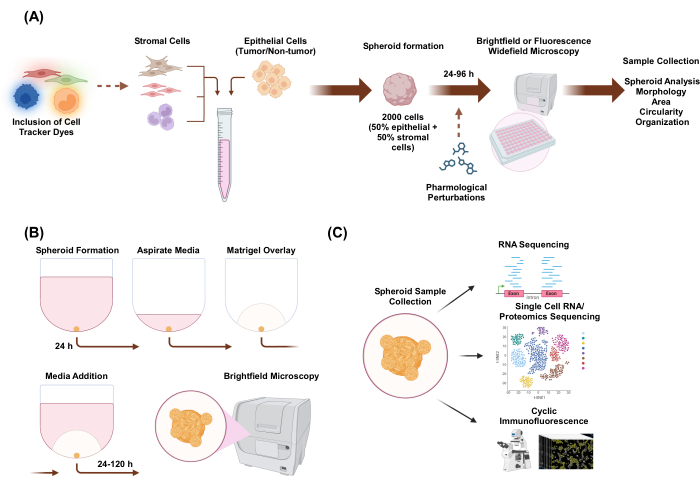
图 1:3D 细胞培养过程和潜在应用的示意图。 (A) 将具有非上皮基质细胞的上皮细胞的细胞悬液移液到 3D 超低附着板中以形成球状体。在 96 小时内每 24 小时通过明场显微镜对球体进行成像。在诱导球状体形成之前,可以用荧光细胞示踪剂染料对细胞系 进行染色 ,用于下游宽场显微镜检查,也可以在球状体形成后进行药理学干扰。可以分析球体参数,例如形态、面积、圆度和组织。(B) 具有基质细胞的上皮细胞和上皮细胞的球体是使用 A 中的方案形成的。通过在单一培养条件下接种 2,000 个上皮细胞来建立球状体。在两种细胞类型的共培养条件下,通过接种 1,000 个上皮细胞和 1,000 个基质细胞来建立球状体。在三种细胞类型的共培养条件下,通过接种 1,000 个上皮细胞和两种不同的基质细胞类型(每种细胞类型 500 个细胞)来建立球状体。24 小时后,覆盖支架状基底膜提取物溶液,每 24 小时在明场显微镜下捕获图像,持续 120 小时。(C) 已建立的无支架和基于支架的异源多细胞 3D 培养物可用于多种下游应用,如循环免疫荧光、单细胞 RNA 测序和单细胞蛋白质组学。 请单击此处查看此图的较大版本。
MCF10A、MCF10Ca1h 和 BT-474 单一培养球体在铺板后长达 96 小时内保持紧凑的球形表型。当与 EA.hy926 微血管内皮细胞、BJ-5ta 成纤维细胞和/或 THP-1 单核细胞样细胞共培养时,球体在外围形成细胞突起,在 96 小时时变得更加明显(图 2A-C)。重要的是,球体的这些突起、出芽和压实现象代表了癌症球体和共培养基质细胞的细胞组织的变化,这些变化与添加基于基底膜的水凝胶(如 Matrigel)后的 3D 侵袭性相关。出芽形态范围从固体到松散的细胞聚集体,类似于类器官形态。相比之下,MDA-MB-468 单一培养球体表现为大而松散的细胞聚集体。然而,当 MDA-MB-468 细胞与 EA.hy926、BJ-5ta 和/或 THP-1 共培养时,它们会形成致密的球体(图 2D)。
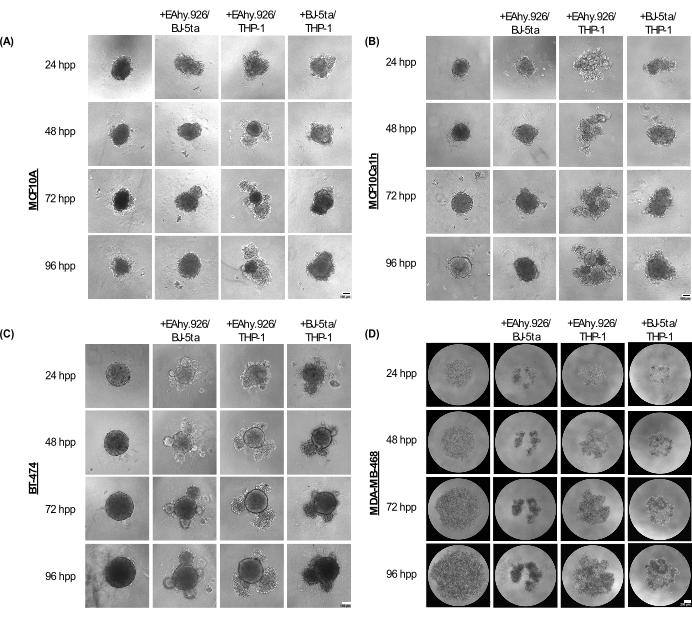
图 2:在无支架 3D 培养中与上皮肿瘤/非肿瘤细胞结合时,非上皮基质细胞组合所采用的结构和形态范围。 (A) MCF10A、 (B) MCF10Ca1h 、 (C) BT-474、 (D) MDA-MB-468 球状体在单一培养或与基质 BJ-5ta 成纤维细胞/Ea.hy926 微血管内皮细胞或 Ea.hy926/THP-1 单核细胞样细胞或 BJ-5ta/THP-1 细胞共培养条件下的代表性明场图像在 96 小时内。每个球体是通过铺板 2,000 个细胞形成的。在单一培养条件下使用 2,000 个上皮细胞形成球状体。在共培养条件下,使用 1,000 个上皮细胞和两种不同的基质细胞类型(500 个细胞)形成球状体。在 MCF10A、MCF10Ca1h 和 BT-474 上皮细胞接种后 24 小时,在球状体共培养条件下开始形成出芽或聚集的类器官样结构。接种后 25 小时,在球状体共培养条件下观察到 MDA-MB-468 细胞的压缩。比例尺 = 100 μm。缩写:hpp = 电镀后小时数。 请单击此处查看此图的较大版本。
铺板后 72 小时,与 EA.hy926 和 THP-1 或 BJ-5ta 和 THP-1 共培养的 MCF10A、MCF10Ca1h 和 BT-474 细胞与单一培养的上皮球体相比,球体面积显著增加。MCF10Ca1h 在与 EA.hy926 和 BJ-5ta 共培养时也显示出球状体面积的显著增加。共培养球状体中出芽结构的出现导致 MCF10A、MCF10Ca1h 和 BT-474 与 EA.hy926 和 THP-1 或 BJ-5ta 和 THP-1 共培养的球状体圆度显著降低。与 EA.hy926 和 BJ-5ta 共培养的 BT-474 观察到类似的效果(图 3A、B)。相比之下,与单一培养的 MDA-MB-468 球体相比,与 EA.hy926 和 BJ-5ta、EA.hy926 和 THP-1 或 BJ-5ta 和 THP-1 共培养的 MDA-MB-468 细胞的球体面积显着降低;然而,对循环度没有影响(图 3A、B)。

图 3:铺板后 72 小时单细胞和异多细胞基质 3D 无支架培养物的面积和圆度分析图。(A) 摊板后 72 小时,MCF10A、MCF10Ca1h、BT-474 和 MDA-MB-468 在单细胞和异多细胞基质球体培养物中的平均圆度。除非另有说明,否则报告的数据代表了至少三个独立的生物学重复,并在 SEM ±报告为技术重复平均值。除非另有说明,否则 *、**、*** 或 **** 分别表示 0.05、0.01、0.001 或 0.0001 < p 值。请单击此处查看此图的较大版本。
在球体建立之前,将细胞示踪剂染料应用于 BT-474 致瘤上皮细胞和基质细胞表明,基质细胞,包括 EA.hy926 和 BJ-5ta,在中央 BT474 球体的周边形成出芽结构(图 4, 补充视频 S1、 补充视频 S2、 补充视频 S3 和 补充视频 S4).铺板后 48 小时,与成纤维细胞共培养的球体的单个宽场荧光图像显示,成纤维细胞球体与内皮细胞共定位,但不与 BT-474 球体共定位。在共培养条件下,还发现少数内皮细胞与 BT-474 球体共定位。这表明球体内基质细胞的排列与类器官样形态相关。
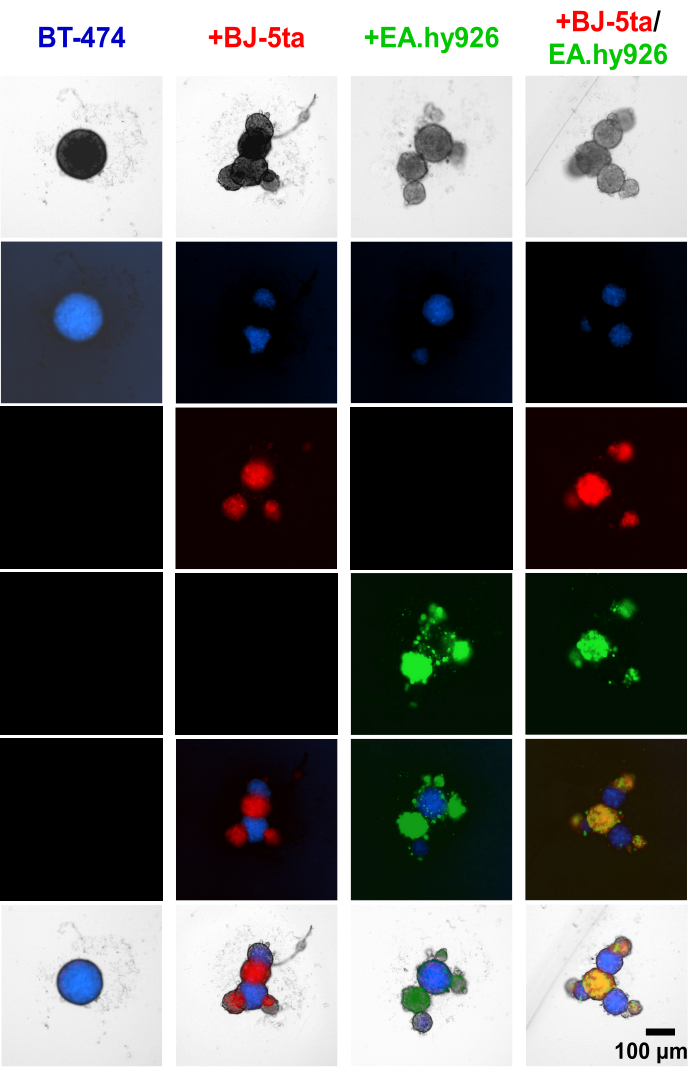
图 4:铺板后 48 小时异质多细胞 3D 培养物中差异染色基质和 BT-474 细胞的宽场荧光静止图像。 BT-474 球体用蓝色细胞追踪剂荧光染料染色。BJ-5ta 成纤维细胞用橙色细胞追踪染料染色,以红色表示。Ea.hy926 内皮细胞用深红色细胞示踪剂染料染色,以绿色表示。每个球体是通过铺板 2,000 个细胞形成的。在单一培养条件下使用 2,000 个上皮细胞形成球状体。在共培养条件 (BT-474/BJ-5ta、BT-474/Ea.hy926) 中使用 1,000 个上皮细胞和 1,000 个基质细胞形成球状体。在双重共培养条件下 (BT-474/BJ-5ta/Ea.hy926) 使用 1,000 个上皮细胞和每种基质细胞类型的 500 个细胞形成球状体。这些数字代表了至少 3 个生物学重复。比例尺 = 100 μm。 请点击此处查看此图的较大版本。
为了评估我们的类器官球体模型的生物学相关性,在接种后 24 小时用基底膜提取物溶液覆盖球体。单一培养 BT-474 球体在铺板后 120 小时表现出无侵袭性。然而,与 BJ-5ta 或 EA.hy926 共培养的 BT-474 球体在球体的外围形成了结构,侵入了支架基底膜提取物溶液环境。在与 BJ-5ta 和 EA.hy926 共培养的 BT-474 球体中,这些突起的数量和长度在铺板后 48 小时内显着增加(图 5, 补充视频 S5, 补充视频 S6, 补充视频 S7 和 补充视频 S8)。
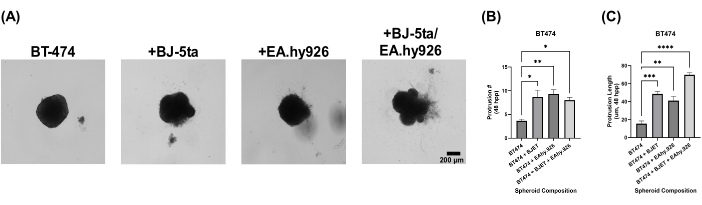
图 5:覆盖后 5 天,异质多细胞 3D 培养物中 BT-474 细胞的明场静态图像,基底膜提取物溶液覆盖。 每个球体是通过铺板 2,000 个细胞形成的。铺板后 24 小时,将基底膜提取物溶液覆盖在球体上。在单一培养条件下使用 2,000 个上皮细胞形成球状体。在共培养条件下(BT-474/BJ-5ta 和 BT-474/Ea.hy926)使用 1,000 个上皮细胞和 1,000 个基质细胞形成球状体。在双重共培养条件下 (BT-474/BJ-5ta/Ea.hy926) 使用 1,000 个上皮细胞和每种基质细胞类型的 500 个细胞形成球状体。(A) 在共培养条件下可以观察到从嵌入基底膜提取物溶液中的癌症球状体突出的侵袭结构。(B) 时间 48 hpp 的侵袭性突起计数的鉴定。(C) 时间 48 hpp 的侵袭突起长度的鉴定。这些数字代表了至少 3 个生物学重复。比例尺 = 200 μm。缩写:hpp = 电镀后小时数。 请单击此处查看此图的较大版本。
补充视频 S1:BT-474 单培养球体,使用 Cell Tracker 蓝色染料。 将 BT-474 (2,000) 细胞重悬于 U 形底部、超低附着的 96 孔微孔板中,以形成球状体。在 48 小时内捕获了明场和宽场荧光图像的重叠。简称:ULA = 超低附着。 请点击此处下载此视频。
补充视频 S2:BT-474 球状体与 BJ-5ta 成纤维细胞共培养。 将 BT-474 (1,000) 和 1,000 个 BJ-5ta 成纤维细胞重悬于 ULA 板中以形成球状体。BT-474 细胞与 Cell Tracker Blue 染料和 BJ-5ta 成纤维细胞与 Cell Tracker Orange 染料一起孵育。在 48 小时内捕获明场和宽场荧光 (蓝色 = BT-474,红色 = BJ-5ta) 图像的重叠。简称:ULA = 超低附着。 请点击此处下载此视频。
补充视频 S3:BT-474 球体与 Ea.hy926 内皮细胞共培养。将 BT-474 (1,000) 和 1,000 个 Ea.hy926 内皮细胞重悬于 ULA 板中以形成球状体。BT-474 细胞与 Cell Tracker Blue 染料一起孵育,Ea.hy926 内皮细胞与 Cell Tracker 深红色染料一起孵育。在 48 小时内捕获明场和宽场荧光 (蓝色 = BT-474,绿色 = Ea.hy926) 图像的重叠。简称:ULA = 超低附着。 请点击此处下载此视频。
补充视频 S4:BT-474 球状体与 BJ-5ta 成纤维细胞和 Ea.hy926 内皮细胞共培养。 将 BT-474 (1,000)、500 个 BJ-5ta 成纤维细胞和 500 个 Ea.hy926 内皮细胞重悬于 ULA 板中以形成球状体。BT-474 细胞与 Cell Tracker Blue 染料一起孵育。BJ-5ta 成纤维细胞和 Ea.hy926 内皮细胞分别与 cell tracker orange 染料和 deep red 染料一起孵育。在 48 小时内捕获明场和宽场荧光 (蓝色 = BT-474,红色 = BJ-5ta,绿色 = Ea.hy926) 图像的重叠。简称:ULA = 超低附着。 请点击此处下载此视频。
补充视频 S5:基底膜提取物溶液中的 BT-474 单一培养球体。 将 BT-474 细胞 (2,000) 重悬于 ULA 板中以形成球体,并在铺板后 24 小时将球体包埋在基底膜溶液中。在 60 小时内拍摄明场图像。简称:ULA = 超低附着。 请点击此处下载此视频。
补充视频 S6:BT-474 球体与 BJ-5ta 成纤维细胞在基底膜提取物溶液中共培养。 将 BT-474 (1,000) 和 1,000 个 BJ-5ta 成纤维细胞重悬于 ULA 板中以形成球体,并将球体在接种后 24 小时包埋在基底膜提取物溶液中。在 60 小时内拍摄明场图像。简称:ULA = 超低附着。 请点击此处下载此视频。
补充视频 S7:BT-474 球体与基底膜提取物溶液中的 Ea.hy926 内皮细胞共培养。 将 BT-474 (1,000) 和 1,000 个 Ea.hy926 内皮细胞重悬于 ULA 板中以形成球体,并将球体在接种后 24 小时包埋在基底膜提取物溶液中。在 60 小时内拍摄明场图像。简称:ULA = 超低附着。 请点击此处下载此视频。
补充视频 S8:BT-474 球体与基底膜提取物溶液中的 BJ-5ta 成纤维细胞和 Ea.hy926 内皮细胞共培养。 将 BT-474 (1,000)、500 个 BJ-5ta 成纤维细胞和 500 个 Ea.hy926 内皮细胞重悬于 ULA 板中以形成球体,并将球体包埋在铺板后 24 小时基底膜提取物溶液中。明场图像是在 60 小时内拍摄的。 请单击此处下载此视频。
讨论
我们的异质多细胞球状体模型表明,上皮-基质细胞相互作用在无支架的 3D 培养条件下驱动基质细胞出芽,并在基于支架的 3D 培养条件下驱动侵袭性结构的形成。我们在致瘤细胞系 (MCF10Ca1h 和 BT-474) 和非致瘤上皮细胞系 MCF10A 中观察到一致的出芽结构形成 (图 2A-C)。有趣的是,虽然来自细胞系 MCF10A、MCF10Ca1h 和 BT-474 的球体,无论是在单一培养中还是与成纤维细胞和内皮细胞共培养,在无支架的环境中形成圆形和紧凑的出芽结构,但来自细胞系 MDA-MB-468 的球体显示出较少的压实(图 2D)。这是出乎意料的,因为预计 MDA-MB-468 细胞会形成圆形球状体,就像其他测试的上皮细胞系一样。细胞系 SUM-149 是一种杂交上皮-间充质原发性乳腺癌细胞系,被发现可形成 MCF10A、MCF10Ca1h 和 BT-474 等致密球状体(数据未显示)28。未来的研究应调查介导 MDA-MB-468 细胞系中不太紧凑的球体形成的信号通路,因为这种异常可能表明细胞脆弱性,可用于开发新的治疗策略。
关于不同细胞系的组合,THP-1 单核细胞样细胞在球体的所有共培养条件下诱导松散聚集体结构的形成。与与 THP-1/BJ-5ta 细胞共培养条件下相比,在与 THP-1/Ea.hy926 细胞共培养条件下的出芽结构中观察到的压实较少(图 2A-D)。因此,球体的压实受模型中基质细胞组成的影响29,30。
与其技术重复相比,异细胞组合的不一致铺板会导致球状体发育不完全或球状体大小发生变化。确保细胞铺板的一致性至关重要,因为决定球状体表型和发育的细胞空间排列主要发生在前 48 小时31 内。在这个关键时期,细胞比率起着至关重要的作用,基质细胞的比例会影响球状体面积和圆度。
松散的球状体聚集体取决于细胞类型,在手动处理过程中很容易拆卸。然而,当用支架状基底膜提取物溶液覆盖球体或收集整个球体样品时,需要手动作。为了缓解这个问题,建议在通过移液器吸液收集球体时以较慢的速度工作,并尽可能减少手动作。在基底膜提取物溶液覆盖期间,球状体容易在孔内移动,通常会沉降在孔的边缘。基底膜提取物溶液与介质的比例对于维持 3D 系统的基质特性很重要;然而,由于基底膜提取物溶液的粘度,球体不能完全包络,因此需要人工干预32.非中心球体定位对成像构成挑战,因为孔塑料边缘附近的光折射会干扰图像清晰度。
本研究中使用的球状体由人类癌细胞系组成;此处描述的方法尚未应用于原代细胞系。我们的结果表明,特定的细胞间相互作用可以驱动类器官样结构的形成,表明该方法对广泛的致瘤细胞系具有潜在适用性。然而,虽然我们的模型试图模拟肿瘤微环境的复杂性,但不同的细胞增殖速率对长期研究构成了挑战33。快速增殖的细胞往往会超过较慢增殖的细胞,这使得该模型不太适合扩展实验。此外,细胞系的不同生长培养基类型要求会引入可能导致球状体表型的其他因素。本研究中的大多数细胞系是在 DMEM 培养基中生长的。在不同培养基中生长的细胞系的研究可能需要不同的培养条件,测试各种培养基比例;然而,这种效应是在长期实验中观察到的30。
与其他 3D 癌症模型相比,我们的模型具有多项优势。我们生成的球体具有均匀且可重复的初始形态和大小,因此更容易将治疗结果与对照进行比较。相比之下,一些使用悬浮在培养基或支架中的单细胞的模型会导致细胞空间分布可变,从而导致不一致。该模型表明,可以有效地研究不同细胞群之间的相互作用。
传统上,类器官和球状体模型由单一培养癌细胞或癌细胞共培养物组成,以研究营养物质的梯度、缺氧或细胞排列34。此外,该模型可以在电镀后 24 小时内在支架环境中进行研究,为探索由不同细胞间相互作用驱动的早期侵袭事件提供了机会。虽然替代的 3D 癌症方法采用不同的支架基质成分来研究球状体形态和侵袭性的变化,但该模型通过允许在细胞群动力学和支架组成的背景下研究这些变化来补充这些变化35。
使用我们的方法生产的大多数球状体在手动处理后仍能保持其结构完整性,从而可以在下游应用中进行样品采集。传统的遗传修饰,如 CRISPR-Cas9、慢病毒 shRNA 转导和 siRNA 干扰,可以在球状体形成的上游引入。在这些球状体中观察到的复杂行为表明基因表达的动态改变,可以使用 RNA-seq 进一步研究。CycIF、scRNA-seq、CosMx 和 Visium 等先进技术也可用于空间或单细胞水平的基因组学和蛋白质组学研究。这种球状体模型有可能通过在基质细胞芽和治疗剂到达癌细胞之前捕获其之间的相互作用来模拟靶向肿瘤治疗的 体内 研究。这很重要,因为它可以帮助确定基质细胞是否影响药物的效力,从而可能保护癌细胞免受治疗效果的影响。
披露声明
作者没有需要声明的利益冲突。
致谢
我们感谢贝勒大学发育癌基因实验室的成员在准备本手稿期间提供的有益评论和反馈。资金支持由贝勒大学生物系和文理学院提供,NIH-NIGMS 2SC1GM121182(给 J.A.K.)。
材料
| Name | Company | Catalog Number | Comments |
| 15 mL Polypropylene Centrifuge Tubes | Falcon | 14-959-53A | |
| 96-Well, Treated, U-Shaped-Bottom Microplate | Thermo Scientific | 12566432 | |
| 100 mm Dish Cell Culture Treated Surface | Thermo Scientific | 130182 | |
| 170 L CO2 Incubators | VWR | VWR51014991(10810902) | |
| 200 Self-Sealing Barrier Pipet Tips | Fisher Scientific | 02-682-255 | |
| 500 mL DMEM/Hams F-12, [+] L-glutamine | Corning | 10-090-CV | |
| 1000 Self-Sealing Barrier Pipet Tips | Molecular Biology Products Inc. | 2179HR | |
| Animal-Free Recombinant Human EGF | PeproTech | AF-100-15 | |
| Automated Pipette Repeater E3x | Eppendorf | 4987000410 | |
| Basement membrane solution | Huntsman Cancer Institute | https://healthcare.utah.edu/huntsmancancerinstitute/ | |
| Bead Bath | Lab Armor | 74300706 | |
| Biorender | Biorender | Biorender.com | |
| Biosafety Laminar Flow Cabinets | Thermo Scientific | 300590389 | |
| BioSpa 8 Automated Incubator | Agilent | 23082120 | |
| Cell Counter | Invitrogen | AMQAF2000 | |
| Cell Counting Chamber Slides | Thermo Scientific | C10283 | |
| CellTracker Deep Red | Thermo Fisher Scientific | C34565 | |
| Centrifuge | Thermo Scientific | 13100675 | |
| Cholera Toxin B subunit | Sigma-Aldrich | C9903-1MG | |
| Combitips advanced, Sterile, 5.0 mL | Fisher Scientific | 13-683-714 | |
| Cytation 10 Reader Imager | Agilent | 2105245 | |
| Defined Trypsin Inhibitor | Gibco | R007100 | soybean trypsin inhibitor in 1x PBS |
| Donor Horse Serum, 500 mL, United States Origin | Corning | 35-030-CV | |
| Dulbecco's Modified Eagle's Medium | Corning | 10-013-CV | |
| Excel Sofware | Microsoft office 365 | https://www.microsoft.com/en-us/microsoft-365/excel | |
| Fetal Bovine Serum | Thermo Scientific | 26140079 | |
| Fetal Bovine Serum, qualified, US origin | Thermo Scientific | 26140079 | |
| Gentamicin Sulfate, Liquid | Corning | 30-005-CR | |
| GraphPad Prism | |||
| Hydrocortisone solution,50 µM, sterile-filtered, BioXtra | Sigma-Aldrich | H6909-10ML | |
| Image J Software | Fiji | https://imagej.net/ij/ | |
| Insulin solution human | Sigma-Aldrich | I9278-5ML | |
| Magnifying Glass | Fisher Scientific | 01-182-392 | |
| Microcentrifuge Tube | Costar | 3621 | |
| Microscope | Olympus | CKX53SF | |
| Mini Lightbox | Fisher Scientific | 361044708 | |
| Molecular Probes CellTracker Blue CMAC Dye | Fisher Scientific | C2110 | |
| Molecular Probes CellTracker Orange CMRA Dye | Fisher Scientific | C34551 | |
| Penicillin-Streptomycin Solution | Cytiva | SV30010 | |
| Penicillin-Streptomycin Solution | Cytiva | SV30010 | |
| Phase-Contrast Microscope | Echo | RVSF1000 | |
| Phosphate Buffered Saline | Fisher Scientific | SH3025601 | |
| Pipet Controller | Corning | 4099 | |
| Pipette 100 – 1,000 µL | Eppendorf | 3123000063 | |
| Pipette 20 – 200 µL | Eppendorf | 3123000055 | |
| Prism | GraphPad Software | https://www.graphpad.com/features | |
| RPMI 1640 with L-glutamine and 25 mM HEPES | Corning | 10-041-CV | |
| Serological Pipette, 10 mL | Thermo Scientific | 170356N | |
| Serological Pipette, 25 mL | Thermo Scientific | 170357N | |
| Serological Pipette, 5 mL | Thermo Scientific | 170355N | |
| Trypan Blue Solution, 0.4% | Corning | 25900CI | |
| Trypsin-EDTA, 0.25% | Corning | 25053CI |
参考文献
- de Visser, K. E., Joyce, J. A. The evolving tumor microenvironment: From cancer initiation to metastatic outgrowth. Cancer Cell. 41 (3), 374-403 (2023).
- Hanahan, D., Weinberg, R. A. Hallmarks of cancer: The next generation. Cell. 144 (5), 646-674 (2011).
- Anderson, N. M., Simon, M. C. The tumor microenvironment. Curr Biol. 30 (16), R921-R925 (2020).
- Baghban, R., et al. Tumor microenvironment complexity and therapeutic implications at a glance. Cell Commun Signal. 18 (1), 59 (2020).
- Sahai, E., et al. A framework for advancing our understanding of cancer-associated fibroblasts. Nat Rev Cancer. 20 (3), 174-186 (2020).
- Erdogan, B., Webb, D. J. Cancer-associated fibroblasts modulate growth factor signaling and extracellular matrix remodeling to regulate tumor metastasis. Biochem Soc Trans. 45 (1), 229-236 (2017).
- Iozzo, R. V., Sanderson, R. D. Proteoglycans in cancer biology, tumour microenvironment and angiogenesis. J Cell Mol Med. 15 (5), 1013-1031 (2011).
- Amersfoort, J., Eelen, G. Immunomodulation by endothelial cells - partnering up with the immune system. Nat Rev Immunol. 22 (9), 576-588 (2022).
- Balani, S., Nguyen, L. V., Eaves, C. J. Modeling the process of human tumorigenesis. Nat Commun. 8 (1), 15422 (2017).
- Drost, J., Clevers, H. Organoids in cancer research. Nat Rev Cancer. 18 (7), 407-418 (2018).
- Wang, E., Xiang, K., Zhang, Y., Wang, X. -. F. Patient-derived organoids (PDOs) and PDO-derived xenografts (PDOXs): New opportunities in establishing faithful pre-clinical cancer models. J Natl Cancer Cent. 2 (4), 263-276 (2022).
- Kamb, A. What's wrong with our cancer models. Nat Rev Drug Discov. 4 (2), 161-165 (2005).
- Tuveson, D., Clevers, H. Cancer modeling meets human organoid technology. Science. 364 (6444), 952-955 (2019).
- Zitvogel, L., Pitt, J. M., Daillère, R., Smyth, M. J. Mouse models in oncoimmunology. Nat Rev Cancer. 16 (12), 759-773 (2016).
- Liu, Y., et al. Patient-derived xenograft models in cancer therapy: technologies and applications. Signal Transduct Target Ther. 8 (1), 160 (2023).
- Ben-David, U., et al. Patient-derived xenografts undergo mouse-specific tumor evolution. Nat Genet. 49 (11), 1567-1575 (2017).
- Byrne, A. T., et al. Interrogating open issues in cancer precision medicine with patient-derived xenografts. Nat Rev Cancer. 17 (4), 254-268 (2017).
- Ivanics, T., et al. Patient-derived xenograft cryopreservation and reanimation outcomes are dependent on cryoprotectant type. Lab Invest. 98 (7), 947-956 (2018).
- Biju, T. S., Priya, V. V., Francis, A. P. Role of three-dimensional cell culture in therapeutics and diagnostics: an updated review. Drug Deliv and Transl Res. 13 (9), 2239-2253 (2023).
- Urzì, O., et al. Three-dimensional cell cultures: The bridge between in vitro and in vivo models. Int J Mol Sci. 24 (15), 12046 (2023).
- Cacciamali, A., Villa, R., Dotti, S. 3D cell cultures: Evolution of an ancient tool for new applications. Front Physiol. 13, 836480 (2022).
- Abuwatfa, W. H., Pitt, W. G. Scaffold-based 3D cell culture models in cancer research. J Biomed Sci. 31 (1), 7 (2024).
- Yakavets, I., et al. Advanced co-culture 3D breast cancer model for investigation of fibrosis induced by external stimuli: optimization study. Sci Rep. 10 (1), 21273 (2020).
- Mohammadrezaei, D., et al. Predicting and elucidating the post-printing behavior of 3D printed cancer cells in hydrogel structures by integrating in-vitro and in-silico experiments. Sci Rep. 13 (1), 1211 (2023).
- Kuen, J., Darowski, D., Kluge, T., Majety, M. Pancreatic cancer cell/fibroblast co-culture induces M2 like macrophages that influence therapeutic response in a 3D model. PLOS ONE. 12 (7), e0182039 (2017).
- Bray, F., et al. Global cancer statistics 2022: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin. 74 (3), 229-263 (2024).
- Kennecke, H., et al. Metastatic behavior of breast cancer subtypes. J Clin Oncol. 28 (20), 3271-3277 (2010).
- Neve, R. M., et al. A collection of breast cancer cell lines for the study of functionally distinct cancer subtypes. Cancer Cell. 10 (6), 515-527 (2006).
- Pingitore, P., et al. Human multilineage 3D spheroids as a model of liver steatosis and fibrosis. Int J Mol Sci. 20 (7), 1629 (2019).
- Bar-Ephraim, Y. E., Kretzschmar, K. Organoids in immunological research. Nat Rev Immunol. 20 (5), 279-293 (2020).
- Beerkens, A. P. M., et al. Characterizing OXPHOS inhibitor-mediated alleviation of hypoxia using high-throughput live cell-imaging. Cancer Metab. 12 (1), 13 (2024).
- Feaster, T. K., et al. Matrigel mattress. Cir Res. 117 (12), 995-1000 (2015).
- Huang, Z., Yu, P., Tang, J. Characterization of triple-negative breast cancer MDA-MB-231 cell spheroid model. Onco Targets Ther. 13, 5395-5405 (2020).
- Nam, S., Khawar, I. A., Park, J. K., Chang, S., Kuh, H. -. J. Cellular context-dependent interaction between cancer and stellate cells in hetero-type multicellular spheroids of pancreatic tumor. Biochem Biophys Res Commun. 515 (1), 183-189 (2019).
- Monteiro, M. V., Gaspar, V. M., Ferreira, L. P. Hydrogel 3D in vitro tumor models for screening cell aggregation mediated drug response. Biomater Sci. 8 (7), 1855-1864 (2020).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。