需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
汇集人类血小板裂解液作为一种有效的补充(pHPL)的动物血清自由人干细胞培养制备
摘要
人类血小板裂解物源丰富的生长因子和细胞培养的有力补充。该协议提出,准备从富含血小板血浆,执行几个冻融循环和消耗血小板片段大池的人血小板裂解过程。
摘要
血小板衍生生长因子已被证明有效刺激细胞增殖
研究方案
1。起始原料
富含血小板血浆(PRP)由cytapheresis准备,或从Buffy大衣派生单位开始。
2。不育检查
对于不育检查从每个PRP单位连接的小袋子(巴克斯特)传输量20毫升的样本。断开焊接袋。
3。覆检单位的冻结
配制后,立即冻结覆检单位至少-20 ° C的原始存储袋,没有进一步的处理。
4。解冻的HPL单位
当细菌测试呈阴性反应,解冻人体血小板裂解单位,现在要求在37℃(水浴),直到冰凝块消失的HPL单位。不暖的防火板。
5。汇集的HPL单位
以至少十到十五的HPL单位之一血小板裂解液池解冻,准备标准化的产品。连续连接HPL袋池双袋(MacoPharma),并转移到这两种袋的防火板。断开焊接空的HPL袋。获取一个汇集了人类的血小板裂解液混合两袋的内容(pHPL)3至4大号的最终体积。一个小袋子(巴克斯特)连接,并采取了20毫升,汇集产品的无菌检查pHPL的样本。断开焊接袋。
6。饭的的pHPL
部分的pHPL得到适合作进一步处理等分。小包装袋(百特)连接池双包(Macopharma)和250毫升的小储物袋(百特)转让的卷。断开焊接填充袋。
7。重新冻结pHPL等分
增加血小板破碎率和释放的生长因子,进一步冻结/解冻步骤。再次冻结分份pHPL的小袋子,至少-20 ° C。
8。再解冻pHPL等分饭
解冻pHPL袋在37℃(水浴)。切割管使用无菌剪刀袋,倒入小瓶的pHPL的内容转移到50 mL样品瓶(猎鹰屋宇署)。执行此步骤,在层流台,以避免细菌或霉菌污染。
9。去除血小板片段
由于血小板片段往往聚集,并可能诱发同种免疫,从pHPL删除。因此在4000克(15分钟,4℃)离心pHPL小瓶。在层流台移液器上清液进入决赛的存储小瓶(猎鹰屋宇署)的血浆及丢弃血小板颗粒,以避免在细胞培养中的片段。
10。存储的pHPL
再次冻结50毫升pHPL小瓶分装,在至少20℃,存放实验用。
11。在细胞培养中使用pHPL
最初添加防腐剂无肝素介质,以避免形成凝胶。在37 ° C解冻一个pHPL等份,并补充培养基除了8 - 10%。
介质
MSC介质:
使用500毫升的A - MEM,添加56毫升解冻pHPL(亦见进一步的细节参考1)和2 IU /毫升(= 224μL原液)(避免通过介质凝固结块的防腐剂,无肝素在血浆中的纤维蛋白原),达到了10%pHPL的终浓度。此外,添加青霉素(100U/mL)/链霉素(100μg/mL)解决方案的L - Glutamin 2MM(均为Sigma公司)。
过滤介质,通过一个20微米孔径真空过滤机(Millipore公司)。瓶适当的标签(内容,日期)。
ECFC,中等:
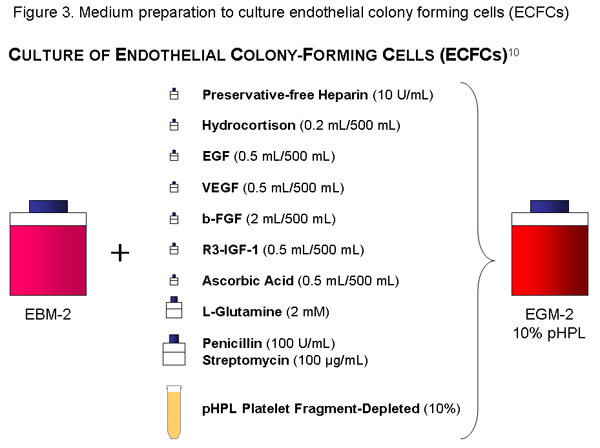
使用EBM的瓶(500毫升),添加细胞因子等分pHPL,10国际单位/毫升(原液1120μl),56毫升的不含防腐剂的肝素,青霉素(100U/mL)/链霉素(100克/毫升)溶液和培养基和20μL孔径真空过滤机(微孔)过滤器的L - 2MM Glutamin。瓶适当的标签(内容,日期)。
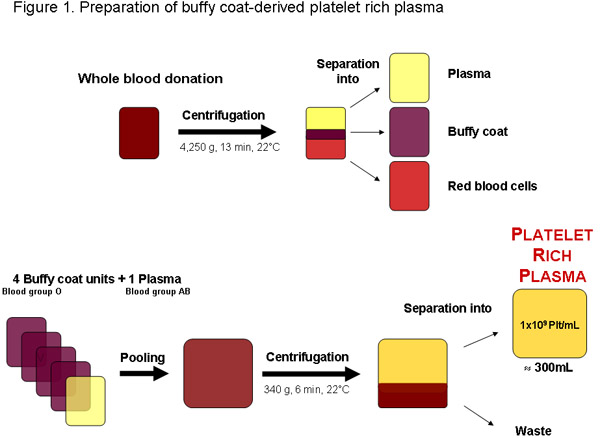
图1:从整个献血从局部血液银行或授权任何其他供应商的富血小板血浆的制备。离心后,血液可分为血浆,捉鬼外套和红细胞。四捉鬼外套单位,血型O和一个血AB型血浆可汇集前离心分离富含血小板血浆。一个定期的质量约300毫升的富含血小板血浆的单位,应包含1 × 10 9血小板每毫升或3X10 11 plateleTS总额。

讨论
在一些地区富含血小板血浆(PRP),棕黄色的大衣,否则被浪费的包装红细胞测试献血(图1)电池生产的产品可从。理想情况下,覆检委员会是立即使用做进一步的准备pHPL,集中在过时的血小板生长因子的可用性可能会减少由于血小板保存损伤和退化 20 。进一步建议匹配的O型血AB型血血浆的血小板,以避免可能影响ABH抗原和isoagglutinins生产的覆检。截至到现在,主要用于细胞培养胎牛血...
致谢
这项工作一直由奥地利研究基金会(FWF,授予N211南到DS)和奥地利研究促进署(FFG,授予N200到DS)的支持。作者感谢优秀的技术援助和莫妮卡法雷尔语言编辑克劳迪亚网址。
材料
| Material Name | Type | Company | Catalogue Number | Comment |
|---|---|---|---|---|
| Name | Company | Catalog Number | Comments | |
| Double bag (2 x 3.5L) | MacoPharma | VDL 8000XQ | originally for ascites puncture | |
| 50 mL Falcon tube | Falcon BD | 2098 | ||
| 50 mL Stripettes | Costar | 4501 | ||
| Plasma bags (600mL) | Baxter | R4R2021 | ||
| Sterile tubing welder | Terumo | TSCD-II | ||
| Welding equipment | Fresenius Kabi | Compo Seal | ||
| Water bath | ||||
| Sterile scissors | ||||
| Clamps | ||||
| Centrifuge |
参考文献
- Nurden, A. T., Nurden, P., Sanchez, M., Andia, I., Anitua, E. Platelets and wound healing. Front Biosci. 13, 3532-3548 (2008).
- Barrientos, S., Stojadinovic, O., Golinko, M. S., Brem, H., Tomic-Canic, M. Growth factors and cytokines in wound healing. Wound Repair Regen. 16, 585-601 (2008).
- Giacco, F. Thrombin-activated platelets induce proliferation of human skin fibroblasts by stimulating autocrine production of insulin-like growth factor-1. FASEB J. 20, 2402-2404 (2006).
- Kocaoemer, A., Kern, S., Kluter, H., Bieback, K. Human AB serum and thrombin-activated platelet-rich plasma are suitable alternatives to fetal calf serum for the expansion of mesenchymal stem cells from adipose tissue. Stem Cells. 25, 1270-1278 (2007).
- Kakudo, N. Proliferation-promoting effect of platelet-rich plasma on human adipose-derived stem cells and human dermal fibroblasts. Plast Reconstr Surg. 122, 1352-1360 (2008).
- Doucet, C. Platelet lysates promote mesenchymal stem cell expansion: A safety substitute for animal serum in cell-based therapy applications. J Cell Physiol. 205, 228-236 (2005).
- Schallmoser, K. Human platelet lysate can replace fetal bovine serum for clinical-scale expansion of functional mesenchymal stromal cells. Transfusion. 47, 1436-1446 (2007).
- Reinisch, A. Humanized system to propagate cord blood-derived multipotent mesenchymal stromal cells for clinical application. Regen Med. 2, 371-382 (2007).
- Schallmoser, K. Rapid large-scale expansion of functional mesenchymal stem cells from unmanipulated bone marrow without animal serum Tissue Eng Part. C Methods. 14, 185-196 (2008).
- Lange, C. Accelerated and safe expansion of human mesenchymal stromal cells in animal serum-free medium for transplantation and regenerative medicine. J Cell Physiol. 213, 18-26 (2007).
- Reinisch, A. Humanized large-scale expanded endothelial colony-forming cells function in vitro and in vivo. Blood. 113, 6716-6725 (2009).
- Bernardo, M. E. Optimization of in vitro expansion of human multipotent mesenchymal stromal cells for cell-therapy approaches: further insights in the search for a fetal calf serum substitute. J Cell Physiol. 211, 121-130 (2007).
- Carrancio, S. Optimization of mesenchymal stem cell expansion procedures by cell separation and culture conditions modification. Exp Hematol. 36, 1014-1021 (2008).
- Muller, A. M. Platelet lysate as a serum substitute for 2D static and 3D perfusion culture of stromal vascular fraction cells from human adipose tissue. Tissue Eng Part A. 15, 869-875 (2009).
- Anitua, E., Sanchez, M., Orive, G., Andia, I. The potential impact of the preparation rich in growth factors (PRGF) in different medical fields. Biomaterials. 28, 4551-4560 (2007).
- Anitua, E. New insights into and novel applications for platelet-rich fibrin therapies. Trends Biotechnol. 24, 227-234 (2006).
- Martinez-Zapata, M. J. Efficacy and safety of the use of autologous plasma rich in platelets for tissue regeneration: a systematic review. Transfusion. 49, 44-56 (2009).
- Weibrich, G., Kleis, W. K., Hafner, G., Hitzler, W. E. Growth factor levels in platelet-rich plasma and correlations with donor age, sex, and platelet count. J Craniomaxillofac Surg. 30, 97-102 (2002).
- Frechette, J. P., Martineau, I. &. a. m. p. ;. a. m. p., Gagnon, G. Platelet-rich plasmas: growth factor content and roles in wound healing. J Dent Res. 84, 434-439 (2005).
- Seghatchian, J., Krailadsiri, P. The platelet storage lesion. Transfus Med Rev. 11, 130-144 (1997).
- Selvaggi, T. A., Walker, R. E., Fleisher, T. A. Development of antibodies to fetal calf serum with arthus-like reactions in human immunodeficiency virus-infected patients given syngeneic lymphocyte infusions. Blood. 89, 776-779 (1997).
- Tonti, G. A., Mannello, F. From bone marrow to therapeutic applications: different behaviour and genetic/epigenetic stability during mesenchymal stem cell expansion in autologous and foetal bovine sera. Int J Dev Biol. 52, 1023-1032 (2008).
- Bieback, K. Human Alternatives to Fetal Bovine Serum for the Expansion of Mesenchymal Stromal Cells from Bone Marrow. Stem Cells. , (2009).
- Rohde, E., Schallmoser, K., Bartmann, C., Reinisch, A., Gad, S. C. GMP-Compliant Propagation of Human Multipotent Mesenchymal Stromal Cells. Pharmaceutical Manufacturing Handbook: Regulations and Quality. , 97-115 (2008).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。