Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Vorbereitung der gepoolten menschlichen Thrombozyten-Lysat (PHPL) als effiziente Ergänzung zum tierischen Serum-freien menschlichen Stammzell-Kulturen
In diesem Artikel
Zusammenfassung
Menschliche Thrombozyten-Lysat ist eine reiche Quelle von Wachstumsfaktoren und eine starke Ergänzung in der Zellkultur. Dieses Protokoll stellt den Prozess der Vorbereitung einen großen Pool an menschlichen Thrombozyten-Lysat ausgehend von platelet rich plasma, Durchführung mehrerer Gefrier-Auftau-Zyklen und zum Abbau der Thrombozyten-Fragmente.
Zusammenfassung
Platelet derived growth Faktoren haben gezeigt, dass die Zellproliferation effizient stimulieren
Protokoll
1. Ausgangsmaterial
Beginnen Sie mit Thrombozyten-reichem Plasma (PRP) Einheiten durch Zytopherese oder aus Buffy Coats.
2. Sterilität zu überprüfen
Für die Sterilität zu überprüfen eine Probe von 20 ml aus jedem PRP-Einheit durch die Übertragung der Lautstärke auf einem angeschlossenen kleinen Beutel (Baxter). Trennen Sie diese Tasche durch Schweißen.
3. Einfrieren von PRP-Einheiten
Unmittelbar nach der Herstellung, frieren die PRP-Einheiten bis mindestens -20 ° C in der ursprünglichen Aufbewahrungstasche ohne weitere Manipulation.
4. Auftauen von HPL-Einheiten
Wenn bakteriellen Tests negativ sind, Tauwetter menschlichen Thrombozyten-Lysat Einheiten, die heute als HPL-Einheiten bei 37 ° C (Wasserbad), bis das Eis Blutgerinnsel verschwinden. Nicht erwärmen die HPL.
5. Pooling von HPL-Einheiten
Nehmen Sie sich mindestens 10 bis 15 aufgetaut HPL-Einheiten für eine Thrombozyten-Lysat-Pool, ein standardisiertes Produkt vorbereiten. Schließen Sie das HPL Beutel nacheinander auf die Zusammenlegung doppelten Beutel (MacoPharma) und übertragen Sie die HPL in diese beiden Taschen. Trennen Sie die leere HPL Beutel verschweißt. Holen Sie sich ein Gesamtvolumen von 3 bis 4 L von gepoolten menschlichen Thrombozyten-Lysat (PHPL) durch Mischen der Inhalt der beiden Tüten. Schließen Sie eine kleine Tasche (Baxter) und nehmen Sie eine Probe von 20 mL PHPL für Sterilität Überprüfung der gepoolten Produkt. Trennen Sie diese Tasche durch Schweißen.
6. Portionieren der PHPL
Portion der PHPL geeignete Aliquots für die weitere Verarbeitung zu bekommen. Connect kleine Beutel (Baxter), um die Bündelung doppelten Beutel (Macopharma) und Transfer Volumen von bis zu 250 mL der kleinen Säcken zur Lagerung (Baxter). Trennen Sie die gefüllten Säcke durch Schweißen.
7. Re-Einfrieren der PHPL Aliquots
Erhöhung des Anteils der Thrombozyten-Fragmentierung und die Menge des freigesetzten Wachstumsfaktoren durch einen weiteren Frost / Tau-Schritt. Frieren Sie den kleinen Beutel portioniert PHPL wieder bei mindestens -20 ° C.
8. Re-Auftau-und Portionierung des PHPL Aliquots
Auftauen PHPL Beutel bei 37 ° C (Wasserbad). Übertragen Sie die Inhalte in 50 ml-Fläschchen (Falcons BD), indem das Rohr des Beutels mit einer sterilen Schere und Gießen der PHPL in das Fläschchen. Führen Sie diesen Schritt in einer laminaren Strömung Bank, um bakterielle oder Pilzinfektionen Kontamination zu vermeiden.
9. Entfernen von Thrombozyten-Fragmente
Da Thrombozyten-Fragmente zur Aggregation neigen und kann Alloimmunisierung induzieren, entfernen Sie sie aus dem PHPL. Zentrifugieren Sie die PHPL Fläschchen daher bei 4.000 g (15 Minuten, 4 ° C). In einer laminaren Strömung Bank Pipette der Überstand Plasma in die Endlagerung Fläschchen (Falcons BD) und entsorgen Sie die Thrombozyten-Pellets zu vermeiden Fragmente in der Zellkultur.
10. Speicherung von PHPL
Freeze-Aliquots von 50 ml Fläschchen PHPL wieder mindestens-20 ° C und lagern Sie sie zu Versuchszwecken verwendet.
11. Verwendung von PHPL in der Zellkultur
Zunächst fügen Sie frei von Konservierungsmitteln Heparin auf die mittel-bis Gelbildung zu vermeiden. Tauwetter ein PHPL Aliquot bei 37 ° C und ergänzen das Kulturmedium durch Zugabe von 8 bis 10%.
Medien
MSC-Medium:
Verwenden Sie 500 ml a-MEM, fügen Sie 56 ml des aufgetauten PHPL (siehe auch Hinweis 1 für weitere Details) und 2 IU / mL (= 224 ul der Stammlösung) der frei von Konservierungsmitteln Heparin (verhindert Koagulation des Mediums durch Verklumpung der das Fibrinogen im Plasma), um eine endgültige Konzentration von 10% PHPL. Zusätzlich fügen Penicillin (100U/mL) / Streptomycin (100μg/mL)-Lösung und 2 mM L-Glutamin (beide Sigma).
Filter das Medium, durch ein 20 um-Porengröße Vakuum-Filter (Millipore). Beschriften Sie die Flasche entsprechend (Inhalt, Datum).
ECFC-Medium:
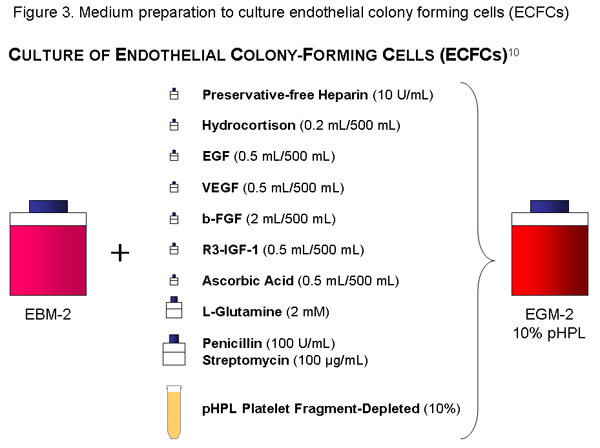
Verwenden Sie eine Flasche (500 ml) von EBM, fügen Sie die Zytokin-Aliquots, 56 ml PHPL, 10 IU / ml (= 1120μl Stammlösung) der frei von Konservierungsmitteln Heparin, Penicillin (100U/mL) / Streptomycin (100 g / ml)-Lösung und 2 mM L-Glutamin, die Basalmedium und Filter mit 20 ul-Porengröße Vakuum-Filter (Millipore). Beschriften Sie die Flasche entsprechend (Inhalt, Datum).
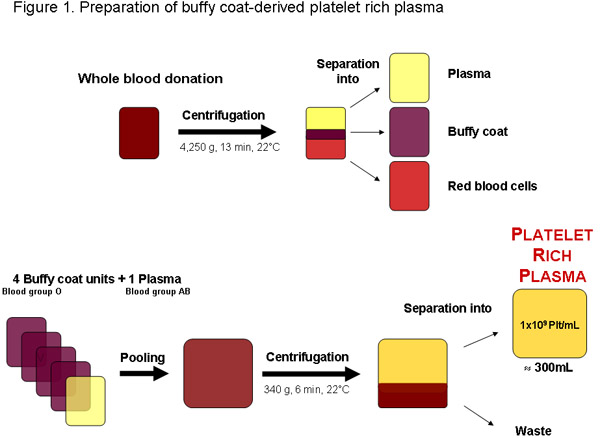
Abbildung 1: Herstellung von Plättchen-reiches Plasma aus einer Vollblutspende von einem lokalen Blutbank oder anderen zugelassenen Anbieter. Nach Zentrifugation kann das Blut in Plasma, Buffy Coat und Erythrozyten getrennt werden. Vier Buffy-Coat-Einheiten, Blutgruppe O und eine Blutgruppe AB Plasma kann gebündelt vor der Zentrifugation der Blutplättchen reiches Plasma getrennt zu sein. Eine regelmäßige Qualitätskontrollen Plättchen-reiches Plasma-Einheit von etwa 300 ml enthalten sollte 1x10 9 Thrombozyten pro ml oder 3x10 11 platelets insgesamt.

Diskussion
In einigen Regionen platelet rich plasma (PRP) kann von Buffy-Coats sonst, ein Abfallprodukt der gepackten roten Blutkörperchen aus getestet Blutspenden (Abbildung 1) erreicht werden. Optimal ist PRP sofort für die weitere Bearbeitung von PHPL verwendet, wie in veralteten Thrombozytenkonzentraten die Verfügbarkeit von Wachstumsfaktoren können durch Thrombozyten-Lagerung Läsionen und Abbau 20 reduziert werden. Es wird ferner empfohlen, PRP durch Anpassung Thrombozyten der Blutgruppe O mit Plasma der Blutg...
Danksagungen
Diese Arbeit wurde von der Austrian Research Foundation (FWF, gewähren N211-NAN DS) und die Österreichische Forschungsförderungsgesellschaft mbH (FFG, gewähren N200 zum DS) unterstützt worden. Die Autoren danken Claudia URL für hervorragende technische Unterstützung und Monica Farrell für die sprachliche Bearbeitung.
Materialien
| Name | Company | Catalog Number | Comments |
| Double bag (2 x 3.5L) | MacoPharma | VDL 8000XQ | originally for ascites puncture |
| 50 mL Falcon tube | Falcon BD | 2098 | |
| 50 mL Stripettes | Costar | 4501 | |
| Plasma bags (600mL) | Baxter Internationl Inc. | R4R2021 | |
| Sterile tubing welder | Terumo Medical Corp. | TSCD-II | |
| Welding equipment | Fresenius Kabi | Compo Seal | |
| Water bath | |||
| Sterile scissors | |||
| Clamps | |||
| Centrifuge |
Referenzen
- Nurden, A. T., Nurden, P., Sanchez, M., Andia, I., Anitua, E. Platelets and wound healing. Front Biosci. 13, 3532-3548 (2008).
- Barrientos, S., Stojadinovic, O., Golinko, M. S., Brem, H., Tomic-Canic, M. Growth factors and cytokines in wound healing. Wound Repair Regen. 16, 585-601 (2008).
- Giacco, F. Thrombin-activated platelets induce proliferation of human skin fibroblasts by stimulating autocrine production of insulin-like growth factor-1. FASEB J. 20, 2402-2404 (2006).
- Kocaoemer, A., Kern, S., Kluter, H., Bieback, K. Human AB serum and thrombin-activated platelet-rich plasma are suitable alternatives to fetal calf serum for the expansion of mesenchymal stem cells from adipose tissue. Stem Cells. 25, 1270-1278 (2007).
- Kakudo, N. Proliferation-promoting effect of platelet-rich plasma on human adipose-derived stem cells and human dermal fibroblasts. Plast Reconstr Surg. 122, 1352-1360 (2008).
- Doucet, C. Platelet lysates promote mesenchymal stem cell expansion: A safety substitute for animal serum in cell-based therapy applications. J Cell Physiol. 205, 228-236 (2005).
- Schallmoser, K. Human platelet lysate can replace fetal bovine serum for clinical-scale expansion of functional mesenchymal stromal cells. Transfusion. 47, 1436-1446 (2007).
- Reinisch, A. Humanized system to propagate cord blood-derived multipotent mesenchymal stromal cells for clinical application. Regen Med. 2, 371-382 (2007).
- Schallmoser, K. Rapid large-scale expansion of functional mesenchymal stem cells from unmanipulated bone marrow without animal serum Tissue Eng Part. C Methods. 14, 185-196 (2008).
- Lange, C. Accelerated and safe expansion of human mesenchymal stromal cells in animal serum-free medium for transplantation and regenerative medicine. J Cell Physiol. 213, 18-26 (2007).
- Reinisch, A. Humanized large-scale expanded endothelial colony-forming cells function in vitro and in vivo. Blood. 113, 6716-6725 (2009).
- Bernardo, M. E. Optimization of in vitro expansion of human multipotent mesenchymal stromal cells for cell-therapy approaches: further insights in the search for a fetal calf serum substitute. J Cell Physiol. 211, 121-130 (2007).
- Carrancio, S. Optimization of mesenchymal stem cell expansion procedures by cell separation and culture conditions modification. Exp Hematol. 36, 1014-1021 (2008).
- Muller, A. M. Platelet lysate as a serum substitute for 2D static and 3D perfusion culture of stromal vascular fraction cells from human adipose tissue. Tissue Eng Part A. 15, 869-875 (2009).
- Anitua, E., Sanchez, M., Orive, G., Andia, I. The potential impact of the preparation rich in growth factors (PRGF) in different medical fields. Biomaterials. 28, 4551-4560 (2007).
- Anitua, E. New insights into and novel applications for platelet-rich fibrin therapies. Trends Biotechnol. 24, 227-234 (2006).
- Martinez-Zapata, M. J. Efficacy and safety of the use of autologous plasma rich in platelets for tissue regeneration: a systematic review. Transfusion. 49, 44-56 (2009).
- Weibrich, G., Kleis, W. K., Hafner, G., Hitzler, W. E. Growth factor levels in platelet-rich plasma and correlations with donor age, sex, and platelet count. J Craniomaxillofac Surg. 30, 97-102 (2002).
- Frechette, J. P., Martineau, I. &. a. m. p. ;. a. m. p., Gagnon, G. Platelet-rich plasmas: growth factor content and roles in wound healing. J Dent Res. 84, 434-439 (2005).
- Seghatchian, J., Krailadsiri, P. The platelet storage lesion. Transfus Med Rev. 11, 130-144 (1997).
- Selvaggi, T. A., Walker, R. E., Fleisher, T. A. Development of antibodies to fetal calf serum with arthus-like reactions in human immunodeficiency virus-infected patients given syngeneic lymphocyte infusions. Blood. 89, 776-779 (1997).
- Tonti, G. A., Mannello, F. From bone marrow to therapeutic applications: different behaviour and genetic/epigenetic stability during mesenchymal stem cell expansion in autologous and foetal bovine sera. Int J Dev Biol. 52, 1023-1032 (2008).
- Bieback, K. Human Alternatives to Fetal Bovine Serum for the Expansion of Mesenchymal Stromal Cells from Bone Marrow. Stem Cells. , (2009).
- Rohde, E., Schallmoser, K., Bartmann, C., Reinisch, A., Gad, S. C. GMP-Compliant Propagation of Human Multipotent Mesenchymal Stromal Cells. Pharmaceutical Manufacturing Handbook: Regulations and Quality. , 97-115 (2008).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten