Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Préparation du Pooled lysat plaquettaire humain (pHPL) comme un supplément efficace pour animaux sans sérum humain cultures de cellules souches
Dans cet article
Résumé
Homme lysat plaquettaire est une riche source de facteurs de croissance et d'un supplément puissant dans la culture cellulaire. Ce protocole présente le processus de préparation d'un grand bassin de lysat plaquettaire humaine en commençant à partir du plasma riche en plaquettes, effectuant plusieurs cycles gel-dégel et d'épuiser les fragments de plaquettes.
Résumé
Facteurs de croissance dérivés des plaquettes ont été montré pour stimuler efficacement la prolifération des cellules
Protocole
1. Matériau de départ
Commencez par plasma riche en plaquettes (PRP) unités préparées par cytaphérèse ou dérivée de Buffy contre les manteaux.
2. Vérifier la stérilité
Pour vérifier la stérilité de prendre un échantillon de 20 ml de chaque unité de PRP en transférant le volume d'un sac de petite connecté (Baxter). Débranchez ce sac par soudage.
3. Gel des unités PRP
Immédiatement après la préparation, de geler les unités PRP jusqu'à au moins -20 ° C dans le sac de stockage d'origine sans autre manipulation.
4. La décongélation des unités de HPL
Lorsque les tests bactériologiques sont négatifs, le dégel des unités humaines lysat plaquettaire, maintenant appelées unités HPL à 37 ° C (bain d'eau) jusqu'à ce que les caillots de glace disparaissent. Ne pas réchauffer le HPL.
5. Regroupement des unités de HPL
Prenez au moins dix à quinze unités décongelés HPL pour un pool de lysat plaquettaire pour préparer un produit standardisé. Connectez les sacs HPL consécutivement à la poche de pooling double (MacoPharma) et transférer le HPL dans ces deux sacs. Débranchez les sacs vides HPL par soudage. Obtenez un volume final de 3 à 4 L de mise en commun lysat plaquettaire humain (pHPL) en mélangeant le contenu des deux sacs. Connectez un petit sac (Baxter) et prendre un échantillon de 20 ml pour vérifier pHPL la stérilité du produit mis en commun. Débranchez ce sac par soudage.
6. Portionnement de l'pHPL
Portion du pHPL pour obtenir la quantité appropriée pour un traitement ultérieur. Connectez petits sacs (Baxter) à la mutualisation double sac (Macopharma) et le transfert des volumes allant jusqu'à 250 ml pour les sacs de stockage de petite taille (Baxter). Débranchez les sacs remplis par soudage.
7. Re-gel des aliquotes pHPL
Augmenter le taux de fragmentation de plaquettes et de la quantité de facteurs de croissance libérés par un autre gel / dégel étape. Geler les petits sacs de pHPL portionné à nouveau au moins à -20 ° C.
8. Re-dégel et le portionnement des aliquotes pHPL
Décongelez les sacs pHPL à 37 ° C (bain d'eau). Transférer le contenu dans des fioles de 50 ml (Falcons BD) en coupant le tube du sac à l'aide de ciseaux stériles et en versant le pHPL dans les flacons. Effectuez cette étape dans un banc de flux laminaire pour éviter toute contamination bactérienne ou fongique.
9. Suppression des fragments de plaquettes
Comme des fragments de plaquettes ont tendance à s'agréger et peut induire l'allo-immunisation, les retirer du pHPL. Centrifuger les fioles pHPL donc à 4000 g (15 minutes, 4 ° C). Dans une pipette banc de flux laminaire le plasma surnageant dans des flacons de stockage définitif (Falcons BD) et jeter les boulettes de plaquettes afin d'éviter des fragments en culture cellulaire.
10. Stockage des pHPL
Gel des aliquotes de 50 ml des flacons pHPL à nouveau à moins-20 ° C et de les stocker à des fins expérimentales.
11. L'utilisation de pHPL en culture cellulaire
Initialement ajouter de l'héparine sans conservateur au milieu pour éviter la formation de gel. Dégeler une aliquote pHPL à 37 ° C et compléter le milieu de culture par addition de 8 - 10%.
Médiums
MSC-Medium:
Utiliser 500 mL d'une MEM-, ajoutez 56 ml d'décongelés pHPL (voir aussi la référence 1 pour plus de détails) et 2 UI / ml (= 224 pi de solution de stock) de l'héparine sans conservateur (évite la coagulation du milieu par l'agglutination des le fibrinogène dans le plasma) pour atteindre une concentration finale de 10% pHPL. De plus ajoutez la pénicilline (100U/mL) / streptomycine (100μg/mL) solution et 2mM de L-glutamine (Sigma fois).
Filtrer le support grâce à un 20-um des pores du filtre à vide de taille (Millipore). Étiquette de la bouteille de façon appropriée (contenu, date).
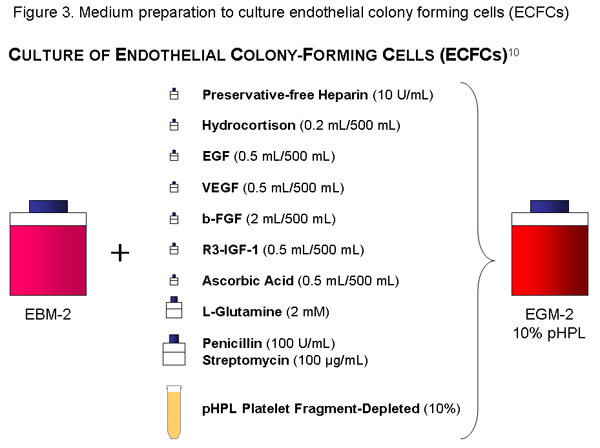
ECFC-Medium:
Utilisez une bouteille (500 ml) de l'EBM, ajouter les parties aliquotes de cytokine, 56 ml de pHPL, 10 UI / ml (= 1120μl de solution mère) de l'héparine sans conservateur, la pénicilline (100U/mL) / streptomycine (100 g / ml) de solution et 2mm de la L-glutamine au milieu de base et le filtre avec un 20 ul-pores sous vide taille du filtre (Millipore). Étiquette de la bouteille de façon appropriée (contenu, date).
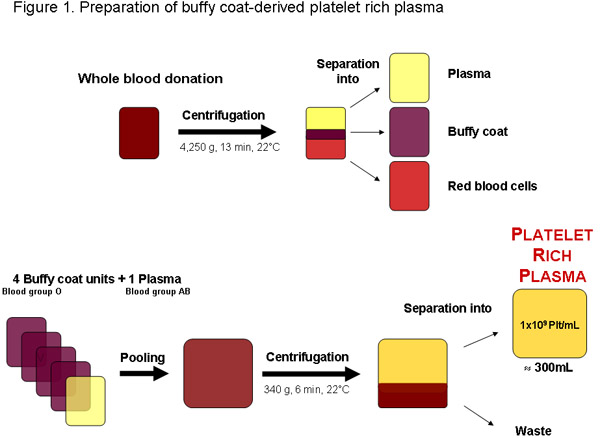
Figure 1: Préparation du plasma riche en plaquettes à partir d'un don de sang total auprès d'une banque de sang locale ou tout autre fournisseur autorisé. Après centrifugation, le sang peut être séparé en plasma, buffy coat et les globules rouges. Quatre unités de couche leuco, le groupe sanguin O et un groupe sanguin AB plasma peuvent être regroupées avant la centrifugation pour séparer le plasma riche en plaquettes. Une unité de qualité régulières du plasma riche en plaquettes d'environ 300 ml doit contenir 1x10 9 plaquettes par ml ou 3x10 11 platelets totale.

Discussion
Dans certaines régions plasma riche en plaquettes (PRP) peuvent être obtenus à partir de buffy-coats contraire être un produit des déchets d'emballage production de globules rouges provenant de dons de sang testés (figure 1). De façon optimale, le PRP est utilisé immédiatement pour la préparation ultérieure d'pHPL, comme en plaquettes périmées concentre la disponibilité de facteurs de croissance peuvent être réduites en raison de lésions de stockage de plaquettes et de la dégradation de 20...
Remerciements
Ce travail a été soutenu par l'Austrian Research Foundation (FWF, accorder N211-NAN à la DS) et l'Agence autrichienne de promotion de la recherche (FFG, accorder à la N200 DS). Les auteurs remercient Url Claudia pour l'assistance technique excellente et Monica Farrell pour l'édition linguistique.
matériels
| Name | Company | Catalog Number | Comments |
| Double bag (2 x 3.5L) | MacoPharma | VDL 8000XQ | originally for ascites puncture |
| 50 mL Falcon tube | Falcon BD | 2098 | |
| 50 mL Stripettes | Costar | 4501 | |
| Plasma bags (600mL) | Baxter Internationl Inc. | R4R2021 | |
| Sterile tubing welder | Terumo Medical Corp. | TSCD-II | |
| Welding equipment | Fresenius Kabi | Compo Seal | |
| Water bath | |||
| Sterile scissors | |||
| Clamps | |||
| Centrifuge |
Références
- Nurden, A. T., Nurden, P., Sanchez, M., Andia, I., Anitua, E. Platelets and wound healing. Front Biosci. 13, 3532-3548 (2008).
- Barrientos, S., Stojadinovic, O., Golinko, M. S., Brem, H., Tomic-Canic, M. Growth factors and cytokines in wound healing. Wound Repair Regen. 16, 585-601 (2008).
- Giacco, F. Thrombin-activated platelets induce proliferation of human skin fibroblasts by stimulating autocrine production of insulin-like growth factor-1. FASEB J. 20, 2402-2404 (2006).
- Kocaoemer, A., Kern, S., Kluter, H., Bieback, K. Human AB serum and thrombin-activated platelet-rich plasma are suitable alternatives to fetal calf serum for the expansion of mesenchymal stem cells from adipose tissue. Stem Cells. 25, 1270-1278 (2007).
- Kakudo, N. Proliferation-promoting effect of platelet-rich plasma on human adipose-derived stem cells and human dermal fibroblasts. Plast Reconstr Surg. 122, 1352-1360 (2008).
- Doucet, C. Platelet lysates promote mesenchymal stem cell expansion: A safety substitute for animal serum in cell-based therapy applications. J Cell Physiol. 205, 228-236 (2005).
- Schallmoser, K. Human platelet lysate can replace fetal bovine serum for clinical-scale expansion of functional mesenchymal stromal cells. Transfusion. 47, 1436-1446 (2007).
- Reinisch, A. Humanized system to propagate cord blood-derived multipotent mesenchymal stromal cells for clinical application. Regen Med. 2, 371-382 (2007).
- Schallmoser, K. Rapid large-scale expansion of functional mesenchymal stem cells from unmanipulated bone marrow without animal serum Tissue Eng Part. C Methods. 14, 185-196 (2008).
- Lange, C. Accelerated and safe expansion of human mesenchymal stromal cells in animal serum-free medium for transplantation and regenerative medicine. J Cell Physiol. 213, 18-26 (2007).
- Reinisch, A. Humanized large-scale expanded endothelial colony-forming cells function in vitro and in vivo. Blood. 113, 6716-6725 (2009).
- Bernardo, M. E. Optimization of in vitro expansion of human multipotent mesenchymal stromal cells for cell-therapy approaches: further insights in the search for a fetal calf serum substitute. J Cell Physiol. 211, 121-130 (2007).
- Carrancio, S. Optimization of mesenchymal stem cell expansion procedures by cell separation and culture conditions modification. Exp Hematol. 36, 1014-1021 (2008).
- Muller, A. M. Platelet lysate as a serum substitute for 2D static and 3D perfusion culture of stromal vascular fraction cells from human adipose tissue. Tissue Eng Part A. 15, 869-875 (2009).
- Anitua, E., Sanchez, M., Orive, G., Andia, I. The potential impact of the preparation rich in growth factors (PRGF) in different medical fields. Biomaterials. 28, 4551-4560 (2007).
- Anitua, E. New insights into and novel applications for platelet-rich fibrin therapies. Trends Biotechnol. 24, 227-234 (2006).
- Martinez-Zapata, M. J. Efficacy and safety of the use of autologous plasma rich in platelets for tissue regeneration: a systematic review. Transfusion. 49, 44-56 (2009).
- Weibrich, G., Kleis, W. K., Hafner, G., Hitzler, W. E. Growth factor levels in platelet-rich plasma and correlations with donor age, sex, and platelet count. J Craniomaxillofac Surg. 30, 97-102 (2002).
- Frechette, J. P., Martineau, I. &. a. m. p. ;. a. m. p., Gagnon, G. Platelet-rich plasmas: growth factor content and roles in wound healing. J Dent Res. 84, 434-439 (2005).
- Seghatchian, J., Krailadsiri, P. The platelet storage lesion. Transfus Med Rev. 11, 130-144 (1997).
- Selvaggi, T. A., Walker, R. E., Fleisher, T. A. Development of antibodies to fetal calf serum with arthus-like reactions in human immunodeficiency virus-infected patients given syngeneic lymphocyte infusions. Blood. 89, 776-779 (1997).
- Tonti, G. A., Mannello, F. From bone marrow to therapeutic applications: different behaviour and genetic/epigenetic stability during mesenchymal stem cell expansion in autologous and foetal bovine sera. Int J Dev Biol. 52, 1023-1032 (2008).
- Bieback, K. Human Alternatives to Fetal Bovine Serum for the Expansion of Mesenchymal Stromal Cells from Bone Marrow. Stem Cells. , (2009).
- Rohde, E., Schallmoser, K., Bartmann, C., Reinisch, A., Gad, S. C. GMP-Compliant Propagation of Human Multipotent Mesenchymal Stromal Cells. Pharmaceutical Manufacturing Handbook: Regulations and Quality. , 97-115 (2008).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon