Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Hayvan Serum Ücretsiz İnsan Kök Hücre Kültürleri Verimli Ek olarak Pooled İnsan Trombosit Lizat (pHPL) hazırlanması
Özet
İnsan trombosit lizat, büyüme faktörleri ve hücre kültüründe güçlü bir ek zengin bir kaynak. Bu protokol, zengin plazma, trombosit başlayarak, çeşitli donma-çözülme döngüsünden performans ve trombosit parçaları tüketen insan trombosit lizat büyük bir havuz hazırlama süreci sunar.
Özet
Trombosit kökenli büyüme faktörleri verimli hücre çoğalması teşvik gösterilmiştir.
Protokol
1. Başlangıç materyali
Cytapheresis tarafından hazırlanmış veya buffy kat elde edilen trombosit zengin plazma (TZP) birimleri ile başlayın.
2. Sterilite kontrol
Sterilite için 20 ml örnek almak bağlı küçük bir çanta (Baxter) ses aktarımı her PRP üniteden kontrol edin. Bu çanta kaynağı ile bağlantısını kesin.
3. PRP birimleri dondurulması
Hemen hazırlandıktan sonra, en az -20 ° C orijinal saklama çantası daha fazla manipülasyon olmadan PRP birimleri aşağı dondurma.
4. HPL birimleri, Çözülme
Bakteri testleri negatif olduğunda, şimdi 37 ° C (su banyosu) buz pıhtıları kayboluncaya kadar HPL birimleri olarak adlandırılan insan trombosit lizat birimleri, Çözülme. HPL sıcak etmeyin.
5. HPL birimleri Pooling
Standart bir ürün hazırlamak için en azından bir trombosit lizat havuzu için on-on beş çözülmüş HPL birimleri ele alalım. Havuz çift torba (MacoPharma) ardışık HPL çanta bağlayın ve bu iki çanta içine HPL aktarmak. Kaynak tarafından boş HPL çanta çıkarın. Son bir iki torba içerik karıştırma toplanmış insan trombosit lizatı (pHPL) 3 ila 4 L hacmi alın. Küçük bir çanta (Baxter) bağlayın ve 20 ml pHPL toplanmış ürün sterilite kontrolü için bir örnek almak. Bu çanta kaynağı ile bağlantısını kesin.
6. PHPL, Porsiyonlama
Taksitleri daha fazla işlem için uygun alikotları almak için pHPL. Küçük çanta (Baxter) havuzu çift torba (Macopharma) bağlayın ve küçük saklama torbaları (Baxter) 250 mL kadar hacimleri aktarmak. Kaynağı ile dolu çanta çıkarın.
7. PHPL alikot yeniden dondurma
Trombosit parçalanma oranı ve donma / çözülme daha ileri bir adım yayımlanan büyüme faktörleri miktarını artırın. Alakart pHPL küçük çanta tekrar dondurun en az -20 ° C
8. Re-çözülme ve pHPL alikotları bir porsiyon
37 pHPL çanta çözülme ° C (su banyosu). Steril makas kullanarak çanta tüp kesme ve şişeleri içine pHPL dökülen 50 ml flakon (Şahinleri BD) içerik aktarın. Laminer akış tezgah bakteriyel veya fungal kontaminasyonu engellemek için bu adımı gerçekleştirin.
9 - Trombosit parçalarının çıkarılması
Trombosit parçaları agrega eğilimindedir ve alloimmünizasyon neden olabilir pHPL onları çıkarın. 4.000 g (15 dakika, 4 ° C) bu nedenle pHPL şişeleri santrifüjleyin. Laminer akış tezgah pipet supernatant nihai depolama şişeleri (Şahinleri BD), plazma ve trombosit pelet iptal hücre kültüründe parçaları önlemek için.
10 PHPL, depolanması
Tekrar 50 ml pHPL şişeleri hacimde Freeze en az 20 ° C ve deneysel kullanmak için saklayın.
11. Hücre kültüründe pHPL kullanımı
Başlangıçta jel oluşumunu önlemek için, orta, koruyucu içermeyen heparin ekleyin. 37 ° C'de pHPL kısım çözülme ve kültür ortamı ek 8 -% 10 ek.
Besiyerleri
MSC-Orta:
500 mL-MEM kullanın çözülmüş pHPL 56 ml (da daha fazla ayrıntı için 1 referans) ve 2 IU / mL (= 224 ul stok solüsyonu), koruyucu içermeyen Heparin (orta, topaklanma yoluyla koagülasyon önler eklemek plazma fibrinojen)% 10 pHPL bir final konsantrasyonuna ulaşmak için. Ayrıca Penisilin (100U/mL) / Streptomisin (100μg/mL) çözüm ve L-glutamin 2mm (Sigma hem) ekleyin.
20 mikron gözenek boyutu vakum filtresi (Millipore) ile orta Filtresi. (Içerik, tarih) uygun şişe etiketi.
ECFC-Orta:
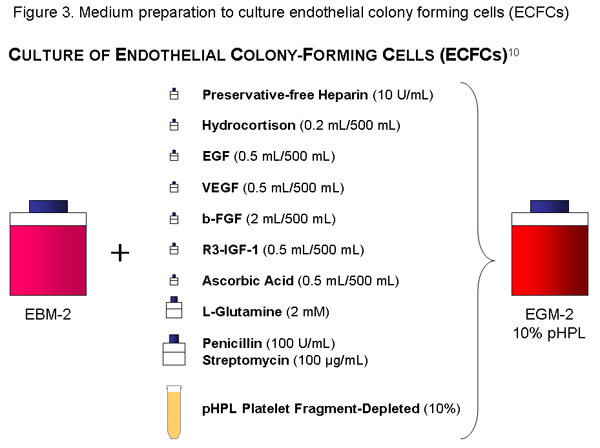
EBM bir şişe (500 ml) kullanın ekleyin, sitokin alikotları, koruyucu içermeyen Heparin pHPL, 10 IU / ml (= 1120μl stok solüsyonu) 56 mL, Penisilin (100U/mL) / Streptomisin (100 g / ml) solüsyonu ve 20 ul-gözenek boyutu vakum filtresi (Millipore) ile bazal, orta ve filtre L-glutamin 2mm. (Içerik, tarih) uygun şişe etiketi.
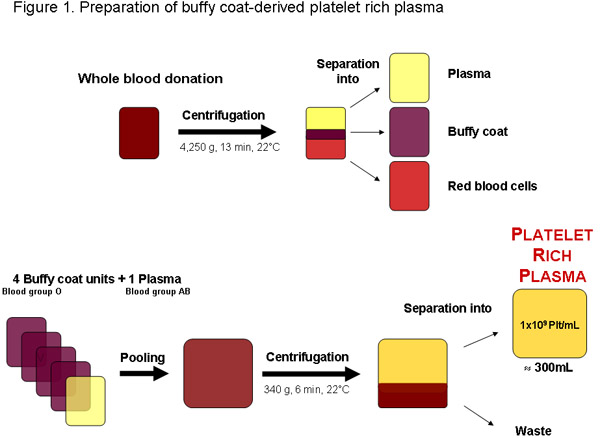
Şekil 1: yerel bir kan bankası ya da herhangi bir diğer yetkili sağlayıcı bir bütün kan bağışı trombosit açısından zengin plazma hazırlanması. Santrifüj sonra kan, plazma buffy coat ve kırmızı kan hücrelerinin ayrılabilir. Dört buffy coat birimleri, kan grubu O ve AB kan grubunda plazma santrifüj trombosit zengin plazma ayırmak için önce toplanmış olabilir. Yaklaşık 300ml düzenli kalite trombosit açısından zengin plazma ünitesi mL veya 3x10 11 platele başına 1x10 9 trombositler içermelidirts toplam.

Tartışmalar
Bazı bölgelerde trombosit zengin plazma (TZP) buffy-kat olarak test edilmiş kan bağışı (Şekil 1) paketlenmiş kırmızı kan hücresi üretimi bir atık ürün elde edilebilir. Optimal, büyüme faktörleri durumu konsantreleri eskimiş trombosit gibi, PRP, hemen pHPL daha fazla hazırlanması için kullanılır trombosit saklama lezyonlar ve 20 bozulması nedeniyle azalabilir . AİHM, ayrıca, ABH antijenleri ve isoagglutinins olası etkileri önlemek için, O kan grubu AB kan grubunda plazma ile tro...
Teşekkürler
Bu çalışma, Avusturya Araştırma Vakfı (FWF, DS hibe N211-NAN) ve Avusturya Araştırma Promosyon Ajansı (FFG, hibe N200 DS) tarafından desteklenmiştir. Yazarlar, dil düzenleme için mükemmel teknik yardım ve Monica Farrell Claudia URL teşekkür ederim.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Double bag (2 x 3.5L) | MacoPharma | VDL 8000XQ | originally for ascites puncture |
| 50 mL Falcon tube | Falcon BD | 2098 | |
| 50 mL Stripettes | Costar | 4501 | |
| Plasma bags (600mL) | Baxter Internationl Inc. | R4R2021 | |
| Sterile tubing welder | Terumo Medical Corp. | TSCD-II | |
| Welding equipment | Fresenius Kabi | Compo Seal | |
| Water bath | |||
| Sterile scissors | |||
| Clamps | |||
| Centrifuge |
Referanslar
- Nurden, A. T., Nurden, P., Sanchez, M., Andia, I., Anitua, E. Platelets and wound healing. Front Biosci. 13, 3532-3548 (2008).
- Barrientos, S., Stojadinovic, O., Golinko, M. S., Brem, H., Tomic-Canic, M. Growth factors and cytokines in wound healing. Wound Repair Regen. 16, 585-601 (2008).
- Giacco, F. Thrombin-activated platelets induce proliferation of human skin fibroblasts by stimulating autocrine production of insulin-like growth factor-1. FASEB J. 20, 2402-2404 (2006).
- Kocaoemer, A., Kern, S., Kluter, H., Bieback, K. Human AB serum and thrombin-activated platelet-rich plasma are suitable alternatives to fetal calf serum for the expansion of mesenchymal stem cells from adipose tissue. Stem Cells. 25, 1270-1278 (2007).
- Kakudo, N. Proliferation-promoting effect of platelet-rich plasma on human adipose-derived stem cells and human dermal fibroblasts. Plast Reconstr Surg. 122, 1352-1360 (2008).
- Doucet, C. Platelet lysates promote mesenchymal stem cell expansion: A safety substitute for animal serum in cell-based therapy applications. J Cell Physiol. 205, 228-236 (2005).
- Schallmoser, K. Human platelet lysate can replace fetal bovine serum for clinical-scale expansion of functional mesenchymal stromal cells. Transfusion. 47, 1436-1446 (2007).
- Reinisch, A. Humanized system to propagate cord blood-derived multipotent mesenchymal stromal cells for clinical application. Regen Med. 2, 371-382 (2007).
- Schallmoser, K. Rapid large-scale expansion of functional mesenchymal stem cells from unmanipulated bone marrow without animal serum Tissue Eng Part. C Methods. 14, 185-196 (2008).
- Lange, C. Accelerated and safe expansion of human mesenchymal stromal cells in animal serum-free medium for transplantation and regenerative medicine. J Cell Physiol. 213, 18-26 (2007).
- Reinisch, A. Humanized large-scale expanded endothelial colony-forming cells function in vitro and in vivo. Blood. 113, 6716-6725 (2009).
- Bernardo, M. E. Optimization of in vitro expansion of human multipotent mesenchymal stromal cells for cell-therapy approaches: further insights in the search for a fetal calf serum substitute. J Cell Physiol. 211, 121-130 (2007).
- Carrancio, S. Optimization of mesenchymal stem cell expansion procedures by cell separation and culture conditions modification. Exp Hematol. 36, 1014-1021 (2008).
- Muller, A. M. Platelet lysate as a serum substitute for 2D static and 3D perfusion culture of stromal vascular fraction cells from human adipose tissue. Tissue Eng Part A. 15, 869-875 (2009).
- Anitua, E., Sanchez, M., Orive, G., Andia, I. The potential impact of the preparation rich in growth factors (PRGF) in different medical fields. Biomaterials. 28, 4551-4560 (2007).
- Anitua, E. New insights into and novel applications for platelet-rich fibrin therapies. Trends Biotechnol. 24, 227-234 (2006).
- Martinez-Zapata, M. J. Efficacy and safety of the use of autologous plasma rich in platelets for tissue regeneration: a systematic review. Transfusion. 49, 44-56 (2009).
- Weibrich, G., Kleis, W. K., Hafner, G., Hitzler, W. E. Growth factor levels in platelet-rich plasma and correlations with donor age, sex, and platelet count. J Craniomaxillofac Surg. 30, 97-102 (2002).
- Frechette, J. P., Martineau, I. &. a. m. p. ;. a. m. p., Gagnon, G. Platelet-rich plasmas: growth factor content and roles in wound healing. J Dent Res. 84, 434-439 (2005).
- Seghatchian, J., Krailadsiri, P. The platelet storage lesion. Transfus Med Rev. 11, 130-144 (1997).
- Selvaggi, T. A., Walker, R. E., Fleisher, T. A. Development of antibodies to fetal calf serum with arthus-like reactions in human immunodeficiency virus-infected patients given syngeneic lymphocyte infusions. Blood. 89, 776-779 (1997).
- Tonti, G. A., Mannello, F. From bone marrow to therapeutic applications: different behaviour and genetic/epigenetic stability during mesenchymal stem cell expansion in autologous and foetal bovine sera. Int J Dev Biol. 52, 1023-1032 (2008).
- Bieback, K. Human Alternatives to Fetal Bovine Serum for the Expansion of Mesenchymal Stromal Cells from Bone Marrow. Stem Cells. , (2009).
- Rohde, E., Schallmoser, K., Bartmann, C., Reinisch, A., Gad, S. C. GMP-Compliant Propagation of Human Multipotent Mesenchymal Stromal Cells. Pharmaceutical Manufacturing Handbook: Regulations and Quality. , 97-115 (2008).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır