このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
動物の無血清ヒト幹細胞培養のための効率的なサプリメントとしてプールしたヒト血小板可溶化物(pHPL)の調製
要約
ヒト血小板溶解液は、増殖因子や細胞培養における強力なサプリメントの豊富な情報源となります。このプロトコルは、多血小板血漿から始まるいくつかの凍結融解サイクルを実行し、血小板の断片を枯渇させることによってヒト血小板溶解物の大規模なプールを準備するプロセスを示します。
要約
血小板由来増殖因子が効率的に細胞増殖を刺激することが示されている
プロトコル
1。出発材料
cytapheresisによって準備または軟膜から派生した多血小板血漿(PRP)の単位で始まります。
2。無菌性のチェック
不妊のために接続されている小さな袋(バクスター)にボリュームを転送することにより、各PRPのユニットから20 mLのサンプルを取るチェック。溶接することで、このバッグを外します。
3。 PRPユニットの凍結
調製直後、° Cオリジナル収納袋でさらに操作することなく、少なくとも-20 PRPユニットを下にフリーズ。
4。 HPL単位の凍結融解
細菌試験が陰性である場合、現在は37℃(水浴)氷の塊がなくなるまででHPLユニットと呼ばれるヒト血小板溶解液の単位を、解凍。 HPLを暖めるしないでください。
5。 HPLユニットのプーリング
標準化された生成物を調製一つ血小板溶解液のプールの少なくとも十から十五融解HPLの単位を取る。プーリング二重袋(MacoPharma)に連続してHPLバッグを接続し、これら2つのバッグにHPLを移す。溶接によって空のHPL袋を外します。 2つの袋の内容を混合することにより、プールされたヒト血小板溶解液(pHPL)3〜4リットルの最終容量を取得する。小さな袋(バクスター)を接続し、プールされた製品の無菌性のチェックのための20mLのpHPLのサンプルを取る。溶接することで、このバッグを外します。
6。 pHPLのPortioning
さらなる処理のために適切なアリコートを取得する部分pHPL。プーリング二重袋(Macopharma)に小さな袋(バクスター)を接続し、小規模なストレージバッグ(バクスター)を250 mLまでのボリュームを転送する。溶接によって満たされた袋を外します。
7。 pHPLのアリコートの再凍結
血小板断片化の割合、さらに凍結/解凍の手順によってリリース成長因子の量を増やします。再びポーションpHPLの小さな袋を凍結少なくとも-20℃
8。再融解しpHPLのアリコートのportioning
37 pHPL袋を解凍℃(水浴)。滅菌済みのハサミを使ってバッグのチューブを切断し、バイアルにpHPLを注いで50 mLのバイアル(ファルコンズBD)にコンテンツを転送します。細菌や真菌汚染を避けるために、層流のベンチで、この手順を実行します。
9。血小板フラグメントの除去
血小板の断片が集約する傾向があると同種免疫を誘発する可能性があるので、pHPLからそれらを削除する。 4000グラム(約15分、4℃)で従ってpHPLバイアルを遠心してください。層流ベンチピペットの最後のストレージバイアルに上清血漿(ファルコンズBD)と細胞培養でのフラグメントを避けるために、血小板ペレットを捨てる。
10。 pHPLの記憶
再び50mLのpHPLバイアルのアリコートを凍結少なくとも、20℃において実験的な使用のためにそれらを保存する。
11。細胞培養でpHPLの使用
最初にゲル形成を避けるために、培地に防腐剤フリーのヘパリンを追加します。 37℃でpHPLアリコートを解凍し、8の添加により培養液補足 - 10%。
媒体
MSC -ミディアム:
、- MEMの500mlを使用してください(詳細は1を参照することも参照)融解pHPL 56 mLを加え、防腐剤フリーのヘパリンの2 IU / mLの(ストック溶液の= 224μL)が(の凝集によって培地の凝固を避けることができます10%のpHPLの最終濃度になるように血漿中のフィブリノゲン)。また、ペニシリン(100U/mL)/ストレプトマイシン(100μg/mL)ソリューションとL -グルタミンの2mMの(両方ともSigma社)を追加します。
20μmの孔径真空フィルター(ミリポア)を介してメディアをフィルタします。 (内容、日付)を適切にボトルにラベルを付けます。
ECFC - ミディアム:
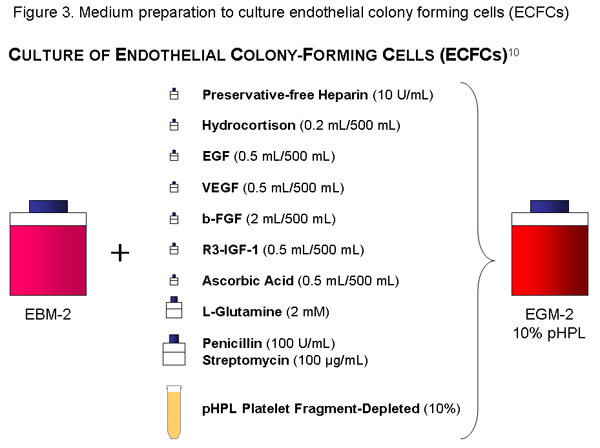
サイトカイン - アリコート、防腐剤フリーヘパリンのpHPL、10 IU / mlの(ストック溶液の=1120μl)の56 mLを、ペニシリン(100U/mL)/ストレプトマイシン(100を追加し、EBMの一瓶(500 mL)を使用してG / 20μlの細孔サイズの真空フィルター(ミリポア社)で基礎培地とフィルタへのL -グルタミンの添加)ソリューションおよび2mM。 (内容、日付)を適切にボトルにラベルを付けます。
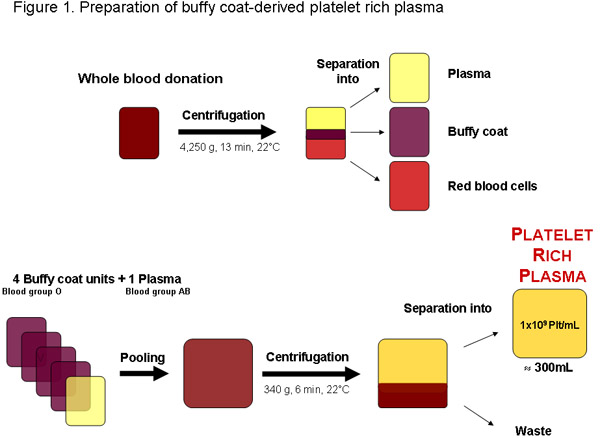
図1:ローカルの血液銀行またはその他の認可プロバイダからの全血献血から多血小板血漿の調製。遠心分離後の血液が血漿、バフィーコートと赤血球に分離することができます。四バフィーコートのユニットは、血液グループOと1つ血液型AB血漿は、多血小板血漿を分離する遠心分離の前にプールできます。約300MLの定期的な品質多血小板血漿の単位はmLまたは3 × 11 plateleあたり1 × 10 9血小板が含まれている必要がありますtsの合計。

ディスカッション
一部の地域では多血小板血漿(PRP)はバフィー-コートは、特にテストされた献血(図1)から濃厚赤血球の生産の廃棄物であることから得ることができる。成長因子の可用性を集中する時代遅れの血小板のように最適に、PRPは、pHPLのさらなる準備のためにすぐに使用されています血小板ストレージの病変と劣化は20〜のために少なくなります。さらに、ABH抗原とisoagglutininsの可能な影?...
謝辞
この作品は、オーストリアの研究財団(FWF、DSへの助成金N211 - NAN)とオーストリアの研究推進機構(FFG、DSへの助成金N200)によってサポートされています。著者は、言語編集用の優れた技術支援とモニカファレルのためクラウディアURLを感謝。
資料
| Material Name | Type | Company | Catalogue Number | Comment |
|---|---|---|---|---|
| Name | Company | Catalog Number | Comments | |
| Double bag (2 x 3.5L) | MacoPharma | VDL 8000XQ | originally for ascites puncture | |
| 50 mL Falcon tube | Falcon BD | 2098 | ||
| 50 mL Stripettes | Costar | 4501 | ||
| Plasma bags (600mL) | Baxter | R4R2021 | ||
| Sterile tubing welder | Terumo | TSCD-II | ||
| Welding equipment | Fresenius Kabi | Compo Seal | ||
| Water bath | ||||
| Sterile scissors | ||||
| Clamps | ||||
| Centrifuge |
参考文献
- Nurden, A. T., Nurden, P., Sanchez, M., Andia, I., Anitua, E. Platelets and wound healing. Front Biosci. 13, 3532-3548 (2008).
- Barrientos, S., Stojadinovic, O., Golinko, M. S., Brem, H., Tomic-Canic, M. Growth factors and cytokines in wound healing. Wound Repair Regen. 16, 585-601 (2008).
- Giacco, F. Thrombin-activated platelets induce proliferation of human skin fibroblasts by stimulating autocrine production of insulin-like growth factor-1. FASEB J. 20, 2402-2404 (2006).
- Kocaoemer, A., Kern, S., Kluter, H., Bieback, K. Human AB serum and thrombin-activated platelet-rich plasma are suitable alternatives to fetal calf serum for the expansion of mesenchymal stem cells from adipose tissue. Stem Cells. 25, 1270-1278 (2007).
- Kakudo, N. Proliferation-promoting effect of platelet-rich plasma on human adipose-derived stem cells and human dermal fibroblasts. Plast Reconstr Surg. 122, 1352-1360 (2008).
- Doucet, C. Platelet lysates promote mesenchymal stem cell expansion: A safety substitute for animal serum in cell-based therapy applications. J Cell Physiol. 205, 228-236 (2005).
- Schallmoser, K. Human platelet lysate can replace fetal bovine serum for clinical-scale expansion of functional mesenchymal stromal cells. Transfusion. 47, 1436-1446 (2007).
- Reinisch, A. Humanized system to propagate cord blood-derived multipotent mesenchymal stromal cells for clinical application. Regen Med. 2, 371-382 (2007).
- Schallmoser, K. Rapid large-scale expansion of functional mesenchymal stem cells from unmanipulated bone marrow without animal serum Tissue Eng Part. C Methods. 14, 185-196 (2008).
- Lange, C. Accelerated and safe expansion of human mesenchymal stromal cells in animal serum-free medium for transplantation and regenerative medicine. J Cell Physiol. 213, 18-26 (2007).
- Reinisch, A. Humanized large-scale expanded endothelial colony-forming cells function in vitro and in vivo. Blood. 113, 6716-6725 (2009).
- Bernardo, M. E. Optimization of in vitro expansion of human multipotent mesenchymal stromal cells for cell-therapy approaches: further insights in the search for a fetal calf serum substitute. J Cell Physiol. 211, 121-130 (2007).
- Carrancio, S. Optimization of mesenchymal stem cell expansion procedures by cell separation and culture conditions modification. Exp Hematol. 36, 1014-1021 (2008).
- Muller, A. M. Platelet lysate as a serum substitute for 2D static and 3D perfusion culture of stromal vascular fraction cells from human adipose tissue. Tissue Eng Part A. 15, 869-875 (2009).
- Anitua, E., Sanchez, M., Orive, G., Andia, I. The potential impact of the preparation rich in growth factors (PRGF) in different medical fields. Biomaterials. 28, 4551-4560 (2007).
- Anitua, E. New insights into and novel applications for platelet-rich fibrin therapies. Trends Biotechnol. 24, 227-234 (2006).
- Martinez-Zapata, M. J. Efficacy and safety of the use of autologous plasma rich in platelets for tissue regeneration: a systematic review. Transfusion. 49, 44-56 (2009).
- Weibrich, G., Kleis, W. K., Hafner, G., Hitzler, W. E. Growth factor levels in platelet-rich plasma and correlations with donor age, sex, and platelet count. J Craniomaxillofac Surg. 30, 97-102 (2002).
- Frechette, J. P., Martineau, I. &. a. m. p. ;. a. m. p., Gagnon, G. Platelet-rich plasmas: growth factor content and roles in wound healing. J Dent Res. 84, 434-439 (2005).
- Seghatchian, J., Krailadsiri, P. The platelet storage lesion. Transfus Med Rev. 11, 130-144 (1997).
- Selvaggi, T. A., Walker, R. E., Fleisher, T. A. Development of antibodies to fetal calf serum with arthus-like reactions in human immunodeficiency virus-infected patients given syngeneic lymphocyte infusions. Blood. 89, 776-779 (1997).
- Tonti, G. A., Mannello, F. From bone marrow to therapeutic applications: different behaviour and genetic/epigenetic stability during mesenchymal stem cell expansion in autologous and foetal bovine sera. Int J Dev Biol. 52, 1023-1032 (2008).
- Bieback, K. Human Alternatives to Fetal Bovine Serum for the Expansion of Mesenchymal Stromal Cells from Bone Marrow. Stem Cells. , (2009).
- Rohde, E., Schallmoser, K., Bartmann, C., Reinisch, A., Gad, S. C. GMP-Compliant Propagation of Human Multipotent Mesenchymal Stromal Cells. Pharmaceutical Manufacturing Handbook: Regulations and Quality. , 97-115 (2008).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved