Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Подготовка Объединенные тромбоцитов человека лизат (pHPL) как эффективное дополнение для животных бессывороточной человеческих культур стволовых клеток
Резюме
Человек тромбоцитов лизат является богатым источником факторов роста и мощным дополнением в клеточной культуре. Этот протокол представляет процесс подготовки большого пула тромбоцитов человека лизат, исходя из богатой тромбоцитами плазмы, выполняя несколько циклов замораживания-оттаивания и истощению тромбоцитов фрагментов.
Аннотация
Тромбоцитарный факторов роста, как было показано, чтобы стимулировать пролиферацию клеток эффективно
протокол
1. Исходный материал
Начните с богатой тромбоцитами плазмы (PRP) единиц подготовленных cytapheresis или полученные из Баффи пальто.
2. Стерильность проверить
Для проверки стерильности взять образец 20 мл с каждой единицы PRP путем перевода объема связано мешочек (Baxter). Отключите эту сумку с помощью сварки.
3. Замораживание PRP единиц
Сразу же после приготовления, заморозить PRP единиц вниз, по крайней мере от -20 ° C в оригинальной сумке хранения без дальнейших манипуляций.
4. Таяние HPL единиц
При бактериальных тестов отрицательны, оттепель тромбоцитов человека единиц лизата, который теперь называется HPL единиц при 37 ° С (водяная баня), пока лед сгустки исчезают. Не теплый HPL.
5. Объединение HPL единиц
Взять хотя бы десять-пятнадцать талой HPL единиц для одного тромбоцитов лизат бассейн для подготовки стандартизированный продукт. Подключите HPL мешки последовательно к объединению двойной мешок (MacoPharma) и передача HPL на эти две сумки. Отключите пустые мешки HPL с помощью сварки. Получить окончательный объем от 3 до 4 л объединенных тромбоцитов человека лизат (pHPL) путем смешивания содержания двух мешков. Подключите мешочек (Baxter) и взять образец 20 мл pHPL на стерильность проверка объединенных продукта. Отключите эту сумку с помощью сварки.
6. Порционирование pHPL
Порция pHPL, чтобы получить подходящую аликвоты для дальнейшей обработки. Подключите мешочки (Baxter) для объединения двойной мешок (Macopharma) и передача объемов до 250 мл до мешочки хранения (Baxter). Отключите наполненных мешков с помощью сварки.
7. Повторное замораживание аликвоты pHPL
Увеличение скорости тромбоцитов фрагментации и количество выпускаемой факторов роста дальнейшего замораживания / оттаивания шаг. Замораживание небольшие мешки порционные pHPL вновь по крайней мере -20 ° C.
8. Re-оттаивания и порционирование аликвоты pHPL
Оттепель pHPL мешках при температуре 37 ° С (водяная баня). Передача контента на 50 ампул мл (Соколы BD) за счет сокращения трубки мешка использованием стерильных ножниц и заливки pHPL в ампул. Выполните это действие в лавке ламинарного потока, чтобы избежать бактериальной или грибковой контаминации.
9. Удаление фрагментов тромбоцитов
Как тромбоцитов фрагменты, как правило, совокупности и может вызвать аллоиммунизации, удалить их из pHPL. Центрифуга pHPL флаконах поэтому в 4000 г (15 минут, 4 ° С). В скамейке пипетки ламинарного потока надосадочной плазмы в окончательном флаконах хранения (Соколы BD) и отбросить тромбоцитов гранул, чтобы избежать фрагментов в клеточной культуре.
10. Хранение pHPL
Замораживание аликвоты 50 мл флаконах pHPL вновь по крайней мере-20 ° С и хранить их для экспериментального использования.
11. Использование pHPL в культуре клеток
Первоначально добавить без консервантов гепарин в среду, чтобы избежать образования геля. Оттепель pHPL аликвоту при 37 ° С и дополнения культуральной среде путем добавления 8 - 10%.
Медиумы
МСЦ-среда:
Используйте 500 мл-MEM, добавить 56 мл талой pHPL (см. также 1 для более подробной информации) и 2 МЕ / мл (= 224 мкл исходного раствора) консерванта без гепарина (избегает коагуляции среды, через слипания фибриногена в плазме), чтобы достичь конечной концентрации 10% pHPL. Кроме того, добавить пенициллин (100U/mL) / Стрептомицин (100μg/mL) решение и на 2 мм от L-глутамин (как Sigma).
Фильтры среды, через 20 мкм, размер пор вакуум-фильтра (Millipore). Этикетка бутылки соответствующим образом (содержание, дата).
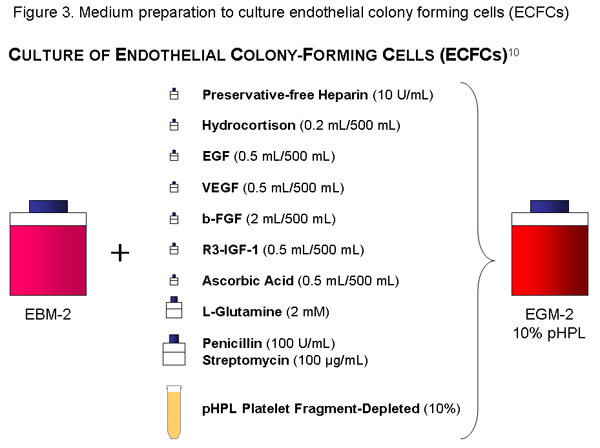
ECFC-среда:
Используйте одну бутылку (500 мл) EBM, добавить цитокин-аликвоты, 56 мл pHPL, 10 МЕ / мл (= 1120μl запаса раствора) без консервантов гепарин, пенициллин (100U/mL) / стрептомицин (100 г / мл) раствора и 2 мм L-глутамин к базальной среды и фильтром с 20 мкл-размер пор вакуум-фильтра (Millipore). Этикетка бутылки соответствующим образом (содержание, дата).
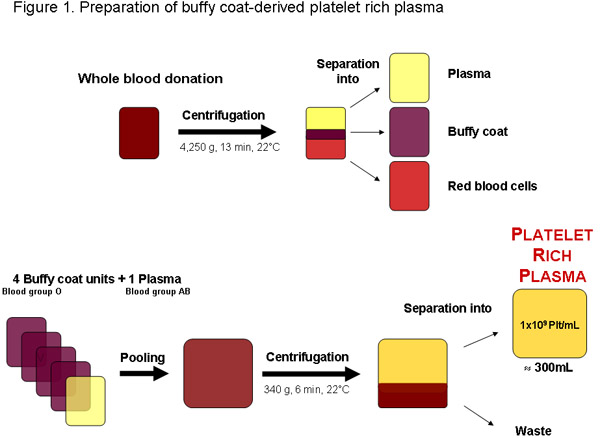
Рисунок 1: Подготовка обогащенной тромбоцитами плазмы вся донорская кровь из местного банка крови или любого другого авторизованного поставщика. После центрифугирования крови могут быть разделены на плазму, лейкомассы и красных кровяных телец. Четыре лейкомассы единиц, группа крови O и одной группы крови AB плазмы могут быть объединены до центрифугирования отделить богатой тромбоцитами плазмы. Регулярные качества обогащенной тромбоцитами плазмы единица примерно 300 мл должно содержаться 1x10 9 тромбоцитов на мл или 3x10 11 plateleTS общего количества.

Обсуждение
В некоторых регионах богатой тромбоцитами плазмы (PRP) могут быть получены из Баффи пальто иначе быть отходы упакованных красных кровяных телец из протестированных доноров крови (рис. 1). Оптимально, PRP используется непосредственно для дальнейшей подготовки pHPL, как в устаревших концентр?...
Благодарности
Эта работа была поддержана австрийским исследовательского фонда (FWF, грант N211-NAN для DS) и Австрийское агентство по продвижению научных исследований (FFG, грант N200 для DS). Авторы выражают благодарность Клаудиа Url за отличную техническую помощь и Моника Фаррелл языковых редактирования.
Материалы
| Name | Company | Catalog Number | Comments |
| Double bag (2 x 3.5L) | MacoPharma | VDL 8000XQ | originally for ascites puncture |
| 50 mL Falcon tube | Falcon BD | 2098 | |
| 50 mL Stripettes | Costar | 4501 | |
| Plasma bags (600mL) | Baxter Internationl Inc. | R4R2021 | |
| Sterile tubing welder | Terumo Medical Corp. | TSCD-II | |
| Welding equipment | Fresenius Kabi | Compo Seal | |
| Water bath | |||
| Sterile scissors | |||
| Clamps | |||
| Centrifuge |
Ссылки
- Nurden, A. T., Nurden, P., Sanchez, M., Andia, I., Anitua, E. Platelets and wound healing. Front Biosci. 13, 3532-3548 (2008).
- Barrientos, S., Stojadinovic, O., Golinko, M. S., Brem, H., Tomic-Canic, M. Growth factors and cytokines in wound healing. Wound Repair Regen. 16, 585-601 (2008).
- Giacco, F. Thrombin-activated platelets induce proliferation of human skin fibroblasts by stimulating autocrine production of insulin-like growth factor-1. FASEB J. 20, 2402-2404 (2006).
- Kocaoemer, A., Kern, S., Kluter, H., Bieback, K. Human AB serum and thrombin-activated platelet-rich plasma are suitable alternatives to fetal calf serum for the expansion of mesenchymal stem cells from adipose tissue. Stem Cells. 25, 1270-1278 (2007).
- Kakudo, N. Proliferation-promoting effect of platelet-rich plasma on human adipose-derived stem cells and human dermal fibroblasts. Plast Reconstr Surg. 122, 1352-1360 (2008).
- Doucet, C. Platelet lysates promote mesenchymal stem cell expansion: A safety substitute for animal serum in cell-based therapy applications. J Cell Physiol. 205, 228-236 (2005).
- Schallmoser, K. Human platelet lysate can replace fetal bovine serum for clinical-scale expansion of functional mesenchymal stromal cells. Transfusion. 47, 1436-1446 (2007).
- Reinisch, A. Humanized system to propagate cord blood-derived multipotent mesenchymal stromal cells for clinical application. Regen Med. 2, 371-382 (2007).
- Schallmoser, K. Rapid large-scale expansion of functional mesenchymal stem cells from unmanipulated bone marrow without animal serum Tissue Eng Part. C Methods. 14, 185-196 (2008).
- Lange, C. Accelerated and safe expansion of human mesenchymal stromal cells in animal serum-free medium for transplantation and regenerative medicine. J Cell Physiol. 213, 18-26 (2007).
- Reinisch, A. Humanized large-scale expanded endothelial colony-forming cells function in vitro and in vivo. Blood. 113, 6716-6725 (2009).
- Bernardo, M. E. Optimization of in vitro expansion of human multipotent mesenchymal stromal cells for cell-therapy approaches: further insights in the search for a fetal calf serum substitute. J Cell Physiol. 211, 121-130 (2007).
- Carrancio, S. Optimization of mesenchymal stem cell expansion procedures by cell separation and culture conditions modification. Exp Hematol. 36, 1014-1021 (2008).
- Muller, A. M. Platelet lysate as a serum substitute for 2D static and 3D perfusion culture of stromal vascular fraction cells from human adipose tissue. Tissue Eng Part A. 15, 869-875 (2009).
- Anitua, E., Sanchez, M., Orive, G., Andia, I. The potential impact of the preparation rich in growth factors (PRGF) in different medical fields. Biomaterials. 28, 4551-4560 (2007).
- Anitua, E. New insights into and novel applications for platelet-rich fibrin therapies. Trends Biotechnol. 24, 227-234 (2006).
- Martinez-Zapata, M. J. Efficacy and safety of the use of autologous plasma rich in platelets for tissue regeneration: a systematic review. Transfusion. 49, 44-56 (2009).
- Weibrich, G., Kleis, W. K., Hafner, G., Hitzler, W. E. Growth factor levels in platelet-rich plasma and correlations with donor age, sex, and platelet count. J Craniomaxillofac Surg. 30, 97-102 (2002).
- Frechette, J. P., Martineau, I. &. a. m. p. ;. a. m. p., Gagnon, G. Platelet-rich plasmas: growth factor content and roles in wound healing. J Dent Res. 84, 434-439 (2005).
- Seghatchian, J., Krailadsiri, P. The platelet storage lesion. Transfus Med Rev. 11, 130-144 (1997).
- Selvaggi, T. A., Walker, R. E., Fleisher, T. A. Development of antibodies to fetal calf serum with arthus-like reactions in human immunodeficiency virus-infected patients given syngeneic lymphocyte infusions. Blood. 89, 776-779 (1997).
- Tonti, G. A., Mannello, F. From bone marrow to therapeutic applications: different behaviour and genetic/epigenetic stability during mesenchymal stem cell expansion in autologous and foetal bovine sera. Int J Dev Biol. 52, 1023-1032 (2008).
- Bieback, K. Human Alternatives to Fetal Bovine Serum for the Expansion of Mesenchymal Stromal Cells from Bone Marrow. Stem Cells. , (2009).
- Rohde, E., Schallmoser, K., Bartmann, C., Reinisch, A., Gad, S. C. GMP-Compliant Propagation of Human Multipotent Mesenchymal Stromal Cells. Pharmaceutical Manufacturing Handbook: Regulations and Quality. , 97-115 (2008).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены