A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
הכנת lysate משולב טסיות דם האדם (pHPL) כתוסף יעיל עבור בעלי חיים סרום ללא בתרביות תאים האדם גזע
In This Article
Summary
Lysate טסיות הדם האנושי הוא מקור עשיר של גורמי גדילה תוסף חזק בתרבות התא. פרוטוקול זה מציג את תהליך הכנת מאגר גדול של lysate הטסיות על ידי אנוש החל פלזמה עשירה בטסיות, ביצוע מספר להקפיא להפשיר מחזורים depleting שברי הטסיות.
Abstract
טסיות דם גורמי גדילה שמקורם הוכחו לעורר התפשטות תאים ביעילות
Protocol
1. החל החומר
התחל עם טסיות דם עשיר פלזמה (PRP) שהוכן על ידי יחידות cytapheresis או נגזר באפי מעילים.
2. עקרות לבדוק
במשך עקרות לבדוק לקחת דגימה של 20 מ"ל של כל יחידה PRP ידי העברת נפח שקית קטנה מחוברת (Baxter). נתק את התיק הזה על ידי ריתוך.
3. הקפאה של יחידות PRP
מיד לאחר ההכנה, להקפיא את יחידות PRP עד לפחות -20 ° C בשקית אחסון המקורי ללא מניפולציה נוספת.
4. הפשרת יחידות HPL
כאשר בדיקות חיידקים שליליים, להפשיר האנושי יחידות lysate טסיות דם, הנקרא כיום יחידות HPL ב 37 ° C (אמבט מים) עד קרישי קרח להיעלם. אין לחמם את HPL.
5. איגום של יחידות HPL
קח לפחות 10-15 יחידות HPL מופשר במשך בשלולית lysate טסיות להכין מוצר סטנדרטי. חבר את שקיות HPL ברציפות לשקית כפולה איגום (MacoPharma) ולהעביר את HPL לתוך שתי שקיות. נתק את שקיות HPL ריק על ידי ריתוך. קבל נפח הסופי של L 3-4 של lysate ונקווה טסיות הדם האנושי (pHPL) על ידי ערבוב את התוכן של שתי שקיות. חבר תיק קטן (Baxter) ולקחת מדגם של 20 מ"ל pHPL לבדיקה סטריליות המוצר ונקווה. נתק את התיק הזה על ידי ריתוך.
6. Portioning של pHPL
PHPL פרשת לקבל aliquots מתאים לעיבוד נוסף. חבר בשקיות קטנות (Baxter) לשקית איגום כפול (Macopharma) ולהעביר כמויות של עד 250 מ"ל של שקיות אחסון קטן (Baxter). נתק את שקיות מלאות על ידי ריתוך.
7. Re-הקפאה של aliquots pHPL
הגדלת שיעור הפיצול הטסיות וכמות גורמי גדילה שפורסמו על ידי צעד הקפאה / הפשרה נוספת. להקפיא את שקיות קטנות של pHPL במנות שוב לפחות -20 ° C.
8. Re-מפשיר portioning של aliquots pHPL
ההפשרה שקיות pHPL ב 37 ° C (אמבט מים). מעבירים את תוכן לתוך צלוחיות 50 מ"ל (פלקונס BD) על ידי חיתוך הצינור של התיק באמצעות מספריים סטרילית לשפוך את pHPL לתוך צלוחיות. בצע פעולה זו על ספסל זרימה למינרית, כדי למנוע זיהום חיידקי או פטרייתי.
9. הסרת שברי טסיות
כמו שברי טסיות נוטים לצבור ועלול לגרום alloimmunization, להסיר אותם מן pHPL. צנטריפוגה צלוחיות pHPL ולכן ב 4000 גרם (15 דקות, 4 ° C). ב פיפטה זרימה למינרית הספסל פלזמה supernatant לתוך צלוחיות אחסון הסופי (פלקונס BD) וזורקים את כדורי טסיות הדם, כדי למנוע שברים בתרבות התא.
10. אחסון של pHPL
הקפאת aliquots של 50 בקבוקונים מ"ל pHPL שוב לפחות-20 ° C ולאחסן אותם לשימוש ניסיוני.
11. השימוש pHPL בתרבות התא
בתחילה להוסיף הפרין ללא חומר משמר עד בינוני, כדי למנוע היווצרות קריש. הפשרה aliquot pHPL ב 37 ° C ו מוסף התרבות בינוני על ידי תוספת של 8 - 10%.
מדיומים
MSC-בינונית:
השתמש ב 500 מ"ל של-ממ, להוסיף 56 מ"ל של pHPL מופשר (ראה גם התייחסות 1 לפרטים נוספים) ו 2 IU / mL (= 224 μl של פתרון המניות) של הפארין, חומר משמר בחינם (מונע קרישה של המדיום דרך ובהצטברויות פיברינוגן של פלזמה) להגיע הריכוז הסופי של pHPL 10%. בנוסף להוסיף פניצילין (100U/mL) / סטרפטומיצין (100μg/mL) פתרון של 2 מ"מ L-Glutamin (הן סיגמא).
סינון בינוני באמצעות מסנן 20 מיקרומטר, גודל הנקבוביות ואקום (Millipore). תווית הבקבוק כיאות (תאריך, תוכן).
ECFC-בינונית:
השתמש בקבוק אחד (500 מ"ל) של EBM, מוסיפים את ציטוקינים-aliquots, 56 מ"ל של pHPL, 10 IU / מ"ל (= 1120μl של פתרון המניות) של הפארין, חומר משמר בחינם, פניצילין (100U/mL) / סטרפטומיצין (100 גר '/ מ"ל) פתרון של 2 מ"מ L-Glutamin עד בינוני המסנן הבסיס, עם 20 μl-נקבוביות ואקום גודל המסנן (Millipore). תווית הבקבוק כיאות (תאריך, תוכן).
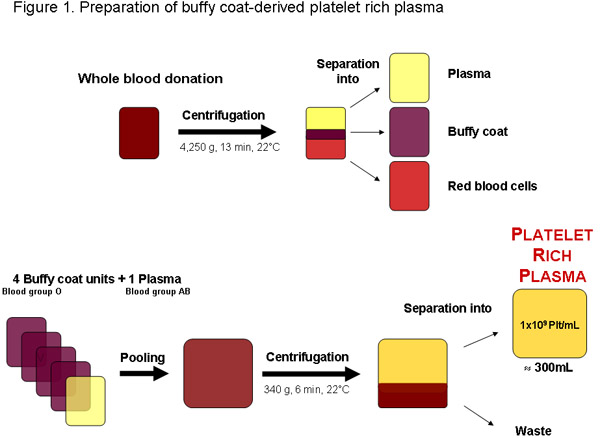
איור 1: הכנת פלזמה טסיות דם עשיר מתרומת דם כל מבנק הדם המקומית או כל ספקית אחרת שאושרה. לאחר צנטריפוגה לדם ניתן לחלק פלזמה, באפי מעיל כדוריות דם אדומות. ארבע יחידות באפי מעיל, דם O קבוצה אחת קבוצה דם AB פלזמה ניתן ונקווה לפני צנטריפוגה להפריד את הפלזמה העשירה בטסיות. איכות רגילה טסיות עשיר פלזמה יחידה של כ 300 מ"ל יכילו 1x10 9 טסיות לכל מ"ל או 3x10 11 platelets מוחלט.

Discussion
באזורים מסוימים טסיות דם עשיר פלזמה (PRP) ניתן לקבל אצל באפי, מעילים אחרת שהוא תוצר פסולת של ארז ייצור תאים דם אדומים מתרומות דם שנבדקו (איור 1). באופן אופטימלי, PRP משמש מיד להכנת נוספת של pHPL, כמו טסיות מיושן מרכזת את הזמינות של גורמי גדילה עשוי להיות מופחת בשל נגעים אחסון ?...
Acknowledgements
עבודה זו נתמכה על ידי קרן המחקר האוסטרי (FWF, מענק N211-NAN ל DS) לבין מחקר אוסטרי קידום הסוכנות (FFG, מענק N200 ל DS). המחברים מודים Url קלאודיה לקבלת סיוע טכני מעולה מוניקה פארל לעריכה לשונית.
Materials
| Name | Company | Catalog Number | Comments |
| Double bag (2 x 3.5L) | MacoPharma | VDL 8000XQ | originally for ascites puncture |
| 50 mL Falcon tube | Falcon BD | 2098 | |
| 50 mL Stripettes | Costar | 4501 | |
| Plasma bags (600mL) | Baxter Internationl Inc. | R4R2021 | |
| Sterile tubing welder | Terumo Medical Corp. | TSCD-II | |
| Welding equipment | Fresenius Kabi | Compo Seal | |
| Water bath | |||
| Sterile scissors | |||
| Clamps | |||
| Centrifuge |
References
- Nurden, A. T., Nurden, P., Sanchez, M., Andia, I., Anitua, E. Platelets and wound healing. Front Biosci. 13, 3532-3548 (2008).
- Barrientos, S., Stojadinovic, O., Golinko, M. S., Brem, H., Tomic-Canic, M. Growth factors and cytokines in wound healing. Wound Repair Regen. 16, 585-601 (2008).
- Giacco, F. Thrombin-activated platelets induce proliferation of human skin fibroblasts by stimulating autocrine production of insulin-like growth factor-1. FASEB J. 20, 2402-2404 (2006).
- Kocaoemer, A., Kern, S., Kluter, H., Bieback, K. Human AB serum and thrombin-activated platelet-rich plasma are suitable alternatives to fetal calf serum for the expansion of mesenchymal stem cells from adipose tissue. Stem Cells. 25, 1270-1278 (2007).
- Kakudo, N. Proliferation-promoting effect of platelet-rich plasma on human adipose-derived stem cells and human dermal fibroblasts. Plast Reconstr Surg. 122, 1352-1360 (2008).
- Doucet, C. Platelet lysates promote mesenchymal stem cell expansion: A safety substitute for animal serum in cell-based therapy applications. J Cell Physiol. 205, 228-236 (2005).
- Schallmoser, K. Human platelet lysate can replace fetal bovine serum for clinical-scale expansion of functional mesenchymal stromal cells. Transfusion. 47, 1436-1446 (2007).
- Reinisch, A. Humanized system to propagate cord blood-derived multipotent mesenchymal stromal cells for clinical application. Regen Med. 2, 371-382 (2007).
- Schallmoser, K. Rapid large-scale expansion of functional mesenchymal stem cells from unmanipulated bone marrow without animal serum Tissue Eng Part. C Methods. 14, 185-196 (2008).
- Lange, C. Accelerated and safe expansion of human mesenchymal stromal cells in animal serum-free medium for transplantation and regenerative medicine. J Cell Physiol. 213, 18-26 (2007).
- Reinisch, A. Humanized large-scale expanded endothelial colony-forming cells function in vitro and in vivo. Blood. 113, 6716-6725 (2009).
- Bernardo, M. E. Optimization of in vitro expansion of human multipotent mesenchymal stromal cells for cell-therapy approaches: further insights in the search for a fetal calf serum substitute. J Cell Physiol. 211, 121-130 (2007).
- Carrancio, S. Optimization of mesenchymal stem cell expansion procedures by cell separation and culture conditions modification. Exp Hematol. 36, 1014-1021 (2008).
- Muller, A. M. Platelet lysate as a serum substitute for 2D static and 3D perfusion culture of stromal vascular fraction cells from human adipose tissue. Tissue Eng Part A. 15, 869-875 (2009).
- Anitua, E., Sanchez, M., Orive, G., Andia, I. The potential impact of the preparation rich in growth factors (PRGF) in different medical fields. Biomaterials. 28, 4551-4560 (2007).
- Anitua, E. New insights into and novel applications for platelet-rich fibrin therapies. Trends Biotechnol. 24, 227-234 (2006).
- Martinez-Zapata, M. J. Efficacy and safety of the use of autologous plasma rich in platelets for tissue regeneration: a systematic review. Transfusion. 49, 44-56 (2009).
- Weibrich, G., Kleis, W. K., Hafner, G., Hitzler, W. E. Growth factor levels in platelet-rich plasma and correlations with donor age, sex, and platelet count. J Craniomaxillofac Surg. 30, 97-102 (2002).
- Frechette, J. P., Martineau, I. &. a. m. p. ;. a. m. p., Gagnon, G. Platelet-rich plasmas: growth factor content and roles in wound healing. J Dent Res. 84, 434-439 (2005).
- Seghatchian, J., Krailadsiri, P. The platelet storage lesion. Transfus Med Rev. 11, 130-144 (1997).
- Selvaggi, T. A., Walker, R. E., Fleisher, T. A. Development of antibodies to fetal calf serum with arthus-like reactions in human immunodeficiency virus-infected patients given syngeneic lymphocyte infusions. Blood. 89, 776-779 (1997).
- Tonti, G. A., Mannello, F. From bone marrow to therapeutic applications: different behaviour and genetic/epigenetic stability during mesenchymal stem cell expansion in autologous and foetal bovine sera. Int J Dev Biol. 52, 1023-1032 (2008).
- Bieback, K. Human Alternatives to Fetal Bovine Serum for the Expansion of Mesenchymal Stromal Cells from Bone Marrow. Stem Cells. , (2009).
- Rohde, E., Schallmoser, K., Bartmann, C., Reinisch, A., Gad, S. C. GMP-Compliant Propagation of Human Multipotent Mesenchymal Stromal Cells. Pharmaceutical Manufacturing Handbook: Regulations and Quality. , 97-115 (2008).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved