É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Preparação de pool de plaquetas Lysate Humanos (pHPL) como um suplemento eficiente para animais de soro livre de culturas de células estaminais humanas
Neste Artigo
Resumo
Lisado de plaquetas humanas é uma fonte rica em fatores de crescimento e um suplemento potente em cultura de células. Este protocolo apresenta o processo de preparação de um grande pool de lisado de plaquetas humanas por a partir de plasma rico em plaquetas, realizando diversos ciclos de congelamento e descongelamento e esgotando os fragmentos de plaquetas.
Resumo
Fatores de crescimento plaquetário derivados têm sido mostrados para estimular a proliferação celular de forma eficiente
Protocolo
1. Material de partida
Comece com plaquetas plasma rico (PRP) unidades preparadas por Citaferese ou derivados de buffy casacos.
2. Verificar a esterilidade
Para verificar a esterilidade tirar uma amostra de 20 mL de cada unidade PRP, transferindo o volume para uma bolsa pequena conectado (Baxter). Desconecte este saco com solda.
3. Congelamento de unidades PRP
Imediatamente após a preparação, congelar as unidades PRP até pelo menos -20 ° C no saco de armazenamento original, sem manipulação posterior.
4. Descongelamento das unidades HPL
Quando os testes bacteriana são negativos, descongele humana unidades lisado de plaquetas, agora chamados de unidades HPL a 37 ° C (banho de água) até que os coágulos de gelo desaparecer. Não aqueça o HPL.
5. Agrupamento de unidades de HPL
Tome pelo menos 10-15 descongelado unidades HPL para um pool de plaquetas lisado para preparar um produto padronizado. Conectar os sacos HPL consecutivamente para o saco de pooling de casal (MacoPharma) e transferir o HPL nesses dois sacos. Desligue o sacos vazios HPL por soldadura. Obter um volume final de 3 a 4 L de pooled lisado de plaquetas humanas (pHPL), misturando o conteúdo dos dois sacos. Conectar um pequeno saco (Baxter) e tirar uma amostra de 20 mL para pHPL verificar a esterilidade do produto em pool. Desconecte este saco com solda.
6. Porcionamento do pHPL
PHPL a parte para obter alíquotas adequadas para processamento posterior. Conectar pequenos sacos (Baxter) para o saco de pooling de casal (Macopharma) e transferência de volumes de até 250 mL para os sacos de armazenamento pequeno (Baxter). Desconecte os sacos cheios de soldagem.
7. Re-congelamento das alíquotas pHPL
Aumentar a taxa de fragmentação de plaquetas e da quantidade de fatores de crescimento liberados por uma etapa de congelamento / descongelamento mais. Congelar os pequenos sacos de pHPL porções de novo, pelo menos, -20 ° C.
8. Re-descongelamento e porcionamento das alíquotas pHPL
Descongelar os sacos pHPL a 37 ° C (banho de água). Transferir o conteúdo em frascos de 50 ml (Falcons BD), cortando o tubo do saco com uma tesoura esterilizada e derramar o pHPL para os frascos. Realizar esta etapa em um banco de fluxo laminar para evitar a contaminação bacteriana ou fúngica.
9. Remoção de fragmentos de plaquetas
Como fragmentos de plaquetas tendem a se agregar e pode induzir a aloimunização, removê-los do pHPL. Centrifugue os tubos pHPL, portanto, a 4.000 g (15 minutos, 4 ° C). Em uma pipeta bancada de fluxo laminar o plasma sobrenadante para os frascos de armazenamento final (Falcons BD) e descartar as pelotas de plaquetas para evitar fragmentos em cultura de células.
10. Armazenamento de pHPL
Congelar alíquotas de 50 mL pHPL novamente em menos 20 ° C e armazená-los para uso experimental.
11. Uso de pHPL em cultura de células
Inicialmente adicionar heparina sem conservantes para o meio para evitar a formação de gel. Descongelar uma alíquota pHPL a 37 ° C e completar o meio de cultura pela adição de 8-10%.
Médiuns
MSC Médio:
Use 500 mL de uma MEM, adicione 56 ml de pHPL descongelados (ver também referência 1 para mais detalhes) e 2 UI / mL (= 224 ml de solução-estoque) de heparina sem conservantes (evita a coagulação do meio através do acúmulo de o fibrinogênio no plasma) para alcançar uma concentração final de pHPL 10%. Além disso adicionar penicilina (100U/ml) / estreptomicina (100μg/mL) e solução de 2mM de L-glutamina (ambos Sigma).
Filtrar o meio através do filtro a vácuo a 20 mM de poros tamanho (Millipore). Rótulo do frasco adequadamente (data, conteúdo).
ECFC-Medium:
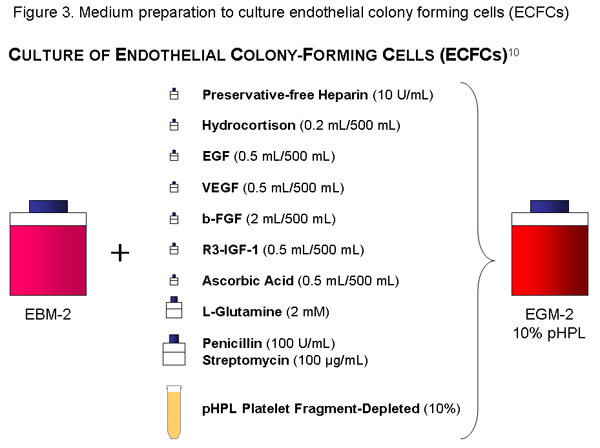
Use uma garrafa (500 ml) de EBM, adicionar as alíquotas de citocinas, 56 mL de pHPL, 10 UI / ml (= 1120μl da solução de reserva) de conservante livre de Heparina, Penicilina (100U/ml) / estreptomicina (100 g / mL de solução) e 2mM de L-glutamina ao meio basal e com um filtro de 20 l de poros tamanho vácuo filtro (Millipore). Rótulo do frasco adequadamente (data, conteúdo).
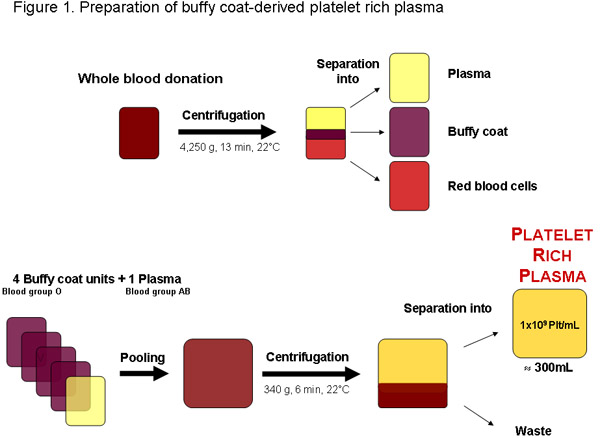
Figura 1: Preparação de plasma rico em plaquetas a partir de uma doação de sangue total de um banco de sangue local ou qualquer outro fornecedor autorizado. Após a centrifugação do sangue pode ser separado em plasma, buffy coat e células vermelhas do sangue. Quatro unidades de buffy coat, o grupo sanguíneo O e um grupo sanguíneo AB plasma podem ser combinadas antes da centrifugação para separar o plasma rico em plaquetas. A regularidade de qualidade unidade de plasma rico em plaquetas de aproximadamente 300mL deve conter 1x10 9 plaquetas por ml ou 11 3x10 plateletotal de ts.

Discussão
Em algumas regiões de plaquetas plasma rico (PRP) podem ser obtidas buffy-coats de outra forma de ser um produto embalado resíduos de produção de glóbulos vermelhos a partir de doações de sangue testadas (Figura 1). Idealmente, PRP é usado imediatamente para melhor preparação de pHPL, como em plaquetas desatualizado concentra a disponibilidade de fatores de crescimento pode ser reduzido devido a lesões de armazenamento de plaquetas e degradação 20. Recomenda-se ainda para produzir PRP combinando ...
Agradecimentos
Este trabalho tem sido apoiada pelo austríaco Research Foundation (FWF, conceder N211-NAN para DS) ea Agência de Promoção Austrian Research (FFG, conceder N200 para DS). Os autores agradecem a Claudia Url para assistência técnica excelente e Farrell Monica para a edição de linguística.
Materiais
| Material Name | Type | Company | Catalogue Number | Comment |
|---|---|---|---|---|
| Name | Company | Catalog Number | Comments | |
| Double bag (2 x 3.5L) | MacoPharma | VDL 8000XQ | originally for ascites puncture | |
| 50 mL Falcon tube | Falcon BD | 2098 | ||
| 50 mL Stripettes | Costar | 4501 | ||
| Plasma bags (600mL) | Baxter | R4R2021 | ||
| Sterile tubing welder | Terumo | TSCD-II | ||
| Welding equipment | Fresenius Kabi | Compo Seal | ||
| Water bath | ||||
| Sterile scissors | ||||
| Clamps | ||||
| Centrifuge |
Referências
- Nurden, A. T., Nurden, P., Sanchez, M., Andia, I., Anitua, E. Platelets and wound healing. Front Biosci. 13, 3532-3548 (2008).
- Barrientos, S., Stojadinovic, O., Golinko, M. S., Brem, H., Tomic-Canic, M. Growth factors and cytokines in wound healing. Wound Repair Regen. 16, 585-601 (2008).
- Giacco, F. Thrombin-activated platelets induce proliferation of human skin fibroblasts by stimulating autocrine production of insulin-like growth factor-1. FASEB J. 20, 2402-2404 (2006).
- Kocaoemer, A., Kern, S., Kluter, H., Bieback, K. Human AB serum and thrombin-activated platelet-rich plasma are suitable alternatives to fetal calf serum for the expansion of mesenchymal stem cells from adipose tissue. Stem Cells. 25, 1270-1278 (2007).
- Kakudo, N. Proliferation-promoting effect of platelet-rich plasma on human adipose-derived stem cells and human dermal fibroblasts. Plast Reconstr Surg. 122, 1352-1360 (2008).
- Doucet, C. Platelet lysates promote mesenchymal stem cell expansion: A safety substitute for animal serum in cell-based therapy applications. J Cell Physiol. 205, 228-236 (2005).
- Schallmoser, K. Human platelet lysate can replace fetal bovine serum for clinical-scale expansion of functional mesenchymal stromal cells. Transfusion. 47, 1436-1446 (2007).
- Reinisch, A. Humanized system to propagate cord blood-derived multipotent mesenchymal stromal cells for clinical application. Regen Med. 2, 371-382 (2007).
- Schallmoser, K. Rapid large-scale expansion of functional mesenchymal stem cells from unmanipulated bone marrow without animal serum Tissue Eng Part. C Methods. 14, 185-196 (2008).
- Lange, C. Accelerated and safe expansion of human mesenchymal stromal cells in animal serum-free medium for transplantation and regenerative medicine. J Cell Physiol. 213, 18-26 (2007).
- Reinisch, A. Humanized large-scale expanded endothelial colony-forming cells function in vitro and in vivo. Blood. 113, 6716-6725 (2009).
- Bernardo, M. E. Optimization of in vitro expansion of human multipotent mesenchymal stromal cells for cell-therapy approaches: further insights in the search for a fetal calf serum substitute. J Cell Physiol. 211, 121-130 (2007).
- Carrancio, S. Optimization of mesenchymal stem cell expansion procedures by cell separation and culture conditions modification. Exp Hematol. 36, 1014-1021 (2008).
- Muller, A. M. Platelet lysate as a serum substitute for 2D static and 3D perfusion culture of stromal vascular fraction cells from human adipose tissue. Tissue Eng Part A. 15, 869-875 (2009).
- Anitua, E., Sanchez, M., Orive, G., Andia, I. The potential impact of the preparation rich in growth factors (PRGF) in different medical fields. Biomaterials. 28, 4551-4560 (2007).
- Anitua, E. New insights into and novel applications for platelet-rich fibrin therapies. Trends Biotechnol. 24, 227-234 (2006).
- Martinez-Zapata, M. J. Efficacy and safety of the use of autologous plasma rich in platelets for tissue regeneration: a systematic review. Transfusion. 49, 44-56 (2009).
- Weibrich, G., Kleis, W. K., Hafner, G., Hitzler, W. E. Growth factor levels in platelet-rich plasma and correlations with donor age, sex, and platelet count. J Craniomaxillofac Surg. 30, 97-102 (2002).
- Frechette, J. P., Martineau, I. &. a. m. p. ;. a. m. p., Gagnon, G. Platelet-rich plasmas: growth factor content and roles in wound healing. J Dent Res. 84, 434-439 (2005).
- Seghatchian, J., Krailadsiri, P. The platelet storage lesion. Transfus Med Rev. 11, 130-144 (1997).
- Selvaggi, T. A., Walker, R. E., Fleisher, T. A. Development of antibodies to fetal calf serum with arthus-like reactions in human immunodeficiency virus-infected patients given syngeneic lymphocyte infusions. Blood. 89, 776-779 (1997).
- Tonti, G. A., Mannello, F. From bone marrow to therapeutic applications: different behaviour and genetic/epigenetic stability during mesenchymal stem cell expansion in autologous and foetal bovine sera. Int J Dev Biol. 52, 1023-1032 (2008).
- Bieback, K. Human Alternatives to Fetal Bovine Serum for the Expansion of Mesenchymal Stromal Cells from Bone Marrow. Stem Cells. , (2009).
- Rohde, E., Schallmoser, K., Bartmann, C., Reinisch, A., Gad, S. C. GMP-Compliant Propagation of Human Multipotent Mesenchymal Stromal Cells. Pharmaceutical Manufacturing Handbook: Regulations and Quality. , 97-115 (2008).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados