JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
동물 세럼 - 무료 인간 줄기 세포 배양을위한 효율적인 보충으로 풀링 인간 혈소판 Lysate (pHPL)의 준비
요약
인간의 혈소판 lysate 성장 요인 풍부한 소스와 세포 배양에서 강력한 보충이다. 이 프로토콜은, 혈소판 풍부 혈장부터 몇 동결 - 해동 사이클을 수행하고 혈소판 조각을 파괴하여 인간의 혈소판 lysate의 큰 수영장을 준비하는 과정을 보여줍니다.
초록
혈소판 유래 성장 요소가 효율적으로 세포 증식을 자극하는 표시되었습니다
프로토콜
1. 시작 물질
cytapheresis으로 준비하거나 버피 외투에서 유래 혈소판 풍부 혈장 (PRP) 단위로 시작합니다.
2. 불임 검사
불임에 대한 연결된 작은 가방 (박스터)에 볼륨을 전송하여 각 PRP 단위 20 ML의 샘플을 확인하십시오. 용접이 가방의 연결을 끊습니다.
3. PRP 단위 동결
즉시 준비 후 ° C 원본 저장소 가방에서 추가 조작없이 최소한 -20 PRP 단위를 동결.
4. HPL 단위의 해동
세균 검사 부정하는 경우, 지금 37 ° C (물 목욕) 얼음 혈전이 사라질 때까지에서 HPL 단위라는 인간의 혈소판 lysate 단위를, 해동. HPL을 따뜻하게하지 마십시오.
5. HPL 단위 풀링
표준 제품을 준비 한 혈소판 lysate 풀장에 최소한 10-15 해동 HPL 단위를 가져가라. 풀링 더블 가방 (MacoPharma)에 연속적으로 HPL 가방을 연결하고이 두 가방에 HPL을 전송하기만하면됩니다. 용접 빈 HPL 가방 연결을 끊습니다. 두 가방의 내용을 혼합하여 풀링 인간의 혈소판 lysate (pHPL)의 3-4 패의 최종 볼륨을하십시오. 작은 가방 (박스터)를 연결하고 풀링 제품의 불임 검사 20 ML의 pHPL의 샘플을 채취할. 용접이 가방의 연결을 끊습니다.
6. pHPL의 Portioning
자세한 처리에 적합한 aliquots을하는 부분 pHPL. 풀링 더블 가방 (Macopharma)에 작은 가방 (박스터)를 연결하고 작은 스토리지 봉지 (박스터) 250 ML 최대 볼륨을 전송할 수 있습니다. 용접으로 가득한 가방을 분리합니다.
7. pHPL의 aliquots의 다시 동결
혈소판 조각의 속도와 더 동결 / 해동 단계 발표 성장 요인의 양을 늘립니다. 다시 portioned pHPL의 작은 가방을 고정 적어도 -20 ° C.
8. 다시 해동하고 pHPL의 aliquots의 portioning
37 pHPL 가방 해동 ° C (물 목욕). 멸균 가위를 사용하여 가방의 튜브를 절단하고 유리병에 pHPL를 따르고 50 ML의 튜브 (팔콘스 BD)로 콘텐츠를 전송합니다. 박테리아 또는 곰팡이 오염을 방지하기 위해 층류 벤치에서이 단계를 수행합니다.
9. 혈소판 파편의 제거
혈소판 조각이 집계하는 경향과 alloimmunization을 유발 수 있듯이, pHPL에서 그들을 제거합니다. 4천그램 (15 분, 4 ° C)에 따라서 pHPL 튜브를 원심 분리기. 층류 벤치 피펫에서 뜨는 최종 저장 유리병 (팔콘스 BD)에 플라즈마와 혈소판 알약을 폐기는 세포 배양에서 조각을 피할 수 있습니다.
10. pHPL의 스토리지
다시 50 ML pHPL의 튜브의 aliquots 고정 최소 20 ° C와 실험적인 사용을 위해 그들을 저장할 수 있습니다.
11. 세포 배양에 pHPL 사용
처음 겔 형성을 피하기 위해 매체 방부제없는 헤파린을 추가합니다. 37 ° C에서 pHPL 나누어지는를 해동하고 8 이외의 문화 매체 보완 - 10 %.
매체
MSC - 중간 :
A - 멤 500 ML을 사용하여 해동 pHPL 56 ML (또한 자세한 내용은 1 참조 참조) 2 IU / ML (재고 솔루션의 μl = 224) 방부제없는 헤파린의을 (의 clumping을 통해 매체의 응고를 방지 추가 플라즈마에있는 섬유소)는 10 % pHPL의 최종 농도에 도달합니다. 또한 페니실린 (100U/mL) / 스트렙토 마이신 (100μg/mL) 솔루션과 L - Glutamin의 2mM을 (시그마 모두) 추가합니다.
20 μm의 기공 크기 - 진공 필터 (Millipore)을 통해 매체를 필터링합니다. (내용, 날짜) 적절하게 병을 라벨.
ECFC - 중간 :
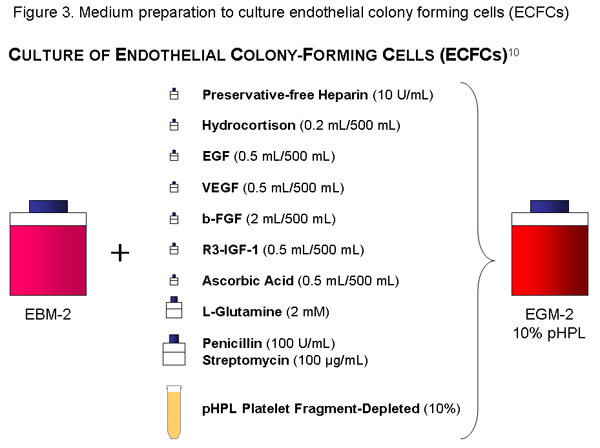
시토킨 - aliquots, 방부제없는 헤파린의 pHPL, 10 IU / ML (재고 솔루션 = 1120μl) 56 ML 페니실린 (100U/mL) / 스트렙토 마이신 (100 추가 EBM 한 병 (500 ML)를 사용하여 G / ML) 솔루션과 20 μl - 기공 크기의 진공 필터 (Millipore)와 기저 매체와 필터 L - Glutamin의 2mM. (내용, 날짜) 적절하게 병을 라벨.
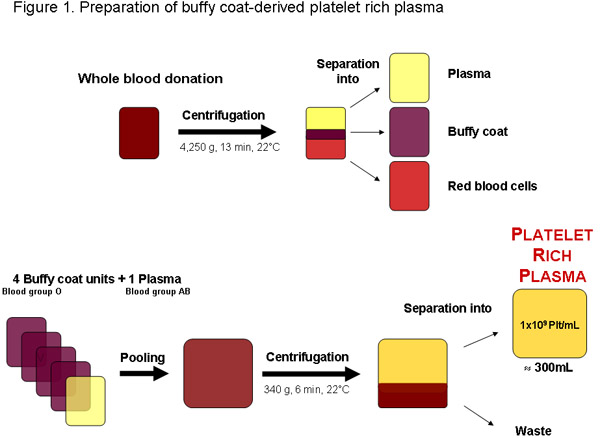
그림 1 : 지역 혈액 은행 또는 기타 승인된 공급자의 전체 혈액 기부에서 혈소판이 풍부한 혈장의 작성. 원심 분리 후 혈액 플라즈마, 버피 코트와 적혈구로 분리 수 있습니다. 원심 분리는 혈소판 풍부 혈장을 분리하기 전에 네 버피 코팅 장치, 혈액 그룹 O 한 혈액 그룹 AB 플라즈마는 풀링된 수 있습니다. 약 300mL의 정기적인 품질의 혈소판이 풍부한 혈장 단위 ML 또는 3x10 11 platele 당 1x10 9 혈소판을 포함한다TS 총.

토론
일부 지역에서는 혈소판 풍부 혈장 (PRP)는 버피 - 코팅이 달리 혈액 검사 기부 (그림 1)에서 포장 적혈구 세포 생산의 낭비되는 제품에서 구할 수 있습니다. 성장 요인의 가용성을 집중 오래된 혈소판에서와 같이 최적 PRP는 pHPL의 더 준비를 위해 즉시 사용되는 혈소판 저장 병변 및 저하 20 인해 줄어들 수 있습니다. 그것은 더 ABH 항원과 isoagglutinins 가능한 영향을 피하기 위해 혈액 AB 그룹의 ...
감사의 말
이 작품은 오스트리아 연구 재단 (FWF, DS 부여 N211 - 할머니)과 오스트리아 연구 진흥 공사 (FFG, DS 부여 N200)에 의해 지원되었습니다. 저자는 언어 편집을위한 우수한 기술 지원과 모니카 패럴에 대한 클로디아 URL을 주셔서 감사합니다.
자료
| Name | Company | Catalog Number | Comments |
| Double bag (2 x 3.5L) | MacoPharma | VDL 8000XQ | originally for ascites puncture |
| 50 mL Falcon tube | Falcon BD | 2098 | |
| 50 mL Stripettes | Costar | 4501 | |
| Plasma bags (600mL) | Baxter Internationl Inc. | R4R2021 | |
| Sterile tubing welder | Terumo Medical Corp. | TSCD-II | |
| Welding equipment | Fresenius Kabi | Compo Seal | |
| Water bath | |||
| Sterile scissors | |||
| Clamps | |||
| Centrifuge |
참고문헌
- Nurden, A. T., Nurden, P., Sanchez, M., Andia, I., Anitua, E. Platelets and wound healing. Front Biosci. 13, 3532-3548 (2008).
- Barrientos, S., Stojadinovic, O., Golinko, M. S., Brem, H., Tomic-Canic, M. Growth factors and cytokines in wound healing. Wound Repair Regen. 16, 585-601 (2008).
- Giacco, F. Thrombin-activated platelets induce proliferation of human skin fibroblasts by stimulating autocrine production of insulin-like growth factor-1. FASEB J. 20, 2402-2404 (2006).
- Kocaoemer, A., Kern, S., Kluter, H., Bieback, K. Human AB serum and thrombin-activated platelet-rich plasma are suitable alternatives to fetal calf serum for the expansion of mesenchymal stem cells from adipose tissue. Stem Cells. 25, 1270-1278 (2007).
- Kakudo, N. Proliferation-promoting effect of platelet-rich plasma on human adipose-derived stem cells and human dermal fibroblasts. Plast Reconstr Surg. 122, 1352-1360 (2008).
- Doucet, C. Platelet lysates promote mesenchymal stem cell expansion: A safety substitute for animal serum in cell-based therapy applications. J Cell Physiol. 205, 228-236 (2005).
- Schallmoser, K. Human platelet lysate can replace fetal bovine serum for clinical-scale expansion of functional mesenchymal stromal cells. Transfusion. 47, 1436-1446 (2007).
- Reinisch, A. Humanized system to propagate cord blood-derived multipotent mesenchymal stromal cells for clinical application. Regen Med. 2, 371-382 (2007).
- Schallmoser, K. Rapid large-scale expansion of functional mesenchymal stem cells from unmanipulated bone marrow without animal serum Tissue Eng Part. C Methods. 14, 185-196 (2008).
- Lange, C. Accelerated and safe expansion of human mesenchymal stromal cells in animal serum-free medium for transplantation and regenerative medicine. J Cell Physiol. 213, 18-26 (2007).
- Reinisch, A. Humanized large-scale expanded endothelial colony-forming cells function in vitro and in vivo. Blood. 113, 6716-6725 (2009).
- Bernardo, M. E. Optimization of in vitro expansion of human multipotent mesenchymal stromal cells for cell-therapy approaches: further insights in the search for a fetal calf serum substitute. J Cell Physiol. 211, 121-130 (2007).
- Carrancio, S. Optimization of mesenchymal stem cell expansion procedures by cell separation and culture conditions modification. Exp Hematol. 36, 1014-1021 (2008).
- Muller, A. M. Platelet lysate as a serum substitute for 2D static and 3D perfusion culture of stromal vascular fraction cells from human adipose tissue. Tissue Eng Part A. 15, 869-875 (2009).
- Anitua, E., Sanchez, M., Orive, G., Andia, I. The potential impact of the preparation rich in growth factors (PRGF) in different medical fields. Biomaterials. 28, 4551-4560 (2007).
- Anitua, E. New insights into and novel applications for platelet-rich fibrin therapies. Trends Biotechnol. 24, 227-234 (2006).
- Martinez-Zapata, M. J. Efficacy and safety of the use of autologous plasma rich in platelets for tissue regeneration: a systematic review. Transfusion. 49, 44-56 (2009).
- Weibrich, G., Kleis, W. K., Hafner, G., Hitzler, W. E. Growth factor levels in platelet-rich plasma and correlations with donor age, sex, and platelet count. J Craniomaxillofac Surg. 30, 97-102 (2002).
- Frechette, J. P., Martineau, I. &. a. m. p. ;. a. m. p., Gagnon, G. Platelet-rich plasmas: growth factor content and roles in wound healing. J Dent Res. 84, 434-439 (2005).
- Seghatchian, J., Krailadsiri, P. The platelet storage lesion. Transfus Med Rev. 11, 130-144 (1997).
- Selvaggi, T. A., Walker, R. E., Fleisher, T. A. Development of antibodies to fetal calf serum with arthus-like reactions in human immunodeficiency virus-infected patients given syngeneic lymphocyte infusions. Blood. 89, 776-779 (1997).
- Tonti, G. A., Mannello, F. From bone marrow to therapeutic applications: different behaviour and genetic/epigenetic stability during mesenchymal stem cell expansion in autologous and foetal bovine sera. Int J Dev Biol. 52, 1023-1032 (2008).
- Bieback, K. Human Alternatives to Fetal Bovine Serum for the Expansion of Mesenchymal Stromal Cells from Bone Marrow. Stem Cells. , (2009).
- Rohde, E., Schallmoser, K., Bartmann, C., Reinisch, A., Gad, S. C. GMP-Compliant Propagation of Human Multipotent Mesenchymal Stromal Cells. Pharmaceutical Manufacturing Handbook: Regulations and Quality. , 97-115 (2008).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유