Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Preparación de combinados lisado plaquetario humano (pHPL) como un suplemento eficaz de los animales libres de suero humano culturas de células madre
En este artículo
Resumen
Lisado de plaquetas humanas es una rica fuente de factores de crecimiento y un suplemento potente en cultivo celular. Este protocolo se presenta el proceso de preparación de una gran cantidad de lisado de plaquetas humanas, partiendo de plasma rico en plaquetas, la realización de varios ciclos de congelación-descongelación y el agotamiento de los fragmentos de plaquetas.
Resumen
Factores de crecimiento derivados de plaquetas se ha demostrado que estimulan la proliferación celular de manera eficiente
Protocolo
1. Material de partida
Comience con plasma rico en plaquetas (PRP) unidades preparadas por citaféresis o derivados de buffy abrigos.
2. Comprobar la esterilidad
Para comprobar la esterilidad tomar una muestra de 20 ml de cada unidad de PRP mediante la transferencia del volumen de una bolsa conectada pequeños (Baxter). Desconecte esta bolsa por soldadura.
3. La congelación de las unidades de PRP
Inmediatamente después de la preparación, congelación de las unidades de PRP hasta al menos -20 ° C en la bolsa de almacenamiento original, sin manipulación.
4. Descongelación de las unidades de HPL
Cuando los ensayos con bacterias son negativos, descongelar humanos unidades lisado de plaquetas, que ahora se llama unidades de HPL a 37 ° C (baño de agua) hasta que la formación de coágulos de hielo desaparecen. No caliente el HPL.
5. Puesta en común de las unidades de HPL
Tomar por lo menos diez a quince unidades descongelado HPL para una piscina lisado de plaquetas para preparar un producto estandarizado. Conecte las bolsas de HPL consecutiva a la bolsa de la puesta en común de matrimonio (MacoPharma) y la transferencia de la HPL en estas dos bolsas. Desconecte las bolsas vacías HPL por soldadura. Obtener un volumen final de 3 a 4 litros de combinado lisado de plaquetas humanas (pHPL) al mezclar el contenido de las dos bolsas. Conecte una bolsa pequeña (Baxter) y tomar una muestra de 20 ml pHPL para comprobar la esterilidad del producto combinado. Desconecte esta bolsa por soldadura.
6. Porcionado de la pHPL
Parte de la pHPL para obtener alícuotas adecuadas para su posterior procesamiento. Conectar pequeñas bolsas (Baxter) a la bolsa de la puesta en común de matrimonio (MacoPharma) y la transferencia de volúmenes de hasta 250 ml a las bolsas de almacenamiento de pequeño (Baxter). Desconecte las bolsas llenas de soldadura.
7. Volver a la congelación de las alícuotas pHPL
Aumentar la tasa de fragmentación de las plaquetas y la cantidad de factores de crecimiento liberados por otros de congelación / descongelación paso. Congelar las pequeñas bolsas de pHPL porciones de nuevo por lo menos a -20 ° C.
8. Re-descongelación y dosificación de las alícuotas pHPL
Descongele las bolsas pHPL a 37 ° C (baño de agua). Transferir el contenido en viales de 50 ml (Falcon BD) por cortar el tubo de la bolsa con unas tijeras estériles y verter el pHPL en los viales. Realice este paso en un banco de flujo laminar para evitar la contaminación bacteriana o micótica.
9. Extirpación de los fragmentos de plaquetas
Como fragmentos de plaquetas tienden a agruparse y puede inducir a aloinmunización, sacarlos de la pHPL. Centrifugue los viales pHPL por lo tanto, a 4.000 g (15 minutos, 4 ° C). En una pipeta banco de flujo laminar el plasma sobrenadante en los viales de almacenamiento final (Falcons BD) y desechar los gránulos de las plaquetas a evitar los fragmentos en cultivos celulares.
10. Almacenamiento de pHPL
Congelar las alícuotas de 50 ml viales pHPL de nuevo en menos de 20 ° C y almacenarlos para su uso experimental.
11. El uso de pHPL en cultivo celular
Inicialmente añadir heparina sin conservantes para el medio para evitar la formación de gel. Descongelar una alícuota de pHPL a 37 ° C y complementar el medio de cultivo mediante la adición de 8 a 10%.
Medios
MSC-Media:
Utilizar 500 ml de una MEM, añadir 56 ml de descongelado pHPL (véase también la referencia 1 para más detalles) e IU 2 / ml (= l de solución madre 224) de la heparina sin conservantes (evita la coagulación del medio a través de la formación de grumos el fibrinógeno en el plasma) para alcanzar una concentración final del 10% pHPL. Además añade la penicilina (100U/mL) / estreptomicina (100μg/mL) y la solución 2 mM de L-glutamina (Sigma ambos).
Filtrar el medio a través de 20 micras de poro del filtro de vacío de tamaño (Millipore). Etiqueta de la botella adecuadamente (contenido, la fecha).
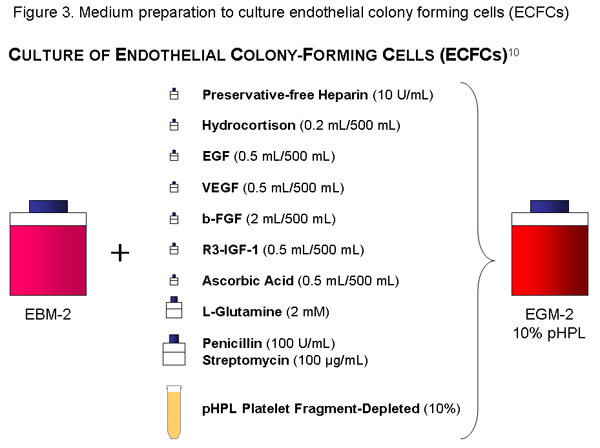
ECFC-Media:
Utilice una botella (500 ml) de la MBE, añadir las alícuotas de citoquinas, 56 ml de pHPL, 10 UI / ml (= 1120μl de la solución madre) sin conservantes heparina, penicilina (100U/mL) / estreptomicina (100 g / ml) y 2 mM de L-glutamina en el medio basal y el filtro con 20 l-de tamaño de poro del filtro de vacío (Millipore). Etiqueta de la botella adecuadamente (contenido, la fecha).
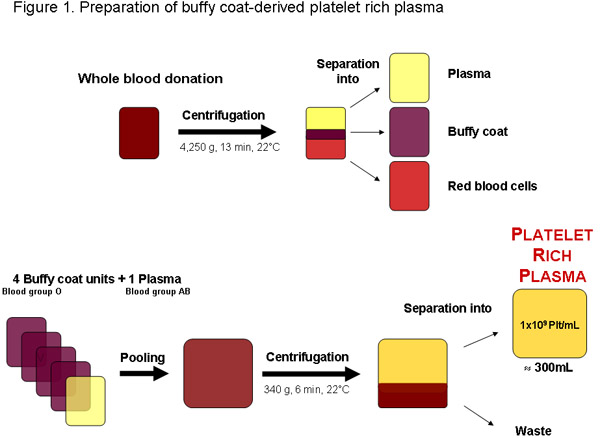
Figura 1: Preparación de plasma rico en plaquetas a partir de una donación de sangre total de un banco de sangre local o cualquier otro proveedor autorizado. Después de la centrifugación de la sangre puede ser separada en plasma, la capa leucocitaria y los glóbulos rojos. Cuatro unidades de la capa leucocitaria, grupo sanguíneo O y un grupo sanguíneo AB plasma pueden agruparse antes de la centrifugación para separar el plasma rico en plaquetas. Una calidad regular rico en plaquetas unidad de plasma de aproximadamente 300 ml debe contener 1x10 9 plaquetas por ml o 3x10 platele 11ts total.

Discusión
En algunas regiones de plaquetas en plasma rico (PRP) se puede obtener a partir de buffy-coats de lo contrario ser un producto de desecho de concentrados de la producción de glóbulos rojos a partir de donaciones de sangre analizadas (Figura 1). En condiciones óptimas, PRP se utiliza inmediatamente para su posterior elaboración de pHPL, como en las plaquetas obsoletas se concentra la disponibilidad de factores de crecimiento puede ser reducida debido a las lesiones de almacenamiento de plaquetas y la degradación
Agradecimientos
Este trabajo ha sido financiado por el Austrian Research Foundation (FMF, la concesión N211-NAN para DS) y la Agencia de Promoción de la Investigación de Austria (FFG, otorgar N200 para DS). Los autores agradecen Url Claudia por su excelente asistencia técnica y Mónica Farrell para la edición lingüística.
Materiales
| Name | Company | Catalog Number | Comments |
| Double bag (2 x 3.5L) | MacoPharma | VDL 8000XQ | originally for ascites puncture |
| 50 mL Falcon tube | Falcon BD | 2098 | |
| 50 mL Stripettes | Costar | 4501 | |
| Plasma bags (600mL) | Baxter Internationl Inc. | R4R2021 | |
| Sterile tubing welder | Terumo Medical Corp. | TSCD-II | |
| Welding equipment | Fresenius Kabi | Compo Seal | |
| Water bath | |||
| Sterile scissors | |||
| Clamps | |||
| Centrifuge |
Referencias
- Nurden, A. T., Nurden, P., Sanchez, M., Andia, I., Anitua, E. Platelets and wound healing. Front Biosci. 13, 3532-3548 (2008).
- Barrientos, S., Stojadinovic, O., Golinko, M. S., Brem, H., Tomic-Canic, M. Growth factors and cytokines in wound healing. Wound Repair Regen. 16, 585-601 (2008).
- Giacco, F. Thrombin-activated platelets induce proliferation of human skin fibroblasts by stimulating autocrine production of insulin-like growth factor-1. FASEB J. 20, 2402-2404 (2006).
- Kocaoemer, A., Kern, S., Kluter, H., Bieback, K. Human AB serum and thrombin-activated platelet-rich plasma are suitable alternatives to fetal calf serum for the expansion of mesenchymal stem cells from adipose tissue. Stem Cells. 25, 1270-1278 (2007).
- Kakudo, N. Proliferation-promoting effect of platelet-rich plasma on human adipose-derived stem cells and human dermal fibroblasts. Plast Reconstr Surg. 122, 1352-1360 (2008).
- Doucet, C. Platelet lysates promote mesenchymal stem cell expansion: A safety substitute for animal serum in cell-based therapy applications. J Cell Physiol. 205, 228-236 (2005).
- Schallmoser, K. Human platelet lysate can replace fetal bovine serum for clinical-scale expansion of functional mesenchymal stromal cells. Transfusion. 47, 1436-1446 (2007).
- Reinisch, A. Humanized system to propagate cord blood-derived multipotent mesenchymal stromal cells for clinical application. Regen Med. 2, 371-382 (2007).
- Schallmoser, K. Rapid large-scale expansion of functional mesenchymal stem cells from unmanipulated bone marrow without animal serum Tissue Eng Part. C Methods. 14, 185-196 (2008).
- Lange, C. Accelerated and safe expansion of human mesenchymal stromal cells in animal serum-free medium for transplantation and regenerative medicine. J Cell Physiol. 213, 18-26 (2007).
- Reinisch, A. Humanized large-scale expanded endothelial colony-forming cells function in vitro and in vivo. Blood. 113, 6716-6725 (2009).
- Bernardo, M. E. Optimization of in vitro expansion of human multipotent mesenchymal stromal cells for cell-therapy approaches: further insights in the search for a fetal calf serum substitute. J Cell Physiol. 211, 121-130 (2007).
- Carrancio, S. Optimization of mesenchymal stem cell expansion procedures by cell separation and culture conditions modification. Exp Hematol. 36, 1014-1021 (2008).
- Muller, A. M. Platelet lysate as a serum substitute for 2D static and 3D perfusion culture of stromal vascular fraction cells from human adipose tissue. Tissue Eng Part A. 15, 869-875 (2009).
- Anitua, E., Sanchez, M., Orive, G., Andia, I. The potential impact of the preparation rich in growth factors (PRGF) in different medical fields. Biomaterials. 28, 4551-4560 (2007).
- Anitua, E. New insights into and novel applications for platelet-rich fibrin therapies. Trends Biotechnol. 24, 227-234 (2006).
- Martinez-Zapata, M. J. Efficacy and safety of the use of autologous plasma rich in platelets for tissue regeneration: a systematic review. Transfusion. 49, 44-56 (2009).
- Weibrich, G., Kleis, W. K., Hafner, G., Hitzler, W. E. Growth factor levels in platelet-rich plasma and correlations with donor age, sex, and platelet count. J Craniomaxillofac Surg. 30, 97-102 (2002).
- Frechette, J. P., Martineau, I. &. a. m. p. ;. a. m. p., Gagnon, G. Platelet-rich plasmas: growth factor content and roles in wound healing. J Dent Res. 84, 434-439 (2005).
- Seghatchian, J., Krailadsiri, P. The platelet storage lesion. Transfus Med Rev. 11, 130-144 (1997).
- Selvaggi, T. A., Walker, R. E., Fleisher, T. A. Development of antibodies to fetal calf serum with arthus-like reactions in human immunodeficiency virus-infected patients given syngeneic lymphocyte infusions. Blood. 89, 776-779 (1997).
- Tonti, G. A., Mannello, F. From bone marrow to therapeutic applications: different behaviour and genetic/epigenetic stability during mesenchymal stem cell expansion in autologous and foetal bovine sera. Int J Dev Biol. 52, 1023-1032 (2008).
- Bieback, K. Human Alternatives to Fetal Bovine Serum for the Expansion of Mesenchymal Stromal Cells from Bone Marrow. Stem Cells. , (2009).
- Rohde, E., Schallmoser, K., Bartmann, C., Reinisch, A., Gad, S. C. GMP-Compliant Propagation of Human Multipotent Mesenchymal Stromal Cells. Pharmaceutical Manufacturing Handbook: Regulations and Quality. , 97-115 (2008).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados