需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
评估外胚层上皮细胞在颅面发育的信号属性
摘要
本文介绍了组织移植技术的目的是测试头的表面外胚层在颅面部发育中的信令和图案属性。
摘要
实验胚胎学家了解细胞的命运,在发展和组织的相互作用,调节脊椎动物的图案和形态发生( 例如,1,2,3,4)作用,帮助禽流胚胎无障碍。在这里,我们说明了一种方法,利用此辅助测试期间面部发展的信令和外胚层组织的图案属性。在这些实验中,我们创建了鹌鹑鸡5或鼠标小鸡6嵌合体移植头的表面外胚层,涉及到同一地区或鸡胚异位地区从鹌鹑或鼠标的上颚。作为供体组织移植到雏鸡的鹌鹑是一个目前在鹌鹑,但不是小鸡细胞的核仁标记的优势,从而使调查来区分主机和捐助组织7。同样,一个重复的元素是在小鼠基因组中是无所不在表示,这使我们能够区分主机和捐助组织在鼠标小鸡嵌合体8。使用鼠标作为供体组织的外胚层,将大大扩展我们对这些组织间的相互作用的理解,因为这将使我们能够测试外胚层的信号来自各种突变胚胎的属性。
研究方案
1。准备供体组织
- 准备文化传媒,增强玻璃引脚,增强钨针。
- 从壳收集胚胎,在冰冷的PBS洗。
- 使用一个10毫升的注射器和18号针头从蛋壳指出删除1.0毫升的白蛋白。
- 制作的外壳用剪刀点上方的一个小孔,然后切一个圆形开口揭露胚胎
- 删除头和地点到DMEM培养液(无血清,室温)
- 额鼻过程剖析从胚胎(或其他捐助者的网站,如上颌或下颌过程)
- 2.4U /毫升的PBS dispase精华为20分钟冰
- 1%BSA停止消化封面用DMEM组织
- 削尖的钨针,使用单独的外胚层,间质细胞和神经外胚层
- 移植组织的DMEM 1%BSA的冰商店,直到主机是准备用于移植
2。准备主机
- 揭露胚胎
- 使用一个10毫升的注射器和18号针头从蛋壳指出删除1.0毫升的白蛋白。
- 制作的外壳用剪刀点上方的小孔。放置一块孔的磁带,然后切一个圆形开口揭露胚胎。
- 使用2双钳,把握羊膜,轻轻地撕了一个洞。
- 转动头部,右眼上放置一对镊子和施加压力。按住头部稳定,使用钨针取出主机外胚层容纳嫁接。
- 将移植到主机使用的玻璃吸管。
- 嫁接,以取代删除外胚层的位置。玻璃针插入针嫁接嫁接组织的每个角落。为了使玻璃引脚,拉microcapillary管到细点超过酒精火焰。
- 在孔放置磁带紧密,并返回适当的长度进行分析的时间,胚胎的孵化器。
- 另见:9
3。代表性的成果:
为了评估嵌合体胚胎应当收集和处理主机和捐助组织的分布进行分析。鹌鹑细胞,使用QcPN抗体免疫组织化学检测(中描述:3)就业,石蜡切片原位杂交检测小鼠细胞,用于6。应只限于供体细胞的上皮细胞,和捐助方的间叶组织不应该有证据(图1)。孤立的供体细胞在间质的存在表明污染的神经嵴细胞的存在,这将混淆的任何形态的解释,由于面部发展的许多方面(如10),这些细胞的影响。一旦确信污染的间质细胞移植技术是免费的,可用于进一步的形态学或分子的结果措施评估嵌合体。对于我们而言,我们发现对应的上颚被移植的组织(图2),并在嫁接外胚层间叶组织中的分子变化引起的(图3)重复异位软骨和骨骼的存在5,6。

图1。嵌合体的评估(一)反QcPN染色是用来检测鹌鹑鹌鹑,鸡嵌合体细胞。有没有证据证明在间质细胞染色。 (二) 在原位杂交技术用来检测鼠标小鸡嵌合体表达正弦B2成绩单。表达仅限于外胚层组成的嫁接。
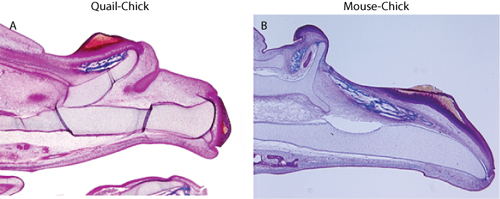
图2:三色染色显示上颚骨骼(一)鹌鹑鸡嵌合体的重复,和(B)鼠标小鸡嵌合体。

图3。外胚层regultes间质细胞的基因表达。 (a)正常BMP7的表达在小鸡胚胎的间质( 放射性原位杂交积极的信号,在Adobe Photoshop中的伪彩色红色)。 (二)BMP7的表达,是诱发相邻的间质细胞在嵌合胚胎移植(箭头)。
讨论
使用这种移植方法,使我们能够确定外胚层包含信令信息,调节背腹极性和proximodistal扩展上颌。鹌鹑或鼠标外胚层,并在这在许多物种6,11组织中的分子信号的保护成果时使用的相似性,表明这是一个高度保守的信号脊椎动物之间的中心。此外,其他研究者使用了类似的技术来测试头外胚层表面的不同区域的信号特性,并发现存在多种信号, 有助于面对12的形态发生在外胚层中心?...
披露声明
致谢
这项工作是由R01 - DE018234和R01 - DE019638。
材料
| Name | Company | Catalog Number | Comments |
| 1x PBS | Tektronix, Inc. | TEKZR114 | |
| DMEM | University of California - San Francisco | CCFDA003 | |
| BSA | Sigma-Aldrich | A7906 | |
| Dispase | GIBCO, by Life Technologies | 17105-041 | |
| 35x10 mm Petri dish | Falcon BD | 1008 | |
| No. 5 Dumont forceps | Fine Science Tools | 11252-20 | |
| Scissors | Fine Science Tools | 14058-11 | |
| Spring Scissors | Fine Science Tools | 15010-11 | |
| Needle holder | Fine Science Tools | 26016-12 | |
| Tungsten Needle | Fine Science Tools | 26000 | |
| Microcapillary tube | Drummond Scientific | 3-000-225-G | |
| Pasteur Pipets | Fisher Scientific | 13-678-6B | |
| Spring scissors | Fine Science Tools | 15010-11 | |
| Blade holder | Fine Science Tools | 10052-11 | |
| Razor blade | Fine Science Tools | 10050-00 |
参考文献
- Noden, D. M. The Role of the Neural Crest in Patterning of Avian Cranial Skeletal, Connective, and Muscle Tissues. Developmental Biology. 96, 144-144 (1983).
- Bronner-Fraser, M., Stern, C. Effects of Mesodermal Tissues on Avian Neural Crest Cell Migration. Developmental Biology. 143, 213-213 (1991).
- Schneider, R. A. Neural crest can form cartilages normally derived from mesoderm during development of the avian head skeleton. Developmental Biology. 208, 441-441 (1999).
- Couly, G. Interactions between Hox-negative cephalic neural crest cells and the foregut endoderm in patterning the facial skeleton in the vertebrate head. Development. 129, 1061-1061 (2002).
- Evans, D. J., Noden, D. M. Spatial relations between avian craniofacial neural crest and paraxial mesoderm cells. Dev Dyn. , (2006).
- Hu, D., Marcucio, R., Helms, J. A. A zone of frontonasal ectoderm regulates patterning and growth in the face. Development. 130, 1749-1749 (2003).
- Hu, D., Marcucio, R. S. Unique organization of the frontonasal ectodermal zone in birds and mammals. Dev Biol. 325, 200-200 (2009).
- Le Lièvre, C. S., Le Douarin, N. M. Mesenchymal derivatives of the neural crest: analysis of chimaeric quail and chick embryos. Journal of Embryology and Experimental Morphology. 34, 125-125 (1975).
- Bollag, R. J. Use of a repetitive mouse B2 element to identify transplanted mouse cells in mouse-chick chimeras. Exp Cell Res. 248, 75-75 (1999).
- Korn, M. J., Cramer, K. S. Windowing chicken eggs for developmental studies. J Vis Exp. , (2007).
- Eames, B. F., Schneider, R. A. Quail-duck chimeras reveal spatiotemporal plasticity in molecular and histogenic programs of cranial feather development. Development. 132, 1499-1499 (2005).
- Odent, S. Expression of the Sonic hedgehog (SHH ) gene during early human development and phenotypic expression of new mutations causing holoprosencephaly. Hum Mol Genet. 8, 1683-1683 (1999).
- Szabo-Rogers, H. L. Novel skeletogenic patterning roles for the olfactory pit. Development. 136, 219-219 (2009).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。