Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Die Beurteilung Signaling Eigenschaften von ektodermale Epithel Während Craniofacial Entwicklung
In diesem Artikel
Zusammenfassung
Dieser Artikel beschreibt ein Gewebetransplantation Technik, die entwickelt, um die Signal-und Strukturierungs-Eigenschaften der Oberfläche cephalica Ektoderm während kraniofazialen Entwicklung Test war.
Zusammenfassung
Die Zugänglichkeit der Vogelembryonen hat dazu beigetragen, experimentelle Embryologie verstehen das Schicksal der Zellen während der Entwicklung und der Rolle der Gewebe-Wechselwirkungen, die Strukturierung und Morphogenese von Wirbeltieren (z. B. 1, 2, 3, 4) zu regulieren. Hier zeigen wir eine Methode, die diese Zugänglichkeit nutzt die Signalisierungs-und Strukturierungs-Eigenschaften der ektodermalen Gewebe während Gesichts-Entwicklung zu testen. In diesen Experimenten, schaffen wir Wachtel-Küken 5 oder Maus-chick 6 Chimären durch Transplantation der Oberfläche cephalica Ektoderm, dass der Oberkiefer von Wachteln oder Maus deckt entweder auf der gleichen Region oder einer ektopischen Region Hühnerembryonen. Die Verwendung von Wachteln als Spendergewebe zur Transplantation in chicks wurde entwickelt, um die Vorteile eines nucleolar Marker in Wachteln, aber nicht chick Zellen tragen, sodass Ermittler zu hosten und zu Spendergewebe 7 unterscheiden. Ebenso ist eine sich wiederholende Element in der Maus-Genom und ist ubiquitär exprimiert, das uns erlaubt, Host-und Spendergewebe in Maus-chick Chimären 8 unterscheiden. Die Verwendung von Maus Ektoderm als Spendergewebe wird erheblich erweitern unser Verständnis dieser Gewebe-Wechselwirkungen, denn dies wird es uns ermöglichen, die Signalisierung Eigenschaften des Ektoderms aus verschiedenen mutierten Embryonen zu testen.
Protokoll
1. Vorbereiten des Spendergewebe
- Bereiten Kulturmedien, schärfen Glas Stifte, schärfen Wolfram Nadeln.
- Sammeln Embryo aus der Schale, in eiskaltem PBS waschen.
- Mit einer 10 ml-Spritze und eine 18-Gauge-Nadel entfernen 1,0 ml Albumin aus dem spitzen Ende der Eierschale.
- Machen Sie ein kleines Loch an der Oberseite des Gehäuses mit dem Punkt der Schere, und schneiden Sie dann eine kreisrunde Öffnung, um den Embryo aussetzen
- Entfernen Sie den Kopf und Ort in DMEM (serumfreien, Raumtemperatur)
- Dissect frontonasale Prozess aus dem Embryo (oder anderer Geber vor Ort wie Ober-oder Unterkiefer-Prozess)
- Digest in 2.4U / mL Dispase in PBS auf Eis 20 Minuten
- Abdeckung Gewebe mit DMEM mit 1% BSA, um die Verdauung zu stoppen
- Verwenden geschärft Wolframnadel zu trennen Ektoderm, Mesenchym und Neuroektoderms
- Shop Transplantatgewebes in DMEM 1% BSA auf Eis, bis Gastgeber ist bereit für die Transplantation
2. Vorbereiten des Host-
- Expose des Embryos
- Mit einer 10 ml-Spritze und eine 18-Gauge-Nadel entfernen 1,0 ml Albumin aus dem spitzen Ende der Eierschale.
- Machen Sie ein kleines Loch an der Oberseite des Gehäuses mit der Spitze einer Schere. Legen Sie ein Stück Klebeband über das Loch, und schneiden Sie dann eine kreisrunde Öffnung, um den Embryo aussetzen.
- Mit 2 Paar Zangen, fassen Sie das Amnion und sanft reißen ein Loch zu machen.
- Drehen Sie den Kopf, indem sie einer Pinzette auf das rechte Auge und Druck. Halten Sie den Kopf ruhig, verwenden Sie eine Wolfram-Nadel an den Host-Ektoderm zu entfernen, um das Transplantat aufnehmen.
- Übertragung des Transplantats an den Host mit einer Glaspipette.
- Position des Transplantats, die entfernt Ektoderm zu ersetzen. Legen Sie ein Glas pin in jeder Ecke des transplantierten Gewebes, um das Transplantat an Stelle pin. Um Glas Stifte, ziehen eine Mikrokapillare Rohr zu einer feinen Spitze über ein Alkohol Flamme.
- Legen Band dicht über dem Loch und zurück Embryo in den Inkubator für angemessene Zeit für die Analyse.
- siehe auch: 9
3. Repräsentative Ergebnisse:
Um zu beurteilen, Chimären, sollte Embryonen erhoben und verarbeitet werden für die Analyse der Verteilung der Gastgeber und Spender Gewebe. Für den Nachweis von Wachtel-Zellen, Immunhistochemie mit dem QcPN Antikörper (beschrieben in: 3) eingesetzt wird, und für die Erkennung von Maus-Zellen, in situ Hybridisierung auf Paraffinschnitten ist 6 verwendet. Spenderzellen sollte das Epithel beschränkt werden, und es sollte keine Beweise für Spender mesenchymalen Gewebe (Abbildung 1). Die Anwesenheit von isolierten Spenderzellen in das Mesenchym zeigt die Anwesenheit von Kontaminationen Neuralleistenzellen die jede morphologische Interpretation durch den Einfluss dieser Zellen auf viele Aspekte der Entwicklung des Gesichtes (z. B. 10) zu verwechseln ist. Einmal überzeugt, dass die Graft-Technik frei von kontaminierenden Mesenchym ist, können weitere morphologischen und molekularen Ergebnissen Maßnahmen verwendet werden, um die Chimären zu beurteilen. Für unsere Zwecke, entdeckten wir das Vorhandensein von ektopen Knorpel und Knochen, die zu Vervielfältigungen im Oberkiefer, die durch die transplantierten Gewebe (Abbildung 2), und molekularen Veränderungen in den mesenchymalen Geweben in Reaktion auf die veredelten Ektoderm induziert wurden (Abbildung 3) entsprach 5,6.

Abbildung 1. Beurteilung des Chimärismus (A) Anti-QcPN Färbung wird verwendet, um Wachteln Zellen in Wachtel-Küken Chimären zu erkennen. Es gibt keinen Beweis der Färbung in das Mesenchym. (B) In-situ-Hybridisierung wird verwendet, um die Expression von SINE B2-Transkripte in der Maus-chick Chimären zu erkennen. Expression ist auf das Ektoderm aus dem Transplantat beschränkt.
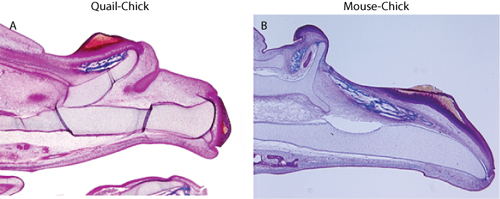
Abbildung 2. Trichromfärbung zeigt Vervielfältigung des Oberkiefers Skelett in (A) Wachtel-Küken Chimäre, und (B) Maus-chick Chimären.

Abbildung 3. Das Ektoderm regultes Genexpression im Mesenchym. (A) Normal BMP7 Ausdruck in dem Mesenchym eines Hühnerembryo (radioaktive in situ Hybridisierung mit positives Signal Pseudo-rot in Adobe Photoshop). (B) BMP7 Ausdruck ist in dem Mesenchym neben dem Transplantat (Pfeil) in chimären Embryonen induziert.
Diskussion
Mit dieser Transplantation Methode konnten wir feststellen, dass die Ektoderm Signalisierung Informationen, die dorsoventrale Polarität und proximodistalen Erweiterung des Oberkiefers regelt enthält. Die Ähnlichkeit der Ergebnisse bei der Verwendung von Wachteln oder Maus Ektoderm, und die Erhaltung der molekularen Signale in diesem Gewebe unter vielen Arten 6,11 bedeutet, dass eine hoch konservierte Signalisierung Zentrum unter den Wirbeltieren ist. Darüber hinaus haben andere Forscher ähnliche Technike...
Offenlegungen
Danksagungen
Diese Arbeit wurde von R01-R01-DE018234 und DE019638 finanziert.
Materialien
| Name | Company | Catalog Number | Comments |
| 1x PBS | Tektronix, Inc. | TEKZR114 | |
| DMEM | University of California - San Francisco | CCFDA003 | |
| BSA | Sigma-Aldrich | A7906 | |
| Dispase | GIBCO, by Life Technologies | 17105-041 | |
| 35x10 mm Petri dish | Falcon BD | 1008 | |
| No. 5 Dumont forceps | Fine Science Tools | 11252-20 | |
| Scissors | Fine Science Tools | 14058-11 | |
| Spring Scissors | Fine Science Tools | 15010-11 | |
| Needle holder | Fine Science Tools | 26016-12 | |
| Tungsten Needle | Fine Science Tools | 26000 | |
| Microcapillary tube | Drummond Scientific | 3-000-225-G | |
| Pasteur Pipets | Fisher Scientific | 13-678-6B | |
| Spring scissors | Fine Science Tools | 15010-11 | |
| Blade holder | Fine Science Tools | 10052-11 | |
| Razor blade | Fine Science Tools | 10050-00 |
Referenzen
- Noden, D. M. The Role of the Neural Crest in Patterning of Avian Cranial Skeletal, Connective, and Muscle Tissues. Developmental Biology. 96, 144-144 (1983).
- Bronner-Fraser, M., Stern, C. Effects of Mesodermal Tissues on Avian Neural Crest Cell Migration. Developmental Biology. 143, 213-213 (1991).
- Schneider, R. A. Neural crest can form cartilages normally derived from mesoderm during development of the avian head skeleton. Developmental Biology. 208, 441-441 (1999).
- Couly, G. Interactions between Hox-negative cephalic neural crest cells and the foregut endoderm in patterning the facial skeleton in the vertebrate head. Development. 129, 1061-1061 (2002).
- Evans, D. J., Noden, D. M. Spatial relations between avian craniofacial neural crest and paraxial mesoderm cells. Dev Dyn. , (2006).
- Hu, D., Marcucio, R., Helms, J. A. A zone of frontonasal ectoderm regulates patterning and growth in the face. Development. 130, 1749-1749 (2003).
- Hu, D., Marcucio, R. S. Unique organization of the frontonasal ectodermal zone in birds and mammals. Dev Biol. 325, 200-200 (2009).
- Le Lièvre, C. S., Le Douarin, N. M. Mesenchymal derivatives of the neural crest: analysis of chimaeric quail and chick embryos. Journal of Embryology and Experimental Morphology. 34, 125-125 (1975).
- Bollag, R. J. Use of a repetitive mouse B2 element to identify transplanted mouse cells in mouse-chick chimeras. Exp Cell Res. 248, 75-75 (1999).
- Korn, M. J., Cramer, K. S. Windowing chicken eggs for developmental studies. J Vis Exp. , (2007).
- Eames, B. F., Schneider, R. A. Quail-duck chimeras reveal spatiotemporal plasticity in molecular and histogenic programs of cranial feather development. Development. 132, 1499-1499 (2005).
- Odent, S. Expression of the Sonic hedgehog (SHH ) gene during early human development and phenotypic expression of new mutations causing holoprosencephaly. Hum Mol Genet. 8, 1683-1683 (1999).
- Szabo-Rogers, H. L. Novel skeletogenic patterning roles for the olfactory pit. Development. 136, 219-219 (2009).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten