È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
La valutazione delle proprietà di segnalazione di ectodermica epiteli durante lo sviluppo craniofacciale
In questo articolo
Riepilogo
Questo articolo descrive una tecnica di trapianto di tessuto che è stato progettato per verificare la segnalazione e le proprietà di patterning ectoderma cefalico superficie durante lo sviluppo cranio-facciale.
Abstract
L'accessibilità degli embrioni aviaria ha aiutato embriologi sperimentali capire il destino delle cellule durante lo sviluppo e il ruolo delle interazioni tessuti che regolano patterning e la morfogenesi dei vertebrati (ad esempio, 1, 2, 3, 4). Qui, illustrare un metodo che sfrutta questa accessibilità per testare la segnalazione e le proprietà patterning dei tessuti durante lo sviluppo ectodermica del viso. In questi esperimenti, creiamo quaglia-chick 5 o topo-chick 6 chimere trapiantando l'ectoderma cefalico superficie che copre la mascella superiore da quaglia o mouse sulla entrambi della stessa regione o di una regione ectopica di embrioni di pollo. L'uso di quaglia come tessuto del donatore per il trapianto in pulcini è stato sviluppato per trarre vantaggio da un marker nucleolare presente in quaglie, ma non le cellule pulcino, permettendo così agli investigatori di distinguere host e tessuti del donatore 7. Allo stesso modo, un elemento ripetitivo è presente nel genoma del topo ed è espressa ubiquitariamente, che ci permette di distinguere host e tessuti del donatore nel topo-chick chimere 8. L'uso di ectoderma mouse come tessuto del donatore amplieranno enormemente la nostra comprensione di queste interazioni dei tessuti, perché questo ci permetterà di testare le proprietà di segnalazione di ectoderma derivate da embrioni mutanti vari.
Protocollo
1. Preparazione del tessuto del donatore
- Preparare terreni di coltura, affinare le spine di vetro, affilare gli aghi di tungsteno.
- Raccogliere embrione dal guscio, lavare in gelide PBS.
- Usando una siringa da 10 ml e 18 gauge rimuovere 1,0 ml di albumina da l'estremità appuntita del guscio d'uovo.
- Fai un piccolo foro sulla parte superiore del guscio utilizzando il punto di forbici, e poi tagliare un'apertura circolare per esporre l'embrione
- Togliere la testa e il luogo in DMEM (siero libero, temperatura ambiente)
- Sezionare processo fronto-nasale dall'embrione (o sito altri donatori, come processo mascellare o mandibolare)
- Digest in 2.4U / mL dispasi in PBS in ghiaccio per 20 minuti
- Coprire i tessuti con DMEM con BSA 1% per fermare la digestione
- Utilizzare l'ago di tungsteno appuntito per ectoderma separati, mesenchima, e neuroectoderma
- Conservare il tessuto innesto in DMEM BSA 1% in ghiaccio fino host è pronto per i trapianti
2. Preparare l'Ostia
- Esporre l'embrione
- Usando una siringa da 10 ml e 18 gauge rimuovere 1,0 ml di albumina da l'estremità appuntita del guscio d'uovo.
- Fai un piccolo foro sulla parte superiore del guscio utilizzando il punto di forbici. Posizionare un pezzo di nastro adesivo sul foro, e poi tagliare un'apertura circolare per esporre l'embrione.
- Con 2 coppie di pinze, afferrare la amnios e delicatamente strappare a fare un buco.
- Ruotare la testa mettendo una coppia di pinze sull'occhio destro e pressione. Tenendo la testa ferma, utilizzare un ago di tungsteno per rimuovere l'ectoderma ospitare per accogliere l'innesto.
- Trasferire l'innesto per l'host utilizzando una pipetta di vetro.
- Posizionare l'innesto di sostituire l'ectoderma rimosso. Inserire un perno di vetro in ogni angolo del tessuto innestato al pin l'innesto in posizione. Per rendere pin vetro, tirare un tubo microcapillare ad un punto preciso su una fiamma alcol.
- Luogo nastro saldamente sopra il buco e tornare embrione per l'incubatore per la lunghezza di tempo adeguato per l'analisi.
- vedi anche: 9
3. Rappresentante dei risultati:
Per valutare chimere, gli embrioni devono essere raccolti ed elaborati per l'analisi della distribuzione di host e dei tessuti del donatore. Per il rilevamento di cellule quaglia, immunoistochimica con l'anticorpo QcPN (descritto in: 3) è impiegata, e per l'individuazione di cellule di topo, ibridazione in situ su sezioni di paraffina viene utilizzata 6. Cellule del donatore deve essere limitato al epitelio, e ci dovrebbe essere alcuna prova donatore di tessuti mesenchimali (Figura 1). La presenza di cellule del donatore isolate nel mesenchima indica la presenza di contaminazione da cellule della cresta neurale, che si confondono ogni interpretazione morfologica per l'influenza di queste cellule in molti aspetti dello sviluppo del viso (per esempio, 10). Una volta convinto che la tecnica dell'innesto è libero di contaminare mesenchima, misure di ulteriore esito morfologico o molecolare può essere utilizzata per valutare le chimere. Per i nostri scopi, abbiamo rilevato la presenza di cartilagini e ossa ectopica che corrispondevano a duplicazioni della mascella superiore, che sono state indotte dai tessuti trapiantati (Figura 2), e cambiamenti molecolari nei tessuti mesenchimali in risposta alla ectoderma innestati (Figura 3) 5,6.

Figura 1. Valutazione del chimerismo (A) Anti-QcPN colorazione è usato per rilevare le cellule di quaglia quaglia-chick chimere. Non ci sono prove di colorazione nel mesenchima. (B) L'ibridazione in situ è utilizzato per rilevare l'espressione di trascrizioni B2 SINE nel topo-chick chimere. Espressione è limitata alla ectoderma che comprende l'innesto.
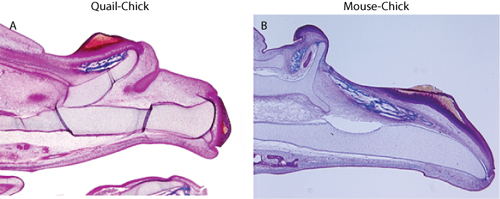
Colorazione Figura 2. Tricromica mostra duplicazione dello scheletro mascellare superiore in (A) quaglia-chick chimera, e (B) topo-chick chimere.

Figura 3. L'ectoderma regultes espressione genica nel mesenchima. (A) Normale Bmp7 espressione nel mesenchima di un embrione di pollo (radioattive ibridazione in situ con positivo segnale pseudo-colore rosso in Adobe Photoshop). (B) Bmp7 espressione è indotta nel mesenchima adiacente al trapianto (Freccia) in embrioni chimerici.
Discussione
Usando questo metodo di trapianto ha permesso di determinare che l'ectoderma contiene informazioni di segnalazione che regola la polarità dorso-ventrale e l'estensione prossimo-distale della mascella superiore. La somiglianza dei risultati quando si usa quaglia o ectoderma mouse e la conservazione dei segnali molecolari in questo tessuto tra le molte specie 6,11 indica che questo è un centro altamente conservato di segnalazione tra i vertebrati. Inoltre, altri ricercatori hanno usato tecniche simili...
Divulgazioni
Riconoscimenti
Questo lavoro è stato finanziato dalla R01-R01-DE018234 e DE019638.
Materiali
| Name | Company | Catalog Number | Comments |
| 1x PBS | Tektronix, Inc. | TEKZR114 | |
| DMEM | University of California - San Francisco | CCFDA003 | |
| BSA | Sigma-Aldrich | A7906 | |
| Dispase | GIBCO, by Life Technologies | 17105-041 | |
| 35x10 mm Petri dish | Falcon BD | 1008 | |
| No. 5 Dumont forceps | Fine Science Tools | 11252-20 | |
| Scissors | Fine Science Tools | 14058-11 | |
| Spring Scissors | Fine Science Tools | 15010-11 | |
| Needle holder | Fine Science Tools | 26016-12 | |
| Tungsten Needle | Fine Science Tools | 26000 | |
| Microcapillary tube | Drummond Scientific | 3-000-225-G | |
| Pasteur Pipets | Fisher Scientific | 13-678-6B | |
| Spring scissors | Fine Science Tools | 15010-11 | |
| Blade holder | Fine Science Tools | 10052-11 | |
| Razor blade | Fine Science Tools | 10050-00 |
Riferimenti
- Noden, D. M. The Role of the Neural Crest in Patterning of Avian Cranial Skeletal, Connective, and Muscle Tissues. Developmental Biology. 96, 144-144 (1983).
- Bronner-Fraser, M., Stern, C. Effects of Mesodermal Tissues on Avian Neural Crest Cell Migration. Developmental Biology. 143, 213-213 (1991).
- Schneider, R. A. Neural crest can form cartilages normally derived from mesoderm during development of the avian head skeleton. Developmental Biology. 208, 441-441 (1999).
- Couly, G. Interactions between Hox-negative cephalic neural crest cells and the foregut endoderm in patterning the facial skeleton in the vertebrate head. Development. 129, 1061-1061 (2002).
- Evans, D. J., Noden, D. M. Spatial relations between avian craniofacial neural crest and paraxial mesoderm cells. Dev Dyn. , (2006).
- Hu, D., Marcucio, R., Helms, J. A. A zone of frontonasal ectoderm regulates patterning and growth in the face. Development. 130, 1749-1749 (2003).
- Hu, D., Marcucio, R. S. Unique organization of the frontonasal ectodermal zone in birds and mammals. Dev Biol. 325, 200-200 (2009).
- Le Lièvre, C. S., Le Douarin, N. M. Mesenchymal derivatives of the neural crest: analysis of chimaeric quail and chick embryos. Journal of Embryology and Experimental Morphology. 34, 125-125 (1975).
- Bollag, R. J. Use of a repetitive mouse B2 element to identify transplanted mouse cells in mouse-chick chimeras. Exp Cell Res. 248, 75-75 (1999).
- Korn, M. J., Cramer, K. S. Windowing chicken eggs for developmental studies. J Vis Exp. , (2007).
- Eames, B. F., Schneider, R. A. Quail-duck chimeras reveal spatiotemporal plasticity in molecular and histogenic programs of cranial feather development. Development. 132, 1499-1499 (2005).
- Odent, S. Expression of the Sonic hedgehog (SHH ) gene during early human development and phenotypic expression of new mutations causing holoprosencephaly. Hum Mol Genet. 8, 1683-1683 (1999).
- Szabo-Rogers, H. L. Novel skeletogenic patterning roles for the olfactory pit. Development. 136, 219-219 (2009).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon