Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
La evaluación de las propiedades de señalización de ectodérmica epitelio durante el desarrollo craneofacial
En este artículo
Resumen
En este artículo se describe una técnica de trasplante de tejido que se diseñó para probar la señalización y las propiedades de los patrones de la superficie del ectodermo cefálico durante el desarrollo craneofacial.
Resumen
La accesibilidad de los embriones de aves ha ayudado a los embriólogos experimentales entender el destino de las células durante el desarrollo y el papel de las interacciones de los tejidos que regulan los patrones y la morfogénesis de los vertebrados (por ejemplo, 1, 2, 3, 4). Aquí, se expone un método que explota esta accesibilidad a la prueba de la señalización y las propiedades de los patrones de tejidos del ectodermo durante el desarrollo facial. En estos experimentos, se crea la codorniz-chick chick 5 o 6 quimeras de ratón mediante el trasplante de la superficie ectodermo cefálico que cubre la mandíbula superior de la codorniz o el ratón sobre cualquiera de la misma región o de una región ectópica de embriones de pollo. El uso de la codorniz como tejido de un donante para el trasplante en los pollos se ha desarrollado para tomar ventaja de un marcador nucleolar presente en la codorniz, pero no las células de pollo, lo que permite a los investigadores distinguir anfitrión y tejidos de donantes 7. Del mismo modo, un elemento repetitivo está presente en el genoma del ratón y se expresa doquier, lo que nos permite distinguir anfitrión y tejidos de donantes en el ratón-chick quimeras 8. El uso de ectodermo ratón como donantes de tejidos en gran medida ampliar nuestra comprensión de estas interacciones de tejidos, ya que esto nos permitirá poner a prueba las propiedades de señalización del ectodermo derivan de varios embriones mutantes.
Protocolo
1. Preparación del tejido de un donante
- Preparar medios de cultivo, afilar pernos de vidrio, afilar agujas de tungsteno.
- Recoger embrión a partir de cáscara, lavado en PBS helado.
- Con una jeringa de 10 ml y una aguja de calibre 18 extraer 1,0 ml de albúmina en la punta de la cáscara del huevo.
- Haz un pequeño agujero en la parte superior de la misma utilizando el punto de tijeras, y luego se corta una abertura circular para exponer el embrión
- Quitar la cabeza y el lugar en DMEM (libre de suero, la temperatura ambiente)
- Diseccionar proceso frontonasal del embrión (o en el sitio de otros donantes como el proceso maxilar o mandibular)
- Compendio de 2.4U / mL dispasa en PBS en hielo durante 20 minutos
- Cubrir los tejidos con DMEM con BSA al 1% para detener la digestión
- El uso de agujas afiladas de tungsteno para ectodermo separado, mesénquima, y neuroectodermo
- Tienda de injerto de tejido en DMEM BSA al 1% en el hielo hasta el ordenador está listo para el trasplante
2. La preparación de la acogida
- Exponer el embrión
- Con una jeringa de 10 ml y una aguja de calibre 18 extraer 1,0 ml de albúmina en la punta de la cáscara del huevo.
- Haz un pequeño agujero en la parte superior de la misma utilizando el punto de tijeras. Coloque un pedazo de cinta adhesiva sobre el agujero, y luego se corta una abertura circular para exponer el embrión.
- Utilizando dos pares de pinzas, sujete el amnios y el desgarro con cuidado para hacer un agujero.
- Gire la cabeza colocando un par de pinzas en el ojo derecho y la aplicación de presión. Mientras mantiene la cabeza firme, utilice una aguja de tungsteno para eliminar el ectodermo de acogida para dar cabida a la corrupción.
- Transferencia del injerto al huésped con una pipeta de vidrio.
- La posición del injerto para reemplazar el ectodermo eliminado. Inserte un vaso en cada esquina del tejido injertado para fijar el injerto en su lugar. Para hacer alfileres de cristal, tirar de un tubo capilar a una punta fina sobre una llama de alcohol.
- Coloque cinta firmemente sobre el agujero y volver embrión de la incubadora de tiempo adecuado para el análisis.
- véase también: 9
3. Los resultados representativos:
Para evaluar las quimeras, los embriones deben ser recogidos y procesados para el análisis de la distribución de los anfitriones y los tejidos del donante. Para la detección de células de codorniz, inmunohistoquímica utilizando el anticuerpo QcPN (que se describe en: 3) se emplea, y para la detección de células de ratón, hibridación in situ en secciones de parafina se utilizan 6. Las células del donante se debe restringir al epitelio, y no debe haber evidencia de donantes tejidos mesenquimales (Figura 1). La presencia de células del donante aislado en el mesénquima indica la presencia de células de la contaminación de la cresta neural que confundir cualquier interpretación morfológica debido a la influencia de estas células en muchos aspectos del desarrollo facial (por ejemplo, 10). Una vez convencidos de que la técnica de injerto libre de contaminantes mesénquima, las medidas de resultado más morfológicos o moleculares se pueden utilizar para evaluar las quimeras. Para nuestros propósitos, hemos detectado la presencia de los cartílagos y los huesos ectópico que se correspondía con la duplicación de la mandíbula superior que fueron inducidos por los tejidos trasplantados (Figura 2), y los cambios moleculares en los tejidos mesenquimales en respuesta a la ectodermo injerto (Figura 3) 5,6.

Figura 1. Evaluación de quimerismo (A) Anti-manchas QcPN se utiliza para detectar células de codorniz en la codorniz, pollo quimeras. No hay evidencia de manchas en el mesénquima. (B) La hibridación in situ se utiliza para detectar la expresión de las transcripciones B2 SINE en quimeras pollo ratón. Expresión está restringida al ectodermo que incluye el injerto.
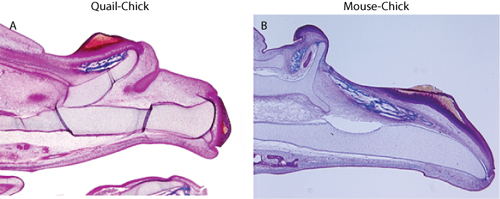
Tinción de la figura 2. Tricrómica muestra la duplicación del esqueleto de la mandíbula superior en (A) de codorniz-chick quimera, y (B) quimeras pollo ratón.

Figura 3. El ectodermo regultes la expresión de genes en el mesénquima. (A) Normal BMP7 expresión en el mesénquima de un embrión de pollo (radiactivos hibridación in situ con señal positiva pseudo-color rojo en Adobe Photoshop). (B) la expresión BMP7 se induce en el mesénquima adyacente al injerto (flecha) en embriones quiméricos.
Discusión
El uso de este método de trasplante nos ha permitido determinar que el ectodermo contiene información de señalización que regula la polaridad dorsoventral y extensión proximodistal de la mandíbula superior. La similitud de resultados cuando se utiliza la codorniz o ectodermo del ratón, y la conservación de las señales moleculares en este tejido, entre muchas especies de 6,11 indica que este es un centro altamente conservadas de señalización entre los vertebrados. Por otra parte, otros investigadore...
Divulgaciones
Agradecimientos
Este trabajo fue financiado por R01-R01 DE018234 y DE019638.
Materiales
| Name | Company | Catalog Number | Comments |
| 1x PBS | Tektronix, Inc. | TEKZR114 | |
| DMEM | University of California - San Francisco | CCFDA003 | |
| BSA | Sigma-Aldrich | A7906 | |
| Dispase | GIBCO, by Life Technologies | 17105-041 | |
| 35x10 mm Petri dish | Falcon BD | 1008 | |
| No. 5 Dumont forceps | Fine Science Tools | 11252-20 | |
| Scissors | Fine Science Tools | 14058-11 | |
| Spring Scissors | Fine Science Tools | 15010-11 | |
| Needle holder | Fine Science Tools | 26016-12 | |
| Tungsten Needle | Fine Science Tools | 26000 | |
| Microcapillary tube | Drummond Scientific | 3-000-225-G | |
| Pasteur Pipets | Fisher Scientific | 13-678-6B | |
| Spring scissors | Fine Science Tools | 15010-11 | |
| Blade holder | Fine Science Tools | 10052-11 | |
| Razor blade | Fine Science Tools | 10050-00 |
Referencias
- Noden, D. M. The Role of the Neural Crest in Patterning of Avian Cranial Skeletal, Connective, and Muscle Tissues. Developmental Biology. 96, 144-144 (1983).
- Bronner-Fraser, M., Stern, C. Effects of Mesodermal Tissues on Avian Neural Crest Cell Migration. Developmental Biology. 143, 213-213 (1991).
- Schneider, R. A. Neural crest can form cartilages normally derived from mesoderm during development of the avian head skeleton. Developmental Biology. 208, 441-441 (1999).
- Couly, G. Interactions between Hox-negative cephalic neural crest cells and the foregut endoderm in patterning the facial skeleton in the vertebrate head. Development. 129, 1061-1061 (2002).
- Evans, D. J., Noden, D. M. Spatial relations between avian craniofacial neural crest and paraxial mesoderm cells. Dev Dyn. , (2006).
- Hu, D., Marcucio, R., Helms, J. A. A zone of frontonasal ectoderm regulates patterning and growth in the face. Development. 130, 1749-1749 (2003).
- Hu, D., Marcucio, R. S. Unique organization of the frontonasal ectodermal zone in birds and mammals. Dev Biol. 325, 200-200 (2009).
- Le Lièvre, C. S., Le Douarin, N. M. Mesenchymal derivatives of the neural crest: analysis of chimaeric quail and chick embryos. Journal of Embryology and Experimental Morphology. 34, 125-125 (1975).
- Bollag, R. J. Use of a repetitive mouse B2 element to identify transplanted mouse cells in mouse-chick chimeras. Exp Cell Res. 248, 75-75 (1999).
- Korn, M. J., Cramer, K. S. Windowing chicken eggs for developmental studies. J Vis Exp. , (2007).
- Eames, B. F., Schneider, R. A. Quail-duck chimeras reveal spatiotemporal plasticity in molecular and histogenic programs of cranial feather development. Development. 132, 1499-1499 (2005).
- Odent, S. Expression of the Sonic hedgehog (SHH ) gene during early human development and phenotypic expression of new mutations causing holoprosencephaly. Hum Mol Genet. 8, 1683-1683 (1999).
- Szabo-Rogers, H. L. Novel skeletogenic patterning roles for the olfactory pit. Development. 136, 219-219 (2009).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados