Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Оценка сигнализации Свойства эктодермальная эпителия Во время черепно-лицевых развития
В этой статье
Резюме
В этой статье описывается методика трансплантации тканей, который был разработан для тестирования сигнализации и структурирование свойств поверхности головной эктодермы при черепно-лицевой развития.
Аннотация
Доступность птичьего эмбриона помог экспериментальных эмбриологов понять судьбы клеток в процессе развития и роль ткань взаимодействий, которые регулируют структурирование и морфогенеза позвоночных животных (например, 1, 2, 3, 4). Здесь мы проиллюстрируем метод, который использует это доступность для тестирования сигнализации и структурирование свойств тканей эктодермального в лице развития. В этих экспериментах мы создаем перепел-5 куриных или мышь-6 куриных химеры путем пересадки поверхности головной эктодермы, который охватывает верхнюю челюсть из перепелиных или мыши на любом же регионе или внематочной области куриных эмбрионах. Использование перепелиных качестве донорских тканей для трансплантации птенцов была разработана, чтобы воспользоваться ядрышковых маркер присутствует в перепела, но не клеток куриного, что позволило исследователям различать хозяина и донорских тканей 7. Кроме того, повторяющиеся элемент присутствует в геноме мыши и выражается повсеместно, что позволяет нам различать хозяина и донорских тканей у мышей-химер куриных 8. Использование мыши эктодермы в качестве донора ткани значительно расширить наше понимание этих тканей взаимодействия, потому что это позволит нам проверить сигнализацию свойства эктодермы получены из различных мутантных эмбрионов.
протокол
1. Подготовка донорских тканей
- Подготовка питательных сред, резкость стекла булавки, резкость вольфрамовой иглы.
- Сбор эмбриона из оболочки, промыть в ледяной PBS.
- Использование 10 мл шприц и иглу 18 калибра удалить 1,0 мл альбумина с заостренным концом из яичной скорлупы.
- Сделайте небольшое отверстие на верхней части корпуса использованием точки ножницами, а затем вырезать круглое отверстие подвергать эмбрион
- Удалите головы и поместить в DMEM (без сыворотки, комнатная температура)
- Рассеките лобно-носовой процесса от эмбриона (или другой сайт доноров, таких как верхнечелюстной или нижней челюсти процесс)
- Дайджест в 2.4U / мл dispase в ФСБ на льду в течение 20 минут
- Обложка тканей с DMEM с 1% BSA, чтобы остановить пищеварения
- Используйте заостренные вольфрамовой иглы для разделения эктодермы, мезенхимы и нейроэктодермы
- Магазин трансплантата ткани в DMEM 1% BSA на льду, пока хозяин готов к трансплантации
2. Подготовка хоста
- Expose эмбриона
- Использование 10 мл шприц и иглу 18 калибра удалить 1,0 мл альбумина с заостренным концом из яичной скорлупы.
- Сделайте небольшое отверстие на верхней части корпуса использованием точки ножниц. Место кусок ленты через отверстия, а затем вырезать круглое отверстие подвергать эмбрион.
- Использование 2 пары щипцов, держитесь амнион и мягко слезу, чтобы сделать отверстие.
- Поворот головы, поставив пару щипцов на правый глаз и применении давления. Удерживая голову неподвижно, использование вольфрамовой иглы для удаления хоста эктодермы для размещения трансплантата.
- Передача трансплантата для хоста с помощью стеклянной пипетки.
- Позиция трансплантата для замены удалены эктодермы. Вставьте стекло штифт в каждом углу пересаженной ткани к контакту трансплантата на месте. Для того, чтобы стекла булавки, тянуть микрокапиллярных трубки в виде штрафа в точку над алкоголем пламени.
- Место лента плотно над отверстием и вернуть эмбрион инкубатор для соответствующего периода времени для анализа.
- см. также: 9
3. Представитель Результаты:
Для оценки химер, эмбрионы должны быть собраны и обработаны для анализа распределения принимающих и донорских тканей. Для обнаружения перепелиные клетки, иммуногистохимия использованием антител QcPN (описано в: 3) работает, и для обнаружения клеток мыши, в гибридизация на парафиновых срезах используется 6. Донорские клетки должны быть ограничены эпителия, и не должно быть никаких признаков донорских тканей мезенхимальные (рис. 1). Наличие изолированных клеток донора в мезенхимы указывает на наличие загрязнения нервных клеток гребню, который будет смешивать любые морфологические интерпретации из-за влияния этих клеток по многим аспектам лица развития (например, 10). Убедившись, что трансплантат техника свободна от загрязняющих мезенхимы, дальнейшие морфологические и молекулярные критерии оценки могут быть использованы для оценки химер. Для наших целей, мы обнаружили наличие внематочной хрящей и костей, которые соответствовали дублирования верхней челюсти, которые были вызваны пересаженных тканей (рис. 2), и молекулярные изменения в мезенхимальной ткани в ответ на привитых эктодермы (рис. 3) 5,6.

Рисунок 1. Оценка химеризма () Анти-QcPN окрашивания используется для обнаружения клеток перепела перепела-цыпленок химеры. Существует никаких доказательств окрашивания в мезенхимы. (Б) В гибридизация используется для обнаружения выражение стенограммы SINE B2 в мыши куриных химеры. Выражение ограничивается эктодермы включает трансплантата.
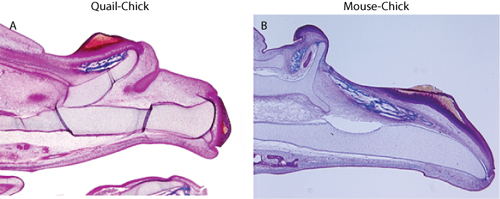
Рисунок 2. Trichrome окрашивания показывает дублирования верхней челюсти в скелет () перепел-цыпленок химера, и (Б) мыши-химеры цыпленок.

Рисунок 3. Эктодермы regultes экспрессии генов в мезенхимы. (А) Обычная BMP7 выражение в мезенхимы из куриного эмбриона (радиоактивные на месте гибридизации с позитивным сигналом псевдо-красного цвета в Adobe Photoshop). (B) BMP7 экспрессия индуцируется в мезенхимы, прилегающих к трансплантата (Стрелка) в химерных эмбрионов.
Обсуждение
Используя этот метод трансплантации позволило нам определить, что эктодерма содержит сигнальной информации, регулирующий дорсовентральной полярности и proximodistal расширение верхней челюсти. Сходство результатов при использовании перепела или мыши эктодермы и сохранения молекулярные ...
Раскрытие информации
Благодарности
Эта работа финансировалась R01-R01 и DE018234-DE019638.
Материалы
| Name | Company | Catalog Number | Comments |
| 1x PBS | Tektronix, Inc. | TEKZR114 | |
| DMEM | University of California - San Francisco | CCFDA003 | |
| BSA | Sigma-Aldrich | A7906 | |
| Dispase | GIBCO, by Life Technologies | 17105-041 | |
| 35x10 mm Petri dish | Falcon BD | 1008 | |
| No. 5 Dumont forceps | Fine Science Tools | 11252-20 | |
| Scissors | Fine Science Tools | 14058-11 | |
| Spring Scissors | Fine Science Tools | 15010-11 | |
| Needle holder | Fine Science Tools | 26016-12 | |
| Tungsten Needle | Fine Science Tools | 26000 | |
| Microcapillary tube | Drummond Scientific | 3-000-225-G | |
| Pasteur Pipets | Fisher Scientific | 13-678-6B | |
| Spring scissors | Fine Science Tools | 15010-11 | |
| Blade holder | Fine Science Tools | 10052-11 | |
| Razor blade | Fine Science Tools | 10050-00 |
Ссылки
- Noden, D. M. The Role of the Neural Crest in Patterning of Avian Cranial Skeletal, Connective, and Muscle Tissues. Developmental Biology. 96, 144-144 (1983).
- Bronner-Fraser, M., Stern, C. Effects of Mesodermal Tissues on Avian Neural Crest Cell Migration. Developmental Biology. 143, 213-213 (1991).
- Schneider, R. A. Neural crest can form cartilages normally derived from mesoderm during development of the avian head skeleton. Developmental Biology. 208, 441-441 (1999).
- Couly, G. Interactions between Hox-negative cephalic neural crest cells and the foregut endoderm in patterning the facial skeleton in the vertebrate head. Development. 129, 1061-1061 (2002).
- Evans, D. J., Noden, D. M. Spatial relations between avian craniofacial neural crest and paraxial mesoderm cells. Dev Dyn. , (2006).
- Hu, D., Marcucio, R., Helms, J. A. A zone of frontonasal ectoderm regulates patterning and growth in the face. Development. 130, 1749-1749 (2003).
- Hu, D., Marcucio, R. S. Unique organization of the frontonasal ectodermal zone in birds and mammals. Dev Biol. 325, 200-200 (2009).
- Le Lièvre, C. S., Le Douarin, N. M. Mesenchymal derivatives of the neural crest: analysis of chimaeric quail and chick embryos. Journal of Embryology and Experimental Morphology. 34, 125-125 (1975).
- Bollag, R. J. Use of a repetitive mouse B2 element to identify transplanted mouse cells in mouse-chick chimeras. Exp Cell Res. 248, 75-75 (1999).
- Korn, M. J., Cramer, K. S. Windowing chicken eggs for developmental studies. J Vis Exp. , (2007).
- Eames, B. F., Schneider, R. A. Quail-duck chimeras reveal spatiotemporal plasticity in molecular and histogenic programs of cranial feather development. Development. 132, 1499-1499 (2005).
- Odent, S. Expression of the Sonic hedgehog (SHH ) gene during early human development and phenotypic expression of new mutations causing holoprosencephaly. Hum Mol Genet. 8, 1683-1683 (1999).
- Szabo-Rogers, H. L. Novel skeletogenic patterning roles for the olfactory pit. Development. 136, 219-219 (2009).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены