Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Kraniofasial Geliştirme sırasında Ektodermal Epiteli Sinyal Özellikleri değerlendirilmesi
Bu Makalede
Özet
Bu makale, kraniyofasiyal gelişimi sırasında sinyalizasyon ve yüzey sefalik ektoderm desenlendirme özellikleri test etmek için tasarlanmış bir doku nakli tekniği açıklar.
Özet
Erişilebilirlik kuş embriyoların deneysel embriyologlar kalkınma ve desenlendirme ve omurgalıların morfolojilerinden (örneğin, 1, 2, 3, 4) düzenleyen doku etkileşimleri rol sırasında hücre kaderi anlamaya yardımcı olmuştur. Burada, yüz gelişimi sırasında ektodermal dokuların sinyalizasyon ve desenlendirme özelliklerini test etmek için bu erişilebilirlik yararlanan bir yöntem göstermektedir. Bu deneylerde, aynı bölgede ya da bir civciv embriyo ektopik bölge üzerine, bıldırcın ya da fare üst çene kapsayan yüzey sefalik ektoderm nakli bıldırcın-chick 5 veya fare civciv 6 kimeralar oluşturmak. Civciv içine nakli için donör doku olarak bıldırcın kullanımı, böylece araştırmacılar host ve donör dokuları 7 ayırt etmek için izin, bıldırcın içinde mevcut değil civciv hücreleri nucleolar marker yararlanmak için geliştirilmiştir . Aynı şekilde, bize fare civciv kuruntulardan 8 host ve donör dokuları ayırt etmek için izin verir, tekrarlayan bir unsur fare genomunda mevcut ve yayg ifade edilir. Bu bize çeşitli mutant embriyolardan elde edilen ektoderm sinyalizasyon özellikleri test etmek için izin verecek, çünkü donör doku olarak fare ektoderm kullanımı büyük ölçüde, bu doku etkileşimleri anlayışımızı uzatacaktır.
Protokol
1. Donör Doku hazırlanması
- Kültür ortamı hazırlayın, cam pimleri keskinleştirmek, tungsten iğneler keskinleştirmek.
- Kabuk embriyonun toplayın, buz gibi soğuk PBS içinde yıkayın.
- 10 ml şırınga ve 18 gauge iğne ile yumurta kabuğu sivri ucundan 1.0 mL albumin çıkarın.
- Makas noktasını kullanarak kabuğun üstünde küçük bir delik açın ve sonra embriyo maruz dairesel bir açılış kesip
- DMEM (serum serbest, oda sıcaklığı), baş ve yer çıkarın
- Embriyo Frontonasal Süreci teşrih (veya maksiller ve mandibular süreci gibi diğer donör sitesi)
- 20mins için buz üzerinde PBS içinde 2.4U / ml dispase Digest
- Sindirim durdurmak için% 1 BSA DMEM birlikte dokularda Kapak
- Ayrı ektoderm, mezenşimin ve neuroectoderm bilenmiş tungsten iğne kullanın.
- Host nakli için hazır olana kadar buz üzerinde DMEM% 1 BSA greft doku Mağaza
2. Host hazırlanması
- Embriyo Açığa
- 10 ml şırınga ve 18 gauge iğne ile yumurta kabuğu sivri ucundan 1.0 mL albumin çıkarın.
- Makas noktasını kullanarak kabuğun üstünde küçük bir delik açın. Delik üzerine bir parça bant yerleştirin ve sonra embriyonun maruz dairesel bir açılış kesmek.
- 2 çift forseps kullanarak, amniyon kavrayın ve yavaşça bir delik yapmak için gözyaşı.
- Sağ göz forseps bir çift yerleştirerek ve basınç uygulayarak baş döndürün. Kafa sabit tutarken, greft yerleştirmek için ev sahibi ektoderm kaldırmak için bir tungsten iğne kullanınız.
- Cam bir pipet kullanarak ana greft aktarın.
- Greft kaldırılan ektoderm yerine yerleştirin. Greft pin aşılı doku her köşesinde bir cam pimi takın. Cam pimleri yapmak için, alkol ateşte ince bir nokta microcapillary tüp çekin.
- Delik üzerinde sıkı bir bant yerleştirin ve analiz için zaman uygun uzunluğu için inkübatör embriyo geri.
- ayrıca bkz: 9
3. Temsilcisi Sonuçlar:
Kimeralar değerlendirmek için, embriyolar toplanan ve ev sahibi ve donör dokuları dağılımı analizi için işlenmiş olmalıdır. QcPN antikor kullanarak bıldırcın hücreleri, immünhistokimya tespiti için (açıklandığı: 3) istihdam ve fare hücreleri algılama, kesitler in situ hibridizasyon için 6 kullanılır. Donör hücreleri epitel sınırlı olmalı ve donör mezenkimal dokuların herhangi bir kanıt olması gerekir (Şekil 1). Mezenşimin izole donör hücrelerinin varlığı yüz geliştirme (örneğin, 10) pek çok açıdan bu hücrelerin etkisi nedeniyle herhangi bir morfolojik yorumlanması bulandırabilir kirlenme nöral krest hücrelerinin varlığını gösterir. Bir kez ikna greft tekniği mezenşimin kirlenmesine neden olduğunu ileri morfolojik veya moleküler sonuç ölçümleri, kuruntulardan değerlendirmek için kullanılabilir. Bizim amaçlarımız için, üst çene (Şekil 3) (Şekil 2) aşılı ektoderm yanıt nakledilen dokuları ve mezenkimal dokuların moleküler değişiklikler ile indüklenen mükerrer denk ektopik kıkırdak ve kemiklerin varlığı tespit 5,6.

Şekil 1. Kimerizm Değerlendirmesi (A) Anti-QcPN boyama, bıldırcın civciv kimeralar bıldırcın hücreleri algılamak için kullanılır . Mezenşimin boyanma hiçbir kanıt yoktur. (B) in situ hibridizasyon fare civciv kimeralar SINE B2 transkript ifade algılamak için kullanılır. İfade greft oluşan ektoderm sınırlıdır.
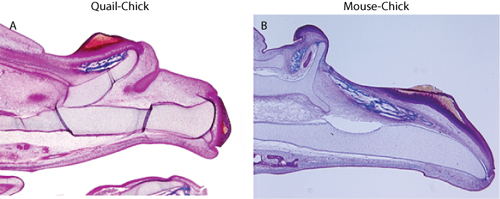
Şekil 2 trikrom boyama, (A) bıldırcın-chick chimera üst çene iskelet çoğaltılması ve (B) fare ve civciv kimeralar gösterir.

Şekil 3 ektoderm mezenşimin gen ekspresyonu regultes. (A) Normal bir civciv embriyo mezenşimin Bmp7 ifade (Adobe Photoshop olumlu sinyal pseudo-kırmızı boyalı in situ hibridizasyon radyoaktif). (B) Bmp7 ifade kimerik embriyolar greft (Ok) bitişik mezenşimin indüklenir.
Tartışmalar
Bu nakli yöntemi kullanarak bize ektoderm dorsoventral polarite ve üst çene proximodistal uzatma düzenleyen sinyal bilgisini içerdiğini belirlemek için izin verdi. Bıldırcın veya fare ektoderm, ve birçok türün 6,11 arasında bu doku moleküler sinyaller korunması kullanarak sonuçların benzerlik omurgalıların hiçbirinde görülmeyen, son derece korunmuş bir sinyalizasyon merkezi olduğunu gösterir . Ayrıca, diğer araştırmacılar, farklı bölgelerin yüzey sefalik ektoderm sinyalizasyo...
Açıklamalar
Teşekkürler
Bu çalışma, R01-DE018234 ve R01-DE019638 tarafından finanse edildi.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 1x PBS | Tektronix, Inc. | TEKZR114 | |
| DMEM | University of California - San Francisco | CCFDA003 | |
| BSA | Sigma-Aldrich | A7906 | |
| Dispase | GIBCO, by Life Technologies | 17105-041 | |
| 35x10 mm Petri dish | Falcon BD | 1008 | |
| No. 5 Dumont forceps | Fine Science Tools | 11252-20 | |
| Scissors | Fine Science Tools | 14058-11 | |
| Spring Scissors | Fine Science Tools | 15010-11 | |
| Needle holder | Fine Science Tools | 26016-12 | |
| Tungsten Needle | Fine Science Tools | 26000 | |
| Microcapillary tube | Drummond Scientific | 3-000-225-G | |
| Pasteur Pipets | Fisher Scientific | 13-678-6B | |
| Spring scissors | Fine Science Tools | 15010-11 | |
| Blade holder | Fine Science Tools | 10052-11 | |
| Razor blade | Fine Science Tools | 10050-00 |
Referanslar
- Noden, D. M. The Role of the Neural Crest in Patterning of Avian Cranial Skeletal, Connective, and Muscle Tissues. Developmental Biology. 96, 144-144 (1983).
- Bronner-Fraser, M., Stern, C. Effects of Mesodermal Tissues on Avian Neural Crest Cell Migration. Developmental Biology. 143, 213-213 (1991).
- Schneider, R. A. Neural crest can form cartilages normally derived from mesoderm during development of the avian head skeleton. Developmental Biology. 208, 441-441 (1999).
- Couly, G. Interactions between Hox-negative cephalic neural crest cells and the foregut endoderm in patterning the facial skeleton in the vertebrate head. Development. 129, 1061-1061 (2002).
- Evans, D. J., Noden, D. M. Spatial relations between avian craniofacial neural crest and paraxial mesoderm cells. Dev Dyn. , (2006).
- Hu, D., Marcucio, R., Helms, J. A. A zone of frontonasal ectoderm regulates patterning and growth in the face. Development. 130, 1749-1749 (2003).
- Hu, D., Marcucio, R. S. Unique organization of the frontonasal ectodermal zone in birds and mammals. Dev Biol. 325, 200-200 (2009).
- Le Lièvre, C. S., Le Douarin, N. M. Mesenchymal derivatives of the neural crest: analysis of chimaeric quail and chick embryos. Journal of Embryology and Experimental Morphology. 34, 125-125 (1975).
- Bollag, R. J. Use of a repetitive mouse B2 element to identify transplanted mouse cells in mouse-chick chimeras. Exp Cell Res. 248, 75-75 (1999).
- Korn, M. J., Cramer, K. S. Windowing chicken eggs for developmental studies. J Vis Exp. , (2007).
- Eames, B. F., Schneider, R. A. Quail-duck chimeras reveal spatiotemporal plasticity in molecular and histogenic programs of cranial feather development. Development. 132, 1499-1499 (2005).
- Odent, S. Expression of the Sonic hedgehog (SHH ) gene during early human development and phenotypic expression of new mutations causing holoprosencephaly. Hum Mol Genet. 8, 1683-1683 (1999).
- Szabo-Rogers, H. L. Novel skeletogenic patterning roles for the olfactory pit. Development. 136, 219-219 (2009).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır