Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Évaluation des propriétés de signalisation ectodermique épithéliums au cours du développement cranio-facial
Dans cet article
Résumé
Cet article décrit une technique de transplantation de tissus qui a été conçu pour tester les propriétés de signalisation et de structuration de la surface ectoderme céphalique au cours du développement cranio-facial.
Résumé
L'accessibilité des embryons aviaires a aidé à comprendre les embryologistes expérimentale du sort des cellules pendant le développement et le rôle des interactions tissus qui régulent la structuration et la morphogenèse des vertébrés (par exemple, 1, 2, 3, 4). Ici, nous illustrons une méthode qui exploite cette accessibilité pour tester les propriétés de signalisation et de structuration des tissus ectodermiques lors de l'élaboration du visage. Dans ces expériences, nous créons de caille-chiches 5 ou 6 souris chimères chiches en transplantant l'ectoderme de surface céphalique qui recouvre la mâchoire supérieure de caille ou de la souris sur soit la même région ou d'une région extra-utérine d'embryons de poulet. L'utilisation de la caille en tissu du donneur pour une transplantation dans les poussins a été développé pour tirer parti d'un marqueur nucléolaire présente dans les cellules de caille, mais pas chiches, permettant ainsi aux enquêteurs d'hôte et de distinguer les tissus des donneurs 7. De même, un élément répétitif est présent dans le génome de la souris et est exprimée de façon ubiquitaire, ce qui nous permet de distinguer les tissus hôtes et les donateurs dans les souris chimères chiches 8. L'utilisation de la souris comme ectoderme tissu du donneur va augmenter considérablement notre compréhension de ces interactions tissulaires, parce que cela va nous permettre de tester les propriétés de signalisation des issues de différentes ectoderme embryons mutants.
Protocole
1. Préparer le tissu du donneur
- Préparer les milieux de culture, d'affiner broches verre, affûter les aiguilles de tungstène.
- Recueillir l'embryon de la coquille, lavez-les à PBS glacé.
- En utilisant une seringue de 10 ml et une aiguille 18 gauge retirer 1,0 ml d'albumine de l'extrémité pointue de la coquille d'oeuf.
- Faire un petit trou sur le dessus de la coquille en utilisant le point de ciseaux, puis couper une ouverture circulaire pour exposer l'embryon
- Retirez la tête et la placer dans du DMEM (sans sérum, température ambiante)
- Disséquer processus fronto partir de l'embryon (ou le site d'autres donateurs tels que le processus maxillaire ou mandibulaire)
- Digest en 2.4U / ml dans le PBS dispase sur la glace pendant 20 minutes
- Couvrir les tissus avec du DMEM avec la BSA à 1% pour arrêter la digestion
- Utiliser l'aiguille de tungstène aiguisé pour ectoderme séparée, mésenchyme, et neuroectoderme
- Magasin de tissu greffé en BSA DMEM 1% sur la glace jusqu'à ce hôte est prêt pour la transplantation
2. Préparation de l'hôte
- Exposer l'embryon
- En utilisant une seringue de 10 ml et une aiguille 18 gauge retirer 1,0 ml d'albumine de l'extrémité pointue de la coquille d'oeuf.
- Faire un petit trou sur le dessus de la coquille en utilisant le point de ciseaux. Placer un morceau de ruban adhésif sur le trou, puis couper une ouverture circulaire pour exposer l'embryon.
- Utiliser 2 paires de pinces, saisir l'amnios et doucement lacrymogènes pour faire un trou.
- Tournez la tête en plaçant une pince sur l'œil droit et en appliquant une pression. Tout en tenant la tête droite, utiliser une aiguille de tungstène pour enlever l'ectoderme d'hôte pour accueillir le greffon.
- Transfert de la greffe à l'hôte à l'aide d'une pipette en verre.
- Position de la greffe pour remplacer l'ectoderme enlevé. Insérez une épingle en verre dans chaque coin du tissu greffé à la broche le greffon en place. Pour rendre broches verre, tirez un tube microcapillaire à un point précis sur une flamme d'alcool.
- Placez ruban serré sur le trou et le retour d'embryon à l'incubateur pour la longueur de temps appropriée pour l'analyse.
- voir aussi: 9
3. Les résultats représentatifs:
Pour évaluer les chimères, embryons doivent être collectées et traitées à l'analyse de la répartition de l'hôte et les tissus des donateurs. Pour la détection de cellules de caille, immunohistochimie en utilisant l'anticorps QcPN (décrit dans: 3) est utilisé, et pour la détection de cellules de souris, l'hybridation in situ sur coupes en paraffine est utilisée 6. Les cellules donneuses doivent être limitées à l'épithélium, et il devrait y avoir aucune preuve de tissus mésenchymateux donneur (Figure 1). La présence de cellules du donneur isolées dans le mésenchyme indique la présence de cellules de contamination de la crête neurale qui se confondent toute interprétation morphologique due à l'influence de ces cellules sur plusieurs aspects du développement du visage (par exemple, 10). Une fois convaincu que la technique de greffe est libre de contamination de mésenchyme, les mesures des résultats encore morphologiques ou moléculaires peuvent être utilisés pour évaluer les chimères. Pour nos fins, nous avons détecté la présence de cartilages et des os ectopique qui correspondaient à des duplications de la mâchoire supérieure qui ont été induites par les tissus transplantés (figure 2), et des changements moléculaires dans les tissus mésenchymateux en réponse à l'ectoderme greffé (figure 3) 5,6.

Figure 1. Évaluation de chimérisme (A) Anti-QcPN coloration est utilisée pour détecter les cellules de caille dans le caille-chiches chimères. Il n'existe aucune preuve de la coloration dans le mésenchyme. (B) L'hybridation in situ est utilisée pour détecter l'expression des transcrits B2 SINE chez la souris-chiches chimères. L'expression est limitée à l'ectoderme comprenant la greffe.
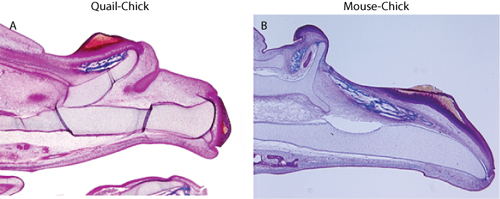
Coloration Figure 2. Trichrome montre duplication du squelette mâchoire supérieure en (A) de caille-chiches chimère, et (B) de souris chimères chiches.

Figure 3. L'ectoderme regultes l'expression des gènes dans le mésenchyme. (A) Normale BMP7 expression dans le mésenchyme d'un embryon de poulet (radioactive d'hybridation in situ avec un signal pseudo-couleur rouge positif dans Adobe Photoshop). (B) l'expression BMP7 est induite dans le mésenchyme adjacent à la greffe (Arrow) dans les embryons chimériques.
Discussion
En utilisant cette méthode de transplantation nous a permis de déterminer que l'ectoderme contient des informations de signalisation qui régule la polarité dorso-ventrale et l'extension proximodistal de la mâchoire supérieure. La similitude des résultats lors de l'utilisation de caille ou ectoderme de la souris, et la conservation des signaux moléculaires dans ce tissu parmi les nombreuses espèces 6,11 indique qu'il s'agit d'un centre de signalisation hautement conservée chez...
Déclarations de divulgation
Remerciements
Ce travail a été financé par R01 et R01-DE018234-DE019638.
matériels
| Name | Company | Catalog Number | Comments |
| 1x PBS | Tektronix, Inc. | TEKZR114 | |
| DMEM | University of California - San Francisco | CCFDA003 | |
| BSA | Sigma-Aldrich | A7906 | |
| Dispase | GIBCO, by Life Technologies | 17105-041 | |
| 35x10 mm Petri dish | Falcon BD | 1008 | |
| No. 5 Dumont forceps | Fine Science Tools | 11252-20 | |
| Scissors | Fine Science Tools | 14058-11 | |
| Spring Scissors | Fine Science Tools | 15010-11 | |
| Needle holder | Fine Science Tools | 26016-12 | |
| Tungsten Needle | Fine Science Tools | 26000 | |
| Microcapillary tube | Drummond Scientific | 3-000-225-G | |
| Pasteur Pipets | Fisher Scientific | 13-678-6B | |
| Spring scissors | Fine Science Tools | 15010-11 | |
| Blade holder | Fine Science Tools | 10052-11 | |
| Razor blade | Fine Science Tools | 10050-00 |
Références
- Noden, D. M. The Role of the Neural Crest in Patterning of Avian Cranial Skeletal, Connective, and Muscle Tissues. Developmental Biology. 96, 144-144 (1983).
- Bronner-Fraser, M., Stern, C. Effects of Mesodermal Tissues on Avian Neural Crest Cell Migration. Developmental Biology. 143, 213-213 (1991).
- Schneider, R. A. Neural crest can form cartilages normally derived from mesoderm during development of the avian head skeleton. Developmental Biology. 208, 441-441 (1999).
- Couly, G. Interactions between Hox-negative cephalic neural crest cells and the foregut endoderm in patterning the facial skeleton in the vertebrate head. Development. 129, 1061-1061 (2002).
- Evans, D. J., Noden, D. M. Spatial relations between avian craniofacial neural crest and paraxial mesoderm cells. Dev Dyn. , (2006).
- Hu, D., Marcucio, R., Helms, J. A. A zone of frontonasal ectoderm regulates patterning and growth in the face. Development. 130, 1749-1749 (2003).
- Hu, D., Marcucio, R. S. Unique organization of the frontonasal ectodermal zone in birds and mammals. Dev Biol. 325, 200-200 (2009).
- Le Lièvre, C. S., Le Douarin, N. M. Mesenchymal derivatives of the neural crest: analysis of chimaeric quail and chick embryos. Journal of Embryology and Experimental Morphology. 34, 125-125 (1975).
- Bollag, R. J. Use of a repetitive mouse B2 element to identify transplanted mouse cells in mouse-chick chimeras. Exp Cell Res. 248, 75-75 (1999).
- Korn, M. J., Cramer, K. S. Windowing chicken eggs for developmental studies. J Vis Exp. , (2007).
- Eames, B. F., Schneider, R. A. Quail-duck chimeras reveal spatiotemporal plasticity in molecular and histogenic programs of cranial feather development. Development. 132, 1499-1499 (2005).
- Odent, S. Expression of the Sonic hedgehog (SHH ) gene during early human development and phenotypic expression of new mutations causing holoprosencephaly. Hum Mol Genet. 8, 1683-1683 (1999).
- Szabo-Rogers, H. L. Novel skeletogenic patterning roles for the olfactory pit. Development. 136, 219-219 (2009).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon