このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
頭蓋顔面の開発時には外胚葉上皮のシグナリング特性を評価する
要約
この記事では、頭蓋顔面の開発中にシグナリングと表面頭部外胚葉のパターニング特性をテストするために設計された組織移植の手法を説明します。
要約
鳥類胚のアクセシビリティは、実験的な発生学者が開発し、パターニングし、脊椎動物の形態形成(例えば、1、2、3、4)規制組織の相互作用の役割の間に細胞の運命を理解して支援してきました。ここで、我々は、顔の開発中に外胚葉組織のシグナリングとパターニング特性をテストするには、このアクセシビリティを悪用する方法を示しています。これらの実験では、我々は、同じ地域やニワトリ胚の異所性の領域のいずれかの上にウズラやマウスからの上顎を覆う表面頭部外胚葉を移植することにより、ウズラ、ニワトリ5またはマウス-ひよこ6キメラを作成します。雛への移植のドナー組織としてのウズラの使用は、このように研究者がホストとドナーの組織7を区別できるように、ウズラの存在ではなく、ニワトリの細胞核マーカーを活用するために開発されました。私たちはマウスニワトリキメラ8のホストとドナーの組織を区別できるようになる、同様に、反復的な要素は、マウスのゲノムに存在し、遍在的に発現される。これは、私たちは様々な変異体胚に由来する外胚葉のシグナル伝達の特性をテストすることができますので、ドナーの組織としてのマウスの外胚葉の使用は大幅に、これらの組織の相互作用の理解を拡張します。
プロトコル
1。ドナー組織の準備
- 培地を準備し、ガラスのピンをシャープに、タングステンの針を強めています。
- シェルから胚を回収、氷冷PBSで洗う。
- 10mLのシリンジと18ゲージの針を使用すると、卵の殻の先端からアルブミン1.0 mLを削除します。
- はさみのポイントを使用してシェルの上に小さな穴を確認し、胚を露出させる円形の開口部をカット
- DMEM(無血清、室温)に頭と場所を削除します。
- 胚(またはそのような上顎または下顎のプロセスなど、他のドナーサイト)からFrontonasalプロセスを細かく分析
- 20分氷上でPBSの2.4U / mLのディスパーゼのダイジェスト
- 消化を停止するには、1%BSAを含むDMEMでティッシュカバー
- 別の外胚葉、間充織、および神経外胚葉に尖ったタングステン針を使用して、
- ホストは、移植の準備ができるまで、氷上でDMEM、1%BSAで移植組織を保存する
2。ホストの準備
- 胚を公開
- 10mLのシリンジと18ゲージの針を使用すると、卵の殻の先端からアルブミン1.0 mLを削除します。
- はさみのポイントを使用してシェルの上に小さな穴をあけます。穴の上のテープを配置して、胚を露出させる円形の開口部をカット。
- 鉗子の2組を使用して、羊膜を持ち、ゆっくりと穴を作るために引き裂く。
- 右眼にピンセットを配置し、圧力をかけて頭を回転させる。頭を固定し、移植片を収容するために、ホスト外胚葉を除去するためにタングステン針を使用。
- ガラスピペットを使用してホストに移植片を移す。
- 削除された外胚葉を交換する移植片を置きます。場所に移植片を固定するために移植された組織の各コーナーでガラスのピンを挿入します。ガラスのピンを作成するには、アルコールの炎の細かい点にマイクロキャピラリーチューブを引き出します。
- 穴にしっかりとテープを配置し、分析のために適切な時間のためにインキュベーターに胚を戻す。
- も参照してください:9
3。代表的な結果:
キメラを評価するために、胚を回収し、ホストとドナー組織の分布の分析のために処理されなければなりません。ウズラ細胞の検出、QcPNの抗体を用いた免疫組織化学が(で説明されている:3)採用されている、とマウス細胞の検出のための、パラフィン切片上でin situハイブリダイゼーションで 6が使用されます。ドナー細胞は、上皮に限定すべきである、とドナー間葉系組織(図1)の証拠があってはならない。間充織での孤立したドナー細胞の存在は、顔の開発の多くの側面(例えば、10)上でこれらの細胞の影響により、任意の形態学的解釈を混乱させるだろう汚染神経堤細胞の存在を示している。一度移植技術は間充織の汚染がないことを確信し、さらに形態学的または分子のアウトカム指標は、キメラを評価するために使用することができます。我々の目的のために、我々は(図3)グラフト化された外胚葉への応答における移植組織(図2)、及び間葉組織中の分子の変化によって誘発された上顎の重複に対応する異所性軟骨や骨の存在を検出5,6。

図1。キメラ現象の評価 ()アンチQcPN染色は、ウズラ、ニワトリのキメラでウズラの細胞を検出するために使用されます。間葉で染色の証拠はない。 (B)in situハイブリダイゼーションは、マウス、ニワトリのキメラでSINEのB2の転写産物の発現を検出するために使用されます。式は、移植片を構成する外胚葉に制限されます。
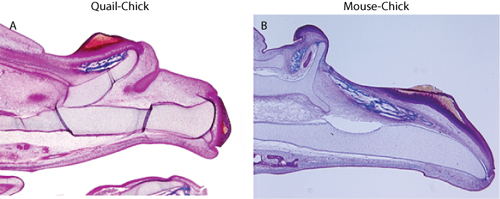
図2。トリクローム染色では、(A)ウズラ-ニワトリキメラの上顎の骨格の複製、及び(B)マウス、ニワトリキメラを示しています。

図3外胚葉は、間充織での遺伝子発現をregultes。ニワトリ胚の間充織の(A)ノーマルBMP7発現(Adobe Photoshopの正の信号擬似色の赤とin situハイブリダイゼーション放射性)。 (B)BMP7の発現は、キメラ胚の移植片(矢印)に隣接する間充組織に誘導される。
ディスカッション
この移植の方法を使用すると、私たちは外胚葉の背腹極性と上顎のproximodistal拡張を調節するシグナル伝達情報が含まれていることを決定することができました。ウズラやマウスの外胚葉、および多くの種6,11の間でこの組織の分子シグナルの保全を使用して結果の類似性は、これは脊椎動物間で高度に保存されたシグナル伝達の中心であることを示します。さらに、他の研究者らは、...
開示事項
謝辞
この作品は、R01 - DE018234とR01 - DE019638によって賄われていた。
資料
| Name | Company | Catalog Number | Comments |
| 1x PBS | Tektronix, Inc. | TEKZR114 | |
| DMEM | University of California - San Francisco | CCFDA003 | |
| BSA | Sigma-Aldrich | A7906 | |
| Dispase | GIBCO, by Life Technologies | 17105-041 | |
| 35x10 mm Petri dish | Falcon BD | 1008 | |
| No. 5 Dumont forceps | Fine Science Tools | 11252-20 | |
| Scissors | Fine Science Tools | 14058-11 | |
| Spring Scissors | Fine Science Tools | 15010-11 | |
| Needle holder | Fine Science Tools | 26016-12 | |
| Tungsten Needle | Fine Science Tools | 26000 | |
| Microcapillary tube | Drummond Scientific | 3-000-225-G | |
| Pasteur Pipets | Fisher Scientific | 13-678-6B | |
| Spring scissors | Fine Science Tools | 15010-11 | |
| Blade holder | Fine Science Tools | 10052-11 | |
| Razor blade | Fine Science Tools | 10050-00 |
参考文献
- Noden, D. M. The Role of the Neural Crest in Patterning of Avian Cranial Skeletal, Connective, and Muscle Tissues. Developmental Biology. 96, 144-144 (1983).
- Bronner-Fraser, M., Stern, C. Effects of Mesodermal Tissues on Avian Neural Crest Cell Migration. Developmental Biology. 143, 213-213 (1991).
- Schneider, R. A. Neural crest can form cartilages normally derived from mesoderm during development of the avian head skeleton. Developmental Biology. 208, 441-441 (1999).
- Couly, G. Interactions between Hox-negative cephalic neural crest cells and the foregut endoderm in patterning the facial skeleton in the vertebrate head. Development. 129, 1061-1061 (2002).
- Evans, D. J., Noden, D. M. Spatial relations between avian craniofacial neural crest and paraxial mesoderm cells. Dev Dyn. , (2006).
- Hu, D., Marcucio, R., Helms, J. A. A zone of frontonasal ectoderm regulates patterning and growth in the face. Development. 130, 1749-1749 (2003).
- Hu, D., Marcucio, R. S. Unique organization of the frontonasal ectodermal zone in birds and mammals. Dev Biol. 325, 200-200 (2009).
- Le Lièvre, C. S., Le Douarin, N. M. Mesenchymal derivatives of the neural crest: analysis of chimaeric quail and chick embryos. Journal of Embryology and Experimental Morphology. 34, 125-125 (1975).
- Bollag, R. J. Use of a repetitive mouse B2 element to identify transplanted mouse cells in mouse-chick chimeras. Exp Cell Res. 248, 75-75 (1999).
- Korn, M. J., Cramer, K. S. Windowing chicken eggs for developmental studies. J Vis Exp. , (2007).
- Eames, B. F., Schneider, R. A. Quail-duck chimeras reveal spatiotemporal plasticity in molecular and histogenic programs of cranial feather development. Development. 132, 1499-1499 (2005).
- Odent, S. Expression of the Sonic hedgehog (SHH ) gene during early human development and phenotypic expression of new mutations causing holoprosencephaly. Hum Mol Genet. 8, 1683-1683 (1999).
- Szabo-Rogers, H. L. Novel skeletogenic patterning roles for the olfactory pit. Development. 136, 219-219 (2009).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved