A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
הערכת נכסים איתות של Ectodermal epithelia במהלך פיתוח Craniofacial
In This Article
Summary
מאמר זה מתאר השתלת רקמות טכניקה שנועדה לבדוק את איתות ותכונות של דפוסים האאקטודרם משטח cephalic במהלך הפיתוח craniofacial.
Abstract
הנגישות של עוברי העופות סייע embryologists ניסיוני להבין את גורלם של תאים במהלך ההתפתחות ואת תפקידו של אינטראקציות רקמות המווסתים דפוסים המורפוגנזה של בעלי חוליות (לדוגמה: 1, 2, 3, 4). כאן, אנו ממחישים שיטה זו מנצלת את הנגישות כדי לבדוק את איתות ותכונות דפוסים של רקמות ectodermal במהלך התפתחות הפנים. בניסויים אלו, אנו יוצרים שליו, חומוס 5 או עכבר חומוס 6 מפלצות ידי השתלת האאקטודרם משטח cephalic המכסה את הלסת העליונה של שליו או בעכבר על אזור או באותו אזור או מחוץ לרחם של עוברים חומוס. השימוש שליו כמו רקמות התורם להשתלה לתוך אפרוחים פותחה על מנת לנצל את הסמן nucleolar נוכח שליו אך לא תאים חומוס, ובכך מאפשר לחוקרים להבחין מארח ורקמות תורם 7. בדומה לכך, מרכיב חוזרות נמצא גנום העכבר, והוא הביע בכל מקום בגוף, אשר מאפשר לנו להבחין המארח רקמות התורם אפרוח ועכבר מפלצות 8. השימוש האאקטודרם עכבר כמו רקמות התורם יהיה מאוד להרחיב את ההבנה שלנו של האינטראקציות הללו רקמות, כי זה יאפשר לנו לבחון את המאפיינים של איתות האאקטודרם שמקורם בעוברים מוטנטיים שונים.
Protocol
1. הכנת רקמות התורם
- הכן התקשורת לתרבות, לחדד סיכות זכוכית, לחדד מחטים טונגסטן.
- איסוף העובר מן המעטפת, להתרחץ קר כקרח PBS.
- בעזרת מזרק 10 מ"ל ו - 18 מחט מד להסיר 1.0 מ"ל של אלבומין מהקצה המחודד של מעטפת הביצית.
- עושים חור קטן בחלק העליון של הקליפה באמצעות נקודת מספריים, ולאחר מכן לחתוך פתח עגול לחשוף את העובר
- הסר את הראש אל המקום DMEM (נסיוב בחינם, בטמפרטורת החדר)
- לנתח תהליכים Frontonasal מעובר (או לאתר תורם אחרים, כגון תהליך לסתי או mandibular)
- תקציר ב 2.4U / mL dispase ב PBS על הקרח עבור 20mins
- כיסוי רקמות עם DMEM עם BSA 1% כדי לעצור העיכול
- שימוש במחט טונגסטן חידד את האאקטודרם mesenchyme נפרד, ו neuroectoderm
- חנות רקמת שתל ב BSA DMEM 1% על הקרח עד מארח מוכן להשתלה
2. הכנת מארח
- לחשוף את העובר
- בעזרת מזרק 10 מ"ל ו - 18 מחט מד להסיר 1.0 מ"ל של אלבומין מהקצה המחודד של מעטפת הביצית.
- עושים חור קטן בחלק העליון של הקליפה באמצעות נקודת מספריים. מניחים נייר דבק על החור, ולאחר מכן לחתוך פתח עגול לחשוף את העובר.
- שימוש 2 זוגות מלקחיים, לתפוס את amnion בעדינות דמעה לעשות חור.
- סובב את ראשו על ידי הנחת זוג מלקחיים על עין ימין ועל הפעלת לחץ. בעוד מחזיק את הראש יציב, להשתמש במחט טונגסטן להסיר את האאקטודרם לארח כדי להתאים את השתל.
- מעבירים את השתל לארח בעזרת פיפטה מזכוכית.
- מיקום השתל להחליף את האאקטודרם הוסרו. הכנס סיכה זכוכית בכל פינה של הרקמה מורכבים להצמיד את השתל במקום. כדי להפוך את סיכות זכוכית, למשוך צינור microcapillary לנקודה קנס על אש אלכוהול.
- מקום קלטת בחוזקה מעל החור ולהחזיר העובר אל האינקובטור לאורך זמן מתאים לניתוח.
- ראה גם: 9
3. נציג תוצאות:
כדי להעריך מפלצות, עוברים יש לאסוף ולעבד לניתוח ההתפלגות של המארח רקמות התורם. עבור זיהוי של תאים שליו, אימונוהיסטוכימיה באמצעות נוגדן QcPN (המתואר: 3) הוא מועסק, וכן עבור זיהוי של תאים בעכבר, ב הכלאה באתרו על סעיפים פרפין משמש 6. תאים התורם צריך להיות מוגבל האפיתל, ולא צריך להיות שום עדות של רקמות התורם mesenchymal (איור 1). נוכחות של תאים מתורם בודד mesenchyme מצביע על נוכחות של תאים עצביים לפסגה זיהום אשר לבלבל כל פרשנות מורפולוגיים בשל השפעתם של תאים אלה על היבטים רבים של פיתוח פנים (למשל, 10). לאחר משוכנע כי הטכניקה שתל ללא זיהום mesenchyme, מדדי התוצאה מורפולוגי נוסף או מולקולרית ניתן להשתמש כדי להעריך את מפלצות. לענייננו, זיהינו את נוכחותו של סחוסים ועצמות מחוץ לרחם כי תאמו כפילויות של הלסת העליונה שהיו המושרה על ידי רקמות להשתלה (איור 2), ואת השינויים המולקולריים ברקמות mesenchymal בתגובה האאקטודרם מורכבים (איור 3) 5,6.

באיור 1. הערכת chimerism (א) נגד QcPN מכתים משמש כדי לזהות תאים שלווים שלווים, חומוס מפלצות. אין ראיות של מכתים ב mesenchyme. (ב) הכלאה באתרו משמש כדי לזהות את הביטוי של תעתיקים B2 סינוס ב עכבר חומוס מפלצות. הביטוי מוגבל האאקטודרם המרכיבים את השתל.
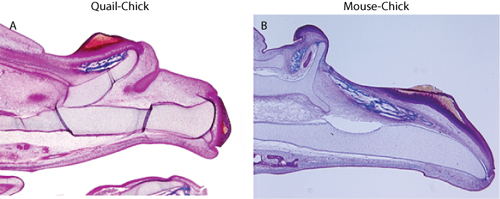
איור 2. מכתים Trichrome מראה שכפול של השלד הלסת העליונה הכימרה (א) שליו, חומוס, ו (ב) עכבר חומוס מפלצות.

איור 3. האאקטודרם regultes ביטוי גנים mesenchyme. (א) הביטוי רגיל Bmp7 ב mesenchyme של עובר אפרוח (רדיואקטיביים הכלאה באתרו עם אדום אות חיובי פסאודו בצבע ב Adobe Photoshop). (ב) הוא ביטוי Bmp7 המושרה mesenchyme הסמוך השתל (חץ) בעוברים chimeric.
Discussion
באמצעות שיטה זו השתלת אפשרה לנו לקבוע כי האאקטודרם מכיל מידע איתות המווסת את הקוטביות dorsoventral והסיומת proximodistal של הלסת העליונה. הדמיון של תוצאות בעת שימוש שליו או האאקטודרם העכבר השימור של אותות מולקולריים ברקמה זו בקרב מינים רבים 6,11 מציין כי מדובר במרכז איתות ש?...
Disclosures
Acknowledgements
עבודה זו מומנה על ידי R01-R01 DE018234 ו-DE019638.
Materials
| Name | Company | Catalog Number | Comments |
| 1x PBS | Tektronix, Inc. | TEKZR114 | |
| DMEM | University of California - San Francisco | CCFDA003 | |
| BSA | Sigma-Aldrich | A7906 | |
| Dispase | GIBCO, by Life Technologies | 17105-041 | |
| 35x10 mm Petri dish | Falcon BD | 1008 | |
| No. 5 Dumont forceps | Fine Science Tools | 11252-20 | |
| Scissors | Fine Science Tools | 14058-11 | |
| Spring Scissors | Fine Science Tools | 15010-11 | |
| Needle holder | Fine Science Tools | 26016-12 | |
| Tungsten Needle | Fine Science Tools | 26000 | |
| Microcapillary tube | Drummond Scientific | 3-000-225-G | |
| Pasteur Pipets | Fisher Scientific | 13-678-6B | |
| Spring scissors | Fine Science Tools | 15010-11 | |
| Blade holder | Fine Science Tools | 10052-11 | |
| Razor blade | Fine Science Tools | 10050-00 |
References
- Noden, D. M. The Role of the Neural Crest in Patterning of Avian Cranial Skeletal, Connective, and Muscle Tissues. Developmental Biology. 96, 144-144 (1983).
- Bronner-Fraser, M., Stern, C. Effects of Mesodermal Tissues on Avian Neural Crest Cell Migration. Developmental Biology. 143, 213-213 (1991).
- Schneider, R. A. Neural crest can form cartilages normally derived from mesoderm during development of the avian head skeleton. Developmental Biology. 208, 441-441 (1999).
- Couly, G. Interactions between Hox-negative cephalic neural crest cells and the foregut endoderm in patterning the facial skeleton in the vertebrate head. Development. 129, 1061-1061 (2002).
- Evans, D. J., Noden, D. M. Spatial relations between avian craniofacial neural crest and paraxial mesoderm cells. Dev Dyn. , (2006).
- Hu, D., Marcucio, R., Helms, J. A. A zone of frontonasal ectoderm regulates patterning and growth in the face. Development. 130, 1749-1749 (2003).
- Hu, D., Marcucio, R. S. Unique organization of the frontonasal ectodermal zone in birds and mammals. Dev Biol. 325, 200-200 (2009).
- Le Lièvre, C. S., Le Douarin, N. M. Mesenchymal derivatives of the neural crest: analysis of chimaeric quail and chick embryos. Journal of Embryology and Experimental Morphology. 34, 125-125 (1975).
- Bollag, R. J. Use of a repetitive mouse B2 element to identify transplanted mouse cells in mouse-chick chimeras. Exp Cell Res. 248, 75-75 (1999).
- Korn, M. J., Cramer, K. S. Windowing chicken eggs for developmental studies. J Vis Exp. , (2007).
- Eames, B. F., Schneider, R. A. Quail-duck chimeras reveal spatiotemporal plasticity in molecular and histogenic programs of cranial feather development. Development. 132, 1499-1499 (2005).
- Odent, S. Expression of the Sonic hedgehog (SHH ) gene during early human development and phenotypic expression of new mutations causing holoprosencephaly. Hum Mol Genet. 8, 1683-1683 (1999).
- Szabo-Rogers, H. L. Novel skeletogenic patterning roles for the olfactory pit. Development. 136, 219-219 (2009).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved