É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Avaliar Propriedades Sinalização de Ectodérmica Epitélio Durante o Desenvolvimento Craniofacial
Neste Artigo
Resumo
Este artigo descreve uma técnica de transplante de tecido que foi projetado para testar a sinalização e padronização das propriedades ectoderma de superfície cefálica durante o desenvolvimento craniofacial.
Resumo
A acessibilidade dos embriões aviária ajudou embriologistas experimental entender o destino das células durante o desenvolvimento eo papel das interações tecido que regulam padronização e morfogênese de vertebrados (eg, 1, 2, 3, 4). Aqui, nós ilustrar um método que explora essa acessibilidade para testar a sinalização e as propriedades padrões dos tecidos durante o desenvolvimento ectodérmico facial. Nesses experimentos, nós criamos codornas-chick 5 ou 6 do mouse grão-de-quimeras transplantando o ectoderma cefálica que cobre a mandíbula superior de codorniz ou o mouse para qualquer região do mesmo ou uma região ectópica de embriões de galinha. O uso de codorna como tecido do doador para o transplante em pintos foi desenvolvido para tirar vantagem de um marcador nucleolar presente em codornas mas não células de bico, permitindo assim que os pesquisadores a distinguir host e tecidos de doadores 7. Da mesma forma, um elemento repetitivo está presente no genoma do rato e é expressa ubiquitously, que nos permite distinguir host e tecidos de doadores em grão-de-rato quimeras 8. O uso de ectoderma mouse como tecido do doador será extremamente estender nossa compreensão dessas interações tecido, porque isso irá permitir-nos testar as propriedades de sinalização do ectoderma derivado de vários embriões mutantes.
Protocolo
1. Preparar o tecido do doador
- Prepare meios de cultura, sharpen pinos de vidro, afiar agulhas de tungstênio.
- Coletar embriões a partir de casca, lavar em PBS gelado.
- Usando uma seringa de 10 ml e uma agulha de calibre 18 remover 1,0 mL de albumina da extremidade pontiaguda da casca do ovo.
- Faça um pequeno furo na parte superior do escudo usando o ponto de tesouras, e depois cortar uma abertura circular para expor o embrião
- Retire a cabeça e coloque em DMEM (soro livre, temperatura ambiente)
- Dissecar processo frontonasal do embrião (ou o site de outros doadores, como processo maxilar ou mandibular)
- Digest em 2.4U / mL em PBS dispase em gelo por 20 minutos
- Cobrir tecidos com DMEM com BSA 1% para parar a digestão
- Use agulha de tungstênio afiadas para ectoderma separado, mesênquima, e neuroectoderma
- Loja de tecidos do enxerto em DMEM BSA 1% em gelo até anfitrião está pronto para transplante
2. Preparando o Host
- Expor o embrião
- Usando uma seringa de 10 ml e uma agulha de calibre 18 remover 1,0 mL de albumina da extremidade pontiaguda da casca do ovo.
- Faça um pequeno furo na parte superior do escudo usando o ponto de tesouras. Coloque um pedaço de fita adesiva sobre o furo, e depois cortar uma abertura circular para expor o embrião.
- Usando dois pares de fórceps, segure o âmnio e gentilmente lacrimogêneo para fazer um buraco.
- Gire a cabeça, colocando um par de fórceps no olho direito e aplicar pressão. Enquanto segura a cabeça firme, use uma agulha de tungstênio para remover o ectoderma host para acomodar o enxerto.
- Transferência do enxerto ao hospedeiro, utilizando uma pipeta de vidro.
- Posição do enxerto para substituir o ectoderma removido. Insira um alfinete de vidro em cada canto do tecido enxertado para fixar o enxerto no local. Para fazer com que os pinos de vidro, puxe um tubo microcapilar a um ponto fino sobre uma chama de álcool.
- Coloque fita firmemente em cima do buraco e voltar embrião para a incubadora para o comprimento de tempo adequado para análise.
- veja também: 9
3. Resultados representativos:
Para avaliar quimeras, os embriões devem ser coletadas e processadas para análise da distribuição de host e tecidos de doadores. Para a detecção de células de codorna, imunohistoquímica utilizando o anticorpo QcPN (descrito em: 3) é empregado, e para a detecção de células de camundongo, hibridização in situ em cortes de parafina é usada 6. Células do doador deve ser restrito ao epitélio, e não deve haver nenhuma evidência de tecidos de doadores mesenquimais (Figura 1). A presença de células do doador isolado no mesênquima indica a presença de células da crista neural contaminação que irá confundir qualquer interpretação morfológica devido à influência dessas células em muitos aspectos do desenvolvimento facial (por exemplo, 10). Uma vez convencidos de que a técnica de enxerto é livre de contaminação mesênquima, medidas de resultados ainda morfológicas ou moleculares podem ser utilizados para avaliar as quimeras. Para nossos propósitos, que detectou a presença de cartilagens e ossos ectópica que correspondeu a duplicação da mandíbula superior, que foram induzidos pelos tecidos transplantados (Figura 2), e alterações moleculares nos tecidos mesenquimais, em resposta ao ectoderma enxertado (Figura 3) 5,6.

Figura 1. Avaliação do quimerismo (A) coloração Anti-QcPN é usado para detectar células de codorna em codorna-chick quimeras. Não há nenhuma evidência de coloração no mesênquima. (B) A hibridização in situ é usado para detectar a expressão de transcritos SINE B2 em grão-de-rato quimeras. Expressão é restrita ao ectoderma que compõem o enxerto.
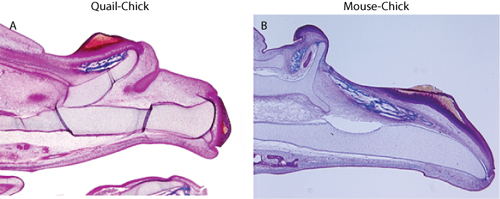
Figura 2. Coloração Tricrômico mostra a duplicação do esqueleto maxilar superior em (A) de codorna-chick quimera, e (B) do mouse grão-de-quimeras.

Figura 3. O ectoderma regultes expressão gênica no mesênquima. (A) expressão Bmp7 normal no mesênquima de um embrião de galinha (radioativo hibridização in situ com o positivo sinal vermelho pseudo-colorido no Adobe Photoshop). (B) expressão Bmp7 é induzida no mesênquima adjacente ao enxerto (Seta) em embriões quiméricos.
Discussão
Usando este método de transplante nos permitiu determinar que o ectoderma contém informações de sinalização que regula a polaridade dorsoventral e extensão proximodistal do maxilar superior. A similaridade de resultados quando se utiliza codorniz ou ectoderma mouse, ea conservação dos sinais moleculares neste tecido entre muitas espécies 6,11 indica que este é um centro altamente conservada entre os vertebrados de sinalização. Além disso, outros pesquisadores usaram técnicas semelhantes para te...
Divulgações
Agradecimentos
Este trabalho foi financiado pelo R01-R01-DE018234 e DE019638.
Materiais
| Name | Company | Catalog Number | Comments |
| 1x PBS | Tektronix, Inc. | TEKZR114 | |
| DMEM | University of California - San Francisco | CCFDA003 | |
| BSA | Sigma-Aldrich | A7906 | |
| Dispase | GIBCO, by Life Technologies | 17105-041 | |
| 35x10 mm Petri dish | Falcon BD | 1008 | |
| No. 5 Dumont forceps | Fine Science Tools | 11252-20 | |
| Scissors | Fine Science Tools | 14058-11 | |
| Spring Scissors | Fine Science Tools | 15010-11 | |
| Needle holder | Fine Science Tools | 26016-12 | |
| Tungsten Needle | Fine Science Tools | 26000 | |
| Microcapillary tube | Drummond Scientific | 3-000-225-G | |
| Pasteur Pipets | Fisher Scientific | 13-678-6B | |
| Spring scissors | Fine Science Tools | 15010-11 | |
| Blade holder | Fine Science Tools | 10052-11 | |
| Razor blade | Fine Science Tools | 10050-00 |
Referências
- Noden, D. M. The Role of the Neural Crest in Patterning of Avian Cranial Skeletal, Connective, and Muscle Tissues. Developmental Biology. 96, 144-144 (1983).
- Bronner-Fraser, M., Stern, C. Effects of Mesodermal Tissues on Avian Neural Crest Cell Migration. Developmental Biology. 143, 213-213 (1991).
- Schneider, R. A. Neural crest can form cartilages normally derived from mesoderm during development of the avian head skeleton. Developmental Biology. 208, 441-441 (1999).
- Couly, G. Interactions between Hox-negative cephalic neural crest cells and the foregut endoderm in patterning the facial skeleton in the vertebrate head. Development. 129, 1061-1061 (2002).
- Evans, D. J., Noden, D. M. Spatial relations between avian craniofacial neural crest and paraxial mesoderm cells. Dev Dyn. , (2006).
- Hu, D., Marcucio, R., Helms, J. A. A zone of frontonasal ectoderm regulates patterning and growth in the face. Development. 130, 1749-1749 (2003).
- Hu, D., Marcucio, R. S. Unique organization of the frontonasal ectodermal zone in birds and mammals. Dev Biol. 325, 200-200 (2009).
- Le Lièvre, C. S., Le Douarin, N. M. Mesenchymal derivatives of the neural crest: analysis of chimaeric quail and chick embryos. Journal of Embryology and Experimental Morphology. 34, 125-125 (1975).
- Bollag, R. J. Use of a repetitive mouse B2 element to identify transplanted mouse cells in mouse-chick chimeras. Exp Cell Res. 248, 75-75 (1999).
- Korn, M. J., Cramer, K. S. Windowing chicken eggs for developmental studies. J Vis Exp. , (2007).
- Eames, B. F., Schneider, R. A. Quail-duck chimeras reveal spatiotemporal plasticity in molecular and histogenic programs of cranial feather development. Development. 132, 1499-1499 (2005).
- Odent, S. Expression of the Sonic hedgehog (SHH ) gene during early human development and phenotypic expression of new mutations causing holoprosencephaly. Hum Mol Genet. 8, 1683-1683 (1999).
- Szabo-Rogers, H. L. Novel skeletogenic patterning roles for the olfactory pit. Development. 136, 219-219 (2009).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados