需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
利用笼子分子胶作为可活性标记的活细胞中的贵宾的时空控制核移位
摘要
该协议描述了使用笼子分子胶标签的光触发核移位的客人在活细胞中的位置。该方法对现场选择性核靶向药物的输送具有广阔的应用前景。
摘要
细胞核是作为亚细胞药物传递靶点的最重要的细胞器之一, 因为基因复制和表达的调节对治疗各种疾病是有效的。在这里, 我们展示了光触发核移位的客人使用笼分子胶 (笼胶 r) 标签, 其多个鸟苷离子 (gu+) 挂件是由一个阴离子光裂解组 (丁酸酯取代硝基甲氧基酯;文学学士nvoc)。贴有笼状胶 r 标记的客人通过内吞进入活细胞, 并留在内质体中。然而, 在光辐射下,笼胶-r 被转化为不带多个 gu+吊坠的未分类分子胶 (Uncaged-r), 便于客人的内部逃逸和随后的核移位。这种方法对于现场选择性核靶向药物输送很有希望, 因为标记的客人只有在光辐照时才能迁移到细胞质中, 然后是细胞核。笼中胶粘剂 r 标签可以提供大分子客人, 如量子点 (qd) 以及小分子客人。笼中胶-r 标签不仅可以用紫外光照射, 还可以用双光子近红外 (nir) 光进行解锁, 从而深入组织。
引言
携带遗传信息的细胞核是作为亚细胞药物传递靶点最重要的细胞器之一, 因为基因复制和表达的调节对治疗包括癌症和基因在内的各种疾病是有效的疾病1,2,3。对于核输送药物, 核定位信号 (nls)4、5、6 等肽标记的共轭已被广泛研究。然而, 为了减少不想要的副作用, 对核转移进行时空控制是必要的。
以前, 利用笼子 nls7、8、9实现了蛋白质在细胞核中的光触发移位。nls 通过与细胞质转运蛋白结合而迁移到细胞核中.在所报道的方法中, 采用遗传密码扩展技术 9, 通过微注射8将带有冠状 nls 的客人蛋白直接整合到细胞质中, 或在目标细胞中表达。因此, 一种既能实现细胞吸收又能实现光致核转移的方法, 有利于实际应用。
在此, 我们描述了光触发核移位的客人在活细胞使用树突状胶-r,图 1)标签活细胞。水溶性分子胶10,11,12,13, 14, 15,16, 17,18,19,20,21,22,23轴承多个 gu+吊坠以前已经开发, 其中紧密粘附蛋白质11,12,13,14,15, 16,17,核酸18,19,20, 磷脂膜21, 和粘土纳米板22,23通过在目标上的 gu+挂件和氧阴离子基团之间形成多个盐桥。笼胶 r的 gu +吊坠受阴离子光裂解组丁酸取代的硝基氮氧基 (banvoc) 的保护。贴有笼状胶 r 标记的客人通过内吞进入活细胞, 并留在内染色体中 (图 2)。在光照射下, c形胶-r 的banvoc 基团分离出一种不带多个 gu+吊坠的未分类分子胶 (解链胶 r), 从而促进了标记客人的迁移进入细胞质, 然后是细胞核 (图 2)。通过暴露在 uv 或双光子近红外 (nir) 光下, 可以在不产生严重光毒性的情况下, 取消笼子胶-r 标记。我们用量子点 (qd) 和荧光染料 (硝基苯并二恶唑), 用胶格 r 标记演示了高分子嘉宾和小分子嘉宾的时空控制核输送;(nbd), 分别作为例子。
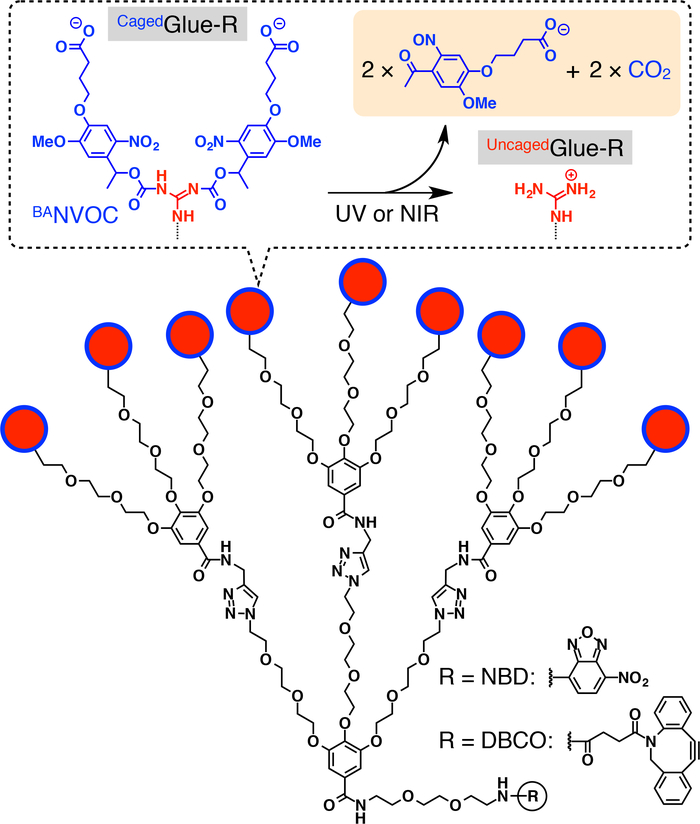
图 1:笼胶-r 的原理图结构.环胶 r 的9个鸟离子 (gu+) 吊坠受丁酸取代的硝基硝基氧氧氧烷基 (banvoc) 保护。banvoc 基团通过紫外或双光子近红外光的照射进行切割。用硝基苯二唑 (nbd) 或二苯环磷酰胺 (dbco) 对环胶-r 的焦核进行了功能化处理。在引用20的允许下重新打印。请点击这里查看此图的较大版本.
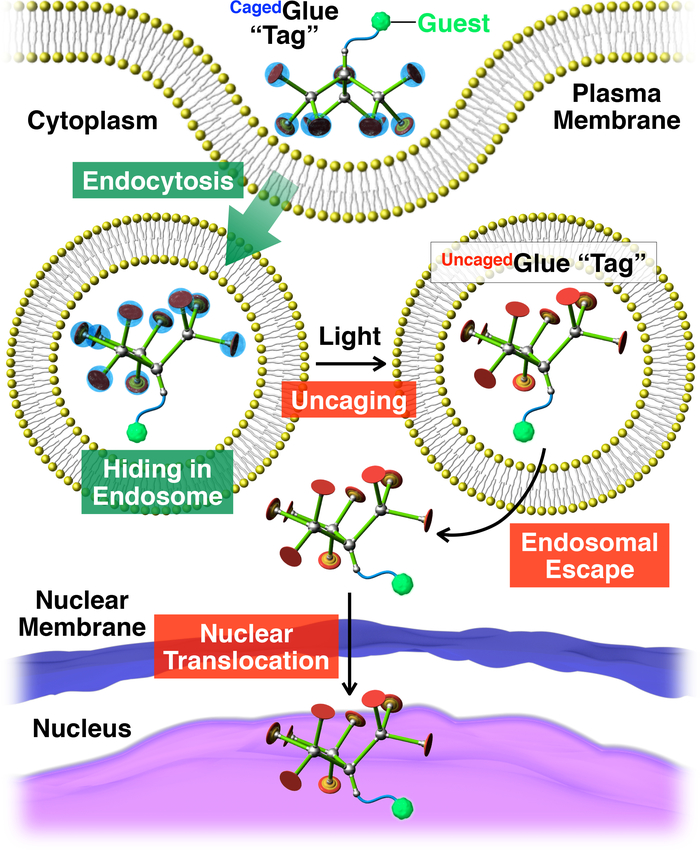
图 2: 与带笼子胶粘剂 r 标记共轭的来宾的光触发核移位示意图.通过内吞将客魔/笼胶-r 共轭带入活细胞。在光照射下,笼子胶质 r 标签被取消, 以产生一个取消胶-r 标签, 这可以促进标记的客人的内部染色体逃逸。随后, 贴有标记的客人迁移到细胞核中。在引用20的允许下重新打印。请点击这里查看此图的较大版本.
研究方案
1. 使用笼子胶粘剂 r 标签的客人的准备
- 准备笼子里的 glu-nbd 解决方案。
- 按照前面描述的过程合成笼子 gnbd (图 1) 20。
- 制备干二甲基亚硫酸盐 (dmso) 中的环胶-nbd (10 mm) 的库存溶液。
注意: 将库存解决方案存储在黑暗中。该溶液可在使用时用水缓冲液或细胞培养介质稀释。
- 准备笼式胶-qd 解决方案。
- 按照前面描述的程序合成笼胶-二苯并呋喃 (cypye-dbco) (图 1).
- 在干燥的 dmso 中制备了笼式 gbco (10mm) 的库存解决方案。
- 为制备笼式胶粘剂 qd, 首先制备氮化物功能化 qd (azide-functionalized;图 3)。将偶氮素-peg4-nhs 酯的二甲基甲酰 (dmf, 125μm) 溶液 (图 3) 添加到含有氨基功能化 peg (ai-qd) 的量子点 (qd) 的 dmf (500 nm) 溶液的400μl 中;图 3)。在室温下搅拌混合物1小时。
- 利用 3, 500 分子量截止 (mwco) 的再生纤维素膜, 将生成的溶液透析24小时对800毫升的 dmf。
- 用 dmf 将笼式 gbco 的库存溶液稀释至50μm。在透析后溶液中加入200μl 溶液 (图 3), 并在室温下搅拌混合物3小时。
- 利用再生纤维素膜 (25, 000 mwco) 将生成的溶液透析 24小时, 对800毫升的 dmf 进行分析。
- 使用 dmf 将生成的解决方案稀释到 200 nm。
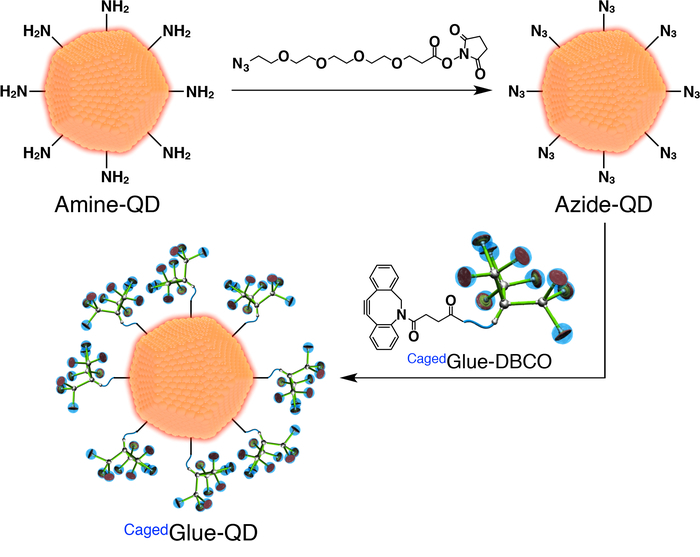
图 3:笼式胶-qd 制备示意图.请点击这里查看此图的较大版本.
2. 为显微观察制备 hep3b 细胞样本
- 在 5% co 2 以下37°c 维持在鹰的最低必要培养基 (emem) 中含有10% 胎儿牛血清 (fbs) 的人肝癌 Hep3B 细胞.
- 在实验前一天给细胞播种。种子 5.0x10 3 hep3b 细胞每井在 emem (10% fbs, 200μl), 并在37°c 孵育细胞样品在 5% co2 下 24小时.
- 取出培养基, 用100μl 的杜尔贝科磷酸盐缓冲盐 (d-pbs) 冲洗细胞样品两次。
3. 紫外光触发的小分子宾客核转移观测
- 向细胞样品 (在步骤2.3 中制备) 提供200μl 的无 fbs emem, 其中含有cim葡萄-nbd (10μm), 并在25°c 下孵育产生的细胞样品在 5% co2 下, 为3小时。
注意: 在无 fbs emem 中培养细胞样本超过4小时会导致严重的细胞损伤。 - 取出培养基, 用100μl 的 d-pbs 冲洗细胞样品两次。
- 为显示内窥镜, 向细胞样本提供含有红色荧光染料 (例如, lysotracker red, 100 nm) 的 200μl emem (10%fbs), 并在 5% co 2 下孵育所产生的细胞样本 20分钟.用100μl 的 d-pbs 冲洗细胞样品两次。为电池样品提供200μl 的 emem (10% fbs)。
- 对于c蒂gog-nbd 的核转位, 使用配备365纳米带通滤波器的100-w 氙气光源,通过光纤将电池样品暴露在紫外光下2分钟。对于不受紫外线照射的参考细胞样本, 请将细胞样本保持在黑暗中。
注意: 玻璃基板的盖子可以取下, 以便有效地进行紫外线照射。长时间暴露在紫外线下可能会导致细胞对细胞的毒性。 - 为了显示细胞核, 在培养基中加入 1μl hoechst 33342 (1mg/ml), 并在 5% co2 下37°c 孵育所产生的细胞样本 10分钟.
- 将细胞样本置于共聚焦激光扫描显微镜下, 并在 488 nm (obs = 550-530 nm)、543 nm (ob = 565-620 nm) 和 710 nm (双光子) 的激发下记录显微图像; bbd、红色荧光染料和 hoechst 33342 分别为 390-465 nm)。
4. 双光子近红外光触发的小分子宾客核转移观测
- 向细胞样品 (在步骤2.3 中制备) 提供200μl 的无 fbs emem, 其中含有cim葡萄-nbd (10μm), 并在25°c 下孵育产生的细胞样品在 5% co2 下, 为3小时。
- 取出培养基, 用100μl 的 d-pbs 冲洗细胞样品两次。为电池样品提供200μl 的 emem (10% fbs)。
- 对细胞样本进行共聚焦激光扫描显微镜检查, 并在 488 nm (obs = 500-530 nm) 时记录显微镜。
- 对于圣极 glu-nbd 的核移位, 用双光子激发激光 (710 nm) 照射该区域, 作为光源安装在显微镜下, 持续 2分钟 (30 sx4)。观察步骤4.3 中所述的移位。
5. 紫外光触发的大分子宾客核转移观测
- 向细胞样品 (在步骤2.3 中制备) 提供含有 cim g有害 gqd (10nm ) 的200μl 无 fbs emem, 并在25°c 下将生成的细胞样品孵育3小时.
- 取出培养基, 用100μl 的 d-pbs 冲洗细胞样品两次。为电池样品提供200μl 的 emem (10% fbs)。
- 对于c蒂胶粘剂 qd 的核转位, 使用配备365纳米带通滤波器的 100 w 氙气光源,通过光纤将电池样品暴露在紫外光下2分钟。对于不受紫外线照射的参考细胞样本, 请将细胞样本保持在黑暗中。
- 为了显示细胞核, 在培养基中加入 1μl hoechst 33342 (1mg/ml), 并在 5% co2 下37°c 孵育所产生的细胞样本 10分钟.
- 对细胞样本进行共聚焦激光扫描显微镜检查, 并分别记录在 405 nm (obs = 430-520 nm) 和 405 nm (obs = 625-680 nm) 下的显微镜下, 分别用于 hoechst 33342 和 qds。
6. 细胞活力检测
- 在 5% co 2 以下37°c 维持人肝癌肝细胞 Hep3B 细胞在 emem (10% fbs) 中的作用。
- 在实验前一天给细胞播种。种子 5.0x10 96 孔培养板每孔 3 hep3b 细胞在 emem (10% fbs, 200μl) 中, 在37°c 下孵育细胞样本在 5% co2 下 24小时.
- 取出培养基, 用100μl 的 d-pbs 冲洗细胞样品两次。
- 为细胞样品提供200μl 的不含 cim 葡萄-nbd (0.1-100μm) 的无 fbs emem, 并在37°c 下孵育所产生的细胞样品在 5% co2 下, 为 3小时.
- 使用配备 365 nm 带通滤波器的 100 w 氙气光源,通过光纤将电池样品暴露在紫外光中2分钟。对于不受紫外线照射的类似细胞样本, 请将细胞样本保持在黑暗中。
- 在培养基中加入10μl 细胞计数 kit-8 试剂 (10μl), 并在37°c 下孵育所产生的细胞样本在 5% co 2 以下 2小时。
- 使用微板读取器对细胞样品进行吸收光谱 ( = 450 nm)。
结果
在光照射前, 用笼状葡萄-nbd 培养的 hep3b 细胞从其内部显示出点状荧光发射 (ext = 488 nm;图 4 a 和4A, 绿色)。在543纳米的激发下, 红荧光染料 (图 4b和4B, 红色) 得到了类似的显微图像, 表明笼子葡萄-nbd 在内质体中局部化。因此, 在细胞核外观察到可分配给cagedglar-nbd (
讨论
以前使用 cagednls 7、8、9实现了对光触发蛋白质转移到细胞核中的研究。如前所述, 这些方法需要额外的技术, 以纳入 nls 标记的蛋白质到细胞质。相反, 我们的 c蒂胶粘剂-r 标签不仅可以实现光致核的移位, 还可以让客人的手机吸收。笼胶- r标记的这一特性有利于在体内应用。
笼子...
披露声明
作者没有什么可透露的。
致谢
我们感谢东京大学纳米生物集成中心。这项工作得到了青年科学家补助金 (b) (26810046) 至 k. o. 的支持, 并得到了对 t. a. r. m. 的特别促进研究补助金 (25000005) 的部分支持, 感谢日本促进科学协会研究研究研究研究研究研究研究研究研究研究研究金 (jps)。), 为青年科学家和主要研究生院 (gplli) 计划。
材料
| Name | Company | Catalog Number | Comments |
| Azide-PEG4-NHS ester | Click Chemistry Tools | AZ103 | |
| Q-dot 655 ITK | Invitrogen | Q21521MP | |
| Regenerated cellulose membrane (MWCO 3,500) | NIPPON Genetics | TOR-3K | |
| Regenerated cellulose membrane (MWCO 25,000) | Harvard Apparatus | 7425-RC25K | |
| Hep3B Cells | ATCC | HB-8064 | |
| 8-chambered glass substrate | Nunc | 155411JP | |
| 96-well culture plate | Nunc | 167008 | |
| Eagle's minimal essential medium (EMEM) | Thermo Fisher Scientific | 10370-021 | |
| Fetal bovine serum (FBS) | GE Healthcare | SH30406.02 | |
| Dulbecco's phosphate buffer saline (D-PBS) | Wako Pure Chemical Industries | 045-29795 | |
| LysoTracker Red | Lonza Walkersville | PA-3015 | |
| Hoechst 33342 | Dojindo | H342 | |
| Cell Counting Kit-8 | Dojindo | CK04 | |
| Confocal laser scanning microscope | Carl-Zeiss | LSM 510 | Equipped with two-photon excitation laser (Mai Tai laser, Spectra-Physics) |
| Confocal laser scanning microscope | Leica | TCS SP8 | |
| Xenon light source | Asahi Spectra | LAX-102 | |
| Microplate reader | Molecular Devices | SpectraMax Paradigm |
参考文献
- Miller, A. D. Human gene therapy comes of age. Nature. 357, 455-460 (1992).
- Roth, J. A., Cristiano, R. J. Gene Therapy for Cancer: What Have We Done and Where Are We Going. Journal of the National Cancer Institute. 89, 21-39 (1997).
- Verma, I. M., Weitzman, M. D. GENE THERAPY: Twenty-First Century Medicine. Annual Review of Biochemistry. 74, 711-738 (2005).
- Ragin, A. D., Morgan, R. A., Chmielewski, J. Cellular Import Mediated by Nuclear Localization Signal Peptide Sequences. Chemistry & Biology. 9, 943-948 (2002).
- Martin, R. M., et al. Principles of protein targeting to the nucleolus. Nucleus. 6, 314-325 (2015).
- Sun, Y., et al. Factors influencing the nuclear targeting ability of nuclear localization signals. Journal of Drug Targeting. 24, 927-933 (2016).
- Ventura, B. D., Kuhlman, B. Go in! Go out! Inducible control of nuclear localization. Current Opinion in Chemical Biology. 34, 62-71 (2016).
- Watai, Y., Sase, I., Shiono, H., Nakano, Y. Regulation of nuclear import by light-induced activation of caged nuclear localization signal in living cells. FEBS Letters. 488, 39-44 (2001).
- Engelke, H., Chou, C., Uprety, R., Jess, P., Deiters, A. Control of Protein Function through Optochemical Translocation. ACS Synthetic Biology. 3, 731-736 (2014).
- Mogaki, R., Hashim, P. K., Okuro, K., Aida, T. Guanidinium-based "molecular glues" for modulation of biomolecular functions. Chemical Society Reviews. 46, 6480-6491 (2017).
- Okuro, K., Kinbara, K., Tsumoto, K., Ishii, N., Aida, T. Molecular Glues Carrying Multiple Guanidinium Ion Pendants via an Oligoether Spacer: Stabilization of Microtubules against Depolymerization. Journal of the American Chemical Society. 131, 1626-1627 (2009).
- Okuro, K., et al. Adhesion Effects of a Guanidinium Ion Appended Dendritic "Molecular Glue" on the ATP-Driven Sliding Motion of Actomyosin. Angewandte Chemie, International Edition. 48, 3030-3033 (2010).
- Uchida, N., et al. Photoclickable Dendritic Molecular Glue: Noncovalent-to-Covalent Photochemical Transformation of Protein Hybrids. Journal of the American Chemical Society. 135, 4684-4687 (2013).
- Garzoni, M., Okuro, K., Ishii, N., Aida, T., Pavan, G. M. Structure and Shape Effects of Molecular Glue on Supramolecular Tubulin Assemblies. ACS Nano. 8, 904-914 (2014).
- Mogaki, R., Okuro, K., Aida, T. Molecular glues for manipulating enzymes: trypsin inhibition by benzamidine-conjugated molecular glues. Chemical Science. 6, 2802-2805 (2015).
- Okuro, K., Sasaki, M., Aida, T. Boronic Acid-Appended Molecular Glues for ATP-Responsive Activity Modulation of Enzymes. Journal of the American Chemical Society. 138, 5527-5530 (2016).
- Mogaki, R., Okuro, K., Aida, T. Adhesive Photoswitch: Selective Photochemical Modulation of Enzymes under Physiological Conditions. Journal of the American Chemical Society. 139, 10072-10078 (2017).
- Hashim, P. K., Okuro, K., Sasaki, S., Hoashi, Y., Aida, T. Reductively Cleavable Nanocaplets for siRNA Delivery by Template-Assisted Oxidative Polymerization. Journal of the American Chemical Society. 137, 15608-15611 (2015).
- Hatano, J., Okuro, K., Aida, T. Photoinduced Bioorthogonal 1,3-Dipolar Poly-cycloaddition Promoted by Oxyanionic Substrates for Spatiotemporal Operation of Molecular Glues. Angewandte Chemie, International Edition. 55, 193-198 (2016).
- Arisaka, A., Mogaki, R., Okuro, K., Aida, T. Caged Molecular Glues as Photoactivatable Tags for Nuclear Translocation of Guests in Living Cells. Journal of the American Chemical Society. 140, 2687-2692 (2018).
- Suzuki, Y., Okuro, K., Takeuchi, T., Aida, T. Friction-Mediated Dynamic Disordering of Phospholipid Membrane by Mechanical Motions of Photoresponsive Molecular Glue: Activation of Ion Permeation. Journal of the American Chemical Society. 134, 15273-15276 (2012).
- Wang, Q., et al. High-water-content mouldable hydrogels by mixing clay and a dendritic molecular binder. Nature. 463, 339-343 (2010).
- Tamesue, S., et al. Linear versus Dendritic Molecular Binders for Hydrogel Network Formation with Clay Nanosheets: Studies with ABA Triblock Copolyethers Carrying Guanidinium Ion Pendants. Journal of the American Chemical Society. 135, 15650-15655 (2013).
- Mohr, D., Frey, S., Fischer, T., Güttler, T., Görlich, D. Characterisation of the passive permeability barrier of nuclear pore complexes. EMBO Journal. 28, 2541-2553 (2009).
- Best, M. D. Click Chemistry and Bioorthogonal Reactions: Unprecedented Selectivity in the Labeling of Biological Molecules. Biochemistry. 48, 6571-6584 (2009).
- Klán, P., et al. Photoremovable Protecting Groups in Chemistry and Biology: Reaction Mechanisms and Efficacy. Chemical Reviews. 113, 119-191 (2013).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。