È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Spatiotemporally controllato traslocazione nucleare di ospiti in cellule viventi utilizzando colle molecolare in gabbia come tag fuse
In questo articolo
Riepilogo
Questo protocollo descrive la traslocazione nucleare attivato luce di ospiti in cellule viventi utilizzando tag colla molecolare in gabbia. Questo metodo è promettente per il nucleare-targeting selettivo sito drug delivery.
Abstract
Il nucleo cellulare è uno degli organelli più importanti come obiettivo subcellulare della droga consegna, dalla modulazione della replica di gene ed espressione è efficace per il trattamento di varie malattie. Qui, dimostriamo che la traslocazione nucleare attivato luce degli ospiti usando in gabbia Tag colla molecolare (Cagedcolla-R), cui più pendenti di guanidinium ione (Gu+) sono protetti da un gruppo di photocleavable anionici (butirrato-sostituiti nitroveratryloxycarbonyl; BA NVOC). Gli ospiti con etichettati Cagedcolla-R sono presi in vita le cellule tramite endocitosi e rimangono in endosomi. Tuttavia, al momento photoirradiation, Cagedcolla-R è convertito in uncaged molecolare colla (Uncagedcolla-R) che trasportano più pendenti Gu+ , che facilita la fuga endosomal e conseguente traslocazione nucleare degli ospiti. Questo metodo è promettente per il nucleare-targeting selettivo sito drug delivery, poiché gli ospiti con tag possono migrare nel citoplasma seguito da nucleo cellulare solo quando photoirradiated. In gabbia Tag: colla-R in grado di fornire macromolecolari ospiti come punti quantici (QD) così come gli ospiti della piccolo-molecola. In gabbia Tag: colla-R può essere uncaged con non solo luce UV, ma anche luce di due fotoni vicino infrarosso (NIR), che possa penetrare in profondità nel tessuto.
Introduzione
Il nucleo delle cellule, che porta le informazioni genetiche, è uno degli organelli più importanti come obiettivo subcellulare della droga consegna, dalla modulazione della replica di gene ed espressione è efficace per il trattamento di varie malattie tra cui il cancro e genetica disordini di1,2,3. Per consegna nucleare delle droghe, coniugazione di peptide tag come localizzazione nucleare (NLS) di segnali4,5,6 è stato ampiamente studiato. Tuttavia, al fine di ridurre gli effetti collaterali indesiderati, controllo spazio-temporale della traslocazione nucleare è necessario.
In precedenza, ha attivato luce traslocazione delle proteine nel nucleo delle cellule è stato raggiunto utilizzando in gabbia NLS7,8,9. NLS migra nel nucleo cellulare legandosi a proteine di trasporto citoplasmico6. Nei metodi segnalati, proteine ospite NLS in gabbia del cuscinetto sono direttamente incorporati nel citoplasma di microiniezione8 o espresso nelle celle di destinazione utilizzando un codice genetico espansione tecnica9. Pertanto, un metodo che si può raggiungere sia l'assorbimento cellulare e traslocazione nucleare foto-indotta è vantaggioso per applicazioni pratiche.
Qui, descriviamo la traslocazione nucleare attivato luce di ospiti in cellule viventi utilizzando tag dendritiche colla molecolare in gabbia (Cagedcolla-R, Figura 1). Solubile in acqua molecolare Colle10,11,12,13,14,15,16,17,18 , 19 , 20 , 21 , 22 , 23 cuscinetto più pendenti Gu+ sono stati sviluppati in precedenza, cui aderiscono strettamente al proteine11,12,13,14,15, 16,17, acidi nucleici18,19,20, fosfolipide membrane21e argilla nanosheets22,23 attraverso la Formazione di ponti più sale tra loro pendenti Gu+ e oxyanionic gruppi sugli obiettivi. I pendenti di Gu+ di Cagedcolla-R sono protetti da un gruppo di photocleavable anionici, nitroveratryloxycarbonyl butirrato-sostituiti (BANVOC). Gli ospiti con etichettati Cagedcolla-R sono presi in vita le cellule tramite endocitosi e soggiorno in endosomi (Figura 2). Al momento photoirradiation, i gruppi NVOC BAdi Cagedcolla-R sono staccati per produrre una uncaged molecolare colla (Uncagedcolla-R) che trasportano più pendenti Gu+ , che poi facilita la migrazione dell'ospite con tag nel citoplasma seguito dal nucleo della cellula (Figura 2). Il tag di colla-R Cagedpuò essere uncaged da esposizione a UV o due-fotone vicino infrarosso (NIR) luce senza serio fototossicità. Dimostriamo la consegna nucleare spatiotemporally controllata di ospiti macromolecolari, nonché ospiti della piccolo-molecola con CagedTag colla-R, utilizzando punti quantici (QD) ed un colorante fluorescente (nitrobenzoxadiazole; NBD), rispettivamente, come esempi.
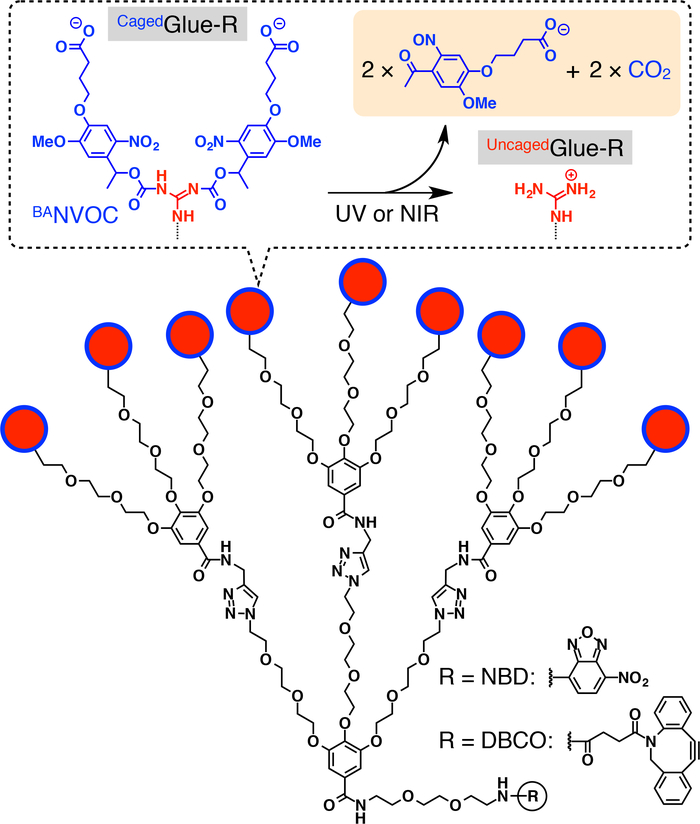
Figura 1: Strutture schematiche di Cagedcolla-R. I pendenti di ioni (Gu+) guanidinium 9 Cagedcolla-r sono protetti da un gruppo di nitroveratryloxycarbonyl butirrato-sostituiti (BANVOC). I gruppi NVOC BAsono spaccati da irradiazione con UV o luce di due fotoni NIR. Il nucleo focale della colla Caged-R è funzionalizzato con nitrobenzoxadiazole (NBD) o dibenzocylooctyne (DBCO). Ristampato con il permesso di riferimento20. Clicca qui per visualizzare una versione più grande di questa figura.
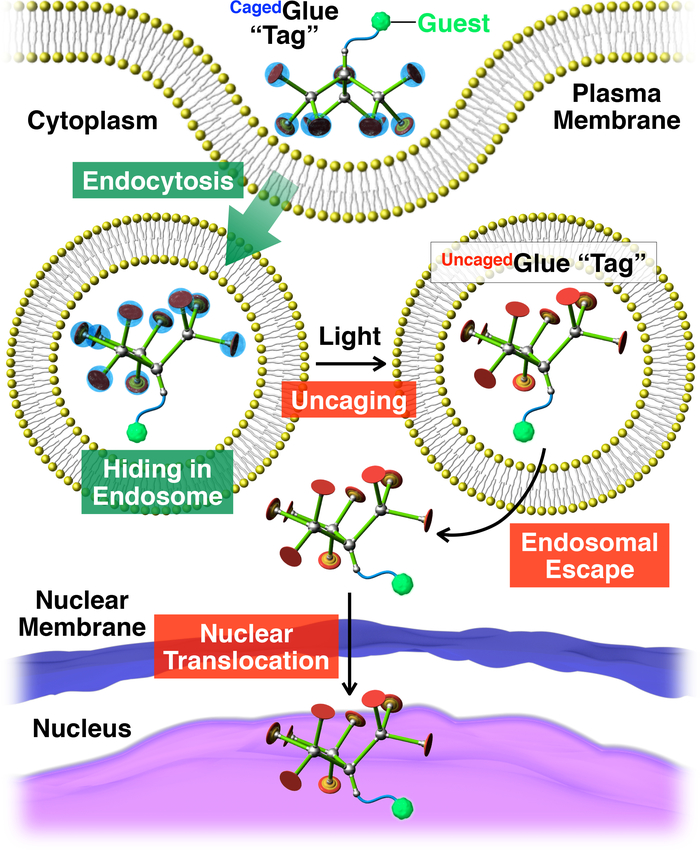
Figura 2: Illustrazione schematica della traslocazione nucleare attivato luce degli ospiti coniugato con un tag di Cagedcolla-R. L'ospite / coniugato colla-RCagedè ripreso in vita le cellule tramite endocitosi. Su photoirradiation, il tag di colla-R Cagedè uncaged cedere un tag colla-R Uncaged, che può facilitare la fuga endosomal dell'ospite con tag. Successivamente, l'ospite con tag migra nel nucleo cellulare. Ristampato con il permesso di riferimento20. Clicca qui per visualizzare una versione più grande di questa figura.
Protocollo
1. preparazione degli ospiti con gabbiacolla-R Tag
- Preparare la soluzione di colla-NBD Caged.
- Sintetizzare Cagedcolla-NBD (Figura 1) seguendo le procedure precedentemente descritte20.
- Preparare una soluzione stock di Cagedcolla-NBD (10 mM) a secco dimetilsolfossido (DMSO).
Nota: Conservare la soluzione magazzino buio. La soluzione può essere diluita con amplificatori acquosi o terreni di coltura delle cellule al momento di utilizzo.
- Preparare la soluzione di colla-QD Caged.
- Sintetizzare Cagedcolla-dibenzocylooctyne (Cagedcolla-DBCO) (Figura 1) seguendo le procedure precedentemente descritte20.
- Preparare una soluzione stock di Cagedcolla-DBCO (10 mM) in DMSO asciutto.
- Per la preparazione di colla Caged-QD, innanzitutto preparare azide-funzionalizzate QD (Azide-QD; Figura 3). Aggiungere 100 µ l di una soluzione di dimetil formammide (DMF, 125 µM) di azide-PEG4-NHS estere (Figura 3) a 400 µ l di un DMF (500 nM) soluzione di punti quantici (QD) rivestito con ammina-funzionalizzate PEG (ammina-QD; Figura 3). Mescolare il composto per 1 h a temperatura ambiente.
- Dializzare la soluzione risultante per 24 h contro 800 mL di DMF utilizzando una membrana di cellulosa rigenerata con 3.500 peso molecolare cut-off (MWCO).
- Diluire la soluzione madre di Cagedcolla-DBCO a 50 µM con DMF. Aggiungere 200 µ l della soluzione alla soluzione post-dialisi (Figura 3) e mescolare il composto per 3 ore a temperatura ambiente.
- Dializzare la soluzione risultante per 24 h contro 800 mL di DMF utilizzando una membrana di cellulosa rigenerata (25.000 MWCO).
- Diluire la soluzione risultante a 200 nM con DMF.
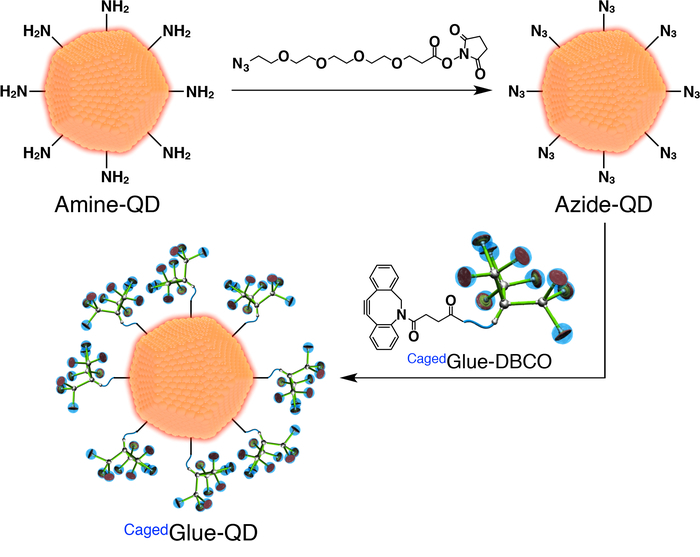
Figura 3: illustrazione schematica della preparazione della colla Caged-QD. Clicca qui per visualizzare una versione più grande di questa figura.
2. preparazione del campione di cellule di Hep3B per osservazioni al microscopio
- Mantenere le cellule di Hep3B il carcinoma epatocellulare umano in medium essenziale minimo di Eagle (EMEM) contenente 10% siero bovino fetale (FBS) a 37 ° C inferiore al 5% di CO2.
- Le cellule del seme il giorno prima dell'esperimento. Seme 5.0 × 103 Hep3B cellule per pozzetto di un substrato di vetro 8-camerato in EMEM (10% FBS, 200 µ l) e incubare il campione di cellule a 37 ° C inferiore al 5% di CO2 per 24 h.
- Rimuovere il terreno di coltura e sciacquare il campione di cellule con 100 µ l di soluzione salina tampone di fosfato di Dulbecco (D-PBS) due volte.
3. osservazione della traslocazione nucleare di piccole molecole ospiti attivati dalla luce UV
- Fornire il campione di cellule (preparato in passaggio 2.3) con 200 µ l di FBS-libero EMEM contenente Cagedcolla-NBD (10 µM) ed incubare il campione di cellule risultante a 37 ° C inferiore al 5% di CO2 per 3 h.
Nota: Incubazione del campione delle cellule in EMEM FBS-libero per più di 4 h provoca danni gravi delle cellule. - Rimuovere il terreno di coltura e sciacquare il campione di cellule con 100 µ l di D-PBS due volte.
- Per la visualizzazione degli endosomi, fornire il campione di cellule con 200 µ l di EMEM (10% FBS) contenente un colorante rosso fluorescente (ad es., LysoTracker rosso, 100 nM) e incubare il campione di cellule risultante a 37 ° C inferiore al 5% di CO2 per 20 minuti rimuovere la cultura medio e sciacquare il campione di cellule con 100 µ l di D-PBS due volte. Fornire il campione di cellule con 200 µ l di EMEM (10% FBS).
- Per traslocazione nucleare di Cagedcolla-NBD, esporre il campione di cellule ai raggi UV per 2 min tramite una fibra ottica utilizzando una sorgente di luce allo xeno 100-W dotata di filtro passa-banda 365 nm. Per un esempio di cella di riferimento senza esposizione ai raggi UV, conservare il campione di cellule buio.
Nota: Il coperchio dei substrati di vetro può essere tolto per efficiente esposizione ai raggi UV. Lunga esposizione ai raggi UV può causare citotossicità per le cellule. - Per la visualizzazione dei nuclei, aggiungere 1 µ l di Hoechst 33342 (1 mg/mL) al terreno di coltura e incubare il campione di cellule risultante a 37 ° C inferiore al 5% di CO2 per 10 min.
- Sottoporre il campione di cellule per microscopia a scansione laser confocale e registrare le micrografie eccitazione a 488 nm (λobs = 500-530 nm), 543 nm (λobs = 565-620 nm) e 710 nm (due-fotone; Λ OBS = 390-465 nm) per NBD, colorante rosso fluorescente e Hoechst 33342, rispettivamente.
4. osservazione della traslocazione nucleare di piccole molecole ospiti attivati dalla luce di due fotoni NIR
- Fornire il campione di cellule (preparato in passaggio 2.3) con 200 µ l di FBS-libero EMEM contenente Cagedcolla-NBD (10 µM) ed incubare il campione di cellule risultante a 37 ° C inferiore al 5% di CO2 per 3 h.
- Rimuovere il terreno di coltura e sciacquare il campione di cellule con 100 µ l di D-PBS due volte. Fornire il campione di cellule con 200 µ l di EMEM (10% FBS).
- Sottoporre il campione di cellule per microscopia a scansione laser confocale e registrare le micrografie eccitazione a 488 nm (λobs = 500-530 nm).
- Per traslocazione nucleare di Cagedcolla-NBD, irradiare la regione inclusa la cella di interesse con un laser di eccitazione del due-fotone (710 nm), installato come fonte luminosa del microscopio, per 2 min (30 s × 4). Osservare la traslocazione come descritto al punto 4.3.
5. osservazione della traslocazione nucleare di ospiti macromolecolari attivati dalla luce UV
- Fornire il campione di cellule (preparato in passaggio 2.3) con 200 µ l di FBS-libero EMEM contenente Cagedcolla-QD (10 nM) e incubare il campione di cellule risultante a 37 ° C inferiore al 5% di CO2 per 3 h.
- Rimuovere il terreno di coltura e sciacquare il campione di cellule con 100 µ l di D-PBS due volte. Fornire il campione di cellule con 200 µ l di EMEM (10% FBS).
- Per traslocazione nucleare di Cagedcolla-QD, esporre il campione di cellule ai raggi UV per 2 min tramite una fibra ottica utilizzando una sorgente di luce allo xeno 100-W dotata di filtro passa-banda 365 nm. Per un esempio di cella di riferimento senza esposizione ai raggi UV, conservare il campione di cellule buio.
- Per la visualizzazione dei nuclei, aggiungere 1 µ l di Hoechst 33342 (1 mg/mL) al terreno di coltura e incubare il campione di cellule risultante a 37 ° C inferiore al 5% di CO2 per 10 min.
- Sottoporre il campione di cellule per microscopia a scansione laser confocale e registrare le micrografie eccitazione a 405 nm (λobs = 430-520 nm) e 488 nm (λobs = 625-680 nm) per Hoechst 33342 e QD, rispettivamente.
6. cellule
- Mantenere le cellule di Hep3B il carcinoma epatocellulare umano in EMEM (10% FBS) a 37 ° C inferiore al 5% di CO2.
- Le cellule del seme il giorno prima dell'esperimento. Cellule di3 Hep3B seme 5.0 × 10 per pozzetto di una piastra a 96 pozzetti cultura in EMEM (10% FBS, 200 µ l) e incubare il campione di cellule a 37 ° C inferiore al 5% di CO2 per 24 h.
- Rimuovere il terreno di coltura e sciacquare il campione di cellule con 100 µ l di D-PBS due volte.
- Fornire il campione di cellule con 200 µ l di FBS-libero EMEM contenente Cagedcolla-NBD (0.1-100 µM) e incubare il campione di cellule risultante a 37 ° C inferiore al 5% di CO2 per 3 h.
- Esporre il campione di cellule a luce UV per 2 min tramite una fibra ottica utilizzando una sorgente di luce allo xeno 100-W dotata di filtro passa-banda 365 nm. Per un esempio di cella analoga senza esposizione ai raggi UV, conservare il campione di cellule buio.
- Aggiungere 10 µ l di reagente di cella contando Kit-8 (10 µ l) al terreno di coltura e incubare il campione di cellule risultante a 37 ° C inferiore al 5% di CO2 per 2 h.
- Sottoporre il campione di cellule a spettroscopia di assorbimento (λ = 450 nm) utilizzando un lettore di micropiastre.
Risultati
Prima photoirradiation, Hep3B cellule incubate con Cagedcolla-NBD ha esibito l'emissione di fluorescenza punctate dal loro interno (λext = 488 nm; Figure 4A e 4C, verde). Un Micrografo analogo è stato ottenuto al momento di eccitazione a 543 nm per colorante rosso fluorescente (figure 4B e 4C, rosso), che indica che il Cagedcolla-NBD localizzata negli endosomi....
Discussione
Le indagini precedenti di luce-attivato traslocazione delle proteine nel nucleo delle cellule sono stati raggiunti utilizzando in gabbia NLS7,8,9. Come accennato in precedenza, questi metodi richiedono tecniche aggiuntive per incorporare le proteine NLS-etichettate nel citoplasma. Al contrario, nostro tag colla-R Cagedconsente non solo la traslocazione nucleare indotta da foto, ma anche l'assorbimento cellulare degli ...
Divulgazioni
Gli autori non hanno nulla a rivelare.
Riconoscimenti
Riconosciamo il centro per l'integrazione di NanoBio, l'Università di Tokyo. Questo lavoro è stato supportato da sovvenzione per giovani scienziati (B) (26810046) per K.O. e parzialmente supportato da sovvenzione per ricerca promosso appositamente (25000005) con T.A. R.M. grazie Research Fellowships di Japan Society per la promozione della scienza (JSPS ) per giovani ricercatori e il programma per scuole laureate leader (GPLLI).
Materiali
| Name | Company | Catalog Number | Comments |
| Azide-PEG4-NHS ester | Click Chemistry Tools | AZ103 | |
| Q-dot 655 ITK | Invitrogen | Q21521MP | |
| Regenerated cellulose membrane (MWCO 3,500) | NIPPON Genetics | TOR-3K | |
| Regenerated cellulose membrane (MWCO 25,000) | Harvard Apparatus | 7425-RC25K | |
| Hep3B Cells | ATCC | HB-8064 | |
| 8-chambered glass substrate | Nunc | 155411JP | |
| 96-well culture plate | Nunc | 167008 | |
| Eagle's minimal essential medium (EMEM) | Thermo Fisher Scientific | 10370-021 | |
| Fetal bovine serum (FBS) | GE Healthcare | SH30406.02 | |
| Dulbecco's phosphate buffer saline (D-PBS) | Wako Pure Chemical Industries | 045-29795 | |
| LysoTracker Red | Lonza Walkersville | PA-3015 | |
| Hoechst 33342 | Dojindo | H342 | |
| Cell Counting Kit-8 | Dojindo | CK04 | |
| Confocal laser scanning microscope | Carl-Zeiss | LSM 510 | Equipped with two-photon excitation laser (Mai Tai laser, Spectra-Physics) |
| Confocal laser scanning microscope | Leica | TCS SP8 | |
| Xenon light source | Asahi Spectra | LAX-102 | |
| Microplate reader | Molecular Devices | SpectraMax Paradigm |
Riferimenti
- Miller, A. D. Human gene therapy comes of age. Nature. 357, 455-460 (1992).
- Roth, J. A., Cristiano, R. J. Gene Therapy for Cancer: What Have We Done and Where Are We Going. Journal of the National Cancer Institute. 89, 21-39 (1997).
- Verma, I. M., Weitzman, M. D. GENE THERAPY: Twenty-First Century Medicine. Annual Review of Biochemistry. 74, 711-738 (2005).
- Ragin, A. D., Morgan, R. A., Chmielewski, J. Cellular Import Mediated by Nuclear Localization Signal Peptide Sequences. Chemistry & Biology. 9, 943-948 (2002).
- Martin, R. M., et al. Principles of protein targeting to the nucleolus. Nucleus. 6, 314-325 (2015).
- Sun, Y., et al. Factors influencing the nuclear targeting ability of nuclear localization signals. Journal of Drug Targeting. 24, 927-933 (2016).
- Ventura, B. D., Kuhlman, B. Go in! Go out! Inducible control of nuclear localization. Current Opinion in Chemical Biology. 34, 62-71 (2016).
- Watai, Y., Sase, I., Shiono, H., Nakano, Y. Regulation of nuclear import by light-induced activation of caged nuclear localization signal in living cells. FEBS Letters. 488, 39-44 (2001).
- Engelke, H., Chou, C., Uprety, R., Jess, P., Deiters, A. Control of Protein Function through Optochemical Translocation. ACS Synthetic Biology. 3, 731-736 (2014).
- Mogaki, R., Hashim, P. K., Okuro, K., Aida, T. Guanidinium-based "molecular glues" for modulation of biomolecular functions. Chemical Society Reviews. 46, 6480-6491 (2017).
- Okuro, K., Kinbara, K., Tsumoto, K., Ishii, N., Aida, T. Molecular Glues Carrying Multiple Guanidinium Ion Pendants via an Oligoether Spacer: Stabilization of Microtubules against Depolymerization. Journal of the American Chemical Society. 131, 1626-1627 (2009).
- Okuro, K., et al. Adhesion Effects of a Guanidinium Ion Appended Dendritic "Molecular Glue" on the ATP-Driven Sliding Motion of Actomyosin. Angewandte Chemie, International Edition. 48, 3030-3033 (2010).
- Uchida, N., et al. Photoclickable Dendritic Molecular Glue: Noncovalent-to-Covalent Photochemical Transformation of Protein Hybrids. Journal of the American Chemical Society. 135, 4684-4687 (2013).
- Garzoni, M., Okuro, K., Ishii, N., Aida, T., Pavan, G. M. Structure and Shape Effects of Molecular Glue on Supramolecular Tubulin Assemblies. ACS Nano. 8, 904-914 (2014).
- Mogaki, R., Okuro, K., Aida, T. Molecular glues for manipulating enzymes: trypsin inhibition by benzamidine-conjugated molecular glues. Chemical Science. 6, 2802-2805 (2015).
- Okuro, K., Sasaki, M., Aida, T. Boronic Acid-Appended Molecular Glues for ATP-Responsive Activity Modulation of Enzymes. Journal of the American Chemical Society. 138, 5527-5530 (2016).
- Mogaki, R., Okuro, K., Aida, T. Adhesive Photoswitch: Selective Photochemical Modulation of Enzymes under Physiological Conditions. Journal of the American Chemical Society. 139, 10072-10078 (2017).
- Hashim, P. K., Okuro, K., Sasaki, S., Hoashi, Y., Aida, T. Reductively Cleavable Nanocaplets for siRNA Delivery by Template-Assisted Oxidative Polymerization. Journal of the American Chemical Society. 137, 15608-15611 (2015).
- Hatano, J., Okuro, K., Aida, T. Photoinduced Bioorthogonal 1,3-Dipolar Poly-cycloaddition Promoted by Oxyanionic Substrates for Spatiotemporal Operation of Molecular Glues. Angewandte Chemie, International Edition. 55, 193-198 (2016).
- Arisaka, A., Mogaki, R., Okuro, K., Aida, T. Caged Molecular Glues as Photoactivatable Tags for Nuclear Translocation of Guests in Living Cells. Journal of the American Chemical Society. 140, 2687-2692 (2018).
- Suzuki, Y., Okuro, K., Takeuchi, T., Aida, T. Friction-Mediated Dynamic Disordering of Phospholipid Membrane by Mechanical Motions of Photoresponsive Molecular Glue: Activation of Ion Permeation. Journal of the American Chemical Society. 134, 15273-15276 (2012).
- Wang, Q., et al. High-water-content mouldable hydrogels by mixing clay and a dendritic molecular binder. Nature. 463, 339-343 (2010).
- Tamesue, S., et al. Linear versus Dendritic Molecular Binders for Hydrogel Network Formation with Clay Nanosheets: Studies with ABA Triblock Copolyethers Carrying Guanidinium Ion Pendants. Journal of the American Chemical Society. 135, 15650-15655 (2013).
- Mohr, D., Frey, S., Fischer, T., Güttler, T., Görlich, D. Characterisation of the passive permeability barrier of nuclear pore complexes. EMBO Journal. 28, 2541-2553 (2009).
- Best, M. D. Click Chemistry and Bioorthogonal Reactions: Unprecedented Selectivity in the Labeling of Biological Molecules. Biochemistry. 48, 6571-6584 (2009).
- Klán, P., et al. Photoremovable Protecting Groups in Chemistry and Biology: Reaction Mechanisms and Efficacy. Chemical Reviews. 113, 119-191 (2013).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon